6.3金属矿物与冶炼同步练习(含答案)科粤版化学九年级下册
文档属性
| 名称 | 6.3金属矿物与冶炼同步练习(含答案)科粤版化学九年级下册 |  | |
| 格式 | docx | ||
| 文件大小 | 545.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-03 10:45:12 | ||
图片预览




文档简介
6.3金属矿物与冶炼
一、多选题
1.某兴趣小组同学取7.2g固体样品(由氧化铁和铁粉混合而成),用下图所示的装置进行实验,待完全反应后,得到固体的质量为6g,B中澄清石灰水变浑浊。下列说法正确的是
A.一氧化碳在反应中体现了氧化性 B.该实验中共发生了3个化学反应
C.样品中铁元素与氧元素质量比为5:1 D.实验结束时先熄灭酒精灯,最后熄灭酒精喷灯
2.下列说法正确的是
A.高炉炼铁中所需高温和CO生成都与焦炭有关
B.由一种元素组成的物质可能是单质,一定不是化合物
C.原子通过得失电子形成离子,离子一定不能形成原子
D.某气体不能使带火星木条复燃,该气体中一定不含氧气
3.下列有关实验的描述中,错误的是( )
A.红磷在空气中燃烧,产生浓厚的烟雾,生成有刺激性气味的气体
B.加热高锰酸钾制取氧气,要在试管口放一团蓬松的棉花
C.一氧化碳与氧化铁的反应,需要处理尾气
D.向氢氧化钠溶液中滴加无色酚酞试液,溶液变蓝色
4.在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。”(注:炉甘石的主要成分是碳酸锌)火法炼锌主要发生的化学反应是,下列说法正确的是( )
A.X的化学式是CO B.“逐层用煤炭饼垫盛”是为了燃烧提供高温
C.反应前后固体的质量不变 D.“罐中炉甘石熔化成团”,团的主要成分是锌
5.某学习小组模拟工业炼铁原理,从13.6g铁和氧化铁的混合物中提取铁,向该混合物中通入足量的CO并灼热至完全反应,所得固体质量为11.2g,下列结论正确的是( )
A.该混合物中铁的质量为5.6g
B.该实验需要CO总质量为4.2g
C.该混合物中铁元素质量分数为50%
D.反应生成CO2的总质量为6.6g
二、选择题
6.不属于赤铁矿冶铁过程中的主要反应的是
A.
B.
C.
D.
7.下列矿石的主要成分为Fe3O4的是( )
A.赤铁矿 B.磁铁矿 C.菱铁矿 D.褐铁矿
8.下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
9.下列金属中一定以化合物形态存在于矿物之中的是( )
A.金 B.银 C.铁 D.铂
10.用1000t含氧化铁80%的赤铁矿炼铁,可炼出铁的质量为:
A.140t B.200t C.560t D.800t
11.冶铁的原料中,除铁矿石、焦炭、空气,还应添加的是
A.一氧化碳 B.石灰石 C.二氧化锰 D.碳化铁
12.下列实验现象描述正确的是
A.细铁丝在氧气中剧烈燃烧,火星四射,生成红棕色固体
B.将CO通入灼热的氧化铁中,硬质玻璃管中黑色固体变为红色
C.往氯化铜溶液中插入铝丝,铝丝表面出现红色固体,溶液由蓝色变为无色
D.红磷在氧气中燃烧,产生大量白色烟雾,放出热量
13.下列各组转化中,一定条件下不能一步实现的组合是
A.H2CO3 CO2CO
B.CO2CCO2
C.H2OO2H2O2
D.Fe2O3Fe Fe3O4
14.将4.84g某纯净的铁的氧化物,与足量的一氧化碳在加热的条件下完全反应,反应生成的气体被足量的澄清石灰水完全吸收,得到11.0g白色沉淀,则该铁的氧化物的化学式为
A.FeO B.FeO2 C.Fe2O3 D.Fe3O4
15.下列化学方程式中,错误的是
A.3Fe+2O2Fe3O4
B.2HgO=2Hg+O2
C.Fe+CuSO4=FeSO4+Cu
D.Fe2O3+3CO2Fe+3CO2
三、综合应用题
16.氢能是未来的理想能源。
I.氢气制备
(1)有研究表明,在某催化剂作用下可实现光解海水制H2,反应的化学方程式为 。光解水生成的两种气体体积与时间的关系如图1所示,其中表示H2生成的是 (填“a”或“b”)。
(2)一定温度下,用钼铁(Mo—Fe)作催化剂,可以裂解乙醇(C2H5OH)制备H2。研究数据如图2所示,分析可知:其它条件相同时,裂解乙醇制氢的最佳温度是 ,催化剂中最佳的钼(Mo)铁用量比是 。
Ⅱ.氢气储存
(3)Mg17Al12是一种储氢材料,完全吸氢后得MgH2和Al,储氢过程属于 变化(填“物理”或“化学”)。
(4)X也是一种储氢材料,11.2gX在O2中完全燃烧,只生成8.0gCuO和8.0gMgO,则化合物X的化学式是 。
Ⅲ.氢气应用
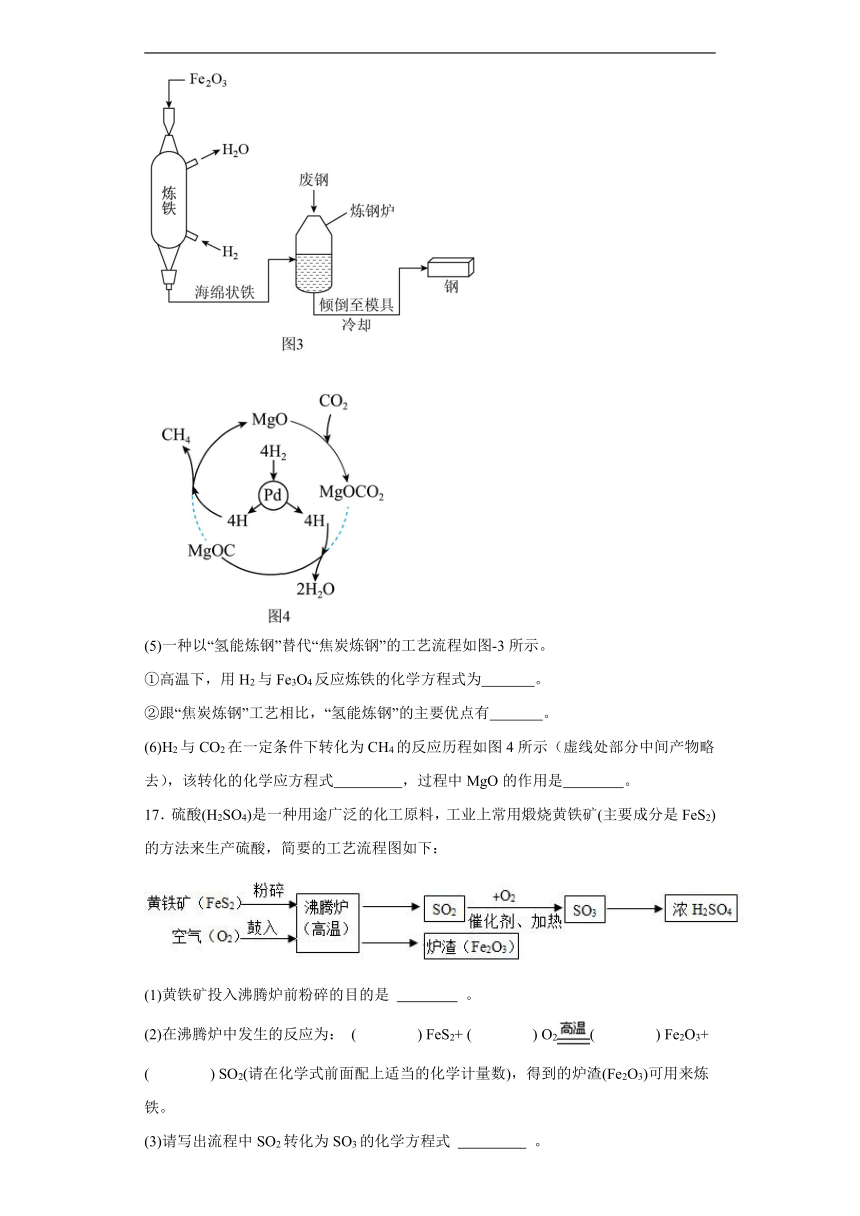
(5)一种以“氢能炼钢”替代“焦炭炼钢”的工艺流程如图-3所示。
①高温下,用H2与Fe3O4反应炼铁的化学方程式为 。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有 。
(6)H2与CO2在一定条件下转化为CH4的反应历程如图4所示(虚线处部分中间产物略去),该转化的化学应方程式 ,过程中MgO的作用是 。
17.硫酸(H2SO4)是一种用途广泛的化工原料,工业上常用煅烧黄铁矿(主要成分是FeS2)的方法来生产硫酸,简要的工艺流程图如下:
(1)黄铁矿投入沸腾炉前粉碎的目的是 。
(2)在沸腾炉中发生的反应为: ( ) FeS2+ ( ) O2( ) Fe2O3+ ( ) SO2(请在化学式前面配上适当的化学计量数),得到的炉渣(Fe2O3)可用来炼铁。
(3)请写出流程中SO2转化为SO3的化学方程式 。
【炉渣的综合利用】
为了实现炉渣(Fe2O3)的综合利用,工业上把炉渣和焦炭、石灰石一起投入高炉,主要反应过程如图:
(4)步骤②发生反应的化学方程式为 。
(5)下列有关高炉炼铁的说法正确的是 (填序号)。
A.上述流程中涉及的三个反应均为吸热反应
B.上述步骤①反应中,还原剂是焦炭
C.焦炭的作用之一是为炼铁炉提供高温条件
D.焦炭的另一个作用是除去铁矿石中的杂质
(6)分析高炉所得的生铁中单质铁的含量:
小瑾同学为测定生铁中铁的质量分数,先后进行了四次实验,实验数据记录如下表。根据她的实验数据,试计算生铁中铁的质量分数是 ?
第一次 第二次 第三次 第四次
所取生铁的质量∕g 10 10 10 10
所加稀硫酸的质量∕g 25 50 75 100
生成氢气的质量∕g 0.10 0.20 0.30 0.35
【反思质疑】小宇同学在梳理工业炼铁的相关知识时,提出了以下质疑:
【质疑一】焦炭也具有还原性而且成本低,工业炼铁为什么不直接用焦炭作为还原剂冶炼铁矿石?
(7)他设计了下图所示的一组对比实验:称取两份相同质量的氧化铁粉末,一份与足量的焦炭粉末混合均匀放入装置A的试管中,另一份放入装置B的玻璃管中。
①装置B的玻璃管中发生反应的化学方程式为 。
②当他观察到装置B的玻璃管中固体 、澄清石灰水变浑浊时,装置A的试管中尚无明显现象。
③通过上述实验对比,小宇同学认为工业上不直接用焦炭作为还原剂炼铁的主要原因有:反应不充分、反应速度慢、 等。
【质疑二】装置B中反应后的黑色固体一定就是单质铁吗?
【查阅资料】
a.铁常见的氧化物有氧化铁(Fe2O3)、四氧化三铁(Fe3O4)和氧化亚铁(FeO)。
b.四氧化三铁是具有磁性的黑色晶体,氧化亚铁是不溶于水的黑色粉末,无磁性,也不能被磁铁吸引。
④小宇同学设计了如下实验方案:用磁铁吸引装置B进行实验后的黑色固体,发现黑色固体可以部分被吸引,由此得出结论:黑色固体的成分是 。
18.碳是形成化合物种类最多的元素,含碳物质是化学研究的重要内容。
(1)如图是碳原子的结构示意图,图中的数值为 。
(2)碳元素可组成多种单质,下列有关说法不正确的是 (填字母)。
a.金刚石的硬度很大
b.每个C60分子是由60个碳原子构成的
c.石墨的导电性良好
d.金刚石、石墨和C60里碳原子排列方式相同
(3)CO和CO2均属于碳的氧化物。下列图示中,A是CO还原Fe2O3的部分实验装置,B是探究CO2性质的趣味实验装置。
①写出装置A中CO还原Fe2O3的化学方程式;从环保角度考虑,写出一种尾气处理的方法 。
②装置B中,注入浓NaOH溶液后,可观察到气球逐渐胀大,请分析原因 。
(4)实验室制取CO2等常见气体的相关装置如下图所示。
①实验室用大理石和稀盐酸反应制取干燥的CO2,所需装置从左到右的正确连接顺序为 接 接 (填字母)。
②用①中装置,选择过氧化氢溶液和二氧化锰制取O2,写出反应的化学方程式 。
(5)现用大理石和稀盐酸反应制取4.4g二氧化碳,理论上需质量分数为10%的盐酸的质量是多少?
参考答案:
1.BC
2.AB
3.AD
4.AD
5.AD
6.C
7.B
8.C
9.C
10.C
11.B
12.C
13.C
14.B
15.B
16.(1)
a
(2) 600℃ 1:9
(3)化学
(4)CuMg2/Mg2Cu
(5)
不会产生空气污染物
(6)
催化作用
17. 增大反应物的接触面积,使反应更快更充分 4 11 2 8 2SO2+O22SO3 CO2+C2CO BC 98% Fe2O3+3CO2Fe+3CO2 固体从红色变成黑色 炼出的生铁杂质含量高 Fe3O4、FeO或FeO、Fe或Fe3O4、FeO、Fe
18.(1)4
(2)d
(3)
用一燃着的酒精灯放在尾气处理处,将尾气点燃 氢氧化钠能与二氧化碳反应生成碳酸钠和水,而使瓶内的气体被消耗,压强变小,气球变大
(4) B E C
(5)设:理论上需质量分数为10%的盐酸的质量是。
答:理论上需质量分数为10%的盐酸的质量是73g。
一、多选题
1.某兴趣小组同学取7.2g固体样品(由氧化铁和铁粉混合而成),用下图所示的装置进行实验,待完全反应后,得到固体的质量为6g,B中澄清石灰水变浑浊。下列说法正确的是
A.一氧化碳在反应中体现了氧化性 B.该实验中共发生了3个化学反应
C.样品中铁元素与氧元素质量比为5:1 D.实验结束时先熄灭酒精灯,最后熄灭酒精喷灯
2.下列说法正确的是
A.高炉炼铁中所需高温和CO生成都与焦炭有关
B.由一种元素组成的物质可能是单质,一定不是化合物
C.原子通过得失电子形成离子,离子一定不能形成原子
D.某气体不能使带火星木条复燃,该气体中一定不含氧气
3.下列有关实验的描述中,错误的是( )
A.红磷在空气中燃烧,产生浓厚的烟雾,生成有刺激性气味的气体
B.加热高锰酸钾制取氧气,要在试管口放一团蓬松的棉花
C.一氧化碳与氧化铁的反应,需要处理尾气
D.向氢氧化钠溶液中滴加无色酚酞试液,溶液变蓝色
4.在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。”(注:炉甘石的主要成分是碳酸锌)火法炼锌主要发生的化学反应是,下列说法正确的是( )
A.X的化学式是CO B.“逐层用煤炭饼垫盛”是为了燃烧提供高温
C.反应前后固体的质量不变 D.“罐中炉甘石熔化成团”,团的主要成分是锌
5.某学习小组模拟工业炼铁原理,从13.6g铁和氧化铁的混合物中提取铁,向该混合物中通入足量的CO并灼热至完全反应,所得固体质量为11.2g,下列结论正确的是( )
A.该混合物中铁的质量为5.6g
B.该实验需要CO总质量为4.2g
C.该混合物中铁元素质量分数为50%
D.反应生成CO2的总质量为6.6g
二、选择题
6.不属于赤铁矿冶铁过程中的主要反应的是
A.
B.
C.
D.
7.下列矿石的主要成分为Fe3O4的是( )
A.赤铁矿 B.磁铁矿 C.菱铁矿 D.褐铁矿
8.下图是实验室模拟工业炼铁的实验装置图,下列说法不正确的是( )
A.B处玻璃管内发生的化学反应是氧化还原反应,还原剂是CO
B.在点燃酒精喷灯前,应先通入CO气体排尽装置中的空气
C.该实验可以观察到B处固体从黑色逐渐变成红色
D.该模拟实验缺少尾气处理装置,会污染空气
9.下列金属中一定以化合物形态存在于矿物之中的是( )
A.金 B.银 C.铁 D.铂
10.用1000t含氧化铁80%的赤铁矿炼铁,可炼出铁的质量为:
A.140t B.200t C.560t D.800t
11.冶铁的原料中,除铁矿石、焦炭、空气,还应添加的是
A.一氧化碳 B.石灰石 C.二氧化锰 D.碳化铁
12.下列实验现象描述正确的是
A.细铁丝在氧气中剧烈燃烧,火星四射,生成红棕色固体
B.将CO通入灼热的氧化铁中,硬质玻璃管中黑色固体变为红色
C.往氯化铜溶液中插入铝丝,铝丝表面出现红色固体,溶液由蓝色变为无色
D.红磷在氧气中燃烧,产生大量白色烟雾,放出热量
13.下列各组转化中,一定条件下不能一步实现的组合是
A.H2CO3 CO2CO
B.CO2CCO2
C.H2OO2H2O2
D.Fe2O3Fe Fe3O4
14.将4.84g某纯净的铁的氧化物,与足量的一氧化碳在加热的条件下完全反应,反应生成的气体被足量的澄清石灰水完全吸收,得到11.0g白色沉淀,则该铁的氧化物的化学式为
A.FeO B.FeO2 C.Fe2O3 D.Fe3O4
15.下列化学方程式中,错误的是
A.3Fe+2O2Fe3O4
B.2HgO=2Hg+O2
C.Fe+CuSO4=FeSO4+Cu
D.Fe2O3+3CO2Fe+3CO2
三、综合应用题
16.氢能是未来的理想能源。
I.氢气制备
(1)有研究表明,在某催化剂作用下可实现光解海水制H2,反应的化学方程式为 。光解水生成的两种气体体积与时间的关系如图1所示,其中表示H2生成的是 (填“a”或“b”)。
(2)一定温度下,用钼铁(Mo—Fe)作催化剂,可以裂解乙醇(C2H5OH)制备H2。研究数据如图2所示,分析可知:其它条件相同时,裂解乙醇制氢的最佳温度是 ,催化剂中最佳的钼(Mo)铁用量比是 。
Ⅱ.氢气储存
(3)Mg17Al12是一种储氢材料,完全吸氢后得MgH2和Al,储氢过程属于 变化(填“物理”或“化学”)。
(4)X也是一种储氢材料,11.2gX在O2中完全燃烧,只生成8.0gCuO和8.0gMgO,则化合物X的化学式是 。
Ⅲ.氢气应用
(5)一种以“氢能炼钢”替代“焦炭炼钢”的工艺流程如图-3所示。
①高温下,用H2与Fe3O4反应炼铁的化学方程式为 。
②跟“焦炭炼钢”工艺相比,“氢能炼钢”的主要优点有 。
(6)H2与CO2在一定条件下转化为CH4的反应历程如图4所示(虚线处部分中间产物略去),该转化的化学应方程式 ,过程中MgO的作用是 。
17.硫酸(H2SO4)是一种用途广泛的化工原料,工业上常用煅烧黄铁矿(主要成分是FeS2)的方法来生产硫酸,简要的工艺流程图如下:
(1)黄铁矿投入沸腾炉前粉碎的目的是 。
(2)在沸腾炉中发生的反应为: ( ) FeS2+ ( ) O2( ) Fe2O3+ ( ) SO2(请在化学式前面配上适当的化学计量数),得到的炉渣(Fe2O3)可用来炼铁。
(3)请写出流程中SO2转化为SO3的化学方程式 。
【炉渣的综合利用】
为了实现炉渣(Fe2O3)的综合利用,工业上把炉渣和焦炭、石灰石一起投入高炉,主要反应过程如图:
(4)步骤②发生反应的化学方程式为 。
(5)下列有关高炉炼铁的说法正确的是 (填序号)。
A.上述流程中涉及的三个反应均为吸热反应
B.上述步骤①反应中,还原剂是焦炭
C.焦炭的作用之一是为炼铁炉提供高温条件
D.焦炭的另一个作用是除去铁矿石中的杂质
(6)分析高炉所得的生铁中单质铁的含量:
小瑾同学为测定生铁中铁的质量分数,先后进行了四次实验,实验数据记录如下表。根据她的实验数据,试计算生铁中铁的质量分数是 ?
第一次 第二次 第三次 第四次
所取生铁的质量∕g 10 10 10 10
所加稀硫酸的质量∕g 25 50 75 100
生成氢气的质量∕g 0.10 0.20 0.30 0.35
【反思质疑】小宇同学在梳理工业炼铁的相关知识时,提出了以下质疑:
【质疑一】焦炭也具有还原性而且成本低,工业炼铁为什么不直接用焦炭作为还原剂冶炼铁矿石?
(7)他设计了下图所示的一组对比实验:称取两份相同质量的氧化铁粉末,一份与足量的焦炭粉末混合均匀放入装置A的试管中,另一份放入装置B的玻璃管中。
①装置B的玻璃管中发生反应的化学方程式为 。
②当他观察到装置B的玻璃管中固体 、澄清石灰水变浑浊时,装置A的试管中尚无明显现象。
③通过上述实验对比,小宇同学认为工业上不直接用焦炭作为还原剂炼铁的主要原因有:反应不充分、反应速度慢、 等。
【质疑二】装置B中反应后的黑色固体一定就是单质铁吗?
【查阅资料】
a.铁常见的氧化物有氧化铁(Fe2O3)、四氧化三铁(Fe3O4)和氧化亚铁(FeO)。
b.四氧化三铁是具有磁性的黑色晶体,氧化亚铁是不溶于水的黑色粉末,无磁性,也不能被磁铁吸引。
④小宇同学设计了如下实验方案:用磁铁吸引装置B进行实验后的黑色固体,发现黑色固体可以部分被吸引,由此得出结论:黑色固体的成分是 。
18.碳是形成化合物种类最多的元素,含碳物质是化学研究的重要内容。
(1)如图是碳原子的结构示意图,图中的数值为 。
(2)碳元素可组成多种单质,下列有关说法不正确的是 (填字母)。
a.金刚石的硬度很大
b.每个C60分子是由60个碳原子构成的
c.石墨的导电性良好
d.金刚石、石墨和C60里碳原子排列方式相同
(3)CO和CO2均属于碳的氧化物。下列图示中,A是CO还原Fe2O3的部分实验装置,B是探究CO2性质的趣味实验装置。
①写出装置A中CO还原Fe2O3的化学方程式;从环保角度考虑,写出一种尾气处理的方法 。
②装置B中,注入浓NaOH溶液后,可观察到气球逐渐胀大,请分析原因 。
(4)实验室制取CO2等常见气体的相关装置如下图所示。
①实验室用大理石和稀盐酸反应制取干燥的CO2,所需装置从左到右的正确连接顺序为 接 接 (填字母)。
②用①中装置,选择过氧化氢溶液和二氧化锰制取O2,写出反应的化学方程式 。
(5)现用大理石和稀盐酸反应制取4.4g二氧化碳,理论上需质量分数为10%的盐酸的质量是多少?
参考答案:
1.BC
2.AB
3.AD
4.AD
5.AD
6.C
7.B
8.C
9.C
10.C
11.B
12.C
13.C
14.B
15.B
16.(1)
a
(2) 600℃ 1:9
(3)化学
(4)CuMg2/Mg2Cu
(5)
不会产生空气污染物
(6)
催化作用
17. 增大反应物的接触面积,使反应更快更充分 4 11 2 8 2SO2+O22SO3 CO2+C2CO BC 98% Fe2O3+3CO2Fe+3CO2 固体从红色变成黑色 炼出的生铁杂质含量高 Fe3O4、FeO或FeO、Fe或Fe3O4、FeO、Fe
18.(1)4
(2)d
(3)
用一燃着的酒精灯放在尾气处理处,将尾气点燃 氢氧化钠能与二氧化碳反应生成碳酸钠和水,而使瓶内的气体被消耗,压强变小,气球变大
(4) B E C
(5)设:理论上需质量分数为10%的盐酸的质量是。
答:理论上需质量分数为10%的盐酸的质量是73g。
