2024届高三化学二轮专题过关练习-电解池(含解析)
文档属性
| 名称 | 2024届高三化学二轮专题过关练习-电解池(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-03 11:04:07 | ||
图片预览

文档简介
2024届高三化学二轮专题过关练习-电解池
一、单选题
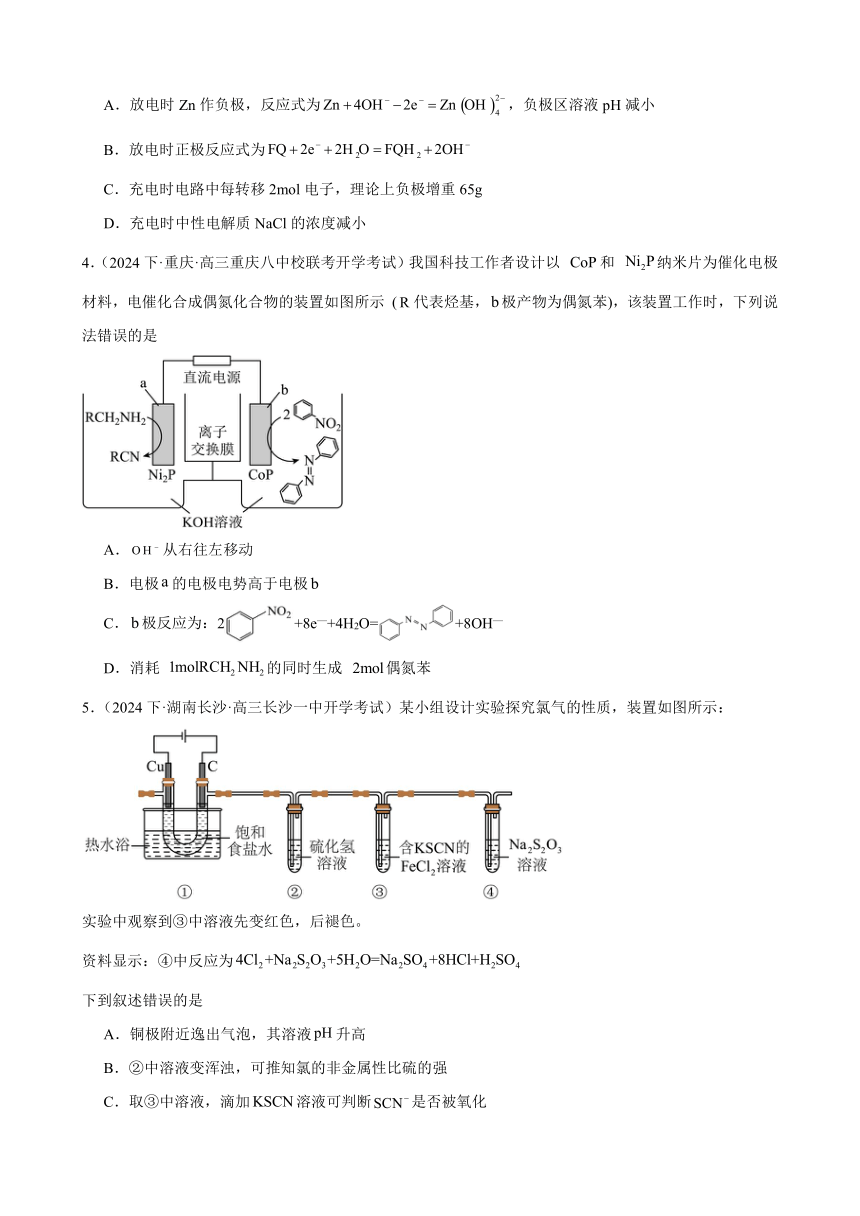
1.(2024下·山东·高三校联考开学考试)硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成.电解槽中水溶液的主要成分及反应过程如图所示,下列说法错误的是
A.惰性电极1为阴极
B.反应前后数量均不变
C.消耗氧气,可得到硝酮
D.外电路通过电子,可得到水
2.(2024·云南昆明·统考三模)科学家设计了一种以石墨为正极的高容量可充电Li/Cl2电池,原理如图所示。氯化铝(AlCl3)溶解在亚硫酰氯(SOCl2)中,以氟化物(LiFSI)为溶剂。下列叙述正确的是
A.放电时,电解质溶液可以是AlCl3水溶液
B.放电时,石墨极的电极反应式为Cl2+2e-+2Li+=2LiCl
C.充电时,石墨极与电源负极连接
D.充电时,转移2NA个电子时锂电极理论上消耗7g锂
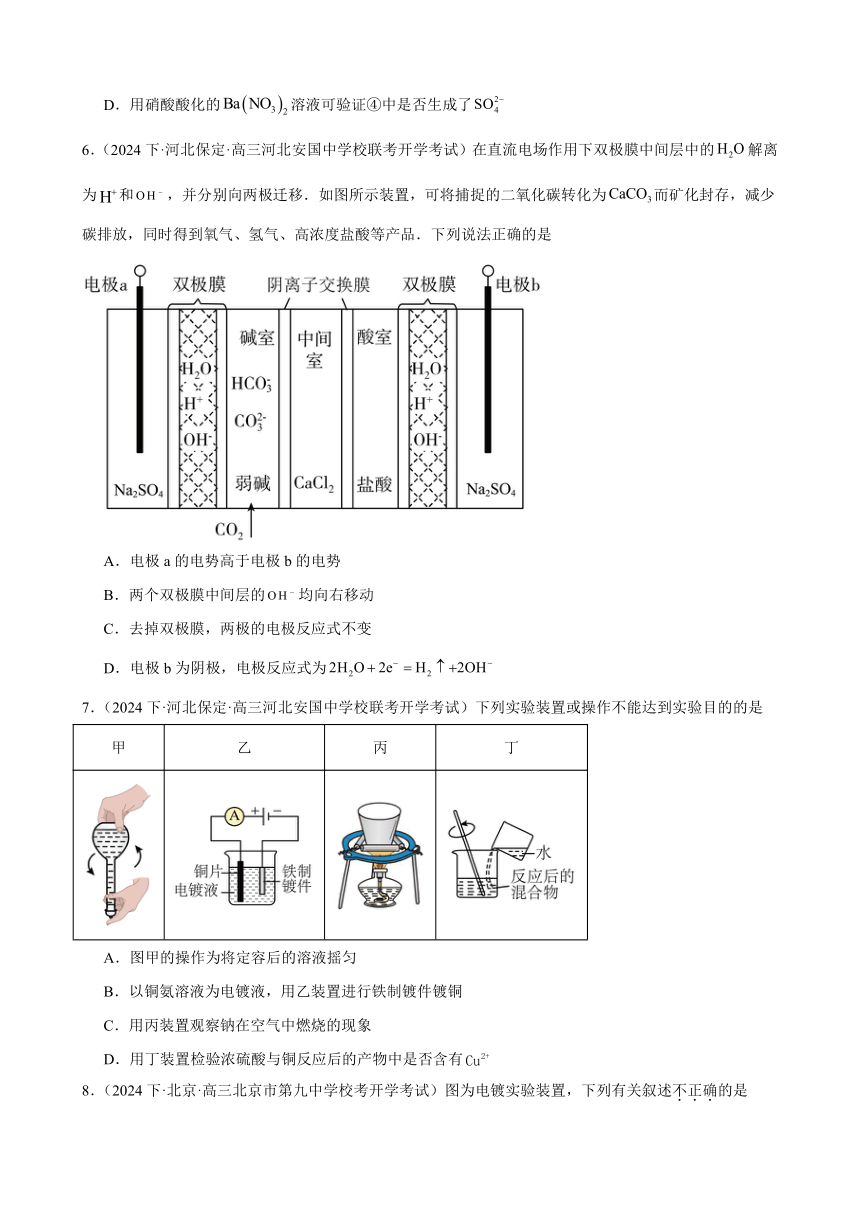
3.(2024·黑龙江哈尔滨·哈尔滨三中校考一模)高电压水系锌—有机混合液流电池的装置如图所示。下列说法错误的是
A.放电时Zn作负极,反应式为,负极区溶液pH减小
B.放电时正极反应式为
C.充电时电路中每转移2mol电子,理论上负极增重65g
D.充电时中性电解质NaCl的浓度减小
4.(2024下·重庆·高三重庆八中校联考开学考试)我国科技工作者设计以 和 纳米片为催化电极材料,电催化合成偶氮化合物的装置如图所示 (代表烃基,极产物为偶氮苯),该装置工作时,下列说法错误的是
A.从右往左移动
B.电极的电极电势高于电极
C.极反应为:2+8e—+4H2O=+8OH—
D.消耗 的同时生成 偶氮苯
5.(2024下·湖南长沙·高三长沙一中开学考试)某小组设计实验探究氯气的性质,装置如图所示:
实验中观察到③中溶液先变红色,后褪色。
资料显示:④中反应为
下到叙述错误的是
A.铜极附近逸出气泡,其溶液升高
B.②中溶液变浑浊,可推知氯的非金属性比硫的强
C.取③中溶液,滴加溶液可判断是否被氧化
D.用硝酸酸化的溶液可验证④中是否生成了
6.(2024下·河北保定·高三河北安国中学校联考开学考试)在直流电场作用下双极膜中间层中的解离为和,并分别向两极迁移.如图所示装置,可将捕捉的二氧化碳转化为而矿化封存,减少碳排放,同时得到氧气、氢气、高浓度盐酸等产品.下列说法正确的是
A.电极a的电势高于电极b的电势
B.两个双极膜中间层的均向右移动
C.去掉双极膜,两极的电极反应式不变
D.电极b为阴极,电极反应式为
7.(2024下·河北保定·高三河北安国中学校联考开学考试)下列实验装置或操作不能达到实验目的的是
甲 乙 丙 丁
A.图甲的操作为将定容后的溶液摇匀
B.以铜氨溶液为电镀液,用乙装置进行铁制镀件镀铜
C.用丙装置观察钠在空气中燃烧的现象
D.用丁装置检验浓硫酸与铜反应后的产物中是否含有
8.(2024下·北京·高三北京市第九中学校考开学考试)图为电镀实验装置,下列有关叙述不正确的是
A.电镀时,待镀铁制品应与直流电源负极相连 B.通电后,溶液中的移向阳极
C.镀铜时,理论上阳极和阴极的质量变化相等 D.待镀铁制品增重2.56 g,电路中通过的电子为0.04 mol
9.(2024下·河北·高三校联考开学考试)我国化学家成功开发出锌—空气二次电池,其工作原理如图所示.下列说法正确的是
A.放电时,a极是原电池的正极,充电时与电源正极相连
B.充电时,b极发生反应:
C.放电时,当b极消耗时,电路中有通过
D.充电过程中,a、b电极附近溶液均不变
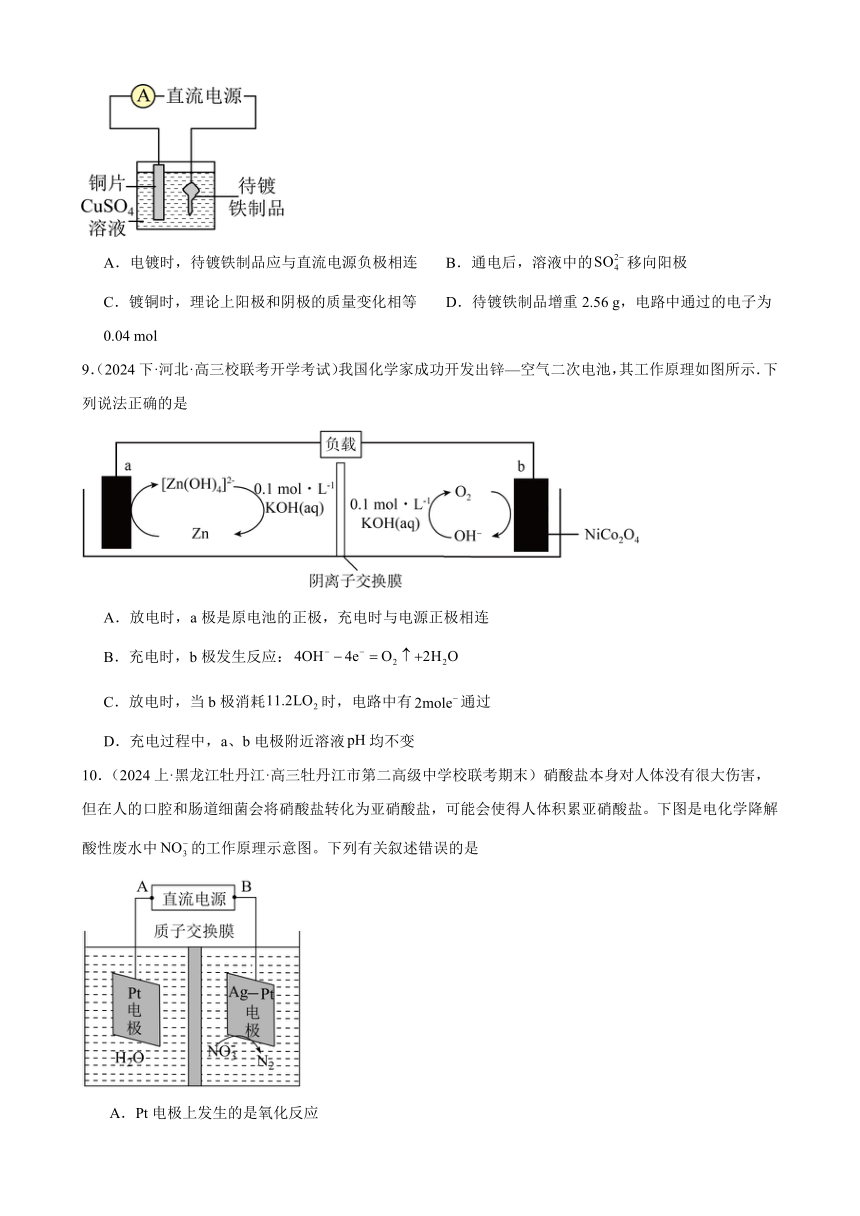
10.(2024上·黑龙江牡丹江·高三牡丹江市第二高级中学校联考期末)硝酸盐本身对人体没有很大伤害,但在人的口腔和肠道细菌会将硝酸盐转化为亚硝酸盐,可能会使得人体积累亚硝酸盐。下图是电化学降解酸性废水中的工作原理示意图。下列有关叙述错误的是
A.Pt电极上发生的是氧化反应
B.由电解池左侧移向右侧
C.当外电路转移2mol电子时,两极一定会收集到标况下15.68L气体
D.阴极反应式为
11.(2024上·河北石家庄·高三校联考期末)一种清洁、低成本的三步法氯碱工艺工作原理的示意图如下,下列说法正确的是
A.第三步中a为直流电源的正极
B.第一步生产的总反应为
C.第二步为原电池,正极质量增加,负极质量减少
D.第三步外电路上每转移电子,电解池中就有被电解
12.(2023上·山东济南·高三济南市历城第二中学校考期末)Co是维生素的重要组成元素。工业上可用下图装置制取单质Co并获得副产品盐酸。下列说法错误的是
A.电势:石墨电极电极
B.A膜为阴离子交换膜
C.阳极反应式:
D.外电路中通过时,阴极室溶液质量减轻59g
13.(2024·浙江宁波·镇海中学校考模拟预测)我国科学家开发出碱性海水里直接电解制氢的技术,工作原理如图1所示。隔水薄膜可以起到阻挡与电极催化剂活性中心接触的作用,电极A含有M金属的催化剂,发生的电极反应过程如图2所示,离子交换膜选择性透过参与电极A反应的物质。下列说法错误的是
A.电极A上发生的反应存在极性键的断裂与生成
B.若去掉隔水薄膜,会在A电极失去电子生成
C.电解结束后,电极B处去掉海水隔水膜,所得溶液中加入适量溶液无混浊现象
D.每当有标准状况下的气体生成时,就会有电子从电极A流向电极B
14.(2024上·河北石家庄·高三正定中学校考期末)大气中过量的和水体中过量的均是污染物。利用钒电池电解含的废水制备硝酸和氨水的原理如下图所示,均为惰性电极。下列说法中正确的是
A.用钒电池处理废水时,电极区溶液由绿色变成紫色
B.为阴极,为阳极
C.隔膜1为阴离子交换膜
D.当钒电池有通过质子交换膜时,共处理含的废水
二、非选择题
15.(2024下·宁夏吴忠·高三青铜峡市高级中学校考开学考试)如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙装置中溶液的体积和浓度都相同,A、B为外接直流电源的两极。将直流电源接通后,F电极附近呈红色。
请回答:
(1)B极是电源的 。
(2)若甲、乙装置中的电解质溶液是足量的,则写出C、D、E、F各电极上的电极反应式和总反应方程式:C电极反应式: 。D电极反应式: 。甲中总反应方程式: 。E电极反应式: 。F电极反应式: 。乙中总反应方程式: 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。
16.(2024上·山西朔州·高三统考期末)电化学在实际生活生产中十分常见,如环境保护,利用电化学进行物质制备等。回答下列问题:
(1)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗。
①离子交换膜应选择 离子交换膜(填“阴或“阳”)。
②反应的总化学方程式为 ,电解一段时间后,右侧溶液质量 (填“增加”或“减少)。
(2)目前科学人员研究发现,用甲、乙电化学装置联合能够捕捉CO2。
①装置甲的能量转化方式主要为 。
②装置甲的b电极采用多孔石墨的目的是 ;b电极的电极反应式为 。
③装置乙中的c电极与装置甲的 (填字母)电极相连接,c电极的电极反应式为 。
④当生成1mol草酸铝时,甲、乙装置联合能够捕捉 molCO2。
17.(2024上·湖北·高三湖北省武汉市汉铁高级中学校联考期末)I.乙醇是一种重要的化工原料和新型燃料。如图是乙醇燃料电池工作的示意图,工作一段时间后,断开K。
(1)甲中负极的电极反应式为 。
(2)若丙中C为铝,D为石墨,W溶液为稀硫酸,若能使铝的表面生成一层致密的氧化膜,则C电极反应式为 。
(3)若A、B、C、D均为石墨,W溶液为饱和氯化钠溶液:
a.丙中电解的总化学方程式为 。
b.工作一段时间后,向乙中所得溶液加入0.1mol Cu2(OH)2CO3后恰好使电解质溶液复原,则丙中D电极上生成的气体标况下的体积为 。
(4)若把乙装置改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),下列说法正确的是______。
A.A为粗铜,发生氧化反应
B.CuSO4溶液的浓度保持不变
C.部分杂质将以单质的形式沉积在电解槽底部形成阳极泥,阳极泥可用来提取贵金属
D.电解过程中,阳极减少的质量与阴极增加的质量相等
Ⅱ.电解硝酸工业的尾气NO可制备NH4NO3,,其工作原理如右图所示:
(5)①阳极的电极反应式为 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为 。
18.(2024上·重庆长寿·高三重庆市长寿中学校校联考期末)完成下列问题。
(1)如图1是一种新型燃料电池,它以CO为燃料,一定比例的和熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应与 极相连(填“C”或“D”)。
③当消耗标准状况下时,C电极的质量变化为 。
(2)工业上,可用铁作阳极,电解溶液制备。
①电解过程中,向 (填“阴”或“阳”)极移动,阳极的电极反应式为 。
②若阳极有溶解,则阴极析出的气体在标准状况下的体积为 L。
试卷第1页,共3页
参考答案:
1.D
【详解】A.在惰性电极1上化合价降低被还原为,因此惰性电极1为阴极,故A正确;
B.根据图中信息得到循环反应,反应前后数量均不变,故B正确;
C.总反应为氧气将二丁基羟基胺氧化为硝酮,二丁基羟基胺失去原子生成硝酮,氧气最终生成水,根据氧原子守恒,消耗氧气,可得到硝酮,故C正确;
D.外电路通过电子,消耗,根据C选项分析消耗氧气,可得到硝酮和2mol水,因此外电路通过电子,可得到水,故D错误。
综上所述,答案为D。
2.B
【分析】具有石墨正极的高容量Li/Cl2可充电电池,放电时锂为负极,锂失电子发生氧化反应,电极反应式为Li-e-=Li+,石墨为正极,氯气得电子发生还原反应,电极反应式为Cl2+2e-+2Li+=2LiCl,充电时锂电极端为阴极,发生还原反应:Li++e-=Li,石墨电极端为阳极,发生氧化反应:2LiCl-2e-=Cl2↑+2Li+,据此分析;
【详解】A.锂是活泼金属,会与水反应,不能用水溶液,A错误;
B.根据分析,放电时,石墨极的电极反应式为:Cl2+2e-+2Li+=2LiCl,B正确;
C.充电时石墨电极端为阳极,与电源正极连接,C错误;
D.充电时,根据电极方程式Li++e-=Li,转移2NA个电子时,锂电极理论上生成14g锂,D错误;
故选B。
3.B
【分析】高电压水系锌-有机混合液流电池工作原理为:放电时为原电池,金属Zn发生失电子的氧化反应生成Zn2+,为负极,则FQ所在电极为正极,正极反应式为2FQ+2e-+2H+═FQH2,负极反应式为Zn-2e-+4OH-=;充电时电解池,原电池的正负极连接电源的正负极,阴阳极的电极反应与原电池的负正极的反应式相反,电解质中阳离子移向阴极、阴离子移向阳极,据此分析解答。
【详解】A.放电时为原电池,金属Zn为负极,负极反应式为Zn-2e-+4OH-=,负极区消耗氢氧根离子则溶液pH减小,故A正确;
B.放电时为原电池,正极反应式为2FQ+2e-+2H+═FQH2,故B错误;
C.负极反应式为Zn-2e-+4OH-=,每转移2mol电子,理论上负极增重1molZn,质量为m=n M=1mol×65g/mol=65g,故C正确;
D.充电时电解池,电解质中阳离子移向阴极、阴离子移向阳极,NaCl溶液中的钠离子和氯离子分别发生定向移动,即电解质NaCl的浓度减小,故D正确;
故选:B。
4.D
【分析】由图可知,与直流电源正极相连的电极a为电解池的阳极,碱性条件下RCH2NH2在阳极失去电子发生氧化反应生成RCN,电极反应式为RCH2NH2—4e—+4OH—=RCN+4H2O,电极b为阴极,水分子作用下在阴极得到电子发生还原反应生成和水,电极反应式为2+8e—+4H2O=+8OH—。
【详解】A.由分析可知,电极a为电解池的阳极,电极b为阴极,则阴离子氢氧根离子从右往左移动,故A正确;
B.由分析可知,电极a为电解池的阳极,电极b为阴极,则电极a的电极电势高于电极b,故B正确;
C.由分析可知,电极b为阴极,水分子作用下在阴极得到电子发生还原反应生成和水,电极反应式为2+8e—+4H2O=+8OH—,故C正确;
D.由得失电子数目守恒可知,阳极消耗1mol RCH2NH2的同时阴极生成0.5mol偶氮苯,故D错误;
故选D。
5.D
【分析】由图可知,①中与直流电源正极相连的石墨电极为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯气,铜电极为阴极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子;②中氯气与氢硫酸溶液反应生成盐酸和硫沉淀;③中氯气将溶液中亚铁离子氧化为铁离子,铁离子与溶液中硫氰酸根离子反应生成硫氰化铁,使溶液变为红色,后氯气将溶液中硫氰酸根离子氧化,导致溶液褪色;④中氯气与硫代硫酸钠溶液反应生成硫酸钠、盐酸和硫酸。
【详解】A.由分析可知,铜电极为阴极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子,所以铜极附近逸出气泡,溶液pH升高,故A正确;
B.由分析可知,②中发生的反应为氯气与氢硫酸溶液反应生成盐酸和硫沉淀,反应中氯元素的化合价降低被还原,氯气时反应的氧化剂,硫元素的化合价升高被氧化,硫是反应的氧化产物,由氧化剂的氧化性强于氧化产物可知,氯气的氧化性强于硫,故B正确;
C.由分析可知,③中发生的反应为氯气将溶液中亚铁离子氧化为铁离子,铁离子与溶液中硫氰酸根离子反应生成硫氰化铁,使溶液变为红色,后氯气将溶液中硫氰酸根离子氧化,导致溶液褪色,则取③中溶液,滴加硫氰化钾溶液,观察溶液颜色变化可以确定硫氰酸根离子是否被氧化,故C正确;
D.酸性条件下,硫代硫酸根离子能与硝酸根离子反应生成硫酸根离子,则用盐酸酸化的硝酸钡溶液不能确认④中是否生成了硫酸根离子,故D错误;
故选D。
6.B
【分析】根据酸室中得到高浓度盐酸可知,中间室的通过阴离子交换膜移向酸室,判断电极a为阴极,电极b为阳极,据此分析。
【详解】A.电极a的电势低于电极b的电势,A项错误;
B.由图可知,电极b是阳极,右侧双极膜中进入酸室生成盐酸,向右迁移进入阳极室,电极为阴极,左侧双极膜中向左迁移进入阴极室,向右迁移进入碱室,B项正确;
C.去掉双极膜,电极b的电极反应变为失电子,C项错误;
D.电极b是阳极,应发生氧化反应,电极a为阴极,电极反应式为,D项错误;
故选B。
7.D
【详解】A.配制一定物质的量浓度的溶液,定容后,反复上下颠倒,摇匀,A项正确;
B.电解液可选择溶液,若使用铜氨溶液,镀层更光亮,B项正确;
C.可在坩埚中进行钠与氧气加热时的反应,C项正确;
D.因为反应后仍有浓硫酸,需将反应后的混合物沿烧杯内壁注入水中,边加边搅拌,D项错误;
故选D。
8.D
【详解】A.电镀时,待镀铁制品为阴极,应与直流电源负极相连,故A正确;
B.电解池中,阴离子向阳极移动,通电后,溶液中的移向阳极,故B正确;
C.电镀铜时,阳极Cu-2e-=Cu2+ ,阴极Cu2++2e-=Cu,理论上阳极和阴极的质量变化相等,故C正确;
D.电镀时,待镀铁制品为阴极,阴极电极方程式为:Cu2++2e-=Cu,待镀铁制品增重2.56 g,生成=0.04,电路中通过的电子为0.04 mol×2=0.08mol,故D错误;
故选D。
9.B
【详解】A.由分析可知,放电时,a电极为原电池的负极,A错误;
B.由分析可知,充电时,b极与电源正极连接,反应为,B正确;
C.未指明温度与压强,无法计算,C错误;
D.由分析可知,充电过程中,a极产生氢氧根,a极附近增大,b极消耗氢氧根,b极附近减小,D错误。
答案选B。
10.C
【分析】由图可知,图乙为电解池,右侧电极上得电子被还原生成,则右侧为阴极,则B为电源负极,阴极反应式为。
【详解】A.Pt电极上发生失电子的反应,是氧化反应,A正确;
B.阳离子向阴极移动,由电解池左侧移向右侧,B正确;
C.当外电路转移2mol电子时,两极共收集15.68L气体,没有指明温度和压强,无法计算,C错误;
D.阴极反应式为,D正确;
故选C。
11.B
【分析】第一步的原理为电解池,通入氧气的一极为阴极,电极反应式为,阳极反应为;第二步的原理为原电池,银电极为负极,电极反应式为,正极反应为;第三步的原理为电解池,银电极上氯化银转化为银,发生还原反应,银电极为阴极,总反应为。
【详解】A.由图可知,第三步中Ag电极的变化是AgCl得到电子转化为Ag,发生还原反应,是阴极,则a为直流电源的负极,故A错误;
B.第一步为电解池,阳极反应为,阴极反应为,根据得失电子守恒,可得第一步电解池的总反应为,故B正确;
C.第二步为原电池,正极反应为,负极反应为,生成的AgCl附着在负极表面,故正、负极质量均增加,故C错误;
D.第三步的总反应为,溶液中HCl的物质的量保持不变,故D错误;
故答案为:B。
12.BD
【分析】该装置为电解池,左侧为阳极,电极反应式为,右侧为阴极,电极反应式为Co2++2e-=Co,A为阳离子交换膜,阳极室的H+移动向产品室,B为阴离子交换膜,阴极室的Cl-移动向产品室,在产品室获得盐酸,据此解答。
【详解】A.石墨电极与电源正极相连作阳极,Co电极与电源负极相连作阴极,因此电势:石墨电极>Co电极,故A正确;
B.根据分析可知,A为阳离子交换膜,B为阴离子交换膜,故B错误;
C.阳极反应式:,故C正确;
D.外电路中通过时,有1molCo2+转化为Co,有2molCl-从阴极室移动向产品室,则阴极溶液减少1molCoCl2,质量减少,故D错误;
故选BD。
13.C
【分析】从图2可知,M金属催化剂,催化氢氧根离子在电极A发生失电子的氧化反应生成氧气,电极反应式为,所以电极A为阳极,电极B为阴极。
【详解】A.由图可知,电极A上发生的反应存在氢氧极性键的断裂与氢氧极性键的生成,A正确;
B.去掉隔水薄膜,氯离子会在阳极A电极失去电子发生氧化反应生成氯气,B正确;
C.电极B为阴极,水放电发生还原反应生成氢气和氢氧根离子:,则加入铁离子会生成氢氧化铁沉淀变浑浊,C错误;
D.电解总反应为,每当有标准状况下的气体生成时,则生成氧气,,故会有电子从电极A流向电极,D正确;
故选C。
14.B
【分析】钒电池放电时,阳离子向正极移动,则a为正极,b为负极,右图为电解池,电解含硝酸铵的废水制备硝酸和氨水,c电极为阴极,d电极为阳极。
【详解】A.用钒电池处理废水时,阳离子向正极移动,则a为正极,b为负极,b电极区发生氧化反应,二价钒转化为三价钒,所以溶液由紫色变成绿色,故A错误;
B.a为正极,b为负极,所以电解池中电解含硝酸铵的废水制备硝酸和氨水时,c电极为阴极,d电极为阳极,故B正确;
C.电解含硝酸铵的废水制备硝酸和氨水时,c电极为阴极、d电极为阳极,阴极上水得电子生成氢气和OH-,废水中通过隔膜1进入X区,OH-与结合生成,阳极上水失电子生成氧气和H+,废水中通过隔膜2进入Y区,H+与结合为HNO3,所以隔膜1为阳离子交换膜,隔膜2为阴离子交换膜,故C错误;
D.正极反应式为,负极反应式为V2+-e-=V3+,所以当原电池转移2mol电子时,有2molH+通过质子交换膜,阳极反应式为,阴极反应式为,即阴极上水得电子生成氢气和OH-,废水中通过隔膜1进入X区,OH-与结合生成,阳极上水失电子生成氧气和H+,废水中通过隔膜2进入Y区,H+与结合为HNO3,当原电池中有2molH+通过质子交换膜时,电路中转移2mol电子,阴极生成的2molOH-与2mol结合生成2mol,阳极生成的2molH+与2mol结合为2mol HNO3,所以当原电池有2molH+通过质子交换膜,处理的硝酸铵的物质的量为2mol,质量为2mol×80g/mol=160g,故D错误;
故答案为:B。
15.(1)负极
(2) 2H2O-4e-=O2↑+4H+ Cu2++2e-=Cu 2Cu +2H O2Cu+O +4H 2Cl--2e-=Cl2↑ 2H2O+2e-=H2↑+2OH- 2Cl- +2H2O2OH- +Cl2↑+H2↑
(3) 镀件 AgNO3
【分析】将直流电源接通后,F极附近呈红色,说明F极的电极反应式为2H2O+2e-=H2↑+2OH-,则F极为阴极;结合装置图,C、E、G、X极为阳极,D、F、H、Y极为阴极,则A为外接电源的正极,B为外接电源的负极;据此分析作答。
【详解】(1)F极附近呈红色,说明F极的电极反应式为2H2O+2e-=H2↑+2OH-,则F极为阴极,E是阳极,则A极为电源正极,B为电源负极;
(2)根据第一问分析可知,A为正极,B为负极,则若甲、乙装置中的电解质溶液是足量的,C、D、E、F的电极反应式和总反应依次为C:2H2O-4e-=O2↑+4H+、D:Cu2++2e-=Cu,甲总反应为:2Cu +2H O2Cu+O +4H ;E:2Cl--2e-=Cl2↑、F:2H2O+2e-=H2↑+2OH-,乙总反应为:2Cl- +2H2O2OH- +Cl2↑+H2↑ ;
(3)现用丙装置给铜件镀银,则G极为Ag,H极为铜件,即H极为镀件,电镀液为AgNO3溶液。
16.(1) 阳 4NaCl+2H2O+O22Cl2↑+4NaOH 增加
(2) 化学能转化为电能 增大与空气的接触面积,提高CO2的捕捉效率 2CO2+2e—=C2O b 2C2O—4e—=4CO2↑+O2↑ 7.5
【详解】(1)由图可知,与直流电源正极相连的电极A为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯气,钠离子通过阳离子交换膜移向阴极室,电极B为电解池的阴极,水分子作用下氧气在阴极得到电子发生还原反应生成氢氧根离子,在阴极室制得氢氧化钠,则电解的总反应为电解通入氧气的氯化钠溶液生成氯气和氢氧化钠;
①由分析可知,电解时,阳极室的钠离子通过阳离子交换膜移向阴极室,故答案为:阳;
②由分析可知,电解时,在阴极室制得氢氧化钠,则右侧溶液质量增加,电解的总反应为电解通入氧气的氯化钠溶液生成氯气和氢氧化钠,反应的化学方程式为4NaCl+2H2O+O22Cl2↑+4NaOH,故答案为:4NaCl+2H2O+O22Cl2↑+4NaOH;增加;
(2)由图可知,装置甲为原电池,电极a为原电池的负极,铝在负极失去电子发生氧化反应生成铝离子,电极b为正极,二氧化碳在正极得到电子发生还原反应生成草酸根离子;装置乙为电解池,与b相连的c电极为电解池的阳极,C2O在阳极失去电子发生氧化反应生成二氧化碳和氧气,d电极为阴极,C2O在阴极得到电子发生还原反应生成碳;
①由分析可知,装置甲为化学能转化为电能的原电池,故答案为:化学能转化为电能;
②由分析可知,装置甲的b电极为正极,二氧化碳在正极得到电子发生还原反应生成草酸根离子,电极反应式为2CO2+2e—=C2O,采用多孔石墨有利于增大电极与空气的接触面积,提高三氧化碳的捕捉效率;故答案为:增大与空气的接触面积,提高CO2的捕捉效率;2CO2+2e—=C2O;
③由分析可知,装置乙为电解池,二氧化碳与氧离子反应生成C2O和碳酸根离子,与b相连的c电极为电解池的阳极,C2O在阳极失去电子发生氧化反应生成二氧化碳和氧气,电极反应式为2C2O—4e—=4CO2↑+O2↑,故答案为:b;2C2O—4e—=4CO2↑+O2↑;
④由化合价变化看,生成1mol草酸铝时,外电路转移6mol电子,由得失电子数目守恒可知,原电池的正极和电解池的阴极共捕捉二氧化碳的物质的量为6mol+6mol×=7.5mol,故答案为:7.5。
17.(1)
(2)
(3) 6.72L
(4)AC
(5) 1∶4
【分析】从图中可以看出,甲为原电池,乙、丙为电解池。加入乙醇的Pt电极为负极,通入O2的Pt电极为正极。则A为阳极,B为阴极,C为阳极,D为阴极。
【详解】(1)由分析可知,甲中负极乙醇失电子产物与电解质反应生成K2CO3等,电极反应式为。
(2)若丙中C为铝,D为石墨,W溶液为稀硫酸,则铝为阳极,石墨为阴极,若能使铝的表面生成一层致密的氧化膜(Al2O3),则C电极反应式为。
(3)若A、B、C、D均为石墨,W溶液为饱和氯化钠溶液:
a.丙中电解饱和食盐水,总化学方程式为。
b.工作一段时间后,向乙中所得溶液加入0.1mol Cu2(OH)2CO3恰好使电解质溶液复原,相当于加入0.2molCuO、0.1molH2O,也即相当于有0.3molO原子失电子,共失电子0.6mol,则丙中D电极上可建立关系式2H+——H2——2e-,生成H2的物质的量为0.3mol,气体标况下的体积为0.3mol×22.4L/mol=6.72L。
(4)若把乙装置改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),则A为粗铜,B为纯铜。
A.由分析可知,A为粗铜,失电子发生氧化反应,A正确;
B.精炼铜时,阳极不仅有Cu失电子,还有比Cu活泼的金属失电子,而阴极只有Cu2+得电子,所以CuSO4溶液的浓度减小,B不正确;
C.在铜的精炼过程中,比铜活动性弱的金属将以单质的形式沉积在电解槽底部形成阳极泥,这些金属通常为金、银等,所以阳极泥可用来提取贵金属,C正确;
D.电解过程中,由于失电子与得电子的金属元素不同,所以阳极减少的质量与阴极增加的质量不相等,D不正确;
故选AC。
(5)①在阳极,NO失电子产物与电解质反应,生成等,则阳极反应式为。
②将电解生成的HNO3全部转化为NH4NO3,阴极NO+5e-+6H+=+H2O,电解总反应式为8NO+7H2O=3NH4NO3+2HNO3,通入NH3与HNO3发生反应NH3+HNO3=NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为2∶8=1∶4。
【点睛】电解CuSO4溶液时,当Cu2+得电子完全后,阴极的H+将继续得电子。
18.(1) D 增加6.4g
(2) 阳 33.6
【详解】(1)①CO具有还原性,在负极上发生氧化反应生成CO2,A极电极反应式为:;
②燃料电池中A极为负极,B极为正极,要用燃料电池为电源进行粗铜的精炼实验,则B极应与粗铜D极相连;
③当消耗标准状况下时,根据,电路中转移0.2mole-,C电极析出0.1molCu,质量增加6.4g;
(2)①电解池中,阴离子移向阳极,电解过程中,向阳极移动;阳极铁失电子生成高铁酸根,电极反应式为:;
②若阳极有溶解,电路中转移3mole-,根据阴极反应式:,生成1.5molH2,阴极析出的气体在标准状况下的体积为33.6L
一、单选题
1.(2024下·山东·高三校联考开学考试)硝酮是重要的有机合成中间体,可采用“成对间接电氧化”法合成.电解槽中水溶液的主要成分及反应过程如图所示,下列说法错误的是
A.惰性电极1为阴极
B.反应前后数量均不变
C.消耗氧气,可得到硝酮
D.外电路通过电子,可得到水
2.(2024·云南昆明·统考三模)科学家设计了一种以石墨为正极的高容量可充电Li/Cl2电池,原理如图所示。氯化铝(AlCl3)溶解在亚硫酰氯(SOCl2)中,以氟化物(LiFSI)为溶剂。下列叙述正确的是
A.放电时,电解质溶液可以是AlCl3水溶液
B.放电时,石墨极的电极反应式为Cl2+2e-+2Li+=2LiCl
C.充电时,石墨极与电源负极连接
D.充电时,转移2NA个电子时锂电极理论上消耗7g锂
3.(2024·黑龙江哈尔滨·哈尔滨三中校考一模)高电压水系锌—有机混合液流电池的装置如图所示。下列说法错误的是
A.放电时Zn作负极,反应式为,负极区溶液pH减小
B.放电时正极反应式为
C.充电时电路中每转移2mol电子,理论上负极增重65g
D.充电时中性电解质NaCl的浓度减小
4.(2024下·重庆·高三重庆八中校联考开学考试)我国科技工作者设计以 和 纳米片为催化电极材料,电催化合成偶氮化合物的装置如图所示 (代表烃基,极产物为偶氮苯),该装置工作时,下列说法错误的是
A.从右往左移动
B.电极的电极电势高于电极
C.极反应为:2+8e—+4H2O=+8OH—
D.消耗 的同时生成 偶氮苯
5.(2024下·湖南长沙·高三长沙一中开学考试)某小组设计实验探究氯气的性质,装置如图所示:
实验中观察到③中溶液先变红色,后褪色。
资料显示:④中反应为
下到叙述错误的是
A.铜极附近逸出气泡,其溶液升高
B.②中溶液变浑浊,可推知氯的非金属性比硫的强
C.取③中溶液,滴加溶液可判断是否被氧化
D.用硝酸酸化的溶液可验证④中是否生成了
6.(2024下·河北保定·高三河北安国中学校联考开学考试)在直流电场作用下双极膜中间层中的解离为和,并分别向两极迁移.如图所示装置,可将捕捉的二氧化碳转化为而矿化封存,减少碳排放,同时得到氧气、氢气、高浓度盐酸等产品.下列说法正确的是
A.电极a的电势高于电极b的电势
B.两个双极膜中间层的均向右移动
C.去掉双极膜,两极的电极反应式不变
D.电极b为阴极,电极反应式为
7.(2024下·河北保定·高三河北安国中学校联考开学考试)下列实验装置或操作不能达到实验目的的是
甲 乙 丙 丁
A.图甲的操作为将定容后的溶液摇匀
B.以铜氨溶液为电镀液,用乙装置进行铁制镀件镀铜
C.用丙装置观察钠在空气中燃烧的现象
D.用丁装置检验浓硫酸与铜反应后的产物中是否含有
8.(2024下·北京·高三北京市第九中学校考开学考试)图为电镀实验装置,下列有关叙述不正确的是
A.电镀时,待镀铁制品应与直流电源负极相连 B.通电后,溶液中的移向阳极
C.镀铜时,理论上阳极和阴极的质量变化相等 D.待镀铁制品增重2.56 g,电路中通过的电子为0.04 mol
9.(2024下·河北·高三校联考开学考试)我国化学家成功开发出锌—空气二次电池,其工作原理如图所示.下列说法正确的是
A.放电时,a极是原电池的正极,充电时与电源正极相连
B.充电时,b极发生反应:
C.放电时,当b极消耗时,电路中有通过
D.充电过程中,a、b电极附近溶液均不变
10.(2024上·黑龙江牡丹江·高三牡丹江市第二高级中学校联考期末)硝酸盐本身对人体没有很大伤害,但在人的口腔和肠道细菌会将硝酸盐转化为亚硝酸盐,可能会使得人体积累亚硝酸盐。下图是电化学降解酸性废水中的工作原理示意图。下列有关叙述错误的是
A.Pt电极上发生的是氧化反应
B.由电解池左侧移向右侧
C.当外电路转移2mol电子时,两极一定会收集到标况下15.68L气体
D.阴极反应式为
11.(2024上·河北石家庄·高三校联考期末)一种清洁、低成本的三步法氯碱工艺工作原理的示意图如下,下列说法正确的是
A.第三步中a为直流电源的正极
B.第一步生产的总反应为
C.第二步为原电池,正极质量增加,负极质量减少
D.第三步外电路上每转移电子,电解池中就有被电解
12.(2023上·山东济南·高三济南市历城第二中学校考期末)Co是维生素的重要组成元素。工业上可用下图装置制取单质Co并获得副产品盐酸。下列说法错误的是
A.电势:石墨电极电极
B.A膜为阴离子交换膜
C.阳极反应式:
D.外电路中通过时,阴极室溶液质量减轻59g
13.(2024·浙江宁波·镇海中学校考模拟预测)我国科学家开发出碱性海水里直接电解制氢的技术,工作原理如图1所示。隔水薄膜可以起到阻挡与电极催化剂活性中心接触的作用,电极A含有M金属的催化剂,发生的电极反应过程如图2所示,离子交换膜选择性透过参与电极A反应的物质。下列说法错误的是
A.电极A上发生的反应存在极性键的断裂与生成
B.若去掉隔水薄膜,会在A电极失去电子生成
C.电解结束后,电极B处去掉海水隔水膜,所得溶液中加入适量溶液无混浊现象
D.每当有标准状况下的气体生成时,就会有电子从电极A流向电极B
14.(2024上·河北石家庄·高三正定中学校考期末)大气中过量的和水体中过量的均是污染物。利用钒电池电解含的废水制备硝酸和氨水的原理如下图所示,均为惰性电极。下列说法中正确的是
A.用钒电池处理废水时,电极区溶液由绿色变成紫色
B.为阴极,为阳极
C.隔膜1为阴离子交换膜
D.当钒电池有通过质子交换膜时,共处理含的废水
二、非选择题
15.(2024下·宁夏吴忠·高三青铜峡市高级中学校考开学考试)如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙装置中溶液的体积和浓度都相同,A、B为外接直流电源的两极。将直流电源接通后,F电极附近呈红色。
请回答:
(1)B极是电源的 。
(2)若甲、乙装置中的电解质溶液是足量的,则写出C、D、E、F各电极上的电极反应式和总反应方程式:C电极反应式: 。D电极反应式: 。甲中总反应方程式: 。E电极反应式: 。F电极反应式: 。乙中总反应方程式: 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。
16.(2024上·山西朔州·高三统考期末)电化学在实际生活生产中十分常见,如环境保护,利用电化学进行物质制备等。回答下列问题:
(1)氯碱工业能耗大,通过如图改进的设计可大幅度降低能耗。
①离子交换膜应选择 离子交换膜(填“阴或“阳”)。
②反应的总化学方程式为 ,电解一段时间后,右侧溶液质量 (填“增加”或“减少)。
(2)目前科学人员研究发现,用甲、乙电化学装置联合能够捕捉CO2。
①装置甲的能量转化方式主要为 。
②装置甲的b电极采用多孔石墨的目的是 ;b电极的电极反应式为 。
③装置乙中的c电极与装置甲的 (填字母)电极相连接,c电极的电极反应式为 。
④当生成1mol草酸铝时,甲、乙装置联合能够捕捉 molCO2。
17.(2024上·湖北·高三湖北省武汉市汉铁高级中学校联考期末)I.乙醇是一种重要的化工原料和新型燃料。如图是乙醇燃料电池工作的示意图,工作一段时间后,断开K。
(1)甲中负极的电极反应式为 。
(2)若丙中C为铝,D为石墨,W溶液为稀硫酸,若能使铝的表面生成一层致密的氧化膜,则C电极反应式为 。
(3)若A、B、C、D均为石墨,W溶液为饱和氯化钠溶液:
a.丙中电解的总化学方程式为 。
b.工作一段时间后,向乙中所得溶液加入0.1mol Cu2(OH)2CO3后恰好使电解质溶液复原,则丙中D电极上生成的气体标况下的体积为 。
(4)若把乙装置改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),下列说法正确的是______。
A.A为粗铜,发生氧化反应
B.CuSO4溶液的浓度保持不变
C.部分杂质将以单质的形式沉积在电解槽底部形成阳极泥,阳极泥可用来提取贵金属
D.电解过程中,阳极减少的质量与阴极增加的质量相等
Ⅱ.电解硝酸工业的尾气NO可制备NH4NO3,,其工作原理如右图所示:
(5)①阳极的电极反应式为 。
②将电解生成的HNO3全部转化为NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为 。
18.(2024上·重庆长寿·高三重庆市长寿中学校校联考期末)完成下列问题。
(1)如图1是一种新型燃料电池,它以CO为燃料,一定比例的和熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。回答下列问题:
①写出A极发生的电极反应式 。
②要用燃料电池为电源进行粗铜的精炼实验,则B极应与 极相连(填“C”或“D”)。
③当消耗标准状况下时,C电极的质量变化为 。
(2)工业上,可用铁作阳极,电解溶液制备。
①电解过程中,向 (填“阴”或“阳”)极移动,阳极的电极反应式为 。
②若阳极有溶解,则阴极析出的气体在标准状况下的体积为 L。
试卷第1页,共3页
参考答案:
1.D
【详解】A.在惰性电极1上化合价降低被还原为,因此惰性电极1为阴极,故A正确;
B.根据图中信息得到循环反应,反应前后数量均不变,故B正确;
C.总反应为氧气将二丁基羟基胺氧化为硝酮,二丁基羟基胺失去原子生成硝酮,氧气最终生成水,根据氧原子守恒,消耗氧气,可得到硝酮,故C正确;
D.外电路通过电子,消耗,根据C选项分析消耗氧气,可得到硝酮和2mol水,因此外电路通过电子,可得到水,故D错误。
综上所述,答案为D。
2.B
【分析】具有石墨正极的高容量Li/Cl2可充电电池,放电时锂为负极,锂失电子发生氧化反应,电极反应式为Li-e-=Li+,石墨为正极,氯气得电子发生还原反应,电极反应式为Cl2+2e-+2Li+=2LiCl,充电时锂电极端为阴极,发生还原反应:Li++e-=Li,石墨电极端为阳极,发生氧化反应:2LiCl-2e-=Cl2↑+2Li+,据此分析;
【详解】A.锂是活泼金属,会与水反应,不能用水溶液,A错误;
B.根据分析,放电时,石墨极的电极反应式为:Cl2+2e-+2Li+=2LiCl,B正确;
C.充电时石墨电极端为阳极,与电源正极连接,C错误;
D.充电时,根据电极方程式Li++e-=Li,转移2NA个电子时,锂电极理论上生成14g锂,D错误;
故选B。
3.B
【分析】高电压水系锌-有机混合液流电池工作原理为:放电时为原电池,金属Zn发生失电子的氧化反应生成Zn2+,为负极,则FQ所在电极为正极,正极反应式为2FQ+2e-+2H+═FQH2,负极反应式为Zn-2e-+4OH-=;充电时电解池,原电池的正负极连接电源的正负极,阴阳极的电极反应与原电池的负正极的反应式相反,电解质中阳离子移向阴极、阴离子移向阳极,据此分析解答。
【详解】A.放电时为原电池,金属Zn为负极,负极反应式为Zn-2e-+4OH-=,负极区消耗氢氧根离子则溶液pH减小,故A正确;
B.放电时为原电池,正极反应式为2FQ+2e-+2H+═FQH2,故B错误;
C.负极反应式为Zn-2e-+4OH-=,每转移2mol电子,理论上负极增重1molZn,质量为m=n M=1mol×65g/mol=65g,故C正确;
D.充电时电解池,电解质中阳离子移向阴极、阴离子移向阳极,NaCl溶液中的钠离子和氯离子分别发生定向移动,即电解质NaCl的浓度减小,故D正确;
故选:B。
4.D
【分析】由图可知,与直流电源正极相连的电极a为电解池的阳极,碱性条件下RCH2NH2在阳极失去电子发生氧化反应生成RCN,电极反应式为RCH2NH2—4e—+4OH—=RCN+4H2O,电极b为阴极,水分子作用下在阴极得到电子发生还原反应生成和水,电极反应式为2+8e—+4H2O=+8OH—。
【详解】A.由分析可知,电极a为电解池的阳极,电极b为阴极,则阴离子氢氧根离子从右往左移动,故A正确;
B.由分析可知,电极a为电解池的阳极,电极b为阴极,则电极a的电极电势高于电极b,故B正确;
C.由分析可知,电极b为阴极,水分子作用下在阴极得到电子发生还原反应生成和水,电极反应式为2+8e—+4H2O=+8OH—,故C正确;
D.由得失电子数目守恒可知,阳极消耗1mol RCH2NH2的同时阴极生成0.5mol偶氮苯,故D错误;
故选D。
5.D
【分析】由图可知,①中与直流电源正极相连的石墨电极为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯气,铜电极为阴极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子;②中氯气与氢硫酸溶液反应生成盐酸和硫沉淀;③中氯气将溶液中亚铁离子氧化为铁离子,铁离子与溶液中硫氰酸根离子反应生成硫氰化铁,使溶液变为红色,后氯气将溶液中硫氰酸根离子氧化,导致溶液褪色;④中氯气与硫代硫酸钠溶液反应生成硫酸钠、盐酸和硫酸。
【详解】A.由分析可知,铜电极为阴极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子,所以铜极附近逸出气泡,溶液pH升高,故A正确;
B.由分析可知,②中发生的反应为氯气与氢硫酸溶液反应生成盐酸和硫沉淀,反应中氯元素的化合价降低被还原,氯气时反应的氧化剂,硫元素的化合价升高被氧化,硫是反应的氧化产物,由氧化剂的氧化性强于氧化产物可知,氯气的氧化性强于硫,故B正确;
C.由分析可知,③中发生的反应为氯气将溶液中亚铁离子氧化为铁离子,铁离子与溶液中硫氰酸根离子反应生成硫氰化铁,使溶液变为红色,后氯气将溶液中硫氰酸根离子氧化,导致溶液褪色,则取③中溶液,滴加硫氰化钾溶液,观察溶液颜色变化可以确定硫氰酸根离子是否被氧化,故C正确;
D.酸性条件下,硫代硫酸根离子能与硝酸根离子反应生成硫酸根离子,则用盐酸酸化的硝酸钡溶液不能确认④中是否生成了硫酸根离子,故D错误;
故选D。
6.B
【分析】根据酸室中得到高浓度盐酸可知,中间室的通过阴离子交换膜移向酸室,判断电极a为阴极,电极b为阳极,据此分析。
【详解】A.电极a的电势低于电极b的电势,A项错误;
B.由图可知,电极b是阳极,右侧双极膜中进入酸室生成盐酸,向右迁移进入阳极室,电极为阴极,左侧双极膜中向左迁移进入阴极室,向右迁移进入碱室,B项正确;
C.去掉双极膜,电极b的电极反应变为失电子,C项错误;
D.电极b是阳极,应发生氧化反应,电极a为阴极,电极反应式为,D项错误;
故选B。
7.D
【详解】A.配制一定物质的量浓度的溶液,定容后,反复上下颠倒,摇匀,A项正确;
B.电解液可选择溶液,若使用铜氨溶液,镀层更光亮,B项正确;
C.可在坩埚中进行钠与氧气加热时的反应,C项正确;
D.因为反应后仍有浓硫酸,需将反应后的混合物沿烧杯内壁注入水中,边加边搅拌,D项错误;
故选D。
8.D
【详解】A.电镀时,待镀铁制品为阴极,应与直流电源负极相连,故A正确;
B.电解池中,阴离子向阳极移动,通电后,溶液中的移向阳极,故B正确;
C.电镀铜时,阳极Cu-2e-=Cu2+ ,阴极Cu2++2e-=Cu,理论上阳极和阴极的质量变化相等,故C正确;
D.电镀时,待镀铁制品为阴极,阴极电极方程式为:Cu2++2e-=Cu,待镀铁制品增重2.56 g,生成=0.04,电路中通过的电子为0.04 mol×2=0.08mol,故D错误;
故选D。
9.B
【详解】A.由分析可知,放电时,a电极为原电池的负极,A错误;
B.由分析可知,充电时,b极与电源正极连接,反应为,B正确;
C.未指明温度与压强,无法计算,C错误;
D.由分析可知,充电过程中,a极产生氢氧根,a极附近增大,b极消耗氢氧根,b极附近减小,D错误。
答案选B。
10.C
【分析】由图可知,图乙为电解池,右侧电极上得电子被还原生成,则右侧为阴极,则B为电源负极,阴极反应式为。
【详解】A.Pt电极上发生失电子的反应,是氧化反应,A正确;
B.阳离子向阴极移动,由电解池左侧移向右侧,B正确;
C.当外电路转移2mol电子时,两极共收集15.68L气体,没有指明温度和压强,无法计算,C错误;
D.阴极反应式为,D正确;
故选C。
11.B
【分析】第一步的原理为电解池,通入氧气的一极为阴极,电极反应式为,阳极反应为;第二步的原理为原电池,银电极为负极,电极反应式为,正极反应为;第三步的原理为电解池,银电极上氯化银转化为银,发生还原反应,银电极为阴极,总反应为。
【详解】A.由图可知,第三步中Ag电极的变化是AgCl得到电子转化为Ag,发生还原反应,是阴极,则a为直流电源的负极,故A错误;
B.第一步为电解池,阳极反应为,阴极反应为,根据得失电子守恒,可得第一步电解池的总反应为,故B正确;
C.第二步为原电池,正极反应为,负极反应为,生成的AgCl附着在负极表面,故正、负极质量均增加,故C错误;
D.第三步的总反应为,溶液中HCl的物质的量保持不变,故D错误;
故答案为:B。
12.BD
【分析】该装置为电解池,左侧为阳极,电极反应式为,右侧为阴极,电极反应式为Co2++2e-=Co,A为阳离子交换膜,阳极室的H+移动向产品室,B为阴离子交换膜,阴极室的Cl-移动向产品室,在产品室获得盐酸,据此解答。
【详解】A.石墨电极与电源正极相连作阳极,Co电极与电源负极相连作阴极,因此电势:石墨电极>Co电极,故A正确;
B.根据分析可知,A为阳离子交换膜,B为阴离子交换膜,故B错误;
C.阳极反应式:,故C正确;
D.外电路中通过时,有1molCo2+转化为Co,有2molCl-从阴极室移动向产品室,则阴极溶液减少1molCoCl2,质量减少,故D错误;
故选BD。
13.C
【分析】从图2可知,M金属催化剂,催化氢氧根离子在电极A发生失电子的氧化反应生成氧气,电极反应式为,所以电极A为阳极,电极B为阴极。
【详解】A.由图可知,电极A上发生的反应存在氢氧极性键的断裂与氢氧极性键的生成,A正确;
B.去掉隔水薄膜,氯离子会在阳极A电极失去电子发生氧化反应生成氯气,B正确;
C.电极B为阴极,水放电发生还原反应生成氢气和氢氧根离子:,则加入铁离子会生成氢氧化铁沉淀变浑浊,C错误;
D.电解总反应为,每当有标准状况下的气体生成时,则生成氧气,,故会有电子从电极A流向电极,D正确;
故选C。
14.B
【分析】钒电池放电时,阳离子向正极移动,则a为正极,b为负极,右图为电解池,电解含硝酸铵的废水制备硝酸和氨水,c电极为阴极,d电极为阳极。
【详解】A.用钒电池处理废水时,阳离子向正极移动,则a为正极,b为负极,b电极区发生氧化反应,二价钒转化为三价钒,所以溶液由紫色变成绿色,故A错误;
B.a为正极,b为负极,所以电解池中电解含硝酸铵的废水制备硝酸和氨水时,c电极为阴极,d电极为阳极,故B正确;
C.电解含硝酸铵的废水制备硝酸和氨水时,c电极为阴极、d电极为阳极,阴极上水得电子生成氢气和OH-,废水中通过隔膜1进入X区,OH-与结合生成,阳极上水失电子生成氧气和H+,废水中通过隔膜2进入Y区,H+与结合为HNO3,所以隔膜1为阳离子交换膜,隔膜2为阴离子交换膜,故C错误;
D.正极反应式为,负极反应式为V2+-e-=V3+,所以当原电池转移2mol电子时,有2molH+通过质子交换膜,阳极反应式为,阴极反应式为,即阴极上水得电子生成氢气和OH-,废水中通过隔膜1进入X区,OH-与结合生成,阳极上水失电子生成氧气和H+,废水中通过隔膜2进入Y区,H+与结合为HNO3,当原电池中有2molH+通过质子交换膜时,电路中转移2mol电子,阴极生成的2molOH-与2mol结合生成2mol,阳极生成的2molH+与2mol结合为2mol HNO3,所以当原电池有2molH+通过质子交换膜,处理的硝酸铵的物质的量为2mol,质量为2mol×80g/mol=160g,故D错误;
故答案为:B。
15.(1)负极
(2) 2H2O-4e-=O2↑+4H+ Cu2++2e-=Cu 2Cu +2H O2Cu+O +4H 2Cl--2e-=Cl2↑ 2H2O+2e-=H2↑+2OH- 2Cl- +2H2O2OH- +Cl2↑+H2↑
(3) 镀件 AgNO3
【分析】将直流电源接通后,F极附近呈红色,说明F极的电极反应式为2H2O+2e-=H2↑+2OH-,则F极为阴极;结合装置图,C、E、G、X极为阳极,D、F、H、Y极为阴极,则A为外接电源的正极,B为外接电源的负极;据此分析作答。
【详解】(1)F极附近呈红色,说明F极的电极反应式为2H2O+2e-=H2↑+2OH-,则F极为阴极,E是阳极,则A极为电源正极,B为电源负极;
(2)根据第一问分析可知,A为正极,B为负极,则若甲、乙装置中的电解质溶液是足量的,C、D、E、F的电极反应式和总反应依次为C:2H2O-4e-=O2↑+4H+、D:Cu2++2e-=Cu,甲总反应为:2Cu +2H O2Cu+O +4H ;E:2Cl--2e-=Cl2↑、F:2H2O+2e-=H2↑+2OH-,乙总反应为:2Cl- +2H2O2OH- +Cl2↑+H2↑ ;
(3)现用丙装置给铜件镀银,则G极为Ag,H极为铜件,即H极为镀件,电镀液为AgNO3溶液。
16.(1) 阳 4NaCl+2H2O+O22Cl2↑+4NaOH 增加
(2) 化学能转化为电能 增大与空气的接触面积,提高CO2的捕捉效率 2CO2+2e—=C2O b 2C2O—4e—=4CO2↑+O2↑ 7.5
【详解】(1)由图可知,与直流电源正极相连的电极A为电解池的阳极,氯离子在阳极失去电子发生氧化反应生成氯气,钠离子通过阳离子交换膜移向阴极室,电极B为电解池的阴极,水分子作用下氧气在阴极得到电子发生还原反应生成氢氧根离子,在阴极室制得氢氧化钠,则电解的总反应为电解通入氧气的氯化钠溶液生成氯气和氢氧化钠;
①由分析可知,电解时,阳极室的钠离子通过阳离子交换膜移向阴极室,故答案为:阳;
②由分析可知,电解时,在阴极室制得氢氧化钠,则右侧溶液质量增加,电解的总反应为电解通入氧气的氯化钠溶液生成氯气和氢氧化钠,反应的化学方程式为4NaCl+2H2O+O22Cl2↑+4NaOH,故答案为:4NaCl+2H2O+O22Cl2↑+4NaOH;增加;
(2)由图可知,装置甲为原电池,电极a为原电池的负极,铝在负极失去电子发生氧化反应生成铝离子,电极b为正极,二氧化碳在正极得到电子发生还原反应生成草酸根离子;装置乙为电解池,与b相连的c电极为电解池的阳极,C2O在阳极失去电子发生氧化反应生成二氧化碳和氧气,d电极为阴极,C2O在阴极得到电子发生还原反应生成碳;
①由分析可知,装置甲为化学能转化为电能的原电池,故答案为:化学能转化为电能;
②由分析可知,装置甲的b电极为正极,二氧化碳在正极得到电子发生还原反应生成草酸根离子,电极反应式为2CO2+2e—=C2O,采用多孔石墨有利于增大电极与空气的接触面积,提高三氧化碳的捕捉效率;故答案为:增大与空气的接触面积,提高CO2的捕捉效率;2CO2+2e—=C2O;
③由分析可知,装置乙为电解池,二氧化碳与氧离子反应生成C2O和碳酸根离子,与b相连的c电极为电解池的阳极,C2O在阳极失去电子发生氧化反应生成二氧化碳和氧气,电极反应式为2C2O—4e—=4CO2↑+O2↑,故答案为:b;2C2O—4e—=4CO2↑+O2↑;
④由化合价变化看,生成1mol草酸铝时,外电路转移6mol电子,由得失电子数目守恒可知,原电池的正极和电解池的阴极共捕捉二氧化碳的物质的量为6mol+6mol×=7.5mol,故答案为:7.5。
17.(1)
(2)
(3) 6.72L
(4)AC
(5) 1∶4
【分析】从图中可以看出,甲为原电池,乙、丙为电解池。加入乙醇的Pt电极为负极,通入O2的Pt电极为正极。则A为阳极,B为阴极,C为阳极,D为阴极。
【详解】(1)由分析可知,甲中负极乙醇失电子产物与电解质反应生成K2CO3等,电极反应式为。
(2)若丙中C为铝,D为石墨,W溶液为稀硫酸,则铝为阳极,石墨为阴极,若能使铝的表面生成一层致密的氧化膜(Al2O3),则C电极反应式为。
(3)若A、B、C、D均为石墨,W溶液为饱和氯化钠溶液:
a.丙中电解饱和食盐水,总化学方程式为。
b.工作一段时间后,向乙中所得溶液加入0.1mol Cu2(OH)2CO3恰好使电解质溶液复原,相当于加入0.2molCuO、0.1molH2O,也即相当于有0.3molO原子失电子,共失电子0.6mol,则丙中D电极上可建立关系式2H+——H2——2e-,生成H2的物质的量为0.3mol,气体标况下的体积为0.3mol×22.4L/mol=6.72L。
(4)若把乙装置改为精炼铜装置(粗铜含Al、Zn、Ag、Pt、Au等杂质),则A为粗铜,B为纯铜。
A.由分析可知,A为粗铜,失电子发生氧化反应,A正确;
B.精炼铜时,阳极不仅有Cu失电子,还有比Cu活泼的金属失电子,而阴极只有Cu2+得电子,所以CuSO4溶液的浓度减小,B不正确;
C.在铜的精炼过程中,比铜活动性弱的金属将以单质的形式沉积在电解槽底部形成阳极泥,这些金属通常为金、银等,所以阳极泥可用来提取贵金属,C正确;
D.电解过程中,由于失电子与得电子的金属元素不同,所以阳极减少的质量与阴极增加的质量不相等,D不正确;
故选AC。
(5)①在阳极,NO失电子产物与电解质反应,生成等,则阳极反应式为。
②将电解生成的HNO3全部转化为NH4NO3,阴极NO+5e-+6H+=+H2O,电解总反应式为8NO+7H2O=3NH4NO3+2HNO3,通入NH3与HNO3发生反应NH3+HNO3=NH4NO3,则通入的NH3与实际参加反应的NO的物质的量之比至少为2∶8=1∶4。
【点睛】电解CuSO4溶液时,当Cu2+得电子完全后,阴极的H+将继续得电子。
18.(1) D 增加6.4g
(2) 阳 33.6
【详解】(1)①CO具有还原性,在负极上发生氧化反应生成CO2,A极电极反应式为:;
②燃料电池中A极为负极,B极为正极,要用燃料电池为电源进行粗铜的精炼实验,则B极应与粗铜D极相连;
③当消耗标准状况下时,根据,电路中转移0.2mole-,C电极析出0.1molCu,质量增加6.4g;
(2)①电解池中,阴离子移向阳极,电解过程中,向阳极移动;阳极铁失电子生成高铁酸根,电极反应式为:;
②若阳极有溶解,电路中转移3mole-,根据阴极反应式:,生成1.5molH2,阴极析出的气体在标准状况下的体积为33.6L
同课章节目录
