河南省南阳市名校2023-2024学年高二下学期开学考试化学试题(PDF版含答案)
文档属性
| 名称 | 河南省南阳市名校2023-2024学年高二下学期开学考试化学试题(PDF版含答案) |  | |
| 格式 | |||
| 文件大小 | 890.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-03 21:13:58 | ||
图片预览


文档简介
南阳市名校 2024 年春高中二年级开学考试
化学试卷
可能用到的相对原子质量:Li 7 O 16 Ti 48 Fe 56
一、单选题(每题 3 分,共 45 分,每小题只有一项符合题意)
1.化学与生活密切相关。下列叙述错误的是
A.合成氨很大程度上解决了地球上因粮食不足而导致的饥饿问题
B.工业废水处理中,常以 Na S、FeS 作沉淀剂除去废水中的 Cu2+、Hg2+2 等
C.燃料电池的反应物不是储存在电池内部,由外部供给。其电极材料可以相同
D.在铁制品上镀铜时,铁制品为阳极,铜盐溶液为电镀液
2.下列关于原子结构的说法正确的是
A.基态砷(As)原子的价电子排布式为 3d104s24p3
B.前 4 周期元素中,有 5 种元素基态原子未成对电子数与其所在周期序数相同
C.某基态原子 3d 能级电子排布为 ,违反了泡利不相容原理
D.同一原子中,2p、3p、4p 能级的轨道数随电子层数增大依次增多
3.甲醇制丙烯的反应为:3CH3OH(g) C3H6 (g) +3H2O(g) H ,已知:速率常数 k 与反应温
E
度 T、活化能E a 之间满足关系:R lg k =
a +R lg A (R 和 A 为常数)。下列说法正确的是
T
A.加催化剂能减小 H
B.升温、加压均能提高该反应的速率常数 k
1
C.若实验得出Rlgk 和 的关系如图,可计算该反应的活
T
化能E a 为184.24 kJ mol
1
D.已知CH3OH、C3H6的燃烧热可以计算该反应的 H
4.下列离子方程式书写正确的是
A.某弱酸的酸式盐 NaHB 在水溶液中水解:HB--+H + 2-2O H3O +B
B.Na S 水解:S2-2 +2H2O H2S↑+2OH-
C.惰性电极电解氯化镁溶液:2Cl-+2H2O 20H-+Cl2↑+H2↑
D.泡沫灭火器工作原理:A13++3HCO - 3 =Al(OH)3↓+3CO2↑
5.下列说法不正确的是
A.向 K2CrO4 溶液中加入稀硫酸,溶液颜色由橙色变为黄色
B.中和滴定实验中,锥形瓶用水洗涤后,不能用待测液润洗
C.中和反应反应热测定实验中,一组完整实验数据需要测温度 3 次
D.配制 FeCl3溶液时,应将 FeCl3 固体溶于较浓的盐酸中,再加水稀释到所需浓度
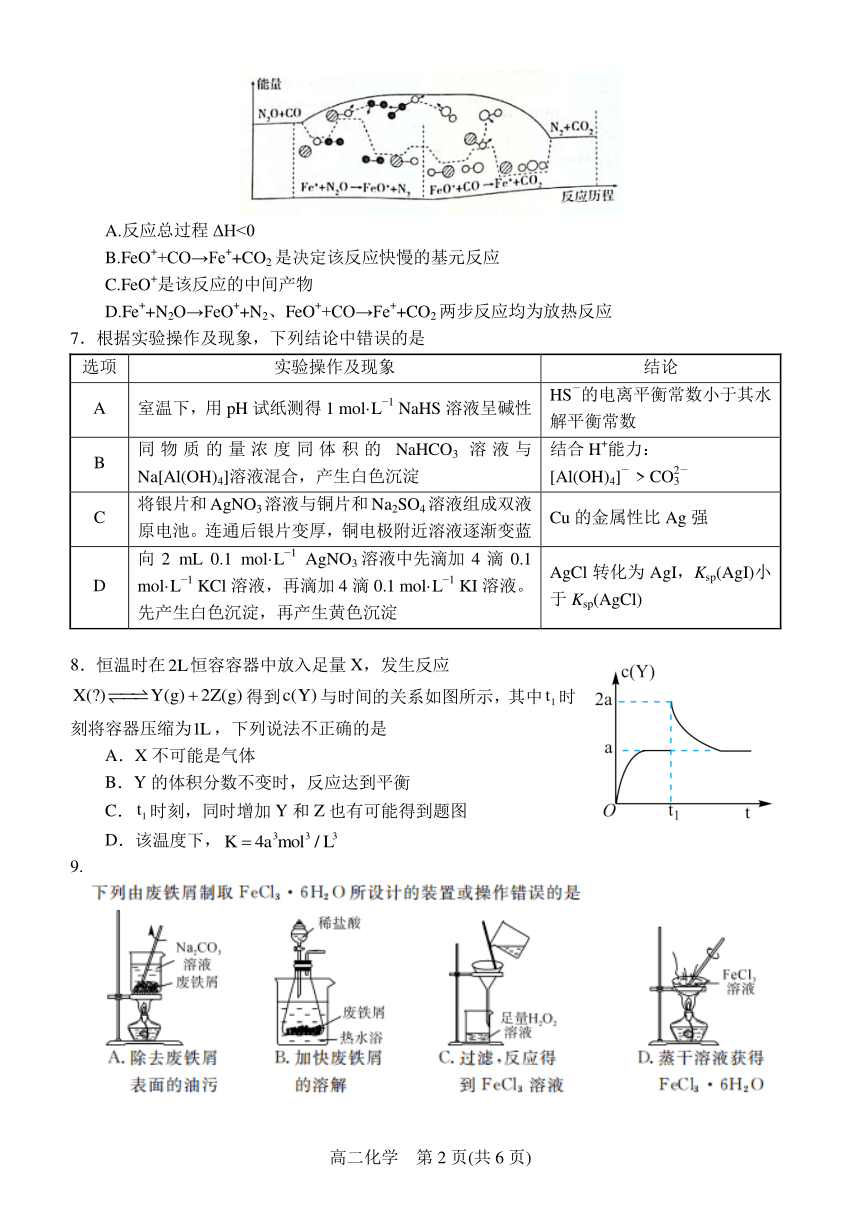
6.研究表明 N2O 与 CO 在 Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的
是
高二化学 第1页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
A.反应总过程 ΔH<0
+ +
B.FeO +CO→Fe +CO2 是决定该反应快慢的基元反应
+
C.FeO 是该反应的中间产物
+ + + +
D.Fe +N2O→FeO +N2、FeO +CO→Fe +CO2两步反应均为放热反应
7.根据实验操作及现象,下列结论中错误的是
选项 实验操作及现象 结论
-
HS 的电离平衡常数小于其水
A 室温下,用 pH 试纸测得 11 mol·L NaHS 溶液呈碱性
解平衡常数
同 物 质 的 量 浓 度 同 体 积 的 +NaHCO3 溶 液 与 结合 H 能力:
B
- -
Na[Al(OH)4]溶液混合,产生白色沉淀
2
[Al(OH)4] > CO3
将银片和AgNO3溶液与铜片和Na2SO4溶液组成双液
C Cu 的金属性比 Ag 强
原电池。连通后银片变厚,铜电极附近溶液逐渐变蓝
向 12 mL 0.1 mol·L AgNO3 溶液中先滴加 4 滴 0.1
1 1 AgCl 转化为 AgI,Ksp(AgI)小
D mol·L KCl 溶液,再滴加 4 滴 0.1 mol·L KI 溶液。
于 Ksp(AgCl)
先产生白色沉淀,再产生黄色沉淀
8.恒温时在2L恒容容器中放入足量 X,发生反应
X( ) Y(g) 2Z(g)得到c(Y)与时间的关系如图所示,其中 t1 时
刻将容器压缩为1L,下列说法不正确的是
A.X 不可能是气体
B.Y 的体积分数不变时,反应达到平衡
C. t1 时刻,同时增加 Y 和 Z 也有可能得到题图
D.该温度下,K 4a3mol3 / L3
9.
高二化学 第 2 页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
10.
11.在城市地下常埋有纵横交错的管道和输电线路,有些地面
上还铺有铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道
或铁轨形成回路时,就会引起后者的腐蚀,其原理简化如图所
示。则下列有关说法错误的是
A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,右侧 Fe 电极有无色气体产生
-
C.溶液中铁丝的左端电极反应式为 Fe-2e === Fe2+
D.地下管道被腐蚀后不易被发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜
(或油漆等)
12.常温下,向 1 L pH=10 的 NaOH 溶液中持续通入 CO2。
通入 CO2的体积(V)与溶液中水电离出的
-
OH 浓度(c)的关系如
图所示。下列叙述不正确的是
A.a 点溶液中:水电离出的 + = - -c(H ) 1×10 10 mol·L 1
B.b 点溶液中: - -c(OH )=1×10 7 mol/L
+ - -
C.c 点溶液中:c(Na )>c(CO 23 )>c(HCO3 )
D.d 点溶液中:溶液是 NaHCO3 和 H2CO3 的混合液
13.工业上电解 NO 制备 NH4NO3,其工作原理如图所示,下
列说法正确的是
A. 在电解池内电路中电子由电极甲流向电极乙
B.阴极上发生还原反应,电极反应为 NO+5H++5 e-
═NH3·H2O
C.为使电解产物全部转化为 NH4NO3,需补充物质 A 为
HNO3
D.电池两极上分别生成 甲是 NH + -4 ,乙是 NO3
14.25℃时,用 NaOH 溶液分别滴定 HX、CuSO4、FeSO4 三种溶液,pM[p 表示负对数,M 表示
c(HX)
、c(Cu2+- )、c(Fe2+)]随 pH 变化关系如图所示,已知:Ksp[Fe(OH)2]>Ksp[Cu(OH)2](不考虑
c(X )
二价铁的氧化)。下列说法错误的是
高二化学 第3页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
A.调节溶液的 pH=6.0 时,可将工业废水中的 Cu2+沉淀完全
B.曲线②代表 NaOH 溶液滴定 FeSO4溶液的变化关系
C.HX 的电离常数 Ka=1.0×10 5
D.滴定 HX 溶液至 a 点时,
- -
溶液中 c(Na+)>c(X )>c(OH )>c(H+)
15.在 t℃时,AgBr 在水中的沉淀溶解平衡曲线如下图所示,
下列说法不正确的是(已知 t℃时 Ksp(AgC1)=4.9x10-10)
A.图中 a 点对应的是 AgBr 的不饱和溶液
B.在 t℃时,AgBr 的 Ksp 为 4.9x10-13
C.在 AgBr 饱和溶液中加入 NaBr 固体,可使溶液由 c 点变到
b 点
D.在 t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数
K=1000
二、非选择题(共 4 小题,55 分)
16.氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿石主要成分是 MnCO3,还含有少量 Fe、Al、Ca、Mg 等元素;
+ -
②相关金属离子[c(Mn )=0.1 mol·L 1]形成氢氧化物沉淀时的 pH 如下:
+ + + + + +
金属离子 Al3 Fe3 Fe2 Ca2 Mn2 Mg2
开始沉淀的 pH 3.8 1.5 6.5 10.6 8.1 9.6
沉淀完全的 pH 5.2 3.7 9.7 12.6 10.1 11.6
- -
③常温下,CaF2、MgF2 的溶度积分别为 1.46×10 10、7.42×10 11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_______________________________。
(2)分析下列图 1,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为______________,
(3)浸出液“净化除杂”过程如下:首先加入 MnO 将 Fe2
+ +
2 氧化为 Fe3 ;然后调节溶液 pH 使
3+ + +Fe 、Al3 沉淀完全,此时溶液的 pH 范围为__________________。再加入 NH4F 沉淀 Ca2 、Mg2
+ + - - + -
,当 c(Ca2 )=1.0×10 5 mol·L 1 时,c(Mg2 )=____________ mol·L 1。(保留两位有效数字)
(4)碳化结晶时,发生反应的离子方程式为___________________________________。
高二化学 第4页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
(5)流程中能循环利用的固态物质是_________________(填化学式)
(6)获得的碳酸锰固体若用酒精洗涤,其优点是:
17.(1) 钛在元素周期表中的位置 ,基态钛原子的价层电子轨道表示式
为 ,与 Ti 同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的
元素有 种。下列状态的钛元素形成得微粒中,电离其最外层的一个电子所需能量最小的是
(填序号)
A.[Ar]3d24s2 B.[Ar]3d2 C.[Ar]3d24s1 D.[Ar]3d24s14p1
(2)第三周期元素中第一电离能介于 Al 和 P 的元素有___________种。
与 Co 同周期,基态原子有 1 个未成对电子的元素有___________种。
(3)SO F 分子结构如图 1 所示,已知键角 α 为 124°,β 为 96°,则 α>β 的
原因主要是___________。
(4)NH3 PH3、AsH3 沸点由高到低的顺序为___________,其主要原因是
___________。
(5)铜离子的一种配合物化学式为[Cu(NH3)4]SO4,该配合物中铜离子的配
位数为___________。
(6)醋酸(CH3COOH)中 C 原子的杂化类型为___________。
(7)等物质的量的 CH3COOH 和 CH3CH2OH 中,δ 键数目之比___________。
18.H2S 广泛存在于天然气等燃气及废水中,热分解或氧化 H2S 有利于环境保护并回收硫资源。
回答下列问题:
(1)用氯气除去废水中 H2S 的反应为 Cl2(aq)+H2S(aq) S(s)+2HCl(aq),该反应的正、逆反应速率表
达式分别为 v =k ×c(Cl )×c(H S),v =k ×c2正 正 2 2 逆 逆 (HCl),(k 正、k 逆分别为正、逆反应的反应速率常
数,只与温度有关),化学平衡常数 K 与 k 正、k 逆的关系是 。
(2)H2S 可用于高效制取氢气,发生的反应为 2H2S(g) S2(g)+2H2(g).若起始时容器中只有 H2S,平
衡时三种物质的物质的量与裂解温度的关系如图 1 所示:
①A、B 两点化学平衡常数较大的是 (填“KA”或“KB”)。
②若在两个等体积的恒容容器中分别加入 2.0 mol H2S、1.0 mol H2S,测得不同温度下 H2S 的平
衡转化率如图 2 所示。代表 1.0 mol H2S 分解的曲线是 (填“甲”或“乙”);M、N 两点容器内的
压强:P(N) 2P(M)(填“大于”或“小于”)。
(3)Binoist 等进行了 H2S 热分解实验:2H2S(g)=2H2(g)+S2(g),开始时,当 1mol H2S 与 23.75mol Ar
混合,在 101kPa 及不同温度下反应达平衡时 H2、H2S 及 S2(g)的体积分数如图 3 所示,
该反应在 Q 点对应温度下的平衡常数 Kp= kPa(K 为以分压表示的平衡常数,分压=总压 x
物质的量分数,结果保留小数点后两位)。
(4)利用如图所示的电化学装置处理工业尾气中的硫化氢可实现硫元素的回收,写出甲电极上的
高二化学 第5页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
电极方程式 。
(5)已知反应 CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ,在恒温恒容的密闭容器中,充入等
物质的量的 CO2与 H2 发生该反应,下列能说明该反应达到化学平衡状态的是
A.混合气体密度保持不变 B.H2的转化率保持不变
C.CO2 的体积分数保持不变 D.3υ(CH3OH)正=υ(H2)逆
19.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
已知部分弱酸的电离常数如下表:
弱酸 HCOOH HCN H2CO3 CH3COOH H2S
-
电离常数 Ka = 1.77×10 -K 7 11a=4.3×l0 Ka1=5.0×l0 , K =5.6×10
1.75 10 5
1
-
(25℃) 4 10 - Ka2=5.6×l0 11 K2=7.0×10 15
-
(1)0.1 mol/L NaCN 溶液和 0.1mol/L NaHCO3 溶液中,c(CN ) c( HCO3 )(填“>”、“<”或“=”)。
(2)常温下,pH 相同的三种溶液 a.HCOONa,b.NaCN,c.Na2CO3,其物质的量浓度由大到小
的顺序是 (填编号)。
(3)向 Na2S 溶液中通入少量 CO2时反应的离子方程式: 。
c(HCOO )
(4)室温下,—定浓度的 HCOONa 溶液 pH =9,溶液中 = 。
c(HCOOH)
c(H2SO4 )
(5)若向 NaHSO3 溶液中加入少量的 I2 ,则溶液中 ( ) 将 (填“增大”、“减小”或c HSO3
“不变”)。
(6)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养
化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性K2Cr2O7 溶液为例)
进行处理。常温处理后,再调节pH 使Cr3+浓度不高于3 10 5 mol / L即可排放,调节pH 应不低
于 。[已知 Ksp[Cr(OH)3]=3×10-32]
(7)常温下,0.1mol/L 醋酸溶液加水稀释过程中,下列表达式的数据减小的是___________(填字母
序号)。
A.n (CH3COOH)
+ +
B.c (H ) / c (CH3COOH) C.c (H ) / c(OH ) D.c (OH ) c (H+ )
CH COOH CH COONa
( 8) 25℃时,在 3 与 3 的混合溶液中,若测得 pH = 5 ,则溶液中
c (CH COO 3 ) c (Na+ ) = mol/L(填精确值)
高二化学 第6页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
化学答案
一、选择题
1-5 D B C D A 6-10 B D B D C 11-15 C B D A C
二、非选择题
16.(共 13 分)
(1)MnCO3+2NH4ClMnCl2+2NH3↑+CO2↑+H2O (2 分)
(2)500 ℃
-
(3) 5.2≤pH<8.1(2 分) 5.1×10 6 (2 分)
(4)Mn2
+ -
+2HCO3 MnCO3↓+CO2↑+H2O(2 分)
(5)NH4Cl(2 分) (6)减少固体的溶解损失,方便后续快速干燥(2 分)
17.(共 17 分)
(1)第四周期ⅣB 族 (其他正确表示也可得分)(2 分) 2 D
(2) 3 5
(3) 双键成键电子对之间的排斥作用大于单键成键电子对之间的排斥作用(2 分)
(4) NH3> AsH3 >PH3
三种物质均由分子组成,结构相似。氨气分子之间存在氢键,分子间作用力最强沸点最高;AsH3
相对分子质量比 PH3 大,分子之间范德华力强,沸点高于 PH3(2 分)
(5)4 (6)sp3、sp2 (2 分) (7)7∶8 (2 分)
18. (共 11 分)
k
K= 正
k K
(1) 逆 (2 分) (2) B 甲 大于
2H S-4e- =S +4H+
(3)1.01 (2 分)(4) 2 2 (2 分) (5) BD(2 分)
19.(共 14 分)
(1)< (2)a>b>c (2 分)
(3) 2S2 +CO2 +H2O 2HS
+CO2 (2 分) 3
(4) 1.77×105 (2 分)
(5) 增大 (6) 5(2 分)
6
(7)AC(2 分) (8) 9.999 10 (2 分)
高二化学 第7页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
化学试卷
可能用到的相对原子质量:Li 7 O 16 Ti 48 Fe 56
一、单选题(每题 3 分,共 45 分,每小题只有一项符合题意)
1.化学与生活密切相关。下列叙述错误的是
A.合成氨很大程度上解决了地球上因粮食不足而导致的饥饿问题
B.工业废水处理中,常以 Na S、FeS 作沉淀剂除去废水中的 Cu2+、Hg2+2 等
C.燃料电池的反应物不是储存在电池内部,由外部供给。其电极材料可以相同
D.在铁制品上镀铜时,铁制品为阳极,铜盐溶液为电镀液
2.下列关于原子结构的说法正确的是
A.基态砷(As)原子的价电子排布式为 3d104s24p3
B.前 4 周期元素中,有 5 种元素基态原子未成对电子数与其所在周期序数相同
C.某基态原子 3d 能级电子排布为 ,违反了泡利不相容原理
D.同一原子中,2p、3p、4p 能级的轨道数随电子层数增大依次增多
3.甲醇制丙烯的反应为:3CH3OH(g) C3H6 (g) +3H2O(g) H ,已知:速率常数 k 与反应温
E
度 T、活化能E a 之间满足关系:R lg k =
a +R lg A (R 和 A 为常数)。下列说法正确的是
T
A.加催化剂能减小 H
B.升温、加压均能提高该反应的速率常数 k
1
C.若实验得出Rlgk 和 的关系如图,可计算该反应的活
T
化能E a 为184.24 kJ mol
1
D.已知CH3OH、C3H6的燃烧热可以计算该反应的 H
4.下列离子方程式书写正确的是
A.某弱酸的酸式盐 NaHB 在水溶液中水解:HB--+H + 2-2O H3O +B
B.Na S 水解:S2-2 +2H2O H2S↑+2OH-
C.惰性电极电解氯化镁溶液:2Cl-+2H2O 20H-+Cl2↑+H2↑
D.泡沫灭火器工作原理:A13++3HCO - 3 =Al(OH)3↓+3CO2↑
5.下列说法不正确的是
A.向 K2CrO4 溶液中加入稀硫酸,溶液颜色由橙色变为黄色
B.中和滴定实验中,锥形瓶用水洗涤后,不能用待测液润洗
C.中和反应反应热测定实验中,一组完整实验数据需要测温度 3 次
D.配制 FeCl3溶液时,应将 FeCl3 固体溶于较浓的盐酸中,再加水稀释到所需浓度
6.研究表明 N2O 与 CO 在 Fe+作用下发生反应的能量变化及反应历程如图所示,下列说法错误的
是
高二化学 第1页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
A.反应总过程 ΔH<0
+ +
B.FeO +CO→Fe +CO2 是决定该反应快慢的基元反应
+
C.FeO 是该反应的中间产物
+ + + +
D.Fe +N2O→FeO +N2、FeO +CO→Fe +CO2两步反应均为放热反应
7.根据实验操作及现象,下列结论中错误的是
选项 实验操作及现象 结论
-
HS 的电离平衡常数小于其水
A 室温下,用 pH 试纸测得 11 mol·L NaHS 溶液呈碱性
解平衡常数
同 物 质 的 量 浓 度 同 体 积 的 +NaHCO3 溶 液 与 结合 H 能力:
B
- -
Na[Al(OH)4]溶液混合,产生白色沉淀
2
[Al(OH)4] > CO3
将银片和AgNO3溶液与铜片和Na2SO4溶液组成双液
C Cu 的金属性比 Ag 强
原电池。连通后银片变厚,铜电极附近溶液逐渐变蓝
向 12 mL 0.1 mol·L AgNO3 溶液中先滴加 4 滴 0.1
1 1 AgCl 转化为 AgI,Ksp(AgI)小
D mol·L KCl 溶液,再滴加 4 滴 0.1 mol·L KI 溶液。
于 Ksp(AgCl)
先产生白色沉淀,再产生黄色沉淀
8.恒温时在2L恒容容器中放入足量 X,发生反应
X( ) Y(g) 2Z(g)得到c(Y)与时间的关系如图所示,其中 t1 时
刻将容器压缩为1L,下列说法不正确的是
A.X 不可能是气体
B.Y 的体积分数不变时,反应达到平衡
C. t1 时刻,同时增加 Y 和 Z 也有可能得到题图
D.该温度下,K 4a3mol3 / L3
9.
高二化学 第 2 页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
10.
11.在城市地下常埋有纵横交错的管道和输电线路,有些地面
上还铺有铁轨,当有电流泄漏入潮湿的土壤中,并与金属管道
或铁轨形成回路时,就会引起后者的腐蚀,其原理简化如图所
示。则下列有关说法错误的是
A.原理图可理解为两个串联电解装置
B.溶液中铁丝被腐蚀时,右侧 Fe 电极有无色气体产生
-
C.溶液中铁丝的左端电极反应式为 Fe-2e === Fe2+
D.地下管道被腐蚀后不易被发现,维修也不便,故应将埋在地下的金属管道表面涂绝缘膜
(或油漆等)
12.常温下,向 1 L pH=10 的 NaOH 溶液中持续通入 CO2。
通入 CO2的体积(V)与溶液中水电离出的
-
OH 浓度(c)的关系如
图所示。下列叙述不正确的是
A.a 点溶液中:水电离出的 + = - -c(H ) 1×10 10 mol·L 1
B.b 点溶液中: - -c(OH )=1×10 7 mol/L
+ - -
C.c 点溶液中:c(Na )>c(CO 23 )>c(HCO3 )
D.d 点溶液中:溶液是 NaHCO3 和 H2CO3 的混合液
13.工业上电解 NO 制备 NH4NO3,其工作原理如图所示,下
列说法正确的是
A. 在电解池内电路中电子由电极甲流向电极乙
B.阴极上发生还原反应,电极反应为 NO+5H++5 e-
═NH3·H2O
C.为使电解产物全部转化为 NH4NO3,需补充物质 A 为
HNO3
D.电池两极上分别生成 甲是 NH + -4 ,乙是 NO3
14.25℃时,用 NaOH 溶液分别滴定 HX、CuSO4、FeSO4 三种溶液,pM[p 表示负对数,M 表示
c(HX)
、c(Cu2+- )、c(Fe2+)]随 pH 变化关系如图所示,已知:Ksp[Fe(OH)2]>Ksp[Cu(OH)2](不考虑
c(X )
二价铁的氧化)。下列说法错误的是
高二化学 第3页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
A.调节溶液的 pH=6.0 时,可将工业废水中的 Cu2+沉淀完全
B.曲线②代表 NaOH 溶液滴定 FeSO4溶液的变化关系
C.HX 的电离常数 Ka=1.0×10 5
D.滴定 HX 溶液至 a 点时,
- -
溶液中 c(Na+)>c(X )>c(OH )>c(H+)
15.在 t℃时,AgBr 在水中的沉淀溶解平衡曲线如下图所示,
下列说法不正确的是(已知 t℃时 Ksp(AgC1)=4.9x10-10)
A.图中 a 点对应的是 AgBr 的不饱和溶液
B.在 t℃时,AgBr 的 Ksp 为 4.9x10-13
C.在 AgBr 饱和溶液中加入 NaBr 固体,可使溶液由 c 点变到
b 点
D.在 t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)的平衡常数
K=1000
二、非选择题(共 4 小题,55 分)
16.氯化铵焙烧菱锰矿制备高纯度碳酸锰的工艺流程如下:
已知:①菱锰矿石主要成分是 MnCO3,还含有少量 Fe、Al、Ca、Mg 等元素;
+ -
②相关金属离子[c(Mn )=0.1 mol·L 1]形成氢氧化物沉淀时的 pH 如下:
+ + + + + +
金属离子 Al3 Fe3 Fe2 Ca2 Mn2 Mg2
开始沉淀的 pH 3.8 1.5 6.5 10.6 8.1 9.6
沉淀完全的 pH 5.2 3.7 9.7 12.6 10.1 11.6
- -
③常温下,CaF2、MgF2 的溶度积分别为 1.46×10 10、7.42×10 11。
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为_______________________________。
(2)分析下列图 1,氯化铵焙烧菱锰矿的最佳条件是:焙烧温度为______________,
(3)浸出液“净化除杂”过程如下:首先加入 MnO 将 Fe2
+ +
2 氧化为 Fe3 ;然后调节溶液 pH 使
3+ + +Fe 、Al3 沉淀完全,此时溶液的 pH 范围为__________________。再加入 NH4F 沉淀 Ca2 、Mg2
+ + - - + -
,当 c(Ca2 )=1.0×10 5 mol·L 1 时,c(Mg2 )=____________ mol·L 1。(保留两位有效数字)
(4)碳化结晶时,发生反应的离子方程式为___________________________________。
高二化学 第4页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
(5)流程中能循环利用的固态物质是_________________(填化学式)
(6)获得的碳酸锰固体若用酒精洗涤,其优点是:
17.(1) 钛在元素周期表中的位置 ,基态钛原子的价层电子轨道表示式
为 ,与 Ti 同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的
元素有 种。下列状态的钛元素形成得微粒中,电离其最外层的一个电子所需能量最小的是
(填序号)
A.[Ar]3d24s2 B.[Ar]3d2 C.[Ar]3d24s1 D.[Ar]3d24s14p1
(2)第三周期元素中第一电离能介于 Al 和 P 的元素有___________种。
与 Co 同周期,基态原子有 1 个未成对电子的元素有___________种。
(3)SO F 分子结构如图 1 所示,已知键角 α 为 124°,β 为 96°,则 α>β 的
原因主要是___________。
(4)NH3 PH3、AsH3 沸点由高到低的顺序为___________,其主要原因是
___________。
(5)铜离子的一种配合物化学式为[Cu(NH3)4]SO4,该配合物中铜离子的配
位数为___________。
(6)醋酸(CH3COOH)中 C 原子的杂化类型为___________。
(7)等物质的量的 CH3COOH 和 CH3CH2OH 中,δ 键数目之比___________。
18.H2S 广泛存在于天然气等燃气及废水中,热分解或氧化 H2S 有利于环境保护并回收硫资源。
回答下列问题:
(1)用氯气除去废水中 H2S 的反应为 Cl2(aq)+H2S(aq) S(s)+2HCl(aq),该反应的正、逆反应速率表
达式分别为 v =k ×c(Cl )×c(H S),v =k ×c2正 正 2 2 逆 逆 (HCl),(k 正、k 逆分别为正、逆反应的反应速率常
数,只与温度有关),化学平衡常数 K 与 k 正、k 逆的关系是 。
(2)H2S 可用于高效制取氢气,发生的反应为 2H2S(g) S2(g)+2H2(g).若起始时容器中只有 H2S,平
衡时三种物质的物质的量与裂解温度的关系如图 1 所示:
①A、B 两点化学平衡常数较大的是 (填“KA”或“KB”)。
②若在两个等体积的恒容容器中分别加入 2.0 mol H2S、1.0 mol H2S,测得不同温度下 H2S 的平
衡转化率如图 2 所示。代表 1.0 mol H2S 分解的曲线是 (填“甲”或“乙”);M、N 两点容器内的
压强:P(N) 2P(M)(填“大于”或“小于”)。
(3)Binoist 等进行了 H2S 热分解实验:2H2S(g)=2H2(g)+S2(g),开始时,当 1mol H2S 与 23.75mol Ar
混合,在 101kPa 及不同温度下反应达平衡时 H2、H2S 及 S2(g)的体积分数如图 3 所示,
该反应在 Q 点对应温度下的平衡常数 Kp= kPa(K 为以分压表示的平衡常数,分压=总压 x
物质的量分数,结果保留小数点后两位)。
(4)利用如图所示的电化学装置处理工业尾气中的硫化氢可实现硫元素的回收,写出甲电极上的
高二化学 第5页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
电极方程式 。
(5)已知反应 CO2(g) + 3H2(g) CH3OH(g) + H2O(g) ,在恒温恒容的密闭容器中,充入等
物质的量的 CO2与 H2 发生该反应,下列能说明该反应达到化学平衡状态的是
A.混合气体密度保持不变 B.H2的转化率保持不变
C.CO2 的体积分数保持不变 D.3υ(CH3OH)正=υ(H2)逆
19.电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
已知部分弱酸的电离常数如下表:
弱酸 HCOOH HCN H2CO3 CH3COOH H2S
-
电离常数 Ka = 1.77×10 -K 7 11a=4.3×l0 Ka1=5.0×l0 , K =5.6×10
1.75 10 5
1
-
(25℃) 4 10 - Ka2=5.6×l0 11 K2=7.0×10 15
-
(1)0.1 mol/L NaCN 溶液和 0.1mol/L NaHCO3 溶液中,c(CN ) c( HCO3 )(填“>”、“<”或“=”)。
(2)常温下,pH 相同的三种溶液 a.HCOONa,b.NaCN,c.Na2CO3,其物质的量浓度由大到小
的顺序是 (填编号)。
(3)向 Na2S 溶液中通入少量 CO2时反应的离子方程式: 。
c(HCOO )
(4)室温下,—定浓度的 HCOONa 溶液 pH =9,溶液中 = 。
c(HCOOH)
c(H2SO4 )
(5)若向 NaHSO3 溶液中加入少量的 I2 ,则溶液中 ( ) 将 (填“增大”、“减小”或c HSO3
“不变”)。
(6)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养
化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性K2Cr2O7 溶液为例)
进行处理。常温处理后,再调节pH 使Cr3+浓度不高于3 10 5 mol / L即可排放,调节pH 应不低
于 。[已知 Ksp[Cr(OH)3]=3×10-32]
(7)常温下,0.1mol/L 醋酸溶液加水稀释过程中,下列表达式的数据减小的是___________(填字母
序号)。
A.n (CH3COOH)
+ +
B.c (H ) / c (CH3COOH) C.c (H ) / c(OH ) D.c (OH ) c (H+ )
CH COOH CH COONa
( 8) 25℃时,在 3 与 3 的混合溶液中,若测得 pH = 5 ,则溶液中
c (CH COO 3 ) c (Na+ ) = mol/L(填精确值)
高二化学 第6页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
化学答案
一、选择题
1-5 D B C D A 6-10 B D B D C 11-15 C B D A C
二、非选择题
16.(共 13 分)
(1)MnCO3+2NH4ClMnCl2+2NH3↑+CO2↑+H2O (2 分)
(2)500 ℃
-
(3) 5.2≤pH<8.1(2 分) 5.1×10 6 (2 分)
(4)Mn2
+ -
+2HCO3 MnCO3↓+CO2↑+H2O(2 分)
(5)NH4Cl(2 分) (6)减少固体的溶解损失,方便后续快速干燥(2 分)
17.(共 17 分)
(1)第四周期ⅣB 族 (其他正确表示也可得分)(2 分) 2 D
(2) 3 5
(3) 双键成键电子对之间的排斥作用大于单键成键电子对之间的排斥作用(2 分)
(4) NH3> AsH3 >PH3
三种物质均由分子组成,结构相似。氨气分子之间存在氢键,分子间作用力最强沸点最高;AsH3
相对分子质量比 PH3 大,分子之间范德华力强,沸点高于 PH3(2 分)
(5)4 (6)sp3、sp2 (2 分) (7)7∶8 (2 分)
18. (共 11 分)
k
K= 正
k K
(1) 逆 (2 分) (2) B 甲 大于
2H S-4e- =S +4H+
(3)1.01 (2 分)(4) 2 2 (2 分) (5) BD(2 分)
19.(共 14 分)
(1)< (2)a>b>c (2 分)
(3) 2S2 +CO2 +H2O 2HS
+CO2 (2 分) 3
(4) 1.77×105 (2 分)
(5) 增大 (6) 5(2 分)
6
(7)AC(2 分) (8) 9.999 10 (2 分)
高二化学 第7页(共 6 页)
{#{QQABZYSQggCIABIAAQgCEwE4CACQkAAACAoGBFAIoAABiAFABAA=}#}
同课章节目录
