第9单元 溶液 复习 学案 (含答案)2023-2024学年初中化学人教版九年级下册
文档属性
| 名称 | 第9单元 溶液 复习 学案 (含答案)2023-2024学年初中化学人教版九年级下册 |
|
|
| 格式 | docx | ||
| 文件大小 | 309.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-03 00:00:00 | ||
图片预览


文档简介
第九单元 溶液 复习
复习目标
1.能判断溶液、溶液中的溶质和溶剂、饱和溶液与不饱和溶液。
2.能够根据溶解度曲线获取信息。
3.能进行溶质质量分数的有关计算。
◎素养要求:初步学会配制一定溶质质量分数的溶液,能将理论和实践结合,培养动手能力。
【合作探究】
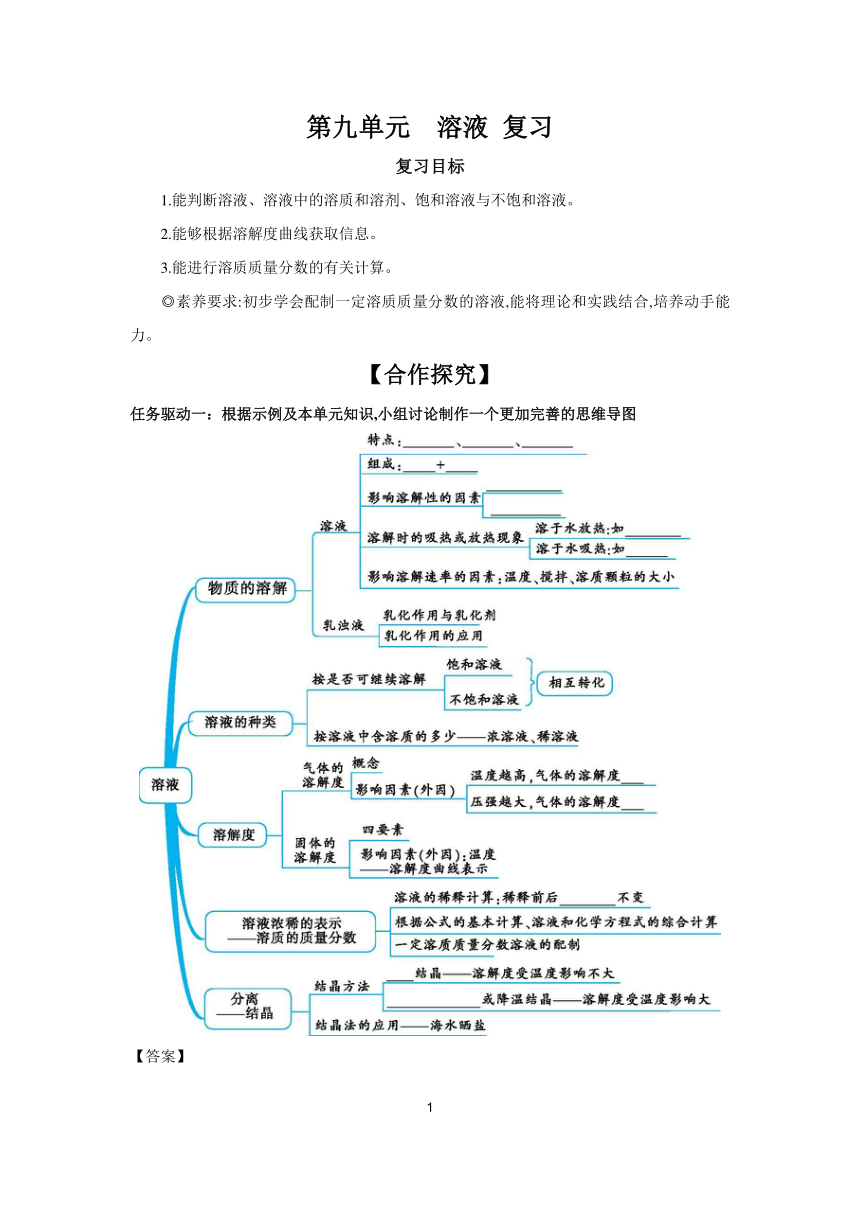
任务驱动一:根据示例及本单元知识,小组讨论制作一个更加完善的思维导图
【答案】
均一 稳定 混合物 溶质 溶剂 溶质的性质 溶剂的性质 氢氧化钠 硝酸铵 越小 越大 溶质质量 蒸发 冷却热饱和溶液
任务驱动二:溶解度曲线的应用总结
1.点的含义及应用
A表示某物质15 ℃时的 (选填“饱和”或“不饱和”)溶液。B表示某物质20 ℃时的 (选填“饱和”或“不饱和”)溶液,此时该物质的溶解度为 ,该物质的溶解性为 。20 ℃时,将0.6 g该物质加入50 g水中,得到的溶液为 (选填“饱和”或“不饱和”)溶液,质量为 g,所得溶液中溶质的质量分数为 。C表示某物质30 ℃时的 (选填“饱和”或“不饱和”)溶液,且有晶体存在。
A→B:升温到20 ℃,加入溶质。
C→B:降温到20℃,过滤。
2.交点的含义
图甲
如图甲所示,P点表示 ,此时两种物质的饱和溶液中一定相等的是 。
3.某温度下物质溶解度大小的判断及比较
如图甲所示,t1 ℃时甲、乙、丙三种物质的溶解度由大到小的顺序为 ,温度 时,丙物质的溶解度大于甲物质的溶解度。
4.物质溶解度受温度影响程度及应用
如图甲所示,甲、乙两种物质中, (选填“甲”或“乙”)物质的溶解度受温度的影响较小;当甲中混有少量的乙时,提纯甲所用的方法为 。
5.溶液、溶剂、溶质质量的计算
(1)t1 ℃时,100 g水中溶解 g丙恰好形成饱和溶液。
(2)t3 ℃时,将等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液的质量大小关系为 。
(3)t1 ℃时,配制相同质量的甲、乙的饱和溶液,所需溶剂的质量关系为 。
6.改变温度时溶液中各种量的变化情况
如图甲所示,将t3 ℃时等质量的甲、乙、丙的饱和溶液降温到t1 ℃,溶质质量分数 ;溶剂的质量 ;溶液的质量 。
【答案】
1.不饱和 饱和 0.6 g 微溶 饱和 50.3 0.6% 饱和
2.t3 ℃时,甲、乙两种物质的溶解度相等 溶质质量分数
3.丙>乙>甲4.乙 降温结晶(或冷却热饱和溶液)
5.(1)50
(2)丙>甲=乙
(3)甲>乙
6.乙>甲>丙 丙>甲=乙 丙>乙>甲
跟踪演练
1.A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中不正确的是 ( )
A.t2 ℃时,A、B两种溶液中溶质的质量分数相同
B.t1 ℃时,三种物质的溶解度从大到小的关系:B>C>A
C.t1 ℃时,30 g固体A放入50 g水中充分溶解,形成饱和溶液65 g
D.要从B溶液中得到B固体,通常采用蒸发溶剂的方法
2.甲、乙两种固体的溶解度曲线如图一所示:
(1)t1 ℃时,溶解度大小关系:甲 (选填“>”、“<”或“=”)乙。
(2)t2 ℃时,配制180 g甲物质的饱和溶液,需称量甲的质量为 g。
(3)由图二推测硝酸钾是图一中的 物质。
(4)图二“某一步操作”前后的溶液状态变化过程可以在图一中表示为 (填字母)。
A.b点→a点 B.c点→a点
C.b点→c点 D.c点→d点
【学习小助手】
在掌握基础知识的同时,要加强经典题型的练习,从中找出解题的规律和方法。
【答案】
1.A
2.(1)> (2)80 (3)甲 (4)B
2
复习目标
1.能判断溶液、溶液中的溶质和溶剂、饱和溶液与不饱和溶液。
2.能够根据溶解度曲线获取信息。
3.能进行溶质质量分数的有关计算。
◎素养要求:初步学会配制一定溶质质量分数的溶液,能将理论和实践结合,培养动手能力。
【合作探究】
任务驱动一:根据示例及本单元知识,小组讨论制作一个更加完善的思维导图
【答案】
均一 稳定 混合物 溶质 溶剂 溶质的性质 溶剂的性质 氢氧化钠 硝酸铵 越小 越大 溶质质量 蒸发 冷却热饱和溶液
任务驱动二:溶解度曲线的应用总结
1.点的含义及应用
A表示某物质15 ℃时的 (选填“饱和”或“不饱和”)溶液。B表示某物质20 ℃时的 (选填“饱和”或“不饱和”)溶液,此时该物质的溶解度为 ,该物质的溶解性为 。20 ℃时,将0.6 g该物质加入50 g水中,得到的溶液为 (选填“饱和”或“不饱和”)溶液,质量为 g,所得溶液中溶质的质量分数为 。C表示某物质30 ℃时的 (选填“饱和”或“不饱和”)溶液,且有晶体存在。
A→B:升温到20 ℃,加入溶质。
C→B:降温到20℃,过滤。
2.交点的含义
图甲
如图甲所示,P点表示 ,此时两种物质的饱和溶液中一定相等的是 。
3.某温度下物质溶解度大小的判断及比较
如图甲所示,t1 ℃时甲、乙、丙三种物质的溶解度由大到小的顺序为 ,温度 时,丙物质的溶解度大于甲物质的溶解度。
4.物质溶解度受温度影响程度及应用
如图甲所示,甲、乙两种物质中, (选填“甲”或“乙”)物质的溶解度受温度的影响较小;当甲中混有少量的乙时,提纯甲所用的方法为 。
5.溶液、溶剂、溶质质量的计算
(1)t1 ℃时,100 g水中溶解 g丙恰好形成饱和溶液。
(2)t3 ℃时,将等质量的甲、乙、丙三种物质分别配制成饱和溶液,所得溶液的质量大小关系为 。
(3)t1 ℃时,配制相同质量的甲、乙的饱和溶液,所需溶剂的质量关系为 。
6.改变温度时溶液中各种量的变化情况
如图甲所示,将t3 ℃时等质量的甲、乙、丙的饱和溶液降温到t1 ℃,溶质质量分数 ;溶剂的质量 ;溶液的质量 。
【答案】
1.不饱和 饱和 0.6 g 微溶 饱和 50.3 0.6% 饱和
2.t3 ℃时,甲、乙两种物质的溶解度相等 溶质质量分数
3.丙>乙>甲
5.(1)50
(2)丙>甲=乙
(3)甲>乙
6.乙>甲>丙 丙>甲=乙 丙>乙>甲
跟踪演练
1.A、B、C三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法中不正确的是 ( )
A.t2 ℃时,A、B两种溶液中溶质的质量分数相同
B.t1 ℃时,三种物质的溶解度从大到小的关系:B>C>A
C.t1 ℃时,30 g固体A放入50 g水中充分溶解,形成饱和溶液65 g
D.要从B溶液中得到B固体,通常采用蒸发溶剂的方法
2.甲、乙两种固体的溶解度曲线如图一所示:
(1)t1 ℃时,溶解度大小关系:甲 (选填“>”、“<”或“=”)乙。
(2)t2 ℃时,配制180 g甲物质的饱和溶液,需称量甲的质量为 g。
(3)由图二推测硝酸钾是图一中的 物质。
(4)图二“某一步操作”前后的溶液状态变化过程可以在图一中表示为 (填字母)。
A.b点→a点 B.c点→a点
C.b点→c点 D.c点→d点
【学习小助手】
在掌握基础知识的同时,要加强经典题型的练习,从中找出解题的规律和方法。
【答案】
1.A
2.(1)> (2)80 (3)甲 (4)B
2
同课章节目录
