第10单元 课题2第1课时 中和反应 学案(含答案) 2023-2024学年初中化学人教版九年级下册
文档属性
| 名称 | 第10单元 课题2第1课时 中和反应 学案(含答案) 2023-2024学年初中化学人教版九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 50.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-03 22:32:46 | ||
图片预览

文档简介
课题2第1课时 中和反应
学习目标
1.认识酸和碱之间发生的中和反应。
2.知道酸碱性对生命活动和农作物的影响。
3.知道酸碱中和反应在实际生活中的应用。
◎素养要求:通过实验探究,初步学会判断化学反应是否发生的一些方法。通过讨论交流,培养学生处理信息的能力和树立良好的学习习惯。体会化学与社会的密切关系,感受化学来源于生活,并广泛地运用于生活。
【预习导学】
课时线索
中和反应的特点及其在实际中的应用
自主学习
阅读教材,回答下列问题。
1.中和反应
(1)酸和碱作用生成 和 的反应叫中和反应。
(2)盐:由 离子和 离子构成的化合物。
2.中和反应在实际中的应用
(1)农业生产中常用 改良土壤的酸性。
(2)工业上常用 来中和硫酸厂的污水。
(3)医疗上用胃舒平[含Al(OH)3]等药物来中和过多的 。
3.写出氢氧化钙和稀盐酸以及氢氧化钠和稀硫酸反应的化学方程式。
【答案】
1.(1)盐 水
(2)金属或铵根 酸根
2.(1)熟石灰
(2)Ca(OH)2
(3)胃酸
3.Ca(OH)2+2HClCaCl2+2H2O
H2SO4+2NaOHNa2SO4+2H2O
【合作探究】
任务驱动一:中和反应
小组合作完成教材实验10-8,探究酸和碱的反应。
1.实验探究酸和碱的反应
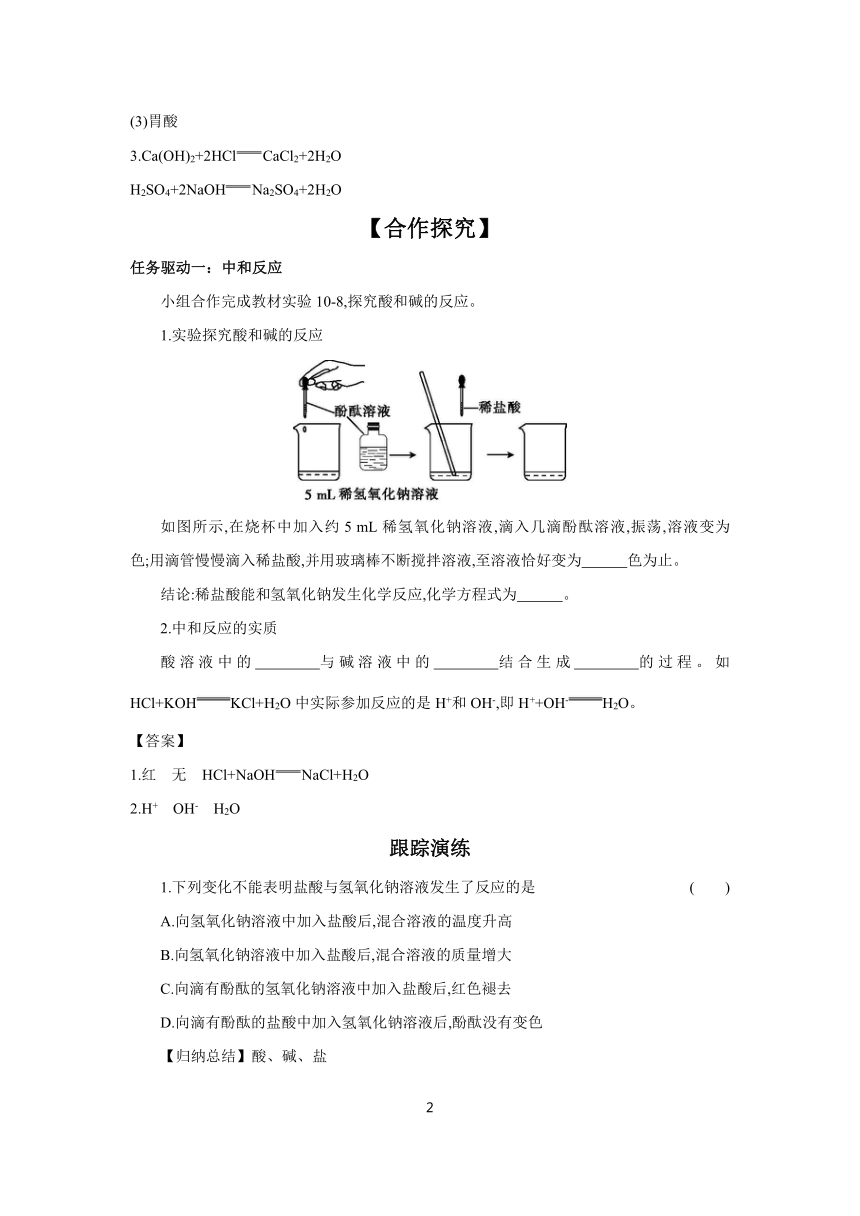
如图所示,在烧杯中加入约5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液,振荡,溶液变为 色;用滴管慢慢滴入稀盐酸,并用玻璃棒不断搅拌溶液,至溶液恰好变为 色为止。
结论:稀盐酸能和氢氧化钠发生化学反应,化学方程式为 。
2.中和反应的实质
酸溶液中的 与碱溶液中的 结合生成 的过程。如HCl+KOHKCl+H2O中实际参加反应的是H+和OH-,即H++OH-H2O。
【答案】
1.红 无 HCl+NaOHNaCl+H2O
2.H+ OH- H2O
跟踪演练
1.下列变化不能表明盐酸与氢氧化钠溶液发生了反应的是 ( )
A.向氢氧化钠溶液中加入盐酸后,混合溶液的温度升高
B.向氢氧化钠溶液中加入盐酸后,混合溶液的质量增大
C.向滴有酚酞的氢氧化钠溶液中加入盐酸后,红色褪去
D.向滴有酚酞的盐酸中加入氢氧化钠溶液后,酚酞没有变色
【归纳总结】酸、碱、盐
名称 酸 碱 盐
定义 H+和酸根离子 金属离子(或铵根离子)和OH- 金属离子(或铵根离子)和酸根离子
特点 阳离子全部是H+ 阴离子全部是OH- 除金属离子(或铵根离子)和酸根离子之外,还可能含有其他离子
举例 HCl、H2SO4、HNO3 NaOH、KOH、NH3·H2O KCl、Na2CO3、NH4Cl
【答案】
1.B
任务驱动二:中和反应在实际中的应用
自主阅读教材,了解中和反应在实际中的应用。
1.改变土壤的酸碱性:如在土壤中加入氢氧化钙可改良酸性土壤。
2.处理工厂废水:如可用熟石灰中和硫酸厂的废水,反应的化学方程式为 。
3.用于医药:
(1)胃酸过多的病人,可遵医嘱服用含氢氧化铝或氢氧化镁的药物。其原理可以用化学方程式表示为 或 。
(2)人被有些蚊虫叮咬后可涂抹稀氨水、牙膏等 物质,以中和蚊虫分泌的蚁酸,减轻痛痒。
【答案】
2.Ca(OH)2+H2SO4CaSO4+2H2O
3.(1)3HCl+Al(OH)3AlCl3+3H2O 2HCl+Mg(OH)2MgCl2+2H2O
(2)碱性
课堂讨论
(1)被蚊虫叮咬处肿成大包,这是蚊虫在人的皮肤内分泌出蚁酸,从而使皮肤肿痛,涂一些碱性物质(如NH3·H2O)的药水可减轻痛痒,你知道其中的原因吗
(2)稀盐酸可以将热水瓶胆壁上的水垢[主要成分是CaCO3和Mg(OH)2]除去,原理是什么 写出有关反应的化学方程式。
【答案】
(1)蚁酸是一种酸,而氨水则是一种碱,酸与碱可发生中和反应,从而减轻痛痒。
(2)水垢的主要成分是CaCO3和Mg(OH)2,都是难溶性的,但它们都能与稀盐酸反应,生成可溶性的盐而除去。有关反应的化学方程式为CaCO3+2HClCaCl2+H2O+CO2↑,2HCl+Mg(OH)2MgCl2+2H2O。
跟踪演练
2.下列做法利用了酸碱中和反应原理的是 ( )
A.用食醋腌木瓜放入食盐进行调味
B.用稀盐酸除去铁钉上的铁锈
C.焙制蛋糕时加入碳酸氢钠使蛋糕膨松
D.服用含氢氧化铝的药物治疗胃酸过多症
【学习小助手】
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。②大多数中和反应发生时无明显现象,需要添加指示剂来帮助判断反应是否发生。③中和反应不属于基本反应类型。④盐中不一定含有金属元素,如NH4Cl。
【答案】
2.D
2
学习目标
1.认识酸和碱之间发生的中和反应。
2.知道酸碱性对生命活动和农作物的影响。
3.知道酸碱中和反应在实际生活中的应用。
◎素养要求:通过实验探究,初步学会判断化学反应是否发生的一些方法。通过讨论交流,培养学生处理信息的能力和树立良好的学习习惯。体会化学与社会的密切关系,感受化学来源于生活,并广泛地运用于生活。
【预习导学】
课时线索
中和反应的特点及其在实际中的应用
自主学习
阅读教材,回答下列问题。
1.中和反应
(1)酸和碱作用生成 和 的反应叫中和反应。
(2)盐:由 离子和 离子构成的化合物。
2.中和反应在实际中的应用
(1)农业生产中常用 改良土壤的酸性。
(2)工业上常用 来中和硫酸厂的污水。
(3)医疗上用胃舒平[含Al(OH)3]等药物来中和过多的 。
3.写出氢氧化钙和稀盐酸以及氢氧化钠和稀硫酸反应的化学方程式。
【答案】
1.(1)盐 水
(2)金属或铵根 酸根
2.(1)熟石灰
(2)Ca(OH)2
(3)胃酸
3.Ca(OH)2+2HClCaCl2+2H2O
H2SO4+2NaOHNa2SO4+2H2O
【合作探究】
任务驱动一:中和反应
小组合作完成教材实验10-8,探究酸和碱的反应。
1.实验探究酸和碱的反应
如图所示,在烧杯中加入约5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液,振荡,溶液变为 色;用滴管慢慢滴入稀盐酸,并用玻璃棒不断搅拌溶液,至溶液恰好变为 色为止。
结论:稀盐酸能和氢氧化钠发生化学反应,化学方程式为 。
2.中和反应的实质
酸溶液中的 与碱溶液中的 结合生成 的过程。如HCl+KOHKCl+H2O中实际参加反应的是H+和OH-,即H++OH-H2O。
【答案】
1.红 无 HCl+NaOHNaCl+H2O
2.H+ OH- H2O
跟踪演练
1.下列变化不能表明盐酸与氢氧化钠溶液发生了反应的是 ( )
A.向氢氧化钠溶液中加入盐酸后,混合溶液的温度升高
B.向氢氧化钠溶液中加入盐酸后,混合溶液的质量增大
C.向滴有酚酞的氢氧化钠溶液中加入盐酸后,红色褪去
D.向滴有酚酞的盐酸中加入氢氧化钠溶液后,酚酞没有变色
【归纳总结】酸、碱、盐
名称 酸 碱 盐
定义 H+和酸根离子 金属离子(或铵根离子)和OH- 金属离子(或铵根离子)和酸根离子
特点 阳离子全部是H+ 阴离子全部是OH- 除金属离子(或铵根离子)和酸根离子之外,还可能含有其他离子
举例 HCl、H2SO4、HNO3 NaOH、KOH、NH3·H2O KCl、Na2CO3、NH4Cl
【答案】
1.B
任务驱动二:中和反应在实际中的应用
自主阅读教材,了解中和反应在实际中的应用。
1.改变土壤的酸碱性:如在土壤中加入氢氧化钙可改良酸性土壤。
2.处理工厂废水:如可用熟石灰中和硫酸厂的废水,反应的化学方程式为 。
3.用于医药:
(1)胃酸过多的病人,可遵医嘱服用含氢氧化铝或氢氧化镁的药物。其原理可以用化学方程式表示为 或 。
(2)人被有些蚊虫叮咬后可涂抹稀氨水、牙膏等 物质,以中和蚊虫分泌的蚁酸,减轻痛痒。
【答案】
2.Ca(OH)2+H2SO4CaSO4+2H2O
3.(1)3HCl+Al(OH)3AlCl3+3H2O 2HCl+Mg(OH)2MgCl2+2H2O
(2)碱性
课堂讨论
(1)被蚊虫叮咬处肿成大包,这是蚊虫在人的皮肤内分泌出蚁酸,从而使皮肤肿痛,涂一些碱性物质(如NH3·H2O)的药水可减轻痛痒,你知道其中的原因吗
(2)稀盐酸可以将热水瓶胆壁上的水垢[主要成分是CaCO3和Mg(OH)2]除去,原理是什么 写出有关反应的化学方程式。
【答案】
(1)蚁酸是一种酸,而氨水则是一种碱,酸与碱可发生中和反应,从而减轻痛痒。
(2)水垢的主要成分是CaCO3和Mg(OH)2,都是难溶性的,但它们都能与稀盐酸反应,生成可溶性的盐而除去。有关反应的化学方程式为CaCO3+2HClCaCl2+H2O+CO2↑,2HCl+Mg(OH)2MgCl2+2H2O。
跟踪演练
2.下列做法利用了酸碱中和反应原理的是 ( )
A.用食醋腌木瓜放入食盐进行调味
B.用稀盐酸除去铁钉上的铁锈
C.焙制蛋糕时加入碳酸氢钠使蛋糕膨松
D.服用含氢氧化铝的药物治疗胃酸过多症
【学习小助手】
①中和反应一定生成盐和水,但生成盐和水的反应不一定是中和反应。②大多数中和反应发生时无明显现象,需要添加指示剂来帮助判断反应是否发生。③中和反应不属于基本反应类型。④盐中不一定含有金属元素,如NH4Cl。
【答案】
2.D
2
同课章节目录
