2024年河北省中考化学备考重难专题:酸碱盐间的坐标曲线分析课件(共26张PPT)
文档属性
| 名称 | 2024年河北省中考化学备考重难专题:酸碱盐间的坐标曲线分析课件(共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 21:15:59 | ||
图片预览






文档简介
(共26张PPT)
河北 化学
酸碱盐间的坐标曲线分析
2024中考备考重难专题课件
课件说明
一、课件设计初衷
基于老师在总复习过程中对重难题型有较大的需求,难易结合化学学科的重难点,为此设计重难专题复习课件,助力高效课堂
二、课件亮点
1.对专题知识体系的构建
侧重专题知识体系分解再构建,根据本区域近五年的中考真题提炼知识点,通过知识点讲授方法和技巧,并进一步形成对应体系,再让学生尝试应用已有体系中的方法与技巧去解决问题,在复习过程中构建自己的重难专题知识体系。会对难题进行分解,降低梯度,准确、高效攻克重难专题。
2.过程性分析设置分步动画
对方法讲解、解题步骤设置分步动画,按步骤播放,更清晰有条理。
三、课件使用场景
适用于中考二轮专题复习
1
方法指导
分类突破
2
巩固练习
3
方法指导
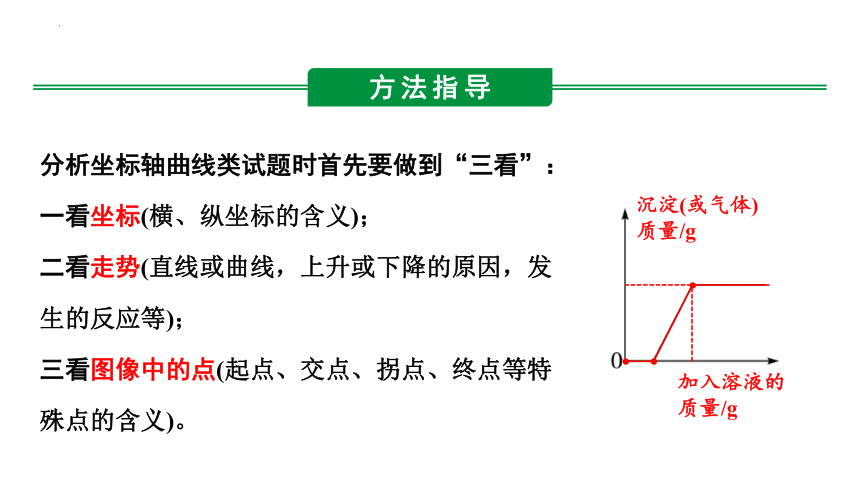
分析坐标轴曲线类试题时首先要做到“三看”:
一看坐标(横、纵坐标的含义);
二看走势(直线或曲线,上升或下降的原因,发生的反应等);
三看图像中的点(起点、交点、拐点、终点等特殊点的含义)。
沉淀(或气体)质量/g
加入溶液的质量/g
分类突破
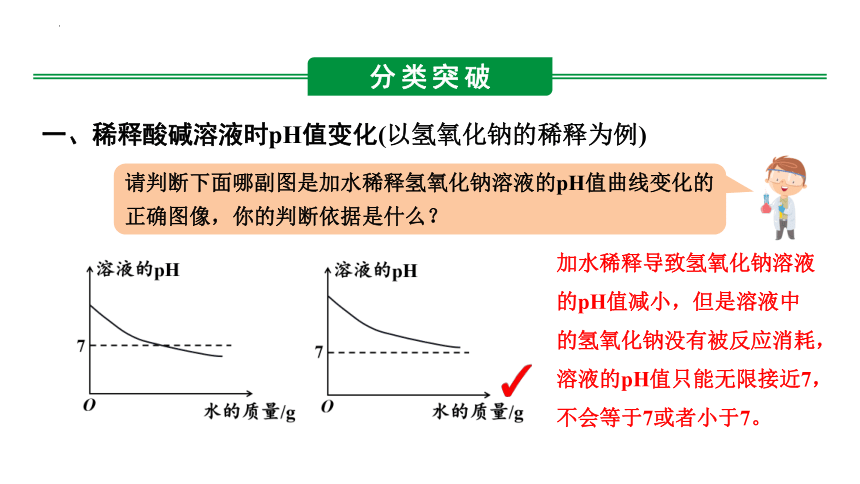
一、稀释酸碱溶液时pH值变化(以氢氧化钠的稀释为例)
加水稀释导致氢氧化钠溶液的pH值减小,但是溶液中的氢氧化钠没有被反应消耗,溶液的pH值只能无限接近7,不会等于7或者小于7。
请判断下面哪副图是加水稀释氢氧化钠溶液的pH值曲线变化的正确图像,你的判断依据是什么?
请你分析画出稀释盐酸时溶液的pH值变化曲线
pH
加水的质量/g
O
加水稀释盐酸,溶质的质量不变,溶剂的质量变大,溶质的质量分数减小,导致溶液的pH值升高,溶液中盐酸未被反应消耗,所以溶液的pH值只能无限接近7,不会等于7或者大于7。
7
二、单一化学反应中pH值、沉淀、气体的坐标曲线图
1. 酸碱中和反应中溶液pH值的变化(以稀盐酸与氢氧化钠溶液反应为例)
在b点时pH=7,溶液恰好完全反应,此时溶液中的溶质是NaCl;在b点前HCl有剩余,溶液中的溶质为NaCl和HCl,溶液呈酸性;在b点后NaOH已滴加至过量,溶液中的溶质为NaCl和NaOH,溶液呈碱性
横坐标表示加入物质的体积,纵坐标表示溶液pH值
一看坐标:
二看走势:
三看图像中的点:
曲线呈上升趋势且pH是从小于7开始变化,溶液的pH随着加入物质的体积增大而逐渐增大,说明该反应是碱入酸
pH值
体积/mL
O
V1 V2
7
pH值
体积/mL
NaOH+HCl===NaCl+H2O
a
b
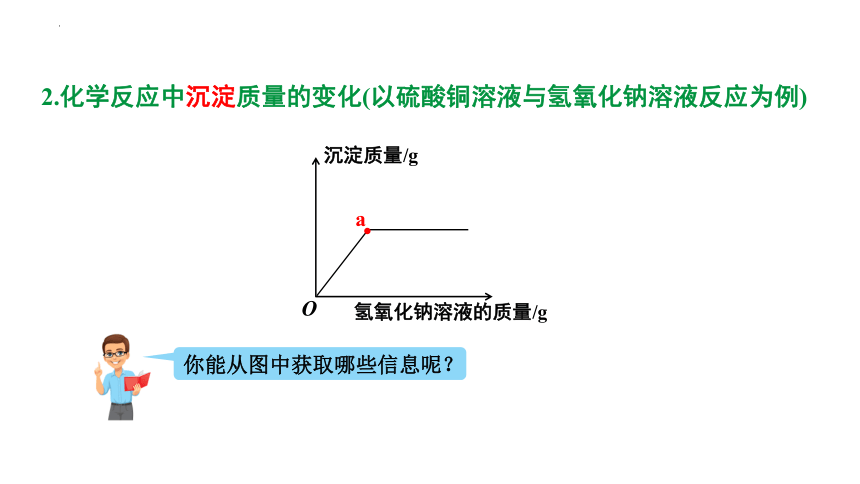
2.化学反应中沉淀质量的变化(以硫酸铜溶液与氢氧化钠溶液反应为例)
沉淀质量/g
氢氧化钠溶液的质量/g
O
你能从图中获取哪些信息呢?
a
硫酸铜溶液与氢氧化钠溶液反应
a点时恰好完全反应,此时溶液中的溶质只有Na2SO4;a点前表示硫酸铜有剩余,溶液中的溶质有CuSO4、Na2SO4;a点后硫酸铜已反应完全,再向溶液中加入氢氧化钠时无反应发生,此时溶液中的溶质有NaOH、Na2SO4
横坐标表示加入氢氧化钠溶液的质量,纵坐标表示反应产生沉淀的质量
一看坐标:
二看走势:
三看图像中的点:
随着氢氧化钠溶液的不断滴入,沉淀质量逐渐增加,待反应完全后不再发生变化
沉淀质量/g
氢氧化钠溶液
的质量/g
O
沉淀质量/g
氢氧化钠溶液
的质量/g
a
2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
3. 化学反应中气体质量的变化(以稀盐酸与碳酸钙反应为例)
CO2的质量/g
稀盐酸的质量/g
O
b
2HCl+CaCO3===H2O+CaCl2+CO2↑
你能描述出曲线的变化趋势原因和b点前后的溶质吗?
反应开始,开始生成气体,Ob段曲线先上升,气体质量慢慢增大,b点时反应结束,气体的质量不再增加,曲线平稳
b点之前溶液中的溶质:CaCl2
b点之后溶液中的溶质:CaCl2+HCl
A B C D
典例精析
1.下列图像分别与选项中的操作相对应,其中合理的是( )
A. 向一定质量的盐酸溶液中滴加水
B. 煅烧一定质量的石灰石
C. 向稀硫酸中滴加氢氧化钡溶液
D. 向一定量的碳酸钠固体中滴入稀盐酸溶液
×
×
×
√
C
三、多个化学反应中某一固定变量的坐标曲线图
向稀硫酸和硫酸铜混合溶液中加入氢氧化钠溶液
向氢氧化钠和碳酸钠混合溶液中
加入稀盐酸
为什么反应一开始时没有沉淀或者气体产生?
酸和碱先发生反应,反应结束后再与盐发生反应
为什么会有这样的反应顺序呢?
知识回顾
酸碱盐之间的优先反应原则:
在混合溶液中:
①H+与OH-的反应优先发生
例:向一定量的CuSO4和H2SO4的混合溶液中滴加NaOH溶液
先:H2SO4+2NaOH===Na2SO4+2H2O
后:CuSO4+2NaOH===Na2SO4+Cu(OH)2↓
例如将稀硫酸加入NaOH和Ba(NO3)2的混合溶液中,由于H+与OH-反应生成H2O,Ba2+和 反应生成BaSO4沉淀,两个反应同时进行互不干扰,不存在先后顺序。
SO4
2-
例:向一定量的HCl和CaCl2的混合溶液中滴加Na2CO3溶液
先:Na2CO3+2HCl===2NaCl+CO2↑+H2O
后:Na2CO3+CaCl2===CaCO3↓+2NaCl
③特殊情况
②生成气体的反应优先进行(如H+与 )
是不是所有的复分解反应都遵循这个原则呢?
Oa段:2NaOH+H2SO4 === Na2SO4+2H2O
滴入的氢氧化钠与稀硫酸发生中和反应,不生成沉淀
ab段:2NaOH+CuSO4 === Na2SO4+Cu(OH)2↓
氢氧化钠与硫酸铜反应生成沉淀
bc段:无反应发生,沉淀质量不发生变化
a点:氢氧化钠与硫酸恰好完全反应
b点:氢氧化钠与硫酸铜恰好完全反应
a点时,溶液中的溶质:硫酸铜、硫酸钠
b点时,溶液中的溶质:硫酸钠
b点之后,溶液中的溶质:硫酸钠、氢氧化钠
b
a
a
c
b
a点,b点
横坐标表示加入氢氧化钠的质量,纵坐标表示反应产生沉淀的质量
一看坐标:
二看走势:
三看图像中的点:
溶液中开始不生成沉淀,然后沉淀质量增加,反应完全后不再发生变化
向硫酸和硫酸铜混合溶液中滴加氢氧化钠溶液
c
b
b
a
a
向氢氧化钠和碳酸钠混合溶液中滴加稀盐酸
你能分析出溶液各阶段发生的反应及溶液中溶质的成分吗?
Oa段:HCl+NaOH === NaCl+H2O
滴入的稀盐酸与氢氧化钠发生中和反应,不生成气体
Oa段溶液中的溶质:氢氧化钠、碳酸钠、氯化钠
bc段:无反应发生,气体质量不发生变化
bc段溶液中的溶质:氯化钠、氯化氢
a点和b点的溶液中有哪些溶质?
a点:稀盐酸与氢氧化钠恰好完全反应
a点溶液中的溶质:氯化钠、碳酸钠
b点:稀盐酸与碳酸钠恰好完全反应
b点溶液中的溶质:氯化钠
你能从离子的角度分析各阶段、各点溶液中有哪些离子吗?
ab段:2HCl+Na2CO3 ===2NaCl+H2O+CO2↑
稀盐酸与碳酸钠反应生成气体
ab段溶液中的溶质:碳酸钠、氯化钠
典例精析
2.(选自2023河北黑白卷)某溶液中含有盐酸、硫酸、氯化铁中的两种物质,向该溶液中加 Ba(OH)2溶液的质量与产生沉淀的质量关系如图所示。下列说法中不正确的是( )
A. 0~a段可以判断出该溶液中一定没有硫酸
B. a~b段生成的沉淀是氢氧化铁沉淀
C. b点时溶液呈黄色
D. c点时溶液中的溶质是氯化钡和氢氧化钡
怎么判断原溶液中含有哪两种物质呢?
H2SO4+Ba(OH)2===BaSO4↓+H2O钡离子和硫酸根离子不受优先反应原则的影响,在反应一开始时就会发生反应产生沉淀
所以原溶液中的溶质:盐酸、氯化铁
确定了原溶液中的溶质,接下来我们分析一下各阶段的反应过程吧!
0~a段:发生的反应2HCl+Ba(OH)2=== BaCl2+2H2O
溶液中溶质成分判断:HCl、FeCl3、BaCl2
溶液的颜色:黄色
a点:HCl反应完全
溶液中溶质成分判断:FeCl3、BaCl2
溶液的颜色:黄色
a
请你分析a~b段中所发生的反应及溶液中溶质的成分及b点和c点中溶液溶质的成分。
a~b段:
发生的反应2FeCl3+3Ba(OH)2===3BaCl2+2Fe(OH)3↓
溶液中溶质成分判断:FeCl3、BaCl2
溶液的颜色:黄色
b点:FeCl3反应完全,反应结束
溶液中溶质成分判断:BaCl2
溶液的颜色:无色
c点:反应已结束
溶液中的溶质:BaCl2、Ba(OH)2
溶液的颜色:无色
b
c
典例精析
2.(选自2022河北黑白卷)某溶液中含有盐酸、硫酸、氯化铁中的两种物质,向该溶液中加 Ba(OH)2溶液的质量与产生沉淀的质量关系如图所示。下列说法中不正确的是( )
A. 0~a段可以判断出该溶液中一定没有硫酸
B. a~b段生成的沉淀是氢氧化铁沉淀
C. b点时溶液呈黄色
D. c点时溶液中的溶质是氯化钡和氢氧化钡
C
×
√
√
溶液中的氯化铁在b点时已反应完,溶液呈无色
√
典例精析
3.(数字化实验)某小组利用稀硫酸与氢氧化钡溶液探究酸碱中和反应,通过数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( )
C
A.该实验是将氢氧化钡溶液滴入稀硫酸中B.b点对应溶液中Ba2+的个数是硫酸根的个数的2倍C.c点对应溶液能使紫色石蕊溶液变蓝D.b点到c点的过程没有发生化学变化
你能描述出该反应的反应过程中溶液电导率的变化吗?
电导率和溶液的中离子的浓度有关,离子浓度(指单位体积中某离子的个数)越大,电导率越大,反应开始时,有沉淀产生,溶液中的离子浓度减小,电导率减小,反应结束时,电导率达到最小值,再向溶液中再加入酸,溶液中离子的浓度变大,电导率变大。
电导率/μS·cm-1
时间/s
O
a
a点的含义是什么?试着分析一下a点前后溶液中溶质的成分
1.(2022河北)如图1为稀盐酸和氢氧化钠溶液反应的实验操作,图2为反应过程中烧杯内溶液pH的变化曲线。下列说法不正确的是( )
A. 胶头滴管中所取溶液为氢氧化钠溶液
B. a点表示的溶液能使酚酞溶液变红
C. b点溶液中加入铁粉,无气泡产生
D. c点表示的溶液中溶质是NaCl和HCl
A
巩固练习
×
pH值逐渐减小→应为稀盐酸
√
√
→b点溶液有溶液有哪几种呢?
√
2. (河北逆袭卷)向盐酸和氯化钡的混合溶液中逐滴加入碳酸钠溶液,下列图像能正确反映有关量之间变化关系的是 ( )
你能分析出反应各阶段溶液中溶质质量和成分的变化吗?
溶液发生的反应
先:2HCl+Na2CO3===2NaCl+CO2↑+H2O
后:BaCl2+Na2CO3===2NaCl+BaCO3↓
2. (河北逆袭卷)向盐酸和氯化钡的混合溶液中逐滴加入碳酸钠溶液,下列图像能正确反映有关量之间变化关系的是 ( )
×
√
×
×
C
反应一开始就有气体产生,直至盐酸消耗完
两个阶段反应结束后,氯化钠的质量不再增加
在氯化钡未反应完之前,溶液的pH=7,不发生变化
3.(数字化实验)化学兴趣小组利用图1装置探究氢氧化钠溶液与二氧化碳的反应,实验中先后将两支注射器中的溶液快速全部推入三颈烧瓶中,利用压强传感器测得一段时间内装置中压强变化如图2所示。下列分析正确的是( )
A. 实验过程中先推入的溶液是稀盐酸
B. bc段压强不变表示没有发生化学反应
C. d点溶液中含有的溶质组成只有一种可能
D. de段气压变小的原因可能是CO2溶于水
D
ab段压强减小→氢氧化钠与CO2反应→先推入的是氢氧化钠
bc段压强无变化,说明反应无气体参加或生成→氢氧化钠有剩余,氢氧化钠先与稀盐酸反应
cd段压强增大→稀盐酸与ab段生成的碳酸钠反应生成CO2气体
压强增大d点反应结束,CO2一部分在水中溶解,容器内压强减小
河北 化学
酸碱盐间的坐标曲线分析
2024中考备考重难专题课件
课件说明
一、课件设计初衷
基于老师在总复习过程中对重难题型有较大的需求,难易结合化学学科的重难点,为此设计重难专题复习课件,助力高效课堂
二、课件亮点
1.对专题知识体系的构建
侧重专题知识体系分解再构建,根据本区域近五年的中考真题提炼知识点,通过知识点讲授方法和技巧,并进一步形成对应体系,再让学生尝试应用已有体系中的方法与技巧去解决问题,在复习过程中构建自己的重难专题知识体系。会对难题进行分解,降低梯度,准确、高效攻克重难专题。
2.过程性分析设置分步动画
对方法讲解、解题步骤设置分步动画,按步骤播放,更清晰有条理。
三、课件使用场景
适用于中考二轮专题复习
1
方法指导
分类突破
2
巩固练习
3
方法指导
分析坐标轴曲线类试题时首先要做到“三看”:
一看坐标(横、纵坐标的含义);
二看走势(直线或曲线,上升或下降的原因,发生的反应等);
三看图像中的点(起点、交点、拐点、终点等特殊点的含义)。
沉淀(或气体)质量/g
加入溶液的质量/g
分类突破
一、稀释酸碱溶液时pH值变化(以氢氧化钠的稀释为例)
加水稀释导致氢氧化钠溶液的pH值减小,但是溶液中的氢氧化钠没有被反应消耗,溶液的pH值只能无限接近7,不会等于7或者小于7。
请判断下面哪副图是加水稀释氢氧化钠溶液的pH值曲线变化的正确图像,你的判断依据是什么?
请你分析画出稀释盐酸时溶液的pH值变化曲线
pH
加水的质量/g
O
加水稀释盐酸,溶质的质量不变,溶剂的质量变大,溶质的质量分数减小,导致溶液的pH值升高,溶液中盐酸未被反应消耗,所以溶液的pH值只能无限接近7,不会等于7或者大于7。
7
二、单一化学反应中pH值、沉淀、气体的坐标曲线图
1. 酸碱中和反应中溶液pH值的变化(以稀盐酸与氢氧化钠溶液反应为例)
在b点时pH=7,溶液恰好完全反应,此时溶液中的溶质是NaCl;在b点前HCl有剩余,溶液中的溶质为NaCl和HCl,溶液呈酸性;在b点后NaOH已滴加至过量,溶液中的溶质为NaCl和NaOH,溶液呈碱性
横坐标表示加入物质的体积,纵坐标表示溶液pH值
一看坐标:
二看走势:
三看图像中的点:
曲线呈上升趋势且pH是从小于7开始变化,溶液的pH随着加入物质的体积增大而逐渐增大,说明该反应是碱入酸
pH值
体积/mL
O
V1 V2
7
pH值
体积/mL
NaOH+HCl===NaCl+H2O
a
b
2.化学反应中沉淀质量的变化(以硫酸铜溶液与氢氧化钠溶液反应为例)
沉淀质量/g
氢氧化钠溶液的质量/g
O
你能从图中获取哪些信息呢?
a
硫酸铜溶液与氢氧化钠溶液反应
a点时恰好完全反应,此时溶液中的溶质只有Na2SO4;a点前表示硫酸铜有剩余,溶液中的溶质有CuSO4、Na2SO4;a点后硫酸铜已反应完全,再向溶液中加入氢氧化钠时无反应发生,此时溶液中的溶质有NaOH、Na2SO4
横坐标表示加入氢氧化钠溶液的质量,纵坐标表示反应产生沉淀的质量
一看坐标:
二看走势:
三看图像中的点:
随着氢氧化钠溶液的不断滴入,沉淀质量逐渐增加,待反应完全后不再发生变化
沉淀质量/g
氢氧化钠溶液
的质量/g
O
沉淀质量/g
氢氧化钠溶液
的质量/g
a
2NaOH+CuSO4===Na2SO4+Cu(OH)2↓
3. 化学反应中气体质量的变化(以稀盐酸与碳酸钙反应为例)
CO2的质量/g
稀盐酸的质量/g
O
b
2HCl+CaCO3===H2O+CaCl2+CO2↑
你能描述出曲线的变化趋势原因和b点前后的溶质吗?
反应开始,开始生成气体,Ob段曲线先上升,气体质量慢慢增大,b点时反应结束,气体的质量不再增加,曲线平稳
b点之前溶液中的溶质:CaCl2
b点之后溶液中的溶质:CaCl2+HCl
A B C D
典例精析
1.下列图像分别与选项中的操作相对应,其中合理的是( )
A. 向一定质量的盐酸溶液中滴加水
B. 煅烧一定质量的石灰石
C. 向稀硫酸中滴加氢氧化钡溶液
D. 向一定量的碳酸钠固体中滴入稀盐酸溶液
×
×
×
√
C
三、多个化学反应中某一固定变量的坐标曲线图
向稀硫酸和硫酸铜混合溶液中加入氢氧化钠溶液
向氢氧化钠和碳酸钠混合溶液中
加入稀盐酸
为什么反应一开始时没有沉淀或者气体产生?
酸和碱先发生反应,反应结束后再与盐发生反应
为什么会有这样的反应顺序呢?
知识回顾
酸碱盐之间的优先反应原则:
在混合溶液中:
①H+与OH-的反应优先发生
例:向一定量的CuSO4和H2SO4的混合溶液中滴加NaOH溶液
先:H2SO4+2NaOH===Na2SO4+2H2O
后:CuSO4+2NaOH===Na2SO4+Cu(OH)2↓
例如将稀硫酸加入NaOH和Ba(NO3)2的混合溶液中,由于H+与OH-反应生成H2O,Ba2+和 反应生成BaSO4沉淀,两个反应同时进行互不干扰,不存在先后顺序。
SO4
2-
例:向一定量的HCl和CaCl2的混合溶液中滴加Na2CO3溶液
先:Na2CO3+2HCl===2NaCl+CO2↑+H2O
后:Na2CO3+CaCl2===CaCO3↓+2NaCl
③特殊情况
②生成气体的反应优先进行(如H+与 )
是不是所有的复分解反应都遵循这个原则呢?
Oa段:2NaOH+H2SO4 === Na2SO4+2H2O
滴入的氢氧化钠与稀硫酸发生中和反应,不生成沉淀
ab段:2NaOH+CuSO4 === Na2SO4+Cu(OH)2↓
氢氧化钠与硫酸铜反应生成沉淀
bc段:无反应发生,沉淀质量不发生变化
a点:氢氧化钠与硫酸恰好完全反应
b点:氢氧化钠与硫酸铜恰好完全反应
a点时,溶液中的溶质:硫酸铜、硫酸钠
b点时,溶液中的溶质:硫酸钠
b点之后,溶液中的溶质:硫酸钠、氢氧化钠
b
a
a
c
b
a点,b点
横坐标表示加入氢氧化钠的质量,纵坐标表示反应产生沉淀的质量
一看坐标:
二看走势:
三看图像中的点:
溶液中开始不生成沉淀,然后沉淀质量增加,反应完全后不再发生变化
向硫酸和硫酸铜混合溶液中滴加氢氧化钠溶液
c
b
b
a
a
向氢氧化钠和碳酸钠混合溶液中滴加稀盐酸
你能分析出溶液各阶段发生的反应及溶液中溶质的成分吗?
Oa段:HCl+NaOH === NaCl+H2O
滴入的稀盐酸与氢氧化钠发生中和反应,不生成气体
Oa段溶液中的溶质:氢氧化钠、碳酸钠、氯化钠
bc段:无反应发生,气体质量不发生变化
bc段溶液中的溶质:氯化钠、氯化氢
a点和b点的溶液中有哪些溶质?
a点:稀盐酸与氢氧化钠恰好完全反应
a点溶液中的溶质:氯化钠、碳酸钠
b点:稀盐酸与碳酸钠恰好完全反应
b点溶液中的溶质:氯化钠
你能从离子的角度分析各阶段、各点溶液中有哪些离子吗?
ab段:2HCl+Na2CO3 ===2NaCl+H2O+CO2↑
稀盐酸与碳酸钠反应生成气体
ab段溶液中的溶质:碳酸钠、氯化钠
典例精析
2.(选自2023河北黑白卷)某溶液中含有盐酸、硫酸、氯化铁中的两种物质,向该溶液中加 Ba(OH)2溶液的质量与产生沉淀的质量关系如图所示。下列说法中不正确的是( )
A. 0~a段可以判断出该溶液中一定没有硫酸
B. a~b段生成的沉淀是氢氧化铁沉淀
C. b点时溶液呈黄色
D. c点时溶液中的溶质是氯化钡和氢氧化钡
怎么判断原溶液中含有哪两种物质呢?
H2SO4+Ba(OH)2===BaSO4↓+H2O钡离子和硫酸根离子不受优先反应原则的影响,在反应一开始时就会发生反应产生沉淀
所以原溶液中的溶质:盐酸、氯化铁
确定了原溶液中的溶质,接下来我们分析一下各阶段的反应过程吧!
0~a段:发生的反应2HCl+Ba(OH)2=== BaCl2+2H2O
溶液中溶质成分判断:HCl、FeCl3、BaCl2
溶液的颜色:黄色
a点:HCl反应完全
溶液中溶质成分判断:FeCl3、BaCl2
溶液的颜色:黄色
a
请你分析a~b段中所发生的反应及溶液中溶质的成分及b点和c点中溶液溶质的成分。
a~b段:
发生的反应2FeCl3+3Ba(OH)2===3BaCl2+2Fe(OH)3↓
溶液中溶质成分判断:FeCl3、BaCl2
溶液的颜色:黄色
b点:FeCl3反应完全,反应结束
溶液中溶质成分判断:BaCl2
溶液的颜色:无色
c点:反应已结束
溶液中的溶质:BaCl2、Ba(OH)2
溶液的颜色:无色
b
c
典例精析
2.(选自2022河北黑白卷)某溶液中含有盐酸、硫酸、氯化铁中的两种物质,向该溶液中加 Ba(OH)2溶液的质量与产生沉淀的质量关系如图所示。下列说法中不正确的是( )
A. 0~a段可以判断出该溶液中一定没有硫酸
B. a~b段生成的沉淀是氢氧化铁沉淀
C. b点时溶液呈黄色
D. c点时溶液中的溶质是氯化钡和氢氧化钡
C
×
√
√
溶液中的氯化铁在b点时已反应完,溶液呈无色
√
典例精析
3.(数字化实验)某小组利用稀硫酸与氢氧化钡溶液探究酸碱中和反应,通过数字化传感器测得烧杯中溶液pH的变化图像如图所示。下列说法正确的是( )
C
A.该实验是将氢氧化钡溶液滴入稀硫酸中B.b点对应溶液中Ba2+的个数是硫酸根的个数的2倍C.c点对应溶液能使紫色石蕊溶液变蓝D.b点到c点的过程没有发生化学变化
你能描述出该反应的反应过程中溶液电导率的变化吗?
电导率和溶液的中离子的浓度有关,离子浓度(指单位体积中某离子的个数)越大,电导率越大,反应开始时,有沉淀产生,溶液中的离子浓度减小,电导率减小,反应结束时,电导率达到最小值,再向溶液中再加入酸,溶液中离子的浓度变大,电导率变大。
电导率/μS·cm-1
时间/s
O
a
a点的含义是什么?试着分析一下a点前后溶液中溶质的成分
1.(2022河北)如图1为稀盐酸和氢氧化钠溶液反应的实验操作,图2为反应过程中烧杯内溶液pH的变化曲线。下列说法不正确的是( )
A. 胶头滴管中所取溶液为氢氧化钠溶液
B. a点表示的溶液能使酚酞溶液变红
C. b点溶液中加入铁粉,无气泡产生
D. c点表示的溶液中溶质是NaCl和HCl
A
巩固练习
×
pH值逐渐减小→应为稀盐酸
√
√
→b点溶液有溶液有哪几种呢?
√
2. (河北逆袭卷)向盐酸和氯化钡的混合溶液中逐滴加入碳酸钠溶液,下列图像能正确反映有关量之间变化关系的是 ( )
你能分析出反应各阶段溶液中溶质质量和成分的变化吗?
溶液发生的反应
先:2HCl+Na2CO3===2NaCl+CO2↑+H2O
后:BaCl2+Na2CO3===2NaCl+BaCO3↓
2. (河北逆袭卷)向盐酸和氯化钡的混合溶液中逐滴加入碳酸钠溶液,下列图像能正确反映有关量之间变化关系的是 ( )
×
√
×
×
C
反应一开始就有气体产生,直至盐酸消耗完
两个阶段反应结束后,氯化钠的质量不再增加
在氯化钡未反应完之前,溶液的pH=7,不发生变化
3.(数字化实验)化学兴趣小组利用图1装置探究氢氧化钠溶液与二氧化碳的反应,实验中先后将两支注射器中的溶液快速全部推入三颈烧瓶中,利用压强传感器测得一段时间内装置中压强变化如图2所示。下列分析正确的是( )
A. 实验过程中先推入的溶液是稀盐酸
B. bc段压强不变表示没有发生化学反应
C. d点溶液中含有的溶质组成只有一种可能
D. de段气压变小的原因可能是CO2溶于水
D
ab段压强减小→氢氧化钠与CO2反应→先推入的是氢氧化钠
bc段压强无变化,说明反应无气体参加或生成→氢氧化钠有剩余,氢氧化钠先与稀盐酸反应
cd段压强增大→稀盐酸与ab段生成的碳酸钠反应生成CO2气体
压强增大d点反应结束,CO2一部分在水中溶解,容器内压强减小
同课章节目录
