9.2溶解度课件(共41张PPT内嵌视频)-2023-2024学年九年级化学人教版下册
文档属性
| 名称 | 9.2溶解度课件(共41张PPT内嵌视频)-2023-2024学年九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 21:29:44 | ||
图片预览









文档简介
(共41张PPT)
人教版九年级化学下册第九单元溶液
饱和溶液
溶解度
带着以下问题阅读教材P33至35“导言和模块一(饱和溶液)”的有内容:
1、饱和溶液和不饱和溶液的概念。
2、谈“饱和”与“不饱和”必须指明“温度”和“溶剂”。
3、实际生活中判断溶液是溶液饱和的方法。
4、溶液饱和与否与溶液的浓稀的关系。
5、什么叫结晶,结晶有哪些方法?
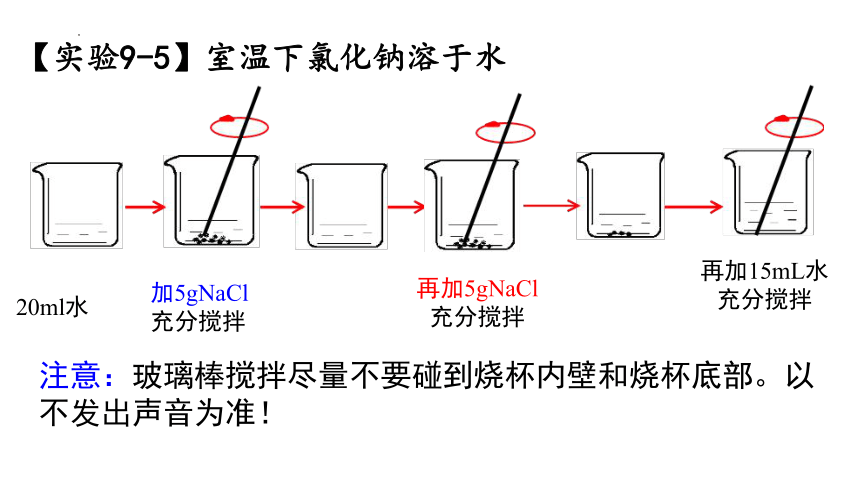
【实验9-5】室温下氯化钠溶于水
20ml水
加5gNaCl
充分搅拌
再加5gNaCl
充分搅拌
注意:玻璃棒搅拌尽量不要碰到烧杯内壁和烧杯底部。以不发出声音为准!
再加15mL水
充分搅拌
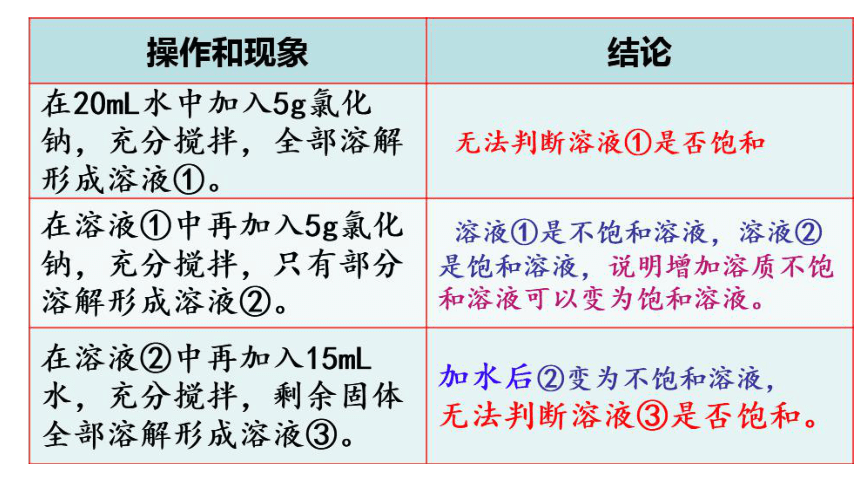
再加15mL水,氯化钠溶解说明了什么?
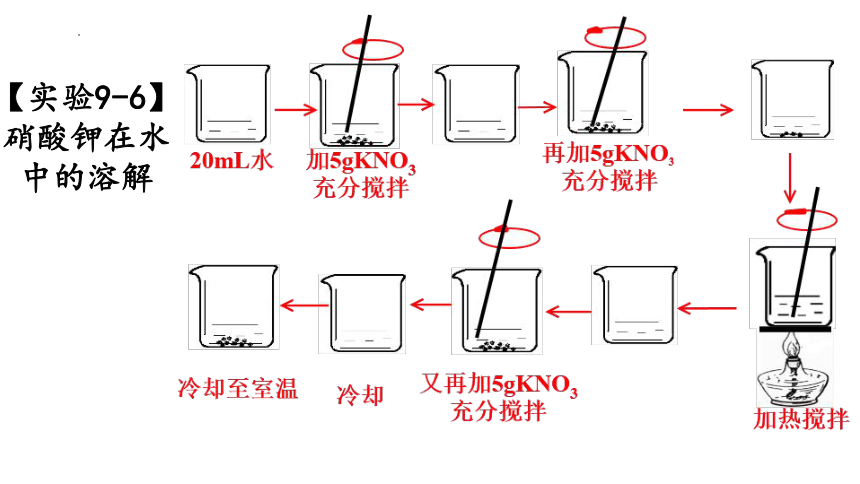
【实验9-6】硝酸钾在水中的溶解
一、饱和溶液
1、概念
饱和溶液:在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质不能继续溶解时,所得溶液叫做这种溶质的饱和溶液;还能继续溶解的溶液叫做这种溶质的不饱和溶液。
理解“饱和溶液”时,要明确以下两点:
①必须指明温度和溶剂,因为改变温度和溶剂后饱和溶液与不饱和溶液可以相互转换。
②“这种溶质”:则该溶液对A物质而言是饱和溶液,对B物质而言则可能是不饱和溶液。
2、相互转化
3、饱和溶液的判断方法——这种溶质 能否继续溶解。
②没有未溶解的溶质,再加少量的溶质,
不能再溶解的是饱和溶液。
⑴概念:溶质从饱和溶液中以晶体的形式析出的过程叫做结晶。
结晶后剩余的溶液称为母液,母液属于该温度下该晶体的饱和溶液
⑵条件:达到饱和后蒸发溶剂或降低温度。
注意:降温或蒸发溶剂不一定结晶,因为不饱和溶液变成饱和溶液的过程中没有晶体析出!
⑶方法:①冷却热饱和溶液法;②蒸发溶剂法。
4、结晶(是物质分离提纯的重要方法)
硝酸钾晶体
第二步:冷却热饱和溶液
降温结晶
第一步:制热饱和溶液
海水
贮水池
蒸发池
结晶池
粗盐
母液
氯化钠
多种化工原料
蒸发结晶:从海水中提取食盐
因含氯化镁和氯化钙等杂质易潮解
苦卤(是氯化钠的饱和溶液)
镁、溴等
浓度大
浓度小
食盐溶解
食盐的不饱和溶液
10毫升水
10毫升水
熟石灰不完全溶解
熟石灰的饱和溶液
0.2克熟石灰
2克食盐
浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
讲授新课
5、饱和、不饱和与浓、稀的关系
在同一温度下对于同种溶质来说饱和溶液比不饱和溶液要浓。
当堂练习:
1、下列有关溶液的认识中错误的是( )
A.析出晶体后的溶液是该温度下的饱和溶液。
B.在溶液里进行的反应通常是比较快的。
C.同种溶质的饱和溶液一定比它的不饱和溶液的浓度大。
D.食物里的营养成分经消化变成溶液,容易被人体吸收。
2、能证明KCl溶液在20°c时已经达到饱和状态的方法是( )
A.温度不变时,向该溶液中加入少量水,结果溶液变稀。
B.取少量该溶液,降温到10°c,有KCl晶体析出。
C.取少量该溶液升温,无KCl晶体析出。
D.温度不变时,向该溶液中加入少量的KCl晶体,晶体不再溶解(质量不减少)。
C
D
A
D
6、20°c时,向50gKNO3溶液中加入5gKNO3晶体,充分搅拌后仍有部分晶体未溶解,加热后晶体全部溶解,下列关于该溶液的说法中正确的是( )
A.加入晶体前一定是饱和溶液 B.加热前一定是饱和溶液
C.加热后一定是饱和溶液 D.此过程中溶液质量不变
B
D
5、下列关于溶液的说法中正确的是( )
A.饱和溶液一定比它的不饱和溶液要浓
B.饱和石灰水一定是浓溶液
C.溶液一定是固体或气体溶于水形成的
D.溶液一定具有均一性和稳定性
7、下列说法正确的是( )
A物质的溶解能力都隨温度的升高而增大。
B任何物质的饱和溶液都比它的不饱和溶液浓。
C某温度下KNO3的不饱和溶液可能是浓溶液
D某温度下在KNO3的饱和溶液中加入食盐,若温度不变则食盐不溶解。
8、怎样判断某一溶液是否是饱和溶液( )
A、保持溶剂的质量不变,降低温度看是否有溶质析出
B、保持溶液的温度不变,蒸发水分看是否有溶质析出
C、保持溶液的温度不变,继续加同种溶质,看能否继续溶解
D、保持溶液的温度不变,继续加不同种溶质,看能否继续溶解
C
C
1、固体物质溶解度概念有哪些要素?
2、物质溶解性与溶解度有什么关系?
3、溶解度概念揭示了什么概念量?
4、影响固体物质溶解度的唯一外因是什么?
阅读教材P35至38第二自然段有关“固体物质的溶解度”的内容。然后完成下列各题:
二、固体物质的溶解度
1、固体物质溶解度的概念(用“S”表示)
在一定的温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种溶质在这种溶剂中的溶解度。
条件:在一定温度下(因为固体物质的溶解度会随温度的变 化而变化)
标准:在100g溶剂里(是人为规定的标准,是控制溶剂质量 的一种选择,否则无法研究)
状态:达到饱和状态(只有达到饱和状态,溶质溶解的量才 是一个确定的值)
单位:以“g”为单位(因为溶解度是溶质质量,且与溶剂 的单位一致)
20℃时,提纯50g粗盐,用多少水溶解粗盐较合理?
2、溶解度概念四要素
思考:20℃时,硝酸钾的溶解度是31.6克的意义?
20℃时,100克水中最多能溶解硝酸
钾的质量为31.6克;
20℃时,100克水中溶了31.6克的硝
酸钾就达到饱和状态。
讲授新课
3、影响固体物质溶解度的因素
⑴内因:溶质溶剂的种类。
⑵温度:只有温度改变,物质的溶解度就随之改变。
①在相同条件下,不同物质在同一溶剂中的溶解度不同。
②在相同条件下,同一物质在不同的溶剂中的溶解度不同。
例:固体物质的溶解度与( )无关。
A、溶质、溶剂的多少 B、温度的高低
C、溶剂的种类 D、溶质的种类
A
1. 20 ℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是 溶物质。
2. 20℃时氯化钠的溶解度是36 g,则氯化钠属于( )
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
难(不)
A
练一练
讲授新课
4、固体物质在不同温度下的溶解度的表示方法
⑴列表法:用实验方法测得物质在不同温度下的溶解度,用列表的方式呈现出来的方法。如:
优缺点:数据直观准确;数据不够齐全,反映溶解度随温度变化的规律不直观。
⑵作图法——溶解度曲线。用纵坐标表示溶解度,横坐标表示温度,根据实验测得的某物质在不同温度下的溶解度数据,在直角坐标系中描点并用平滑的曲线连接起来,即绘制出溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。这种处理数据的方法叫做作图法。
优缺点:数据齐全,反映的溶解度随温度变化的规律形象直观;但数据来源不可靠,可能有误差。
30
20
50
40
硝酸钾
讲授新课
点、线、面的意义
氢氧化钙的溶解度曲线
①大多数固体物质的溶解度随温度的升高而增大(如硝酸钾、氯化钾)。【陡升型】
②少数固体物质的溶解度受温度的影响很小(如氯化钠)。【缓升型】
③极少数固体物质的溶解度随温度的升高而减小(如氢氧化钙)。【下降型】
10
90
80
70
可以比较同一物质在不同温度下的溶解度的大小。
可以比较不同物质在同一温度下的溶解度的大小,两条曲线的交点表示这两种物质在该温度下的溶解度相同。
可以查出某物质在一定温度下的溶解度。
确定温度对某物质溶解度的影响情况。
确定某种物质饱和溶液与不饱和溶液互相转换的方法。
确定物质结晶、分离提纯的方法.
例.下图是a、b两种物质在水中的溶解度曲线。
(1)在_____________,可配制溶质的质量分数相等的a、b两种物质的饱和溶液。
30℃时
a
纯碱的溶解度受温度影响较大
例8.下图是M、N两种物质的溶解度曲线。在t2℃时,往盛有100g水的烧杯中先后加入agM和agN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌。将混合物的温度降低到t1℃,下列说法正确的是( )
C
A. t2℃时,得到M的饱和溶液。
B. t2℃时,得到N的不饱和溶液。
C.温度降低到t1℃时,M、N的溶质质量分数相等,得到M、N的不饱和溶液。
D.温度降低到t1℃时,M、N的溶解度相等,得到M、N的饱和溶液。
联系生活实际:天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
三、气体物质的溶解度
气体物质的溶解度
概念:通常用的气体的溶解度,是指该气体在压强在101kPa和一定温时,在1体积水里溶解达到饱和状态时的气体体积。
【比较】固体溶解度与气体溶解度的不同
P1、P2、P3的大小关系是?
t1、t2的高低关系是?
气体在水中的溶解度曲线
喝了汽水以后,常常会打嗝。
打开啤酒瓶盖,看到大量的气泡冒出。
烧开水时,刚把水壶放到火上就看到有气泡冒出 。
在闷热的天气里,鱼儿常出现浮头的现象。
⑵解释下列现象:
1. 你设想增大二氧化碳在水中的溶解度的方法( )
A. 升温增压; B. 升温减压;
C. 降温增压; D. 降温减压。
2.下列几种物质中①硝酸钾、②熟石灰、③氧气、④二氧化碳,其中溶解度随温度的升高而增大的是( )
A.①② B.③④ C.①③④ D.只有①
C
D
练一练
讲授新课
同种溶质在不同的溶剂中的溶解能力不同
不同的溶质在同种溶剂中的溶解能力不同
物质的溶解性
物质的溶解度
易溶
可溶
微溶
难(不)溶
固体的溶解度
气体的溶解度
影响因素
(温度)
影响因素
(温度、压强)
表示方法
表示方法
课堂小结
定性描述
人教版九年级化学下册第九单元溶液
饱和溶液
溶解度
带着以下问题阅读教材P33至35“导言和模块一(饱和溶液)”的有内容:
1、饱和溶液和不饱和溶液的概念。
2、谈“饱和”与“不饱和”必须指明“温度”和“溶剂”。
3、实际生活中判断溶液是溶液饱和的方法。
4、溶液饱和与否与溶液的浓稀的关系。
5、什么叫结晶,结晶有哪些方法?
【实验9-5】室温下氯化钠溶于水
20ml水
加5gNaCl
充分搅拌
再加5gNaCl
充分搅拌
注意:玻璃棒搅拌尽量不要碰到烧杯内壁和烧杯底部。以不发出声音为准!
再加15mL水
充分搅拌
再加15mL水,氯化钠溶解说明了什么?
【实验9-6】硝酸钾在水中的溶解
一、饱和溶液
1、概念
饱和溶液:在一定的温度下,向一定量的溶剂里加入某种溶质,当溶质不能继续溶解时,所得溶液叫做这种溶质的饱和溶液;还能继续溶解的溶液叫做这种溶质的不饱和溶液。
理解“饱和溶液”时,要明确以下两点:
①必须指明温度和溶剂,因为改变温度和溶剂后饱和溶液与不饱和溶液可以相互转换。
②“这种溶质”:则该溶液对A物质而言是饱和溶液,对B物质而言则可能是不饱和溶液。
2、相互转化
3、饱和溶液的判断方法——这种溶质 能否继续溶解。
②没有未溶解的溶质,再加少量的溶质,
不能再溶解的是饱和溶液。
⑴概念:溶质从饱和溶液中以晶体的形式析出的过程叫做结晶。
结晶后剩余的溶液称为母液,母液属于该温度下该晶体的饱和溶液
⑵条件:达到饱和后蒸发溶剂或降低温度。
注意:降温或蒸发溶剂不一定结晶,因为不饱和溶液变成饱和溶液的过程中没有晶体析出!
⑶方法:①冷却热饱和溶液法;②蒸发溶剂法。
4、结晶(是物质分离提纯的重要方法)
硝酸钾晶体
第二步:冷却热饱和溶液
降温结晶
第一步:制热饱和溶液
海水
贮水池
蒸发池
结晶池
粗盐
母液
氯化钠
多种化工原料
蒸发结晶:从海水中提取食盐
因含氯化镁和氯化钙等杂质易潮解
苦卤(是氯化钠的饱和溶液)
镁、溴等
浓度大
浓度小
食盐溶解
食盐的不饱和溶液
10毫升水
10毫升水
熟石灰不完全溶解
熟石灰的饱和溶液
0.2克熟石灰
2克食盐
浓溶液不一定是饱和溶液,稀溶液也不一定是不饱和溶液。
讲授新课
5、饱和、不饱和与浓、稀的关系
在同一温度下对于同种溶质来说饱和溶液比不饱和溶液要浓。
当堂练习:
1、下列有关溶液的认识中错误的是( )
A.析出晶体后的溶液是该温度下的饱和溶液。
B.在溶液里进行的反应通常是比较快的。
C.同种溶质的饱和溶液一定比它的不饱和溶液的浓度大。
D.食物里的营养成分经消化变成溶液,容易被人体吸收。
2、能证明KCl溶液在20°c时已经达到饱和状态的方法是( )
A.温度不变时,向该溶液中加入少量水,结果溶液变稀。
B.取少量该溶液,降温到10°c,有KCl晶体析出。
C.取少量该溶液升温,无KCl晶体析出。
D.温度不变时,向该溶液中加入少量的KCl晶体,晶体不再溶解(质量不减少)。
C
D
A
D
6、20°c时,向50gKNO3溶液中加入5gKNO3晶体,充分搅拌后仍有部分晶体未溶解,加热后晶体全部溶解,下列关于该溶液的说法中正确的是( )
A.加入晶体前一定是饱和溶液 B.加热前一定是饱和溶液
C.加热后一定是饱和溶液 D.此过程中溶液质量不变
B
D
5、下列关于溶液的说法中正确的是( )
A.饱和溶液一定比它的不饱和溶液要浓
B.饱和石灰水一定是浓溶液
C.溶液一定是固体或气体溶于水形成的
D.溶液一定具有均一性和稳定性
7、下列说法正确的是( )
A物质的溶解能力都隨温度的升高而增大。
B任何物质的饱和溶液都比它的不饱和溶液浓。
C某温度下KNO3的不饱和溶液可能是浓溶液
D某温度下在KNO3的饱和溶液中加入食盐,若温度不变则食盐不溶解。
8、怎样判断某一溶液是否是饱和溶液( )
A、保持溶剂的质量不变,降低温度看是否有溶质析出
B、保持溶液的温度不变,蒸发水分看是否有溶质析出
C、保持溶液的温度不变,继续加同种溶质,看能否继续溶解
D、保持溶液的温度不变,继续加不同种溶质,看能否继续溶解
C
C
1、固体物质溶解度概念有哪些要素?
2、物质溶解性与溶解度有什么关系?
3、溶解度概念揭示了什么概念量?
4、影响固体物质溶解度的唯一外因是什么?
阅读教材P35至38第二自然段有关“固体物质的溶解度”的内容。然后完成下列各题:
二、固体物质的溶解度
1、固体物质溶解度的概念(用“S”表示)
在一定的温度下,某固体物质在100g溶剂里达到饱和状态时所溶解的质量,叫做这种溶质在这种溶剂中的溶解度。
条件:在一定温度下(因为固体物质的溶解度会随温度的变 化而变化)
标准:在100g溶剂里(是人为规定的标准,是控制溶剂质量 的一种选择,否则无法研究)
状态:达到饱和状态(只有达到饱和状态,溶质溶解的量才 是一个确定的值)
单位:以“g”为单位(因为溶解度是溶质质量,且与溶剂 的单位一致)
20℃时,提纯50g粗盐,用多少水溶解粗盐较合理?
2、溶解度概念四要素
思考:20℃时,硝酸钾的溶解度是31.6克的意义?
20℃时,100克水中最多能溶解硝酸
钾的质量为31.6克;
20℃时,100克水中溶了31.6克的硝
酸钾就达到饱和状态。
讲授新课
3、影响固体物质溶解度的因素
⑴内因:溶质溶剂的种类。
⑵温度:只有温度改变,物质的溶解度就随之改变。
①在相同条件下,不同物质在同一溶剂中的溶解度不同。
②在相同条件下,同一物质在不同的溶剂中的溶解度不同。
例:固体物质的溶解度与( )无关。
A、溶质、溶剂的多少 B、温度的高低
C、溶剂的种类 D、溶质的种类
A
1. 20 ℃时碳酸钙的溶解度是0.0013g,所以碳酸钙是 溶物质。
2. 20℃时氯化钠的溶解度是36 g,则氯化钠属于( )
A.易溶物质 B.可溶物质
C.微溶物质 D.难溶物质
难(不)
A
练一练
讲授新课
4、固体物质在不同温度下的溶解度的表示方法
⑴列表法:用实验方法测得物质在不同温度下的溶解度,用列表的方式呈现出来的方法。如:
优缺点:数据直观准确;数据不够齐全,反映溶解度随温度变化的规律不直观。
⑵作图法——溶解度曲线。用纵坐标表示溶解度,横坐标表示温度,根据实验测得的某物质在不同温度下的溶解度数据,在直角坐标系中描点并用平滑的曲线连接起来,即绘制出溶解度随温度变化的曲线,这种曲线叫做溶解度曲线。这种处理数据的方法叫做作图法。
优缺点:数据齐全,反映的溶解度随温度变化的规律形象直观;但数据来源不可靠,可能有误差。
30
20
50
40
硝酸钾
讲授新课
点、线、面的意义
氢氧化钙的溶解度曲线
①大多数固体物质的溶解度随温度的升高而增大(如硝酸钾、氯化钾)。【陡升型】
②少数固体物质的溶解度受温度的影响很小(如氯化钠)。【缓升型】
③极少数固体物质的溶解度随温度的升高而减小(如氢氧化钙)。【下降型】
10
90
80
70
可以比较同一物质在不同温度下的溶解度的大小。
可以比较不同物质在同一温度下的溶解度的大小,两条曲线的交点表示这两种物质在该温度下的溶解度相同。
可以查出某物质在一定温度下的溶解度。
确定温度对某物质溶解度的影响情况。
确定某种物质饱和溶液与不饱和溶液互相转换的方法。
确定物质结晶、分离提纯的方法.
例.下图是a、b两种物质在水中的溶解度曲线。
(1)在_____________,可配制溶质的质量分数相等的a、b两种物质的饱和溶液。
30℃时
a
纯碱的溶解度受温度影响较大
例8.下图是M、N两种物质的溶解度曲线。在t2℃时,往盛有100g水的烧杯中先后加入agM和agN(两种物质溶解时互不影响,且溶质仍是M、N),充分搅拌。将混合物的温度降低到t1℃,下列说法正确的是( )
C
A. t2℃时,得到M的饱和溶液。
B. t2℃时,得到N的不饱和溶液。
C.温度降低到t1℃时,M、N的溶质质量分数相等,得到M、N的不饱和溶液。
D.温度降低到t1℃时,M、N的溶解度相等,得到M、N的饱和溶液。
联系生活实际:天气闷热时,鱼儿为什么总爱在水面上进行呼吸?
三、气体物质的溶解度
气体物质的溶解度
概念:通常用的气体的溶解度,是指该气体在压强在101kPa和一定温时,在1体积水里溶解达到饱和状态时的气体体积。
【比较】固体溶解度与气体溶解度的不同
P1、P2、P3的大小关系是?
t1、t2的高低关系是?
气体在水中的溶解度曲线
喝了汽水以后,常常会打嗝。
打开啤酒瓶盖,看到大量的气泡冒出。
烧开水时,刚把水壶放到火上就看到有气泡冒出 。
在闷热的天气里,鱼儿常出现浮头的现象。
⑵解释下列现象:
1. 你设想增大二氧化碳在水中的溶解度的方法( )
A. 升温增压; B. 升温减压;
C. 降温增压; D. 降温减压。
2.下列几种物质中①硝酸钾、②熟石灰、③氧气、④二氧化碳,其中溶解度随温度的升高而增大的是( )
A.①② B.③④ C.①③④ D.只有①
C
D
练一练
讲授新课
同种溶质在不同的溶剂中的溶解能力不同
不同的溶质在同种溶剂中的溶解能力不同
物质的溶解性
物质的溶解度
易溶
可溶
微溶
难(不)溶
固体的溶解度
气体的溶解度
影响因素
(温度)
影响因素
(温度、压强)
表示方法
表示方法
课堂小结
定性描述
同课章节目录
