2024年中考化学二轮复习从定量的角度认识物质及变化课件(共19张PPT)
文档属性
| 名称 | 2024年中考化学二轮复习从定量的角度认识物质及变化课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 21:36:12 | ||
图片预览





文档简介
(共19张PPT)
化学计算
专题复习之
从定量的角度认识物质及变化
2.微粒的个数比
命题角度 备考策略
根据化学式的计算 审题意——认真审题,找出题中发生的反应,并正确书写化学方程式。
找纯量——通过分析文字、图像和表格,得到化学方程式中某纯净物的质量。
细解题——通过化学方程式、固体混合物中纯度的计算公式、溶质质量分数计算公式等解出相应结果
质量守恒的计算
文字叙述型计算
表格数据型计算
坐标曲线型计算
表格与溶质质量分数综合计算
溶质质量分数和溶液稀释计算
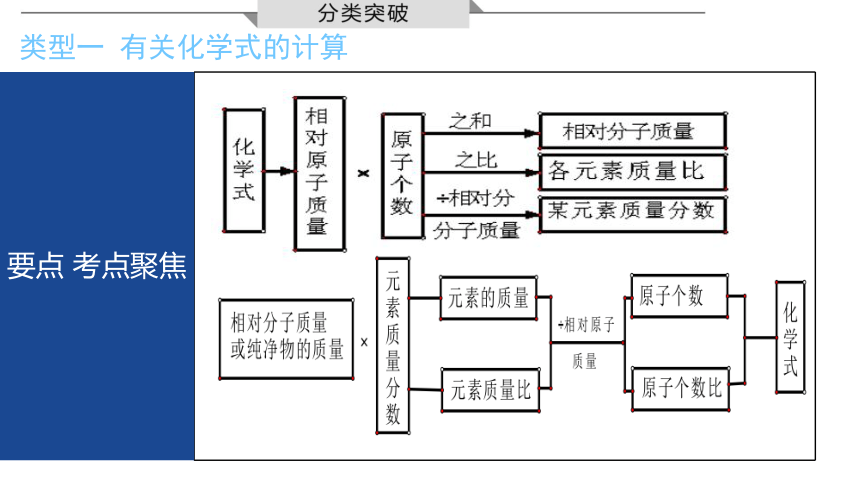
类型一 有关化学式的计算
要点 考点聚焦
c
考法聚焦
例1.苏州盛产杨梅。杨梅中含有丰富的叶酸,对防癌抗癌有积极作用,其化学式为C19H19N7O6。下列有关叶酸的说法中正确的是( )
A.叶酸的相对分子质量为441 g
B.叶酸中氮元素的质量分数大于氧元素的质量分数
C.叶酸中碳、氢、氮、氧四种元素质量比为19∶19∶7∶6
D.叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成
c
考法聚焦
例2. 一定质量的某化合物完全燃烧,需要3.2 g氧气,生
成4.4 g二氧化碳和1.8 g水。下列判断错误的是 ( )
A. 该化合物的质量为3.0 g
B. 该化合物一定含有碳、氢、氧三种元素
C. 该化合物中碳、氢、氧的原子个数比为2∶4∶1
D. 该化合物中碳元素的质量分数是40%
c
方法点拨:有关化学式的计算难度不大,要熟练掌握质量分数的计算方法,计算时要细心,避免失误。
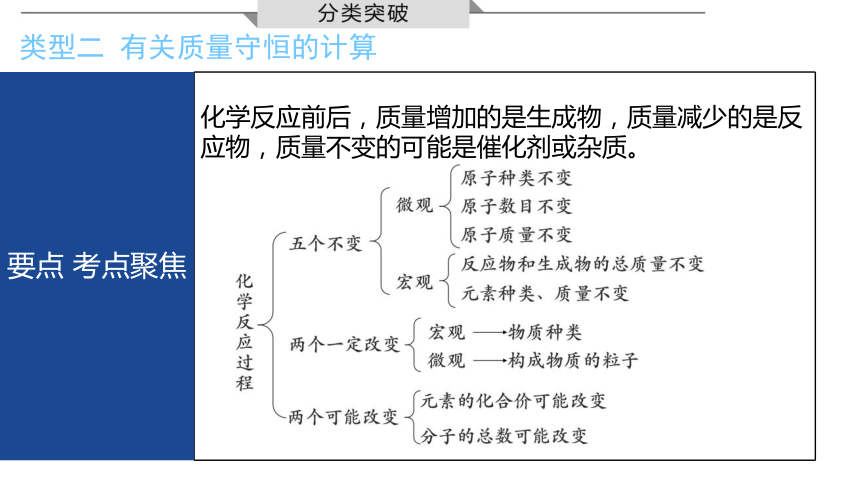
类型二 有关质量守恒的计算
化学反应前后,质量增加的是生成物,质量减少的是反应物,质量不变的可能是催化剂或杂质。
要点 考点聚焦
c
考法聚焦
例1. 在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表。下列说法中不正确的是( )
物质 甲 乙 丙 丁
反应前物质质量/g 8 32 5 4
反应后物质质量/g 16 4 x 24
A.该反应为分解反应 B.丙可能为该反应的催化剂 C.甲、乙两种物质间参加反应的质量比为1:4 D.乙、丁两种物质间反应的质量比为7:5
c
考法聚焦
例2.甲和乙点燃条件下反应生成丙和丁。反应前后分子变化的微观示意图如下,下列说法错误的是( )
A.一个甲分子中含有4个原子
B.4种物质中,属于化合物的是甲和丁
C.生成物丙和丁的质量比为14:27
D.该反应的基本类型为化合反应
类型三 有关化学方程式的计算
分析过程
按题意设未知数
写出题中反应的化学方程式
找出反应物和生成物的质量关系
建立已知量和未知量的比例关系
计算 x,并作答
相对质量
实际质量
相对质量=分子个数×相对分子质量
实际质量:数据要带单位
反应物和生成物的质量关系
已知量和未知量的比例关系
上下相比
比值相等
学会分析有用数据
例1:现有铜锌合金10g,将其放入盛有足量的某浓度的稀硫酸的烧杯中充分反应后,烧杯中混合物的质量减少了0.2g,计算混合物中铜的质量分数
金属活动性:Zn>Cu>(H)
混合物
即:过量
即反应后有剩余
学会分析有用数据
例1:现有铜锌合金10g,将其放入盛有足量的某浓度的稀硫酸的烧杯中充分反应后,烧杯中混合物的质量减少了0.2g,计算合金中铜的质量分数
Zn+H2SO4 =ZnSO4+H2↑
65 2
m 0.2g
65 2
m 0.2g
m=6.5g
答:合金中铜的质量分数为35%。
解:设锌的质量为m
学会分析有用数据
例2:实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验中非气态物质的总质量随时间变化如图所示。回答以下问题:
(1)反应中二氧化锰的作用是 __________
(2)反应中产生氧气的质量是___________
(3)计算过氧化氢溶液中过氧化氢的质量(写出计算过程)
学会分析有用数据
例2:实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验中非气态物质的总质量随时间变化如图所示。回答以下问题:
(1)反应中二氧化锰的作用是 ____催化作用______
(2)反应中产生氧气的质量是_____3.2g______
(3)计算过氧化氢溶液中过氧化氢的质量(写出计算过程)
解:设过氧化氢的质量为m
2H2O2 =2H2O+O2↑
68 32
m 3.2g
68 32
m 3.2g
m=6.8g
答:过氧化氢溶液中过氧化氢的质量为6.8g
c
方法点拨:坐标曲线类计算题目,必须把握好“三点一势”,即“起点”“拐点”“终点”“图线的整体走势”。“拐点”通常是恰好完全反应的点。
例3
——表格数据题
序号 加入稀盐酸质量(g) 剩余固体质量(g)
第1次 10 5.5
第2次 10 m
第3次 10 1.2
第4次 10 1.2
小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。请计算:
(1)表中m的数值应该为多少?
(2)样品中碳酸钙的质量分数是多少?
(3)实验中所用稀盐酸溶质质量分数是多少?
(4)欲配制上述40g稀盐酸,需要质量分数37%(密度为1.19g/cm3)的浓盐酸多少毫升?
(5)第四次反应后溶液溶质氯化钙的质量分数是多少?
例
——表格数据题
石灰石样品
碳酸钙
杂质
(不参与反应)
加稀盐酸
碳酸钙质量变少
杂质质量不变
反应剩余的碳酸钙
杂质(不参与反应)
剩余固体
CaCO3+2HCl = CaCl2+H2O+ CO2↑
第 次反应中,石灰石过量
第 次反应中,盐酸有剩余
例
——表格数据题
序号 加入稀盐酸质量(g) 剩余固体质量(g)
第1次 10 5.5
第2次 10 m
第3次 10 1.2
第4次 10 1.2
反应前样品:8g
-2.5 g
-2.5 g
=3
-1.8 g
0
1、2
3、4
c
方法点拨:
分析题干信息,确定化学方程式;
分析表格数据,确定每组反应的进程(是否恰好完全反应),然后利用合适的数据,进行化学方程式计算。
化学计算
专题复习之
从定量的角度认识物质及变化
2.微粒的个数比
命题角度 备考策略
根据化学式的计算 审题意——认真审题,找出题中发生的反应,并正确书写化学方程式。
找纯量——通过分析文字、图像和表格,得到化学方程式中某纯净物的质量。
细解题——通过化学方程式、固体混合物中纯度的计算公式、溶质质量分数计算公式等解出相应结果
质量守恒的计算
文字叙述型计算
表格数据型计算
坐标曲线型计算
表格与溶质质量分数综合计算
溶质质量分数和溶液稀释计算
类型一 有关化学式的计算
要点 考点聚焦
c
考法聚焦
例1.苏州盛产杨梅。杨梅中含有丰富的叶酸,对防癌抗癌有积极作用,其化学式为C19H19N7O6。下列有关叶酸的说法中正确的是( )
A.叶酸的相对分子质量为441 g
B.叶酸中氮元素的质量分数大于氧元素的质量分数
C.叶酸中碳、氢、氮、氧四种元素质量比为19∶19∶7∶6
D.叶酸由19个碳原子、19个氢原子、7个氮原子和6个氧原子构成
c
考法聚焦
例2. 一定质量的某化合物完全燃烧,需要3.2 g氧气,生
成4.4 g二氧化碳和1.8 g水。下列判断错误的是 ( )
A. 该化合物的质量为3.0 g
B. 该化合物一定含有碳、氢、氧三种元素
C. 该化合物中碳、氢、氧的原子个数比为2∶4∶1
D. 该化合物中碳元素的质量分数是40%
c
方法点拨:有关化学式的计算难度不大,要熟练掌握质量分数的计算方法,计算时要细心,避免失误。
类型二 有关质量守恒的计算
化学反应前后,质量增加的是生成物,质量减少的是反应物,质量不变的可能是催化剂或杂质。
要点 考点聚焦
c
考法聚焦
例1. 在一密闭容器内加入甲、乙、丙、丁四种物质,在一定条件下发生化学反应,反应前后各物质的质量变化见下表。下列说法中不正确的是( )
物质 甲 乙 丙 丁
反应前物质质量/g 8 32 5 4
反应后物质质量/g 16 4 x 24
A.该反应为分解反应 B.丙可能为该反应的催化剂 C.甲、乙两种物质间参加反应的质量比为1:4 D.乙、丁两种物质间反应的质量比为7:5
c
考法聚焦
例2.甲和乙点燃条件下反应生成丙和丁。反应前后分子变化的微观示意图如下,下列说法错误的是( )
A.一个甲分子中含有4个原子
B.4种物质中,属于化合物的是甲和丁
C.生成物丙和丁的质量比为14:27
D.该反应的基本类型为化合反应
类型三 有关化学方程式的计算
分析过程
按题意设未知数
写出题中反应的化学方程式
找出反应物和生成物的质量关系
建立已知量和未知量的比例关系
计算 x,并作答
相对质量
实际质量
相对质量=分子个数×相对分子质量
实际质量:数据要带单位
反应物和生成物的质量关系
已知量和未知量的比例关系
上下相比
比值相等
学会分析有用数据
例1:现有铜锌合金10g,将其放入盛有足量的某浓度的稀硫酸的烧杯中充分反应后,烧杯中混合物的质量减少了0.2g,计算混合物中铜的质量分数
金属活动性:Zn>Cu>(H)
混合物
即:过量
即反应后有剩余
学会分析有用数据
例1:现有铜锌合金10g,将其放入盛有足量的某浓度的稀硫酸的烧杯中充分反应后,烧杯中混合物的质量减少了0.2g,计算合金中铜的质量分数
Zn+H2SO4 =ZnSO4+H2↑
65 2
m 0.2g
65 2
m 0.2g
m=6.5g
答:合金中铜的质量分数为35%。
解:设锌的质量为m
学会分析有用数据
例2:实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验中非气态物质的总质量随时间变化如图所示。回答以下问题:
(1)反应中二氧化锰的作用是 __________
(2)反应中产生氧气的质量是___________
(3)计算过氧化氢溶液中过氧化氢的质量(写出计算过程)
学会分析有用数据
例2:实验室用68g过氧化氢溶液和2g二氧化锰制取氧气,实验中非气态物质的总质量随时间变化如图所示。回答以下问题:
(1)反应中二氧化锰的作用是 ____催化作用______
(2)反应中产生氧气的质量是_____3.2g______
(3)计算过氧化氢溶液中过氧化氢的质量(写出计算过程)
解:设过氧化氢的质量为m
2H2O2 =2H2O+O2↑
68 32
m 3.2g
68 32
m 3.2g
m=6.8g
答:过氧化氢溶液中过氧化氢的质量为6.8g
c
方法点拨:坐标曲线类计算题目,必须把握好“三点一势”,即“起点”“拐点”“终点”“图线的整体走势”。“拐点”通常是恰好完全反应的点。
例3
——表格数据题
序号 加入稀盐酸质量(g) 剩余固体质量(g)
第1次 10 5.5
第2次 10 m
第3次 10 1.2
第4次 10 1.2
小强同学前往当地的石灰石矿区进行调查,他取回了若干块矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:取用8g这种石灰石样品,把40g稀盐酸分四次加入,测量过程所得数据见下表(已知石灰石样品中含有的杂质不溶于水,不与盐酸反应)。请计算:
(1)表中m的数值应该为多少?
(2)样品中碳酸钙的质量分数是多少?
(3)实验中所用稀盐酸溶质质量分数是多少?
(4)欲配制上述40g稀盐酸,需要质量分数37%(密度为1.19g/cm3)的浓盐酸多少毫升?
(5)第四次反应后溶液溶质氯化钙的质量分数是多少?
例
——表格数据题
石灰石样品
碳酸钙
杂质
(不参与反应)
加稀盐酸
碳酸钙质量变少
杂质质量不变
反应剩余的碳酸钙
杂质(不参与反应)
剩余固体
CaCO3+2HCl = CaCl2+H2O+ CO2↑
第 次反应中,石灰石过量
第 次反应中,盐酸有剩余
例
——表格数据题
序号 加入稀盐酸质量(g) 剩余固体质量(g)
第1次 10 5.5
第2次 10 m
第3次 10 1.2
第4次 10 1.2
反应前样品:8g
-2.5 g
-2.5 g
=3
-1.8 g
0
1、2
3、4
c
方法点拨:
分析题干信息,确定化学方程式;
分析表格数据,确定每组反应的进程(是否恰好完全反应),然后利用合适的数据,进行化学方程式计算。
同课章节目录
