2023-2024学年高一下学期化学人教版(2019)必修第二册8.1.1自然资源的开发利用课件(41张ppt)
文档属性
| 名称 | 2023-2024学年高一下学期化学人教版(2019)必修第二册8.1.1自然资源的开发利用课件(41张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 31.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-04 07:53:10 | ||
图片预览










文档简介
(共41张PPT)
第一节 自然资源的开发利用
第1课时
第八章 化学与可持续发展
1.什么是自然资源?可持续发展的目标指什么?
2.金属元素在自然界以化合态还是游离态存在?
3.金属冶炼指什么?
4.为什么不同金属的冶炼方法不同?
5.金属活动顺序与金属冶炼有什么关系?
6.铝热反应?
7.合理开发和利用金属矿物资源有哪些主要途径?
阅读课本P98—99,完成下列问题:
思、议6分钟
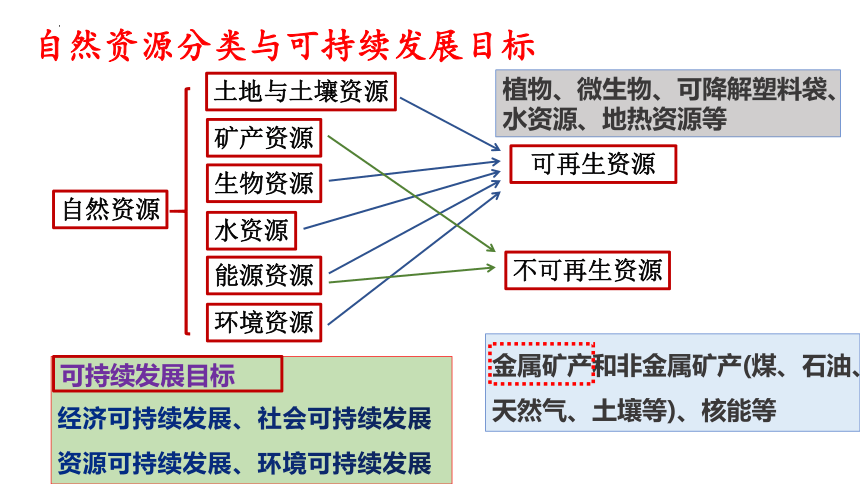
自然资源分类与可持续发展目标
土地与土壤资源
矿产资源
生物资源
水资源
能源资源
环境资源
自然资源
经济可持续发展、社会可持续发展
资源可持续发展、环境可持续发展
可再生资源
不可再生资源
植物、微生物、可降解塑料袋、水资源、地热资源等
金属矿产和非金属矿产(煤、石油、天然气、土壤等)、核能等
可持续发展目标
人们在生活和生产中使用的金属材料多为合金,它是由金属单质加工获得的。
多功能军工刀
高压钠灯
铜导线
铁锅
不锈钢锅
钛合金羽毛球拍
镍合金门锁
铂合金首饰
钠钾合金
那么人们是如何获得金属单质?金属矿物又是如何开发和利用的呢?
2
1
本节重点
本节难点
不同金属的冶炼方法
金属矿物的开发利用
一、金属元素在自然界的存在
游离态:
化合态:
少数不活泼金属
例: 金、铂
及少量铜、银、陨铁
金
铂
绝大多数金属以矿物质形式存在
铜
银
陨铁
铝土矿(Al2O3)
菱镁矿
(MgCO3)
赤铁矿(Fe2O3)
黄铁矿(FeS2)
菱铁矿(FeCO3)
磁铁矿(Fe3O4)
黄铜矿
(CuFeS2)
孔雀石
[CuCO3·Cu(OH)2]
陨铁:从外太空陨落到地面的含铁较多的陨石或纯铁。陨铁的使用始于4500多年前
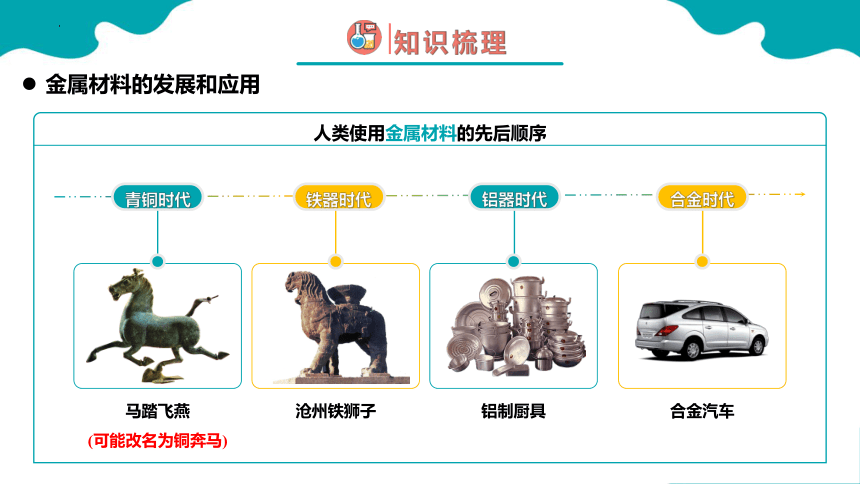
马踏飞燕
沧州铁狮子
铝制厨具
合金汽车
金属材料的发展和应用
青铜时代
铁器时代
铝器时代
合金时代
人类使用金属材料的先后顺序
(可能改名为铜奔马)
金属材料的发展和应用
01
02
03
现阶段
铁年产量最大
铝年产量第二
铜年产量第三
二、金属的冶炼
定义:
实质:
方法:
将金属从其化合物中还原出来的过程,工业上称之为金属的冶炼。
电解法、热还原法、热分解法、富集法。
金属离子(Mn+)被还原的难易程度不同
或说,由于不同的金属离子得电子的能力不同,所以冶炼的方法不同。
不活泼的金属
K、Ca、Na、Mg、Al、
Zn、Fe、Sn、Pb、(H)、Cu、
Hg、Ag、Pt、Au
非常活泼的金属
中等活泼的金属
①富集法:
金、铂在自然界以游离态存在,直接通过物理方法即可提取,如“沙土淘金”。
三、金属冶炼的方法
不活泼金属
②热分解法:
③热还原法:
铝热反应
三、金属冶炼
不活泼金属
相对不活泼金属
常见的还原剂:C 、CO、H2、某些活泼金属Al 等
铝热反应
现象:
1、镁条剧烈燃烧
2、氧化铁与铝粉发生剧烈反应,放出大量的热,放出耀眼的白光,火星四射
3、漏斗下部烧穿,有熔融物落入细沙中
原理:
铝热剂:铝粉 + 金属氧化物 (V2O5 Cr2O3 MnO2 FexOy等)
铝与某些难熔金属氧化物(如Fe2O3、Cr2O3、MnO2等)在高温条件下发生的置换反应称为铝热反应。
1、铝热反应需要高温条件,是否还需要持续加热?
铝热反应为放热反应,放出的热可以维持反应继续进行,因此不需要持续加热。
2、实验中,镁条、氯酸钾的作用是什么?引发反应的操作是什么?
镁条是引燃剂,氯酸钾为助燃剂,点燃镁条,促使氯酸钾分解,释放出氧气,使镁条更剧烈燃烧,单位时间内放出更多热量,从而引发Al和Fe2O3发生反应。
3、蒸发皿中铺少量细沙的作用是什么?
一是防止蒸发皿炸裂,二是防止生成的熔融物溅出。
4、据反应原理,Fe2O3和Al的质量比为多少最好?
3∶1或铝稍稍过量
应用:
反应特点:在高温下进行,反应迅速并放出大量的热,新生成的
金属单质呈熔融态且易与Al2O3(固态)分离。
①焊接钢轨;
②定向爆破;
③冶炼熔点高的金属(如钨、钒、铬、锰等)
Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
③热还原法总结
铝热反应
铝热剂
引发操作
反应特点
反应应用
铝和金属氧化物在高温下发生剧烈反应并放出大量热的化学反应
铝粉 + 金属氧化物 (V2O5 Cr2O3 MnO2 FexOy)
在铝热剂上放KClO3,插入镁条并将镁条点燃
高温引发后即可发生,不用持续加热,放出大量的热 3000°C
焊接钢轨,冶炼高熔点,且活泼型比铝差的金属
2Al+Fe2O3 2Fe+Al2O3
高温
4Al+ 3MnO2 2Al2O3+3Mn
高温
其他特殊还原法冶炼金属
Fe+CuSO4===FeSO4+Cu
将孔雀石和焦炭混合加热炼铜。先将孔雀石[Cu2(OH)2CO3]加热分解成黑色固体、水和二氧化碳三种氧化物,然后利用焦炭去高温还原获得金属铜
Cu2(OH)2CO3==2CuO+CO2↑+H2O
△
2CuO+C==2Cu+CO2↑
高温
①
②
MgCl2 (熔融) Mg+Cl2↑
通电
2NaCl (熔融) 2Na+Cl2↑
通电
2Al2O3 (熔融) 4Al + 3O2↑
通电
冰晶石
④电解法:
非常活泼金属
近代1886年,美国大学生霍尔和法国大学生艾鲁独立研究电解制铝。在实验中霍尔发现向氧化铝中加入冰晶石,可以将氧化铝熔化的温度从2050℃降到950℃。这一创新使人类可以大规模的生产铝。
疑问:为什么不使用电解氯化铝来制备铝单质?
电解炼铝法的流程具体是什么样的呢?
铝的生产原理
示意图
铝土矿
提纯
氧化铝
萤石
制备
冰晶石
石油焦
沥青焦
制备
碳素电极
电解
液态铝
铝锭
氧化铝的熔点高(2050℃),加入冰晶石(Na3AlF6 )能够溶解氧化铝而又能降低其熔点,而且冰晶石在电解温度下不被分解,并有足够的流动性,有利于进行电解。
CaF2
Na3AlF6
六氟合铝酸钠
铝土矿中提取铝工艺路线
途径一
Al2O3
Fe2O3
SiO2
Al3+、Fe3+
Fe(OH)3
AlO2-
Al(OH)3
加HCl后过
滤
SiO2
Al2O3
加NaOH后过滤
过量
CO2
灼烧
电解
Al
Al2O3+6HCl=2AlCl3+3H2O
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
HCl+NaOH=NaCl+H2O
Fe2O3+6HCl=2FeCl3+3H2O
NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3
NaOH+CO2=NaHCO3
Al(OH)3 Al2O3+3H2O
加热
Al2O3(熔融) 4Al+3O2
电解
铝土矿中提取铝工艺路线
金属矿物的开发利用
途径一
问题探讨
不是NaHCO3而是Na2CO3。
不能,原因是Al3+与过量氨水反应生成Al(OH)3沉淀,达不到分离Al3+、Fe3+的目的。
能否用氨水代替NaOH 溶液
探讨一
探讨二
若将CO 的量改为“少量”,得到的产物还是NaHCO3吗
铝土矿中提取铝工艺路线
金属矿物的开发利用
途径二
Al2O3
Fe2O3
SiO2
AlO2-、SiO2-3
H2SiO3
Al3+
Al(OH)3
NH3 H2O
加NaOH后过
滤
Fe2O3
Al2O3
加HCl后过
滤
灼烧
电解
Al
Al2O3+2NaOH=2NaAlO2+H2O
SiO2+2NaOH=NaSiO3+H2O
Na2SiO3+2HCl=H2SiO3↓+2NaCl
NaAlO2+4HCl=NaCl+AlCl3+2H2O
NaOH+HCl=NaCl+H2O
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
HCl+NH3·H2O=NH4Cl+H O
Al(OH)3 Al2O3+3H2O
加热
Al2O3(熔融) 4Al+3O2
电解
铝土矿中提取铝工艺路线
金属矿物的开发利用
途径一
问题探讨
不合适,因为Al(OH)3能溶于NaOH。
不合适,因为过量CO2与NaAlO2、Na2SiO3反应生成Al(OH)3和H2SiO3沉淀,达不到分离SiO2和Al2O3的目的。
能否将将盐酸改为CO2
探讨一
探讨二
将氨水改为“NaOH溶液”合适吗
AlCl3是共价化合物,其熔融状态不导电,不能电解制铝。
探讨三
冶炼金属铝能否用氯化铝代替氧化铝
试从能源消耗和环境污染两个角度分析加强废旧金属回收利用的重要性
废旧铝质
饮料罐
液态
铝
铝
锭
高温熔化
除杂
以废旧饮料罐生产1 kg铝消耗资源及能耗废旧饮料罐1.01 kg,电能能耗≤3.35×106 J
以铝土矿为原料生产1 kg铝的资源及能耗
铝土矿:4 kg 煤:0.5 kg 燃料油:0.25 kg
纯碱:0.5 kg 石灰:0.5 kg 氟化钙:0.04 kg
焙烧碳素:0.6 kg 冰晶石:0.03 kg
电能能耗≥6.7×107 J
用铝土矿生产铝,能耗高,资源消耗量大,在生产过程中会产生大量的废气、废液及废渣,对大气水体及土壤会产生很大污染;
而用废旧饮料罐生产铝,能耗低,资源消耗量小,对环境污染很小,变废为宝,既可以减少废旧金属对环境的污染还可以提高矿物有效利用率,是可持续发展的必然要求。
合理开发和利用金属矿物资源
地球上的金属矿物资源是有限的,且分布不均。
人类通过金属的冶炼,每年从自然界中提取数以亿吨计的金属,这个过程中会消耗许多能量,也易造成环境污染。而金属腐蚀现象普遍存在,也造成了大量损失。
金属保护刻不容缓
三、合理开发和利用金属资源的原因及途径
(1)_________________________;
(2)开发环保高效的金属冶炼方法;
(3)________________________;
(4)_______________________________;
(5)使用其他材料代替金属材料。
提高金属矿物的利用率
防止金属的腐蚀
加强废旧金属的回收和再利用
(1)资源有限且分布不均
(2)金属的冶炼消耗许多能量
(3)金属冶炼造成环境污染
(4)金属腐蚀造成大量损失
1.原因:
2.措施:
冶炼方法总结:
冶炼金属常用以下几种方法:
①以C、H2或CO作为还原剂还原法 ;②热分解法 ;③电解法 ;④铝热法。
现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼方法。
Al: ;Mg: ;Cu: ; Hg: ;Mn: 。
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
热分解法
物理提取(富集)
资料1. 古代炼丹术家葛洪的《抱朴子》中记载有“丹砂烧之成水银”;
唐代诗人刘禹锡在《浪淘沙九首》中有云:“日照澄洲江雾开,淘金女伴满江隈。美人首饰侯王印,尽是沙中浪底来”;
北宋科学家沈括在《梦溪笔谈》中写道:“信州铅山县有苦泉,流以为涧. 挹其水熬之,则成胆矾,烹胆矾则成铜;熬胆矾铁釜,久之亦化为铜”. (火法炼铜) (湿法炼铜)
以上资料中涉及了哪些金属的“冶炼”?
丹砂:HgS
铑极其稀有,铑具有高熔点和惊人的耐腐蚀能力。这种银色属通常因为其反射特性被使用。如今,它的价格大约是黄金的四倍。
特征:银白色,坚硬,耐腐蚀
生产国:南非,俄罗斯,加拿大和其他生产国
用途:这种金属通常用干照明行业,镜子生产;在汽车行业中,用作催化剂,前照灯反射器它也被称为珠宝,特别是“白金”的抗刮擦饰面。
世界上最昂贵的贵金属
金属铑
(1)在自然界中金属元素都以化合态的形式存在( )
(2)利用化合物冶炼金属时,金属元素一定发生还原反应( )
(3)越活泼的金属元素,人类利用的越晚( )
(4)用热还原法冶炼金属时,可以用H2将Mg从化合物中还原出来( )
(5)铝热反应的本质是用铝将比铝活泼性弱的金属从其化合物中置换出来( )
(6)可以通过电解饱和食盐水的方法获取金属钠( )
(7)可以通过电解熔融的MgO和AlCl3来制备金属Mg、Al( )
×
√
×
√
×
×
√
判断正误
2.工业上常用电解法冶炼的金属为( )
A.镁 B.铁 C.铜 D.银
A
3.已知一些金属的发现和使用与其金属活动性有着必然的联系。据此推测,下列事件发生在铁器时代之前的是( )
A.金属钠的使用
B.青铜器的大量使用
C.海水提镁
D.铝热法制铬
B
4.铝能用于冶炼熔点高的金属(如V、Cr、Mn等),用到的铝的性质是( )
A.银白色金属
B.熔、沸点相对较低
C.导电、导热性能好
D.还原性强,在反应中释放出大量的热
D
5.下列各组金属最适合用H2或CO把它从化合物中还原出来的是( )
A.K、Mg B.Fe、Al
C.Fe、Cu D.Hg、Ag
C
6、铝土矿的主要成分是Al2O3和SiO2、Fe2O3等。因此从铝土矿中提Al2O3的流程可以设计成两种方案。
上述过程残渣和沉淀的化学式分别为_______、 _______前后滤液的主要阳离子的符号分别为_______________、_______写出该过程①②离子方程式分别为 ①__________________________________________________________________ ② ;
a.酸溶法的工艺流程:
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
①
②
SiO2
Fe(OH)3
Al3+、Fe3+
Na+
Al2O3+6H+=2Al3++3H2O
Fe2O3+6H+=2Fe3++3H2O
上述过程残渣和沉淀的化学式分别为_______、_______前后滤液的主要阳离子的符号分别为_______、_______写出该过程①②离子方程式分别为①__________________________________________________________
_② _________________________;
反应③的化学方程式______________________________________________
b.碱溶法的工艺流程:
①
③
Na+
H2SiO3
Al3+
Fe2O3
SiO2+2OH-=SiO32-+H2O
②
生成的红热的铁在掉落到蒸发皿的过程中,表面被空气氧化为Fe3O4。
NaOH
第一节
自然资源的开发利用
第1课时
游离态
金属元素在自然界中的存在形态
化合态
人类使用金属材料的先后顺序
金属材料的发展和应用
金属铝冶炼历程
金属冶炼的一般方法
合理开发和利用金属资源显得尤为重要
第一节 自然资源的开发利用
第1课时
第八章 化学与可持续发展
1.什么是自然资源?可持续发展的目标指什么?
2.金属元素在自然界以化合态还是游离态存在?
3.金属冶炼指什么?
4.为什么不同金属的冶炼方法不同?
5.金属活动顺序与金属冶炼有什么关系?
6.铝热反应?
7.合理开发和利用金属矿物资源有哪些主要途径?
阅读课本P98—99,完成下列问题:
思、议6分钟
自然资源分类与可持续发展目标
土地与土壤资源
矿产资源
生物资源
水资源
能源资源
环境资源
自然资源
经济可持续发展、社会可持续发展
资源可持续发展、环境可持续发展
可再生资源
不可再生资源
植物、微生物、可降解塑料袋、水资源、地热资源等
金属矿产和非金属矿产(煤、石油、天然气、土壤等)、核能等
可持续发展目标
人们在生活和生产中使用的金属材料多为合金,它是由金属单质加工获得的。
多功能军工刀
高压钠灯
铜导线
铁锅
不锈钢锅
钛合金羽毛球拍
镍合金门锁
铂合金首饰
钠钾合金
那么人们是如何获得金属单质?金属矿物又是如何开发和利用的呢?
2
1
本节重点
本节难点
不同金属的冶炼方法
金属矿物的开发利用
一、金属元素在自然界的存在
游离态:
化合态:
少数不活泼金属
例: 金、铂
及少量铜、银、陨铁
金
铂
绝大多数金属以矿物质形式存在
铜
银
陨铁
铝土矿(Al2O3)
菱镁矿
(MgCO3)
赤铁矿(Fe2O3)
黄铁矿(FeS2)
菱铁矿(FeCO3)
磁铁矿(Fe3O4)
黄铜矿
(CuFeS2)
孔雀石
[CuCO3·Cu(OH)2]
陨铁:从外太空陨落到地面的含铁较多的陨石或纯铁。陨铁的使用始于4500多年前
马踏飞燕
沧州铁狮子
铝制厨具
合金汽车
金属材料的发展和应用
青铜时代
铁器时代
铝器时代
合金时代
人类使用金属材料的先后顺序
(可能改名为铜奔马)
金属材料的发展和应用
01
02
03
现阶段
铁年产量最大
铝年产量第二
铜年产量第三
二、金属的冶炼
定义:
实质:
方法:
将金属从其化合物中还原出来的过程,工业上称之为金属的冶炼。
电解法、热还原法、热分解法、富集法。
金属离子(Mn+)被还原的难易程度不同
或说,由于不同的金属离子得电子的能力不同,所以冶炼的方法不同。
不活泼的金属
K、Ca、Na、Mg、Al、
Zn、Fe、Sn、Pb、(H)、Cu、
Hg、Ag、Pt、Au
非常活泼的金属
中等活泼的金属
①富集法:
金、铂在自然界以游离态存在,直接通过物理方法即可提取,如“沙土淘金”。
三、金属冶炼的方法
不活泼金属
②热分解法:
③热还原法:
铝热反应
三、金属冶炼
不活泼金属
相对不活泼金属
常见的还原剂:C 、CO、H2、某些活泼金属Al 等
铝热反应
现象:
1、镁条剧烈燃烧
2、氧化铁与铝粉发生剧烈反应,放出大量的热,放出耀眼的白光,火星四射
3、漏斗下部烧穿,有熔融物落入细沙中
原理:
铝热剂:铝粉 + 金属氧化物 (V2O5 Cr2O3 MnO2 FexOy等)
铝与某些难熔金属氧化物(如Fe2O3、Cr2O3、MnO2等)在高温条件下发生的置换反应称为铝热反应。
1、铝热反应需要高温条件,是否还需要持续加热?
铝热反应为放热反应,放出的热可以维持反应继续进行,因此不需要持续加热。
2、实验中,镁条、氯酸钾的作用是什么?引发反应的操作是什么?
镁条是引燃剂,氯酸钾为助燃剂,点燃镁条,促使氯酸钾分解,释放出氧气,使镁条更剧烈燃烧,单位时间内放出更多热量,从而引发Al和Fe2O3发生反应。
3、蒸发皿中铺少量细沙的作用是什么?
一是防止蒸发皿炸裂,二是防止生成的熔融物溅出。
4、据反应原理,Fe2O3和Al的质量比为多少最好?
3∶1或铝稍稍过量
应用:
反应特点:在高温下进行,反应迅速并放出大量的热,新生成的
金属单质呈熔融态且易与Al2O3(固态)分离。
①焊接钢轨;
②定向爆破;
③冶炼熔点高的金属(如钨、钒、铬、锰等)
Na Mg Al Zn Fe Sn Pb Cu Hg Ag Pt Au
③热还原法总结
铝热反应
铝热剂
引发操作
反应特点
反应应用
铝和金属氧化物在高温下发生剧烈反应并放出大量热的化学反应
铝粉 + 金属氧化物 (V2O5 Cr2O3 MnO2 FexOy)
在铝热剂上放KClO3,插入镁条并将镁条点燃
高温引发后即可发生,不用持续加热,放出大量的热 3000°C
焊接钢轨,冶炼高熔点,且活泼型比铝差的金属
2Al+Fe2O3 2Fe+Al2O3
高温
4Al+ 3MnO2 2Al2O3+3Mn
高温
其他特殊还原法冶炼金属
Fe+CuSO4===FeSO4+Cu
将孔雀石和焦炭混合加热炼铜。先将孔雀石[Cu2(OH)2CO3]加热分解成黑色固体、水和二氧化碳三种氧化物,然后利用焦炭去高温还原获得金属铜
Cu2(OH)2CO3==2CuO+CO2↑+H2O
△
2CuO+C==2Cu+CO2↑
高温
①
②
MgCl2 (熔融) Mg+Cl2↑
通电
2NaCl (熔融) 2Na+Cl2↑
通电
2Al2O3 (熔融) 4Al + 3O2↑
通电
冰晶石
④电解法:
非常活泼金属
近代1886年,美国大学生霍尔和法国大学生艾鲁独立研究电解制铝。在实验中霍尔发现向氧化铝中加入冰晶石,可以将氧化铝熔化的温度从2050℃降到950℃。这一创新使人类可以大规模的生产铝。
疑问:为什么不使用电解氯化铝来制备铝单质?
电解炼铝法的流程具体是什么样的呢?
铝的生产原理
示意图
铝土矿
提纯
氧化铝
萤石
制备
冰晶石
石油焦
沥青焦
制备
碳素电极
电解
液态铝
铝锭
氧化铝的熔点高(2050℃),加入冰晶石(Na3AlF6 )能够溶解氧化铝而又能降低其熔点,而且冰晶石在电解温度下不被分解,并有足够的流动性,有利于进行电解。
CaF2
Na3AlF6
六氟合铝酸钠
铝土矿中提取铝工艺路线
途径一
Al2O3
Fe2O3
SiO2
Al3+、Fe3+
Fe(OH)3
AlO2-
Al(OH)3
加HCl后过
滤
SiO2
Al2O3
加NaOH后过滤
过量
CO2
灼烧
电解
Al
Al2O3+6HCl=2AlCl3+3H2O
AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
HCl+NaOH=NaCl+H2O
Fe2O3+6HCl=2FeCl3+3H2O
NaAlO2+H2O+CO2=Al(OH)3↓+NaHCO3
NaOH+CO2=NaHCO3
Al(OH)3 Al2O3+3H2O
加热
Al2O3(熔融) 4Al+3O2
电解
铝土矿中提取铝工艺路线
金属矿物的开发利用
途径一
问题探讨
不是NaHCO3而是Na2CO3。
不能,原因是Al3+与过量氨水反应生成Al(OH)3沉淀,达不到分离Al3+、Fe3+的目的。
能否用氨水代替NaOH 溶液
探讨一
探讨二
若将CO 的量改为“少量”,得到的产物还是NaHCO3吗
铝土矿中提取铝工艺路线
金属矿物的开发利用
途径二
Al2O3
Fe2O3
SiO2
AlO2-、SiO2-3
H2SiO3
Al3+
Al(OH)3
NH3 H2O
加NaOH后过
滤
Fe2O3
Al2O3
加HCl后过
滤
灼烧
电解
Al
Al2O3+2NaOH=2NaAlO2+H2O
SiO2+2NaOH=NaSiO3+H2O
Na2SiO3+2HCl=H2SiO3↓+2NaCl
NaAlO2+4HCl=NaCl+AlCl3+2H2O
NaOH+HCl=NaCl+H2O
AlCl3+3NH3·H2O=Al(OH)3↓+3NH4Cl
HCl+NH3·H2O=NH4Cl+H O
Al(OH)3 Al2O3+3H2O
加热
Al2O3(熔融) 4Al+3O2
电解
铝土矿中提取铝工艺路线
金属矿物的开发利用
途径一
问题探讨
不合适,因为Al(OH)3能溶于NaOH。
不合适,因为过量CO2与NaAlO2、Na2SiO3反应生成Al(OH)3和H2SiO3沉淀,达不到分离SiO2和Al2O3的目的。
能否将将盐酸改为CO2
探讨一
探讨二
将氨水改为“NaOH溶液”合适吗
AlCl3是共价化合物,其熔融状态不导电,不能电解制铝。
探讨三
冶炼金属铝能否用氯化铝代替氧化铝
试从能源消耗和环境污染两个角度分析加强废旧金属回收利用的重要性
废旧铝质
饮料罐
液态
铝
铝
锭
高温熔化
除杂
以废旧饮料罐生产1 kg铝消耗资源及能耗废旧饮料罐1.01 kg,电能能耗≤3.35×106 J
以铝土矿为原料生产1 kg铝的资源及能耗
铝土矿:4 kg 煤:0.5 kg 燃料油:0.25 kg
纯碱:0.5 kg 石灰:0.5 kg 氟化钙:0.04 kg
焙烧碳素:0.6 kg 冰晶石:0.03 kg
电能能耗≥6.7×107 J
用铝土矿生产铝,能耗高,资源消耗量大,在生产过程中会产生大量的废气、废液及废渣,对大气水体及土壤会产生很大污染;
而用废旧饮料罐生产铝,能耗低,资源消耗量小,对环境污染很小,变废为宝,既可以减少废旧金属对环境的污染还可以提高矿物有效利用率,是可持续发展的必然要求。
合理开发和利用金属矿物资源
地球上的金属矿物资源是有限的,且分布不均。
人类通过金属的冶炼,每年从自然界中提取数以亿吨计的金属,这个过程中会消耗许多能量,也易造成环境污染。而金属腐蚀现象普遍存在,也造成了大量损失。
金属保护刻不容缓
三、合理开发和利用金属资源的原因及途径
(1)_________________________;
(2)开发环保高效的金属冶炼方法;
(3)________________________;
(4)_______________________________;
(5)使用其他材料代替金属材料。
提高金属矿物的利用率
防止金属的腐蚀
加强废旧金属的回收和再利用
(1)资源有限且分布不均
(2)金属的冶炼消耗许多能量
(3)金属冶炼造成环境污染
(4)金属腐蚀造成大量损失
1.原因:
2.措施:
冶炼方法总结:
冶炼金属常用以下几种方法:
①以C、H2或CO作为还原剂还原法 ;②热分解法 ;③电解法 ;④铝热法。
现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼方法。
Al: ;Mg: ;Cu: ; Hg: ;Mn: 。
钾 钙 钠 镁 铝 锌 铁 锡 铅 (氢) 铜 汞 银 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
电解法
热还原法
热分解法
物理提取(富集)
资料1. 古代炼丹术家葛洪的《抱朴子》中记载有“丹砂烧之成水银”;
唐代诗人刘禹锡在《浪淘沙九首》中有云:“日照澄洲江雾开,淘金女伴满江隈。美人首饰侯王印,尽是沙中浪底来”;
北宋科学家沈括在《梦溪笔谈》中写道:“信州铅山县有苦泉,流以为涧. 挹其水熬之,则成胆矾,烹胆矾则成铜;熬胆矾铁釜,久之亦化为铜”. (火法炼铜) (湿法炼铜)
以上资料中涉及了哪些金属的“冶炼”?
丹砂:HgS
铑极其稀有,铑具有高熔点和惊人的耐腐蚀能力。这种银色属通常因为其反射特性被使用。如今,它的价格大约是黄金的四倍。
特征:银白色,坚硬,耐腐蚀
生产国:南非,俄罗斯,加拿大和其他生产国
用途:这种金属通常用干照明行业,镜子生产;在汽车行业中,用作催化剂,前照灯反射器它也被称为珠宝,特别是“白金”的抗刮擦饰面。
世界上最昂贵的贵金属
金属铑
(1)在自然界中金属元素都以化合态的形式存在( )
(2)利用化合物冶炼金属时,金属元素一定发生还原反应( )
(3)越活泼的金属元素,人类利用的越晚( )
(4)用热还原法冶炼金属时,可以用H2将Mg从化合物中还原出来( )
(5)铝热反应的本质是用铝将比铝活泼性弱的金属从其化合物中置换出来( )
(6)可以通过电解饱和食盐水的方法获取金属钠( )
(7)可以通过电解熔融的MgO和AlCl3来制备金属Mg、Al( )
×
√
×
√
×
×
√
判断正误
2.工业上常用电解法冶炼的金属为( )
A.镁 B.铁 C.铜 D.银
A
3.已知一些金属的发现和使用与其金属活动性有着必然的联系。据此推测,下列事件发生在铁器时代之前的是( )
A.金属钠的使用
B.青铜器的大量使用
C.海水提镁
D.铝热法制铬
B
4.铝能用于冶炼熔点高的金属(如V、Cr、Mn等),用到的铝的性质是( )
A.银白色金属
B.熔、沸点相对较低
C.导电、导热性能好
D.还原性强,在反应中释放出大量的热
D
5.下列各组金属最适合用H2或CO把它从化合物中还原出来的是( )
A.K、Mg B.Fe、Al
C.Fe、Cu D.Hg、Ag
C
6、铝土矿的主要成分是Al2O3和SiO2、Fe2O3等。因此从铝土矿中提Al2O3的流程可以设计成两种方案。
上述过程残渣和沉淀的化学式分别为_______、 _______前后滤液的主要阳离子的符号分别为_______________、_______写出该过程①②离子方程式分别为 ①__________________________________________________________________ ② ;
a.酸溶法的工艺流程:
AlO2-+2H2O+CO2===Al(OH)3↓+HCO3-
①
②
SiO2
Fe(OH)3
Al3+、Fe3+
Na+
Al2O3+6H+=2Al3++3H2O
Fe2O3+6H+=2Fe3++3H2O
上述过程残渣和沉淀的化学式分别为_______、_______前后滤液的主要阳离子的符号分别为_______、_______写出该过程①②离子方程式分别为①__________________________________________________________
_② _________________________;
反应③的化学方程式______________________________________________
b.碱溶法的工艺流程:
①
③
Na+
H2SiO3
Al3+
Fe2O3
SiO2+2OH-=SiO32-+H2O
②
生成的红热的铁在掉落到蒸发皿的过程中,表面被空气氧化为Fe3O4。
NaOH
第一节
自然资源的开发利用
第1课时
游离态
金属元素在自然界中的存在形态
化合态
人类使用金属材料的先后顺序
金属材料的发展和应用
金属铝冶炼历程
金属冶炼的一般方法
合理开发和利用金属资源显得尤为重要
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
