2023-2024学年高一下学期化学人教版(2019)必修第二册8.1.2海水资源的开发利用课件(35张ppt)
文档属性
| 名称 | 2023-2024学年高一下学期化学人教版(2019)必修第二册8.1.2海水资源的开发利用课件(35张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 29.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-04 08:08:20 | ||
图片预览



文档简介
(共35张PPT)
第一节 自然资源的开发利用
第2课时
第八章 化学与可持续发展
2
海水制盐
1
海水淡化
3
本节重难点
海水提溴
4
本节重难点
海水制镁
地球表面海洋面积占到71%,海洋是人类千万年来取之不尽、用之不竭的巨大资源宝库。其中的水资源和其他化学资源具有十分巨大的开发潜力。
你知道海洋中有哪些资源吗?
海水中的化学元素
由于与岩石、大气和生物的相互作用,海水中溶解和悬浮着大量的无机物和有机物。海水中含量最多的O、H两种元素,加上Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F等11种元素,其总含量超过99%,其他元素为微量。虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度却很低。例如,海水中金元素的总储量约为5×106 t,而1t海水中金元素的含量仅为4×10-6g。海洋还是一个远未充分开发的巨大化学资源宝库。
总量巨大但浓度极低,要耗费大量能源和时间进行富集、分离和提纯
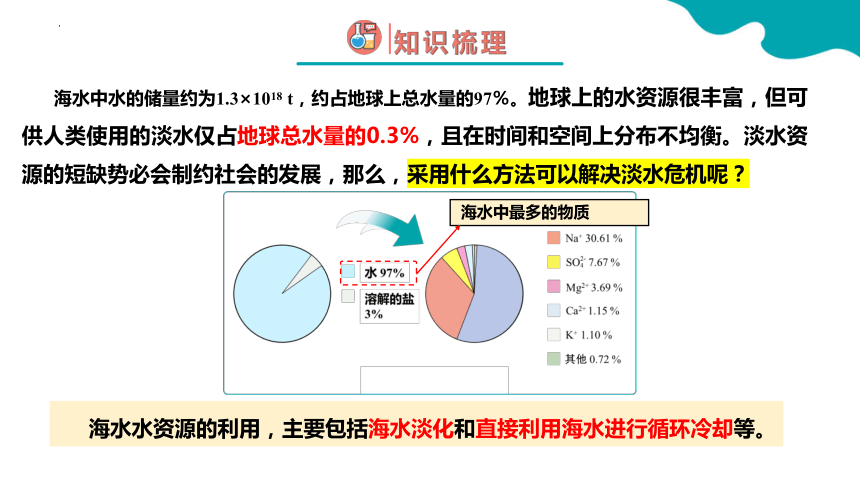
海水中水的储量约为1.3×1018 t,约占地球上总水量的97%。地球上的水资源很丰富,但可供人类使用的淡水仅占地球总水量的0.3%,且在时间和空间上分布不均衡。淡水资源的短缺势必会制约社会的发展,那么,采用什么方法可以解决淡水危机呢?
海水水资源的利用,主要包括海水淡化和直接利用海水进行循环冷却等。
海水中最多的物质
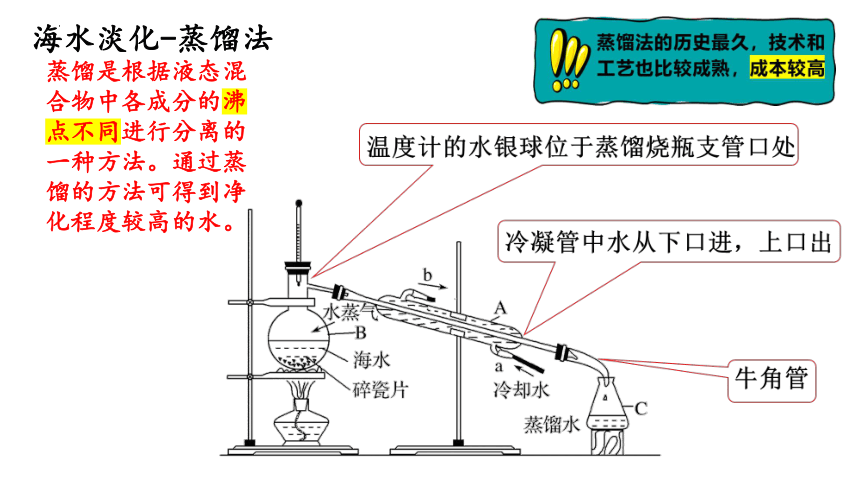
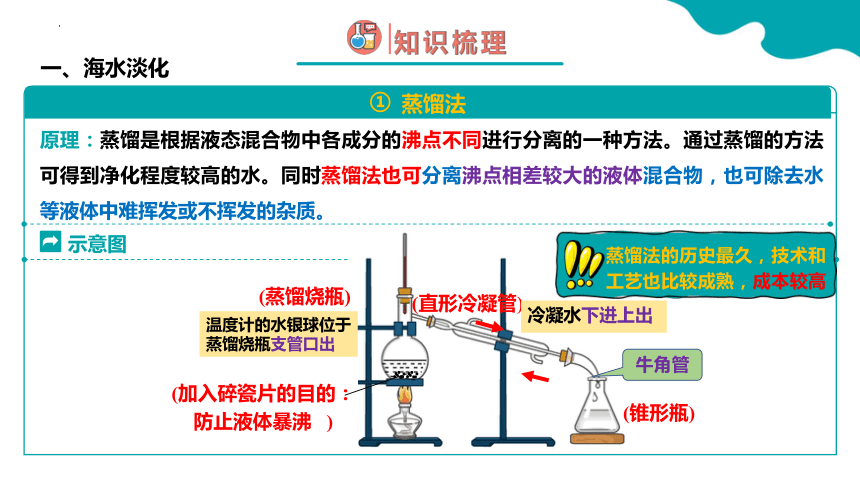
海水淡化-蒸馏法
蒸馏是根据液态混合物中各成分的沸点不同进行分离的一种方法。通过蒸馏的方法可得到净化程度较高的水。
一、海水淡化
蒸馏法
示意图
原理:蒸馏是根据液态混合物中各成分的沸点不同进行分离的一种方法。通过蒸馏的方法可得到净化程度较高的水。同时蒸馏法也可分离沸点相差较大的液体混合物,也可除去水等液体中难挥发或不挥发的杂质。
(直形冷凝管)
(蒸馏烧瓶)
(锥形瓶)
(加入碎瓷片的目的:防止液体暴沸 )
蒸馏法的历史最久,技术和工艺也比较成熟,成本较高
①
冷凝水下进上出
温度计的水银球位于蒸馏烧瓶支管口出
牛角管
【思考】
(1)为什么冷却水通入方向与被冷凝蒸气流向相反?
为了使蒸馏出的蒸气与冷却水长时间充分接触,带走尽可能多的热量。
(2)为什么温度计水银球的顶端要与圆底烧瓶支管下沿处于同一水平线
对于蒸馏来说,只有精确控制蒸馏的温度才能达到分离提纯的目的,而蒸馏烧瓶支管口的温度正是被蒸馏变为气体某组分的温度,故温度计水银球顶端要与圆底烧瓶支管下沿处于同一水平线
一、海水淡化
②电渗析法
示意图
原理:在外加直流电场作用下,利用离子交换膜对溶液中离子的选择透过性,使溶液中阴、阳离子发生离子迁移,分别通过阴、阳离子交换膜而达到除盐或浓缩的目的。
示意图
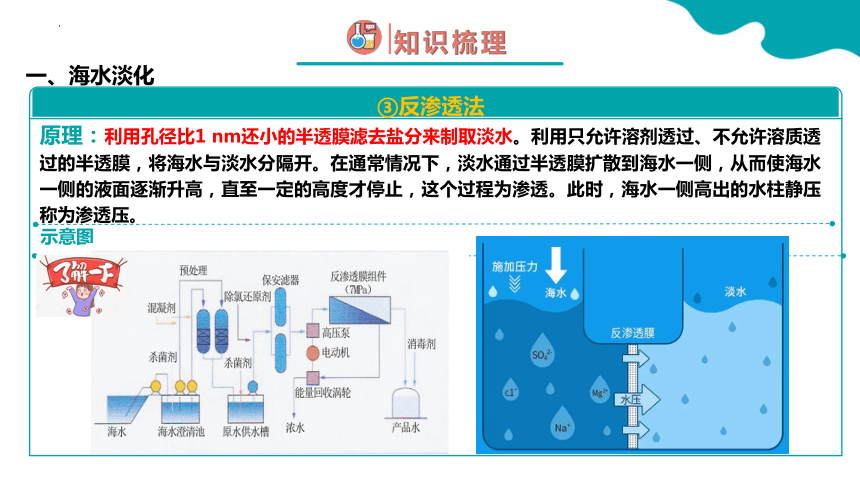
原理:利用孔径比1 nm还小的半透膜滤去盐分来制取淡水。利用只允许溶剂透过、不允许溶质透过的半透膜,将海水与淡水分隔开。在通常情况下,淡水通过半透膜扩散到海水一侧,从而使海水一侧的液面逐渐升高,直至一定的高度才停止,这个过程为渗透。此时,海水一侧高出的水柱静压称为渗透压。
一、海水淡化
③反渗透法
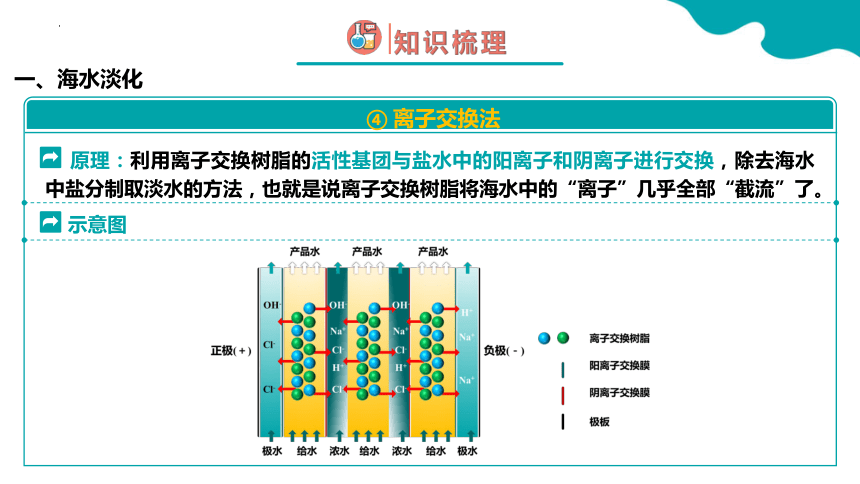
一、海水淡化
④ 离子交换法
示意图
原理:利用离子交换树脂的活性基团与盐水中的阳离子和阴离子进行交换,除去海水中盐分制取淡水的方法,也就是说离子交换树脂将海水中的“离子”几乎全部“截流”了。
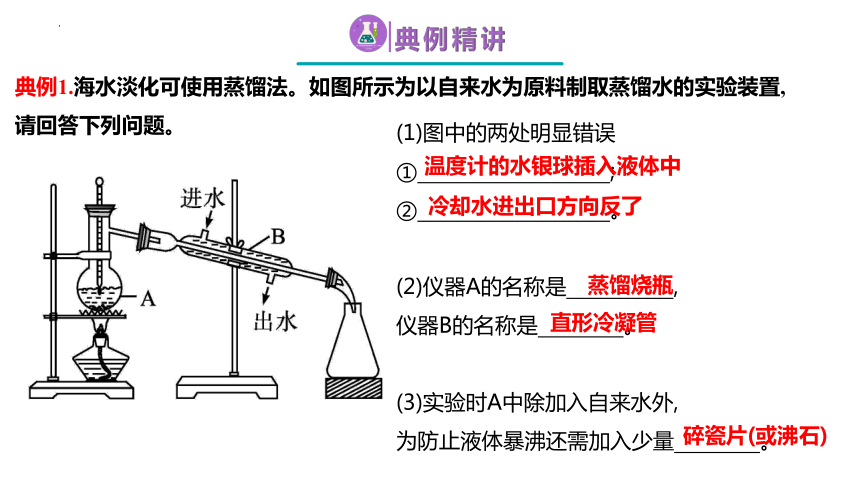
典例1.海水淡化可使用蒸馏法。如图所示为以自来水为原料制取蒸馏水的实验装置,
请回答下列问题。
(1)图中的两处明显错误
① ;
② 。
(2)仪器A的名称是 ,
仪器B的名称是 。
(3)实验时A中除加入自来水外,
为防止液体暴沸还需加入少量 。
温度计的水银球插入液体中
冷却水进出口方向反了
蒸馏烧瓶
碎瓷片(或沸石)
直形冷凝管
二、直接利用海水进行循环冷却
服务于火电厂、核电厂的循环冷却
结论:海中含有的盐主要是
________________
海水中水的储量约为1.3×1018 t,约占地球上总水量的97%。海水水资源的利用,主要包括海水淡化和直接利用海水进行循环冷却等。
三、海水中的物质提取
含量最多的非金属离子
含量前两位的金属离子
NaCl、MgCl2
1、海水制盐
目前,从海水中提取食盐的方法主要为“盐田法”(也称“太阳能蒸发法”),这是一种古老而至今仍广泛沿用的方法。
盐田
盐田法提取食盐的过程
先将海水(或海边地下卤水)引入蒸发池,经日晒蒸发水分到一定程度时,导入结晶池,再晒就会逐渐析出食盐来。这时得到的晶体就是我们常见的“粗盐”。剩余的液体称为母液(也称“苦卤”) 。
“盐田法”提取食盐的工艺流程
海水
蒸发池
结晶池
粗盐
母液
1、海水制盐
氯化钠的应用
氯碱工业
制钠和氯气
制盐酸
制漂白剂(84)
2NaOH+Cl2===NaCl+NaClO+H2O
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
电解
2NaCl(熔融) 2Na+Cl2↑
电解
H2+Cl2 2HCl
点燃
从海水中制得的氯化钠除了供食用,还作为化工原料用于生产烧碱、纯碱、钠、氯气、盐酸等。
工艺流程
通常将 加入海水或卤水中,沉淀出 ,该物质再与 反应生成 ,电解 状态的 ,就能制得金属镁。
石灰乳
氢氧化镁
盐酸
氯化镁
氯化镁
熔融
上述转化过程中发生的化学反应主要有:
MgCl2+Ca(OH)2 Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl MgCl2+2H2O
MgCl2(熔融) Mg+Cl2↑
通电
石灰乳
盐酸
脱水
海水或卤水
氢氧化镁
MgCl2溶液
MgCl2 6H2O
MgCl2
Mg(OH)2
MgCl2
Mg
镁
电解
Mg
2、海水提镁
2、海水提镁
2、海水提镁
海水中本来就有氯化镁,为什么不直接通电?而是要经过“MgCl2→Mg(OH)2→ MgCl2”这样的过程来获取MgCl2呢?
所加盐酸是否要过量?目的是什么?如果过量,如何除去?
要过量,目的是保证Mg(OH)2完全反应,过量的稀盐酸加热蒸发即可除去。
问题1
除去其它杂质,将MgCl2富集起来。
问题2
问题3
为什么不用NaOH代替Ca(OH)2,怎样得到Ca(OH)2?你能用流程图表示吗?
NaOH价格贵,Ca(OH)2 价格便宜且容易得到。工业上可以利用高温煅烧贝壳得到所需要的Ca(OH)2。
贝壳(含CaCO3)
CaO
流程图:
高温煅烧
水
石灰乳
请同学们回顾所学内容,回答下列问题:
飞机
导弹
火箭
人们提取海水中的化学元素,来制备有多种用途的物质。如广泛用于火箭、导弹和飞机制造业的金属镁,就是利用从海水中提取的镁盐制取的。
因此镁也被称为“国防金属”。
溴及其化合物在医药、农药、染料和阻燃剂等的生产中有广泛应用。
溴是海洋元素,地球上99%的溴元素分布在海洋中,
以Br -的形式存在。海水中的溴元素含量约为67mg/L。
CF2ClBr
二氟一氯一溴甲烷
思考:如何从海水中提取溴?
3、海水提溴
3、海水提溴
工艺流程
海水
浓缩海水
(Cl-)
吸收塔用SO2吸收
浓缩海水
(Cl-、Br2)
Br-
SO42-
浓缩
酸化
通入Cl2
(氧化)
通入热空气或水蒸气(吹出)
反应后
富集溴
通入Cl2
(提取)
Br2
Cl-
蒸馏
分离
溴单质
海水晒盐和海水淡化的过程中Br-得到浓缩
Cl2+2Br- = 2Cl-+Br2
Br2+SO2+2H2O=H2SO4 +2HBr
向经过酸化的浓缩海水中通入Cl2,将Br-氧化为Br2
利用溴的挥发性,通入热空气或水蒸气,吹出的溴蒸气用SO2吸收
Cl2+2Br- = 2Cl-+Br2
3、海水提溴
1. 从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 L
D.步骤Ⅳ包含萃取、分液和蒸馏
C
4、海水提碘
增强H2O2的氧化性;抑制I2与水反应。
注意事项:1.海带不能水洗,以免洗去其中的 I 元素。
2.海带可提前用酒精润湿以充分灼烧。
(1)海带中提碘
①工艺流程:海带→浸泡→氧化→过滤→提纯→碘单质。
②主要的化学反应原理:2H++2I-+H2O2===I2+2H2O。
请同学们回顾所学内容,判断正误:
问题1
海洋约占地球表面积的71%,因此地球不缺水,人类可以任意使用,不用节约( )
海水淡化的方法中,蒸馏法成本最低( )
海水中含量最多的两种元素为Na元素和Cl元素( )
可以通过电解饱和食盐水的方式获取金属钠和氯气( )
除了从海水中获取淡水和化学物质外,其他就没有什么价值了( )
问题2
问题3
问题4
问题5
1.在海水资源的综合利用中,不需要化学变化就能够从海水中获得的物质是( )
A.溴、碘单质 B.钠、镁单质
C.食盐、淡水 D.烧碱、纯碱
C
2.我国历来十分重视海水资源的综合利用,下列有关海水综合利用的说法正确的是( )
A.利用潮汐发电是将化学能转化为电能
B.海水蒸发制海盐的过程中发生了化学变化
C.海水中含有溴元素,只需经过物理变化就可以得到溴单质
D.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
D
3. 海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图所示:
(1) 步骤①反应的离子方程式是________________________。
(2) 步骤③反应的化学方程式是_______________________________。
(3) 从理论上考虑,下列物质也能充分吸收Br2的是_____(填字母)。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
2Br-+Cl2===Br2+2Cl-
SO2+Br2+2H2O===H2SO4+2HBr
ABC
(4)步骤⑤蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,若温度过高,大量水蒸气随溴排出,溴蒸气中水分增加;若温度过低,则___________
______________。
溴不能完全
蒸出,产率低
4.海洋又被称为绿色宝库,下列关于海洋的说法正确的是( )
A.海洋约占地球表面积的71% B.海水中元素仅为有限的十几种
C.蒸馏是海水淡化的唯一方法 D.海水因有腐蚀性而不能冷却循环使用
5.下列说法不正确的是( )
A.海洋是一个远未完全开发的巨大化学资源宝库
B.海水中金元素的储存量很大,但它的富集程度却很低
C.从海水中可以提取铀和重水等核原料
D.海水中的溴、氟等元素均为微量元素,但仍有提取的价值
6.从海水中提取镁的工艺流程可表示如下,下列说法不正确的是( )
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2溶液得到金属Mg
C.制备过程中产生的氯气可以用来制备盐酸,循环使用
D.上述工艺流程中涉及化合、分解和复分解反应
7.从海带中提取碘单质,相关实验步骤如下:
①灼烧海带至完全生成灰,停止加热,冷却;
②在滤液中滴加稀H2SO4及适当的氧化剂,然后加入几滴某溶液;
③用剪刀剪碎海带,用酒精润湿,放入坩埚中;
④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤。
(1)合理的步骤顺序是:________________(将步骤的序号填入空格内)。
(2)适当的氧化剂是:___________,反应的离子方程式是:________________________。
(3)证明含碘的操作及现象是:_________________________________________________。
③①④②
H2O2
2I- + 2H+ + H2O2 === I2 + 2H2O
取步骤②后的溶液于试管中,滴入淀粉溶液,溶液变蓝
过滤
蒸发浓缩、降温结晶
c
化学资源
海洋中的资源的分类
动力资源
海水淡化
海水制盐
矿产资源
生物资源
海水提溴
海水制镁
海水资源的开发利用
第一节
自然资源的开发利用
第2课时
第一节 自然资源的开发利用
第2课时
第八章 化学与可持续发展
2
海水制盐
1
海水淡化
3
本节重难点
海水提溴
4
本节重难点
海水制镁
地球表面海洋面积占到71%,海洋是人类千万年来取之不尽、用之不竭的巨大资源宝库。其中的水资源和其他化学资源具有十分巨大的开发潜力。
你知道海洋中有哪些资源吗?
海水中的化学元素
由于与岩石、大气和生物的相互作用,海水中溶解和悬浮着大量的无机物和有机物。海水中含量最多的O、H两种元素,加上Cl、Na、Mg、S、Ca、K、Br、C、Sr、B、F等11种元素,其总含量超过99%,其他元素为微量。虽然海水中元素的种类很多,总储量很大,但许多元素的富集程度却很低。例如,海水中金元素的总储量约为5×106 t,而1t海水中金元素的含量仅为4×10-6g。海洋还是一个远未充分开发的巨大化学资源宝库。
总量巨大但浓度极低,要耗费大量能源和时间进行富集、分离和提纯
海水中水的储量约为1.3×1018 t,约占地球上总水量的97%。地球上的水资源很丰富,但可供人类使用的淡水仅占地球总水量的0.3%,且在时间和空间上分布不均衡。淡水资源的短缺势必会制约社会的发展,那么,采用什么方法可以解决淡水危机呢?
海水水资源的利用,主要包括海水淡化和直接利用海水进行循环冷却等。
海水中最多的物质
海水淡化-蒸馏法
蒸馏是根据液态混合物中各成分的沸点不同进行分离的一种方法。通过蒸馏的方法可得到净化程度较高的水。
一、海水淡化
蒸馏法
示意图
原理:蒸馏是根据液态混合物中各成分的沸点不同进行分离的一种方法。通过蒸馏的方法可得到净化程度较高的水。同时蒸馏法也可分离沸点相差较大的液体混合物,也可除去水等液体中难挥发或不挥发的杂质。
(直形冷凝管)
(蒸馏烧瓶)
(锥形瓶)
(加入碎瓷片的目的:防止液体暴沸 )
蒸馏法的历史最久,技术和工艺也比较成熟,成本较高
①
冷凝水下进上出
温度计的水银球位于蒸馏烧瓶支管口出
牛角管
【思考】
(1)为什么冷却水通入方向与被冷凝蒸气流向相反?
为了使蒸馏出的蒸气与冷却水长时间充分接触,带走尽可能多的热量。
(2)为什么温度计水银球的顶端要与圆底烧瓶支管下沿处于同一水平线
对于蒸馏来说,只有精确控制蒸馏的温度才能达到分离提纯的目的,而蒸馏烧瓶支管口的温度正是被蒸馏变为气体某组分的温度,故温度计水银球顶端要与圆底烧瓶支管下沿处于同一水平线
一、海水淡化
②电渗析法
示意图
原理:在外加直流电场作用下,利用离子交换膜对溶液中离子的选择透过性,使溶液中阴、阳离子发生离子迁移,分别通过阴、阳离子交换膜而达到除盐或浓缩的目的。
示意图
原理:利用孔径比1 nm还小的半透膜滤去盐分来制取淡水。利用只允许溶剂透过、不允许溶质透过的半透膜,将海水与淡水分隔开。在通常情况下,淡水通过半透膜扩散到海水一侧,从而使海水一侧的液面逐渐升高,直至一定的高度才停止,这个过程为渗透。此时,海水一侧高出的水柱静压称为渗透压。
一、海水淡化
③反渗透法
一、海水淡化
④ 离子交换法
示意图
原理:利用离子交换树脂的活性基团与盐水中的阳离子和阴离子进行交换,除去海水中盐分制取淡水的方法,也就是说离子交换树脂将海水中的“离子”几乎全部“截流”了。
典例1.海水淡化可使用蒸馏法。如图所示为以自来水为原料制取蒸馏水的实验装置,
请回答下列问题。
(1)图中的两处明显错误
① ;
② 。
(2)仪器A的名称是 ,
仪器B的名称是 。
(3)实验时A中除加入自来水外,
为防止液体暴沸还需加入少量 。
温度计的水银球插入液体中
冷却水进出口方向反了
蒸馏烧瓶
碎瓷片(或沸石)
直形冷凝管
二、直接利用海水进行循环冷却
服务于火电厂、核电厂的循环冷却
结论:海中含有的盐主要是
________________
海水中水的储量约为1.3×1018 t,约占地球上总水量的97%。海水水资源的利用,主要包括海水淡化和直接利用海水进行循环冷却等。
三、海水中的物质提取
含量最多的非金属离子
含量前两位的金属离子
NaCl、MgCl2
1、海水制盐
目前,从海水中提取食盐的方法主要为“盐田法”(也称“太阳能蒸发法”),这是一种古老而至今仍广泛沿用的方法。
盐田
盐田法提取食盐的过程
先将海水(或海边地下卤水)引入蒸发池,经日晒蒸发水分到一定程度时,导入结晶池,再晒就会逐渐析出食盐来。这时得到的晶体就是我们常见的“粗盐”。剩余的液体称为母液(也称“苦卤”) 。
“盐田法”提取食盐的工艺流程
海水
蒸发池
结晶池
粗盐
母液
1、海水制盐
氯化钠的应用
氯碱工业
制钠和氯气
制盐酸
制漂白剂(84)
2NaOH+Cl2===NaCl+NaClO+H2O
2NaCl+2H2O 2NaOH+H2↑+Cl2↑
电解
2NaCl(熔融) 2Na+Cl2↑
电解
H2+Cl2 2HCl
点燃
从海水中制得的氯化钠除了供食用,还作为化工原料用于生产烧碱、纯碱、钠、氯气、盐酸等。
工艺流程
通常将 加入海水或卤水中,沉淀出 ,该物质再与 反应生成 ,电解 状态的 ,就能制得金属镁。
石灰乳
氢氧化镁
盐酸
氯化镁
氯化镁
熔融
上述转化过程中发生的化学反应主要有:
MgCl2+Ca(OH)2 Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl MgCl2+2H2O
MgCl2(熔融) Mg+Cl2↑
通电
石灰乳
盐酸
脱水
海水或卤水
氢氧化镁
MgCl2溶液
MgCl2 6H2O
MgCl2
Mg(OH)2
MgCl2
Mg
镁
电解
Mg
2、海水提镁
2、海水提镁
2、海水提镁
海水中本来就有氯化镁,为什么不直接通电?而是要经过“MgCl2→Mg(OH)2→ MgCl2”这样的过程来获取MgCl2呢?
所加盐酸是否要过量?目的是什么?如果过量,如何除去?
要过量,目的是保证Mg(OH)2完全反应,过量的稀盐酸加热蒸发即可除去。
问题1
除去其它杂质,将MgCl2富集起来。
问题2
问题3
为什么不用NaOH代替Ca(OH)2,怎样得到Ca(OH)2?你能用流程图表示吗?
NaOH价格贵,Ca(OH)2 价格便宜且容易得到。工业上可以利用高温煅烧贝壳得到所需要的Ca(OH)2。
贝壳(含CaCO3)
CaO
流程图:
高温煅烧
水
石灰乳
请同学们回顾所学内容,回答下列问题:
飞机
导弹
火箭
人们提取海水中的化学元素,来制备有多种用途的物质。如广泛用于火箭、导弹和飞机制造业的金属镁,就是利用从海水中提取的镁盐制取的。
因此镁也被称为“国防金属”。
溴及其化合物在医药、农药、染料和阻燃剂等的生产中有广泛应用。
溴是海洋元素,地球上99%的溴元素分布在海洋中,
以Br -的形式存在。海水中的溴元素含量约为67mg/L。
CF2ClBr
二氟一氯一溴甲烷
思考:如何从海水中提取溴?
3、海水提溴
3、海水提溴
工艺流程
海水
浓缩海水
(Cl-)
吸收塔用SO2吸收
浓缩海水
(Cl-、Br2)
Br-
SO42-
浓缩
酸化
通入Cl2
(氧化)
通入热空气或水蒸气(吹出)
反应后
富集溴
通入Cl2
(提取)
Br2
Cl-
蒸馏
分离
溴单质
海水晒盐和海水淡化的过程中Br-得到浓缩
Cl2+2Br- = 2Cl-+Br2
Br2+SO2+2H2O=H2SO4 +2HBr
向经过酸化的浓缩海水中通入Cl2,将Br-氧化为Br2
利用溴的挥发性,通入热空气或水蒸气,吹出的溴蒸气用SO2吸收
Cl2+2Br- = 2Cl-+Br2
3、海水提溴
1. 从淡化海水中提取溴的流程如下:
下列有关说法不正确的是( )
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,需要消耗Cl2 44.8 L
D.步骤Ⅳ包含萃取、分液和蒸馏
C
4、海水提碘
增强H2O2的氧化性;抑制I2与水反应。
注意事项:1.海带不能水洗,以免洗去其中的 I 元素。
2.海带可提前用酒精润湿以充分灼烧。
(1)海带中提碘
①工艺流程:海带→浸泡→氧化→过滤→提纯→碘单质。
②主要的化学反应原理:2H++2I-+H2O2===I2+2H2O。
请同学们回顾所学内容,判断正误:
问题1
海洋约占地球表面积的71%,因此地球不缺水,人类可以任意使用,不用节约( )
海水淡化的方法中,蒸馏法成本最低( )
海水中含量最多的两种元素为Na元素和Cl元素( )
可以通过电解饱和食盐水的方式获取金属钠和氯气( )
除了从海水中获取淡水和化学物质外,其他就没有什么价值了( )
问题2
问题3
问题4
问题5
1.在海水资源的综合利用中,不需要化学变化就能够从海水中获得的物质是( )
A.溴、碘单质 B.钠、镁单质
C.食盐、淡水 D.烧碱、纯碱
C
2.我国历来十分重视海水资源的综合利用,下列有关海水综合利用的说法正确的是( )
A.利用潮汐发电是将化学能转化为电能
B.海水蒸发制海盐的过程中发生了化学变化
C.海水中含有溴元素,只需经过物理变化就可以得到溴单质
D.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
D
3. 海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图所示:
(1) 步骤①反应的离子方程式是________________________。
(2) 步骤③反应的化学方程式是_______________________________。
(3) 从理论上考虑,下列物质也能充分吸收Br2的是_____(填字母)。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
2Br-+Cl2===Br2+2Cl-
SO2+Br2+2H2O===H2SO4+2HBr
ABC
(4)步骤⑤蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,若温度过高,大量水蒸气随溴排出,溴蒸气中水分增加;若温度过低,则___________
______________。
溴不能完全
蒸出,产率低
4.海洋又被称为绿色宝库,下列关于海洋的说法正确的是( )
A.海洋约占地球表面积的71% B.海水中元素仅为有限的十几种
C.蒸馏是海水淡化的唯一方法 D.海水因有腐蚀性而不能冷却循环使用
5.下列说法不正确的是( )
A.海洋是一个远未完全开发的巨大化学资源宝库
B.海水中金元素的储存量很大,但它的富集程度却很低
C.从海水中可以提取铀和重水等核原料
D.海水中的溴、氟等元素均为微量元素,但仍有提取的价值
6.从海水中提取镁的工艺流程可表示如下,下列说法不正确的是( )
A.用此法提取镁的优点之一是原料来源丰富
B.步骤⑥电解MgCl2溶液得到金属Mg
C.制备过程中产生的氯气可以用来制备盐酸,循环使用
D.上述工艺流程中涉及化合、分解和复分解反应
7.从海带中提取碘单质,相关实验步骤如下:
①灼烧海带至完全生成灰,停止加热,冷却;
②在滤液中滴加稀H2SO4及适当的氧化剂,然后加入几滴某溶液;
③用剪刀剪碎海带,用酒精润湿,放入坩埚中;
④海带灰转移到小烧杯,加蒸馏水,搅拌、煮沸、过滤。
(1)合理的步骤顺序是:________________(将步骤的序号填入空格内)。
(2)适当的氧化剂是:___________,反应的离子方程式是:________________________。
(3)证明含碘的操作及现象是:_________________________________________________。
③①④②
H2O2
2I- + 2H+ + H2O2 === I2 + 2H2O
取步骤②后的溶液于试管中,滴入淀粉溶液,溶液变蓝
过滤
蒸发浓缩、降温结晶
c
化学资源
海洋中的资源的分类
动力资源
海水淡化
海水制盐
矿产资源
生物资源
海水提溴
海水制镁
海水资源的开发利用
第一节
自然资源的开发利用
第2课时
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
