江苏省宜兴市伏东中学2014-2015学年第二学期优质课展示初三化学《金属的化学性质(第2课时)》(共21张PPT)
文档属性
| 名称 | 江苏省宜兴市伏东中学2014-2015学年第二学期优质课展示初三化学《金属的化学性质(第2课时)》(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 373.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-08-24 14:47:30 | ||
图片预览






文档简介
课件21张PPT。 第八单元 金属和金属材料学习目标1.学会应用金属活动性顺序解决实际问题;
2.会运用化学知识辨别真伪,崇尚科学的价值追求。
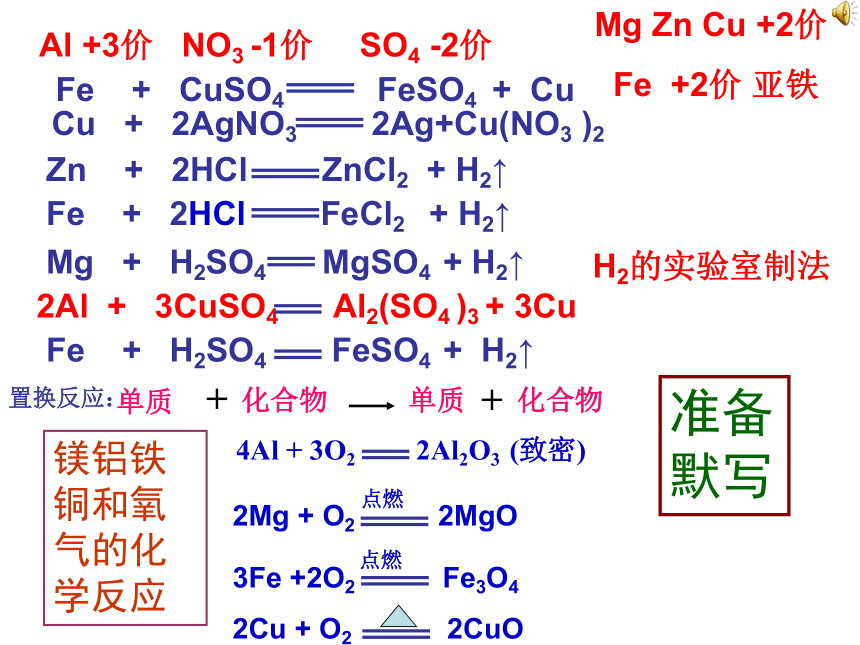
课题2 金属的化学性质 Cu + 2AgNO3 2Ag+Cu(NO3 )2
Zn + 2HCl ZnCl2 + H2↑
Fe + 2HCl FeCl2 + H2↑
Mg + H2SO4 MgSO4 + H2↑
2Al + 3CuSO4 Al2(SO4 )3 + 3Cu
Fe + H2SO4 FeSO4 + H2↑
置换反应: 4Al + 3O2 2Al2O3 (致密)
2Mg + O2 2MgO
3Fe +2O2 Fe3O4
2Cu + O2 2CuO
点燃点燃Mg Zn Cu +2价
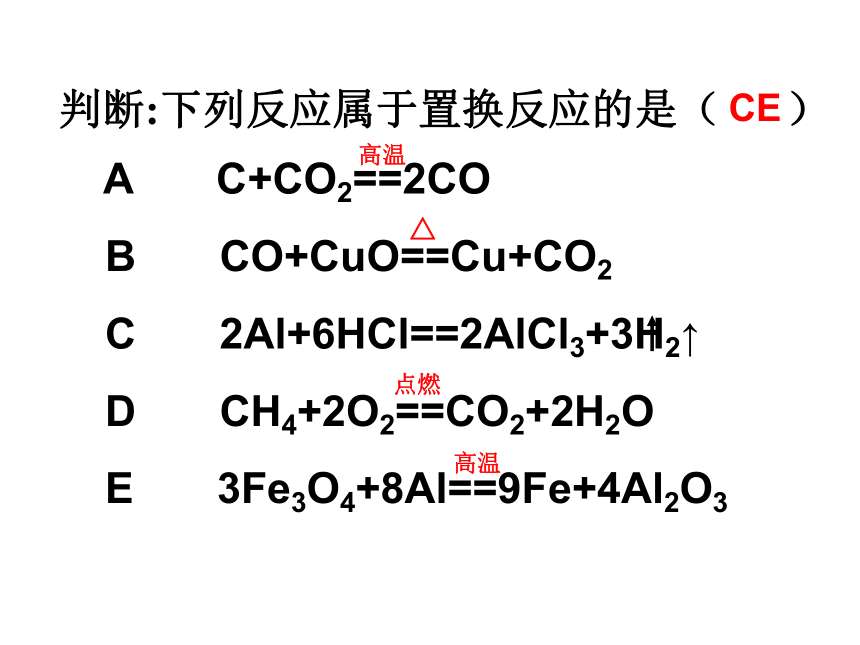
Fe +2价 亚铁Al +3价 NO3 -1价 SO4 -2价 H2的实验室制法镁铝铁铜和氧气的化学反应准备默写Fe + CuSO4 FeSO4 + Cu判断:下列反应属于置换反应的是( )高温点燃CE A C+CO2==2CO
B CO+CuO==Cu+CO2
C 2Al+6HCl==2AlCl3+3H2↑
D CH4+2O2==CO2+2H2O
E 3Fe3O4+8Al==9Fe+4Al2O3 △高温规律:
铁单质发生置换反应都生成亚铁盐
含Fe2+ 溶液:浅绿色;
含Fe3+ 溶液:黄色;
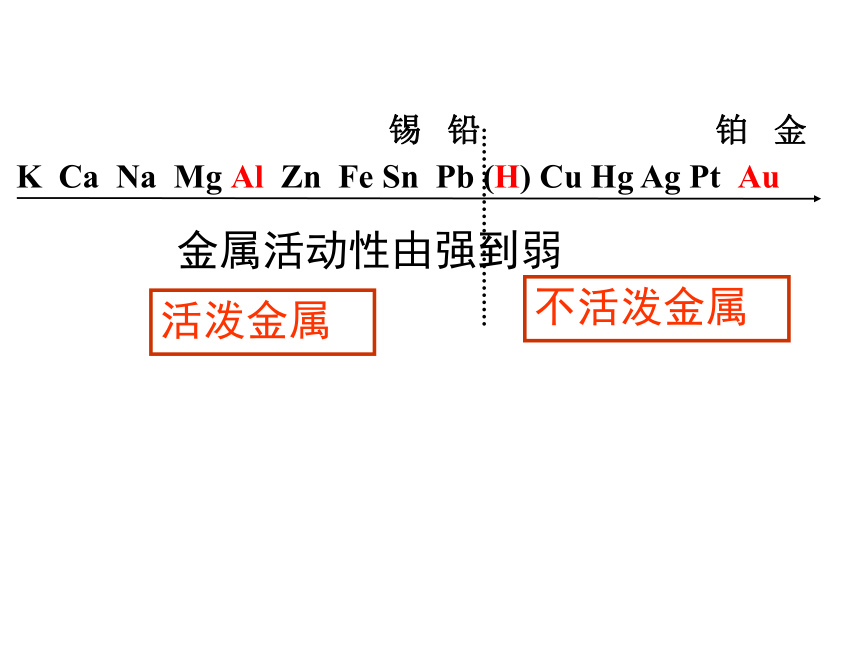
含Cu2+ 溶液:蓝色 。 其他溶液均为无色 锡 铅 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强到弱活泼金属不活泼金属1.判断下列反应能否发生,能的写出方程式,
不能的说明理由
银与盐酸 ,铝与盐酸 ,
镁与硝酸铜 ,银与硫酸铜 ,
铝与氯化锌 ,铁与硝酸银 。金属活动性顺序的应用现有X、Y、Z三种金属,如果把X和Y分别放入
稀硫酸中,X溶解并产生氢气,Y不反应;如果
把Y和Z分别放入硝酸银溶液中,过一会儿,在
Y表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和Z的金属活动性顺序。金属活动性X>(H)>Y金属活动性Y>Ag>Z金属活动性:
X > Y > Z2.区别铁片和铜片物理方法:
化学方法:1.取样,分别用磁铁吸引,能吸引的是铁片,不能吸引的是铜片。
2.观察,紫红色的是铜片,银白色的是铁片。取样,分别滴加稀盐酸(或硫酸),有气泡的是铁片,无现象是的铜片。3.区别真金与假黄金(黄铜成分铜锌)物理方法:
化学方法:测密度,比较硬度等1)取样,分别灼烧,发黑的是假黄金,无变化的是
真金。2)取样,分别滴加稀盐酸(或硫酸),有气泡的是假黄金,无现象的是真金。3)用硫酸铜溶液、硝酸银溶液也可,利用锌能发生置换反应4.如何证明铁、铜的活动性大小?药品: 铁丝、铜丝、
稀盐酸、硫酸铜溶液等 方案5.除杂(括号内为杂质)铜(锌)
硫酸亚铁溶液(硫酸铜)用足量稀盐酸(或稀硫酸、硫酸铜溶液)溶解,再过滤加足量铁粉,再过滤6.分别将三根铁条伸入稀硫酸、硫酸铜溶液、硫酸镁溶液中,会看到什么现象,过一会儿取出铁条,溶液质量将会如何变化?稀硫酸:铁条表面有气泡,溶液逐渐由无色变为浅
绿色。 溶液质量增重。硫酸铜:铁条表面析出红色的铜,溶液逐渐由蓝色
变为浅绿色。 溶液质量减轻。硫酸镁:无现象。无变化。7.在硝酸镁、硝酸铜的混合溶液中加入过 量的铁粉,充分反应后过滤,滤纸上的固 体物质有 , 滤液中的物质有(水除外) 。Fe 、 CuMg(NO3)2 、 Fe(NO3)28、等质量的Zn、 Fe、 Mg、 Al与足量的酸反应,产生H2质量与反应时间的关系如下:m(H2)0t(反应时间)①②③④MgAlZnFeMgAlFeZn8、将过量的Zn、 Fe、 Mg、 Al与等质量且浓度相同的酸反应,则产生H2质量与反应时间的关系:m(H2)0t(反应时间)MgAlFeZn过量的金属镁投入硫酸和硫酸铜的混合溶液中,会观察到什么现象? 1.写出化学方程式。2. 充分反应后过滤,滤纸上有 ,
滤液中有 。实验探究Mg 、Cu水,硫酸镁 1.过量的铁粉投入到硝酸银溶液中, 充分反应后过滤,滤纸上有 , 滤液中除水外还有的物质是 。思考: 一定量的铁粉投入到硝酸银溶液中,充分反应后过滤,分析滤纸上和滤液中物质的成分。 当堂检测2.在硝酸镁、硝酸铜的混合溶液中加入过 量的铁粉,充分反应后过滤,滤纸上的固 体物质有 , 滤液中的物质有(水除外) 。Fe 、 CuMg(NO3)2 、 Fe(NO3)2当堂检测3.在硝酸银、硝酸铜的混合溶液中加入过 量的铁粉,充分反应后过滤,滤纸上的固 体物质有 , 滤液中的物质有(水除外) 。Cu、Ag 、 FeFe(NO3)2当堂检测4. 将10克黄铜(铜--锌合金)放入有100克稀硫酸的烧杯中,恰好完全反应,且反应后烧杯中混合物质量为109.8克。问黄铜中铜的质量分数。当堂检测下课!
2.会运用化学知识辨别真伪,崇尚科学的价值追求。
课题2 金属的化学性质 Cu + 2AgNO3 2Ag+Cu(NO3 )2
Zn + 2HCl ZnCl2 + H2↑
Fe + 2HCl FeCl2 + H2↑
Mg + H2SO4 MgSO4 + H2↑
2Al + 3CuSO4 Al2(SO4 )3 + 3Cu
Fe + H2SO4 FeSO4 + H2↑
置换反应: 4Al + 3O2 2Al2O3 (致密)
2Mg + O2 2MgO
3Fe +2O2 Fe3O4
2Cu + O2 2CuO
点燃点燃Mg Zn Cu +2价
Fe +2价 亚铁Al +3价 NO3 -1价 SO4 -2价 H2的实验室制法镁铝铁铜和氧气的化学反应准备默写Fe + CuSO4 FeSO4 + Cu判断:下列反应属于置换反应的是( )高温点燃CE A C+CO2==2CO
B CO+CuO==Cu+CO2
C 2Al+6HCl==2AlCl3+3H2↑
D CH4+2O2==CO2+2H2O
E 3Fe3O4+8Al==9Fe+4Al2O3 △高温规律:
铁单质发生置换反应都生成亚铁盐
含Fe2+ 溶液:浅绿色;
含Fe3+ 溶液:黄色;
含Cu2+ 溶液:蓝色 。 其他溶液均为无色 锡 铅 铂 金
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强到弱活泼金属不活泼金属1.判断下列反应能否发生,能的写出方程式,
不能的说明理由
银与盐酸 ,铝与盐酸 ,
镁与硝酸铜 ,银与硫酸铜 ,
铝与氯化锌 ,铁与硝酸银 。金属活动性顺序的应用现有X、Y、Z三种金属,如果把X和Y分别放入
稀硫酸中,X溶解并产生氢气,Y不反应;如果
把Y和Z分别放入硝酸银溶液中,过一会儿,在
Y表面有银析出,而Z没有变化。根据以上实验事实,判断X、Y和Z的金属活动性顺序。金属活动性X>(H)>Y金属活动性Y>Ag>Z金属活动性:
X > Y > Z2.区别铁片和铜片物理方法:
化学方法:1.取样,分别用磁铁吸引,能吸引的是铁片,不能吸引的是铜片。
2.观察,紫红色的是铜片,银白色的是铁片。取样,分别滴加稀盐酸(或硫酸),有气泡的是铁片,无现象是的铜片。3.区别真金与假黄金(黄铜成分铜锌)物理方法:
化学方法:测密度,比较硬度等1)取样,分别灼烧,发黑的是假黄金,无变化的是
真金。2)取样,分别滴加稀盐酸(或硫酸),有气泡的是假黄金,无现象的是真金。3)用硫酸铜溶液、硝酸银溶液也可,利用锌能发生置换反应4.如何证明铁、铜的活动性大小?药品: 铁丝、铜丝、
稀盐酸、硫酸铜溶液等 方案5.除杂(括号内为杂质)铜(锌)
硫酸亚铁溶液(硫酸铜)用足量稀盐酸(或稀硫酸、硫酸铜溶液)溶解,再过滤加足量铁粉,再过滤6.分别将三根铁条伸入稀硫酸、硫酸铜溶液、硫酸镁溶液中,会看到什么现象,过一会儿取出铁条,溶液质量将会如何变化?稀硫酸:铁条表面有气泡,溶液逐渐由无色变为浅
绿色。 溶液质量增重。硫酸铜:铁条表面析出红色的铜,溶液逐渐由蓝色
变为浅绿色。 溶液质量减轻。硫酸镁:无现象。无变化。7.在硝酸镁、硝酸铜的混合溶液中加入过 量的铁粉,充分反应后过滤,滤纸上的固 体物质有 , 滤液中的物质有(水除外) 。Fe 、 CuMg(NO3)2 、 Fe(NO3)28、等质量的Zn、 Fe、 Mg、 Al与足量的酸反应,产生H2质量与反应时间的关系如下:m(H2)0t(反应时间)①②③④MgAlZnFeMgAlFeZn8、将过量的Zn、 Fe、 Mg、 Al与等质量且浓度相同的酸反应,则产生H2质量与反应时间的关系:m(H2)0t(反应时间)MgAlFeZn过量的金属镁投入硫酸和硫酸铜的混合溶液中,会观察到什么现象? 1.写出化学方程式。2. 充分反应后过滤,滤纸上有 ,
滤液中有 。实验探究Mg 、Cu水,硫酸镁 1.过量的铁粉投入到硝酸银溶液中, 充分反应后过滤,滤纸上有 , 滤液中除水外还有的物质是 。思考: 一定量的铁粉投入到硝酸银溶液中,充分反应后过滤,分析滤纸上和滤液中物质的成分。 当堂检测2.在硝酸镁、硝酸铜的混合溶液中加入过 量的铁粉,充分反应后过滤,滤纸上的固 体物质有 , 滤液中的物质有(水除外) 。Fe 、 CuMg(NO3)2 、 Fe(NO3)2当堂检测3.在硝酸银、硝酸铜的混合溶液中加入过 量的铁粉,充分反应后过滤,滤纸上的固 体物质有 , 滤液中的物质有(水除外) 。Cu、Ag 、 FeFe(NO3)2当堂检测4. 将10克黄铜(铜--锌合金)放入有100克稀硫酸的烧杯中,恰好完全反应,且反应后烧杯中混合物质量为109.8克。问黄铜中铜的质量分数。当堂检测下课!
同课章节目录
