2024河北化学中考备考重难专题:金属与酸反应的坐标曲线分析 课件 (共20张PPT)
文档属性
| 名称 | 2024河北化学中考备考重难专题:金属与酸反应的坐标曲线分析 课件 (共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 08:44:54 | ||
图片预览





文档简介
(共20张PPT)
河北 化学
金属与酸反应的坐标曲线分析
2024中考备考重难专题课件
课件说明
一、课件设计初衷
基于老师在总复习过程中对重难题型有较大的需求,以及纸质图书和板书展示二次函数图象与几何图形等重难点效果不佳而设计了重难专题课件. 在制作过程中结合课件能使题图动态化且分步骤展示的特性,有助于学生题图结合梳理题意,理解平面图形的变化过程.
二、课件亮点
1.依据区域考情,针对性选题
按照本地区考情及考法选题,针对性强,有效提高老师备课效率
2.贴近学生实际解题情境,形式符合教学习惯
审题时对题目数字、符号、辅助线、动图等关键信息进行题图批注,帮助学生梳理关键信息,激发学生兴趣,调动积极性
3.含解题思路引导与方法总结,提高课堂互动性
通过问题启发式解题思路点拨,激发学生数学思考与探索. 方法总结使学生复习一类题,会一类题,取得有效的复习成果
三、课件使用场景
适用于中考专题复习或题位复习
1
分类突破
典例精析
2
巩固练习
3
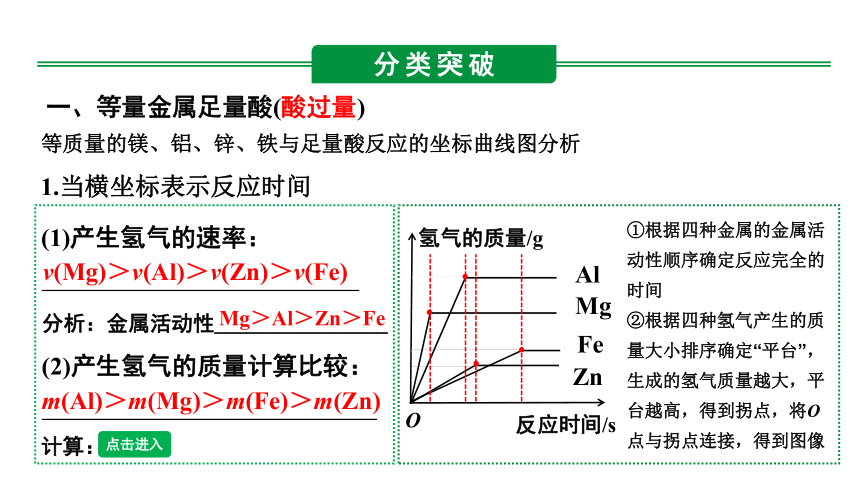
一、等量金属足量酸(酸过量)
等质量的镁、铝、锌、铁与足量酸反应的坐标曲线图分析
1.当横坐标表示反应时间
(1)产生氢气的速率:
v(Mg)>v(Al)>v(Zn)>v(Fe)
分析:金属活动性________________
Mg>Al>Zn>Fe
氢气的质量/g
Mg
Al
Zn
反应时间/s
O
Fe
①根据四种金属的金属活动性顺序确定反应完全的时间
②根据四种氢气产生的质量大小排序确定“平台”,生成的氢气质量越大,平台越高,得到拐点,将O点与拐点连接,得到图像
分类突破
(2)产生氢气的质量计算比较:
m(Al)>m(Mg)>m(Fe)>m(Zn)
计算:
点击进入
③
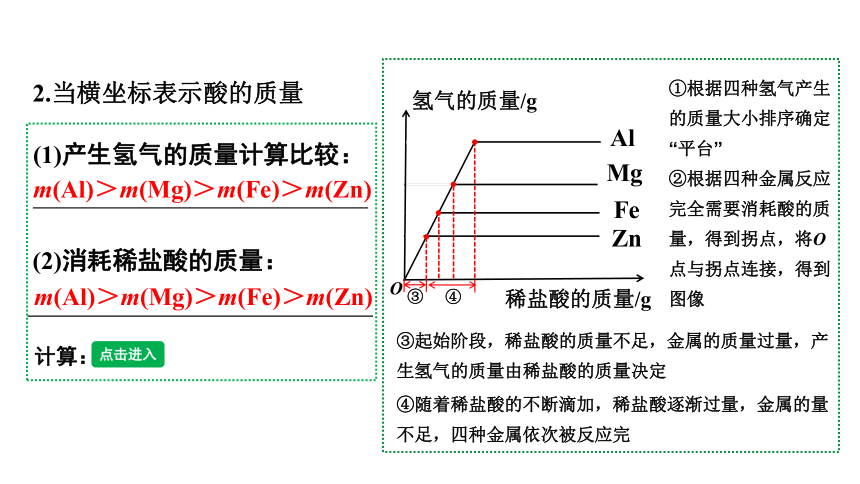
2.当横坐标表示酸的质量
(1)产生氢气的质量计算比较:
m(Al)>m(Mg)>m(Fe)>m(Zn)
计算:
点击进入
m(Al)>m(Mg)>m(Fe)>m(Zn)
(2)消耗稀盐酸的质量:
氢气的质量/g
稀盐酸的质量/g
Mg
Al
Zn
③起始阶段,稀盐酸的质量不足,金属的质量过量,产生氢气的质量由稀盐酸的质量决定
O
④随着稀盐酸的不断滴加,稀盐酸逐渐过量,金属的量不足,四种金属依次被反应完
Fe
①根据四种氢气产生的质量大小排序确定“平台”
②根据四种金属反应完全需要消耗酸的质量,得到拐点,将O点与拐点连接,得到图像
③
④
二、足量金属等量酸(酸不足)
以镁、铝、锌三种金属与等质量、等浓度的盐酸反应为例
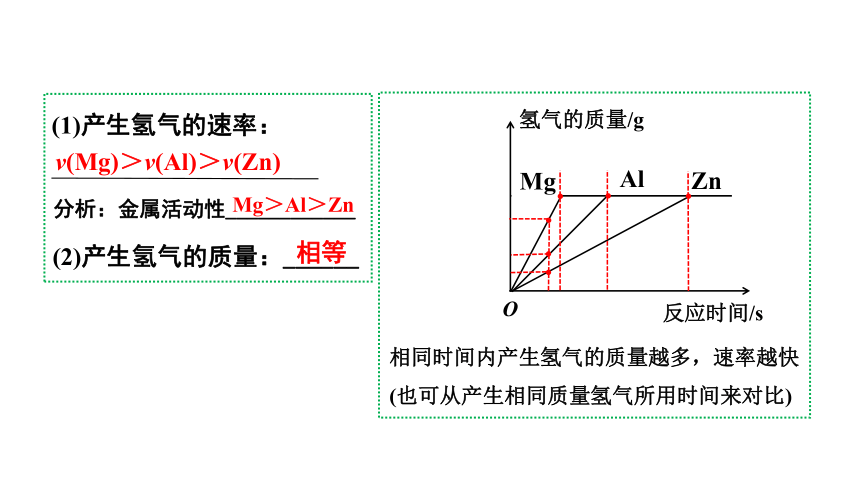
1. 当横坐标表示反应时间
三种金属与等质量、等浓度的盐酸反应时,哪种金属产生的氢气最多?
金属过量,酸不足,产生氢气的质量与金属质量无关,由酸决定。
所以三种金属与等质量、等浓度的盐酸反应产生氢气的质量是相等的。
设:参与反应的HCl的质量为7.3g, 与三种金属反应产生氢气的质量为x,结合反应的质量关系可知:
2HCl ~ H2↑
73 2
7.3g x
(2)产生氢气的质量:______
相等
v(Mg)>v(Al)>v(Zn)
氢气的质量/g
反应时间/s
Mg
Al
Zn
相同时间内产生氢气的质量越多,速率越快(也可从产生相同质量氢气所用时间来对比)
(1)产生氢气的速率:
O
分析:金属活动性____________
Mg>Al>Zn
2.当横坐标表示金属的质量
氢气的质量/g
金属的质量/g
Mg
Al
Zn
m(Zn)>m(Mg)>m(Al)
消耗金属的质量:
产生氢气的质量:
m(Al)=m(Mg)=m(Zn)
分析:
点击进入
①反应未完全时,产生氢气的质量由消耗金属的质量决定
O
②反应完全时,酸消耗完,最终生成氢气的质量由酸的质量决定
①
②
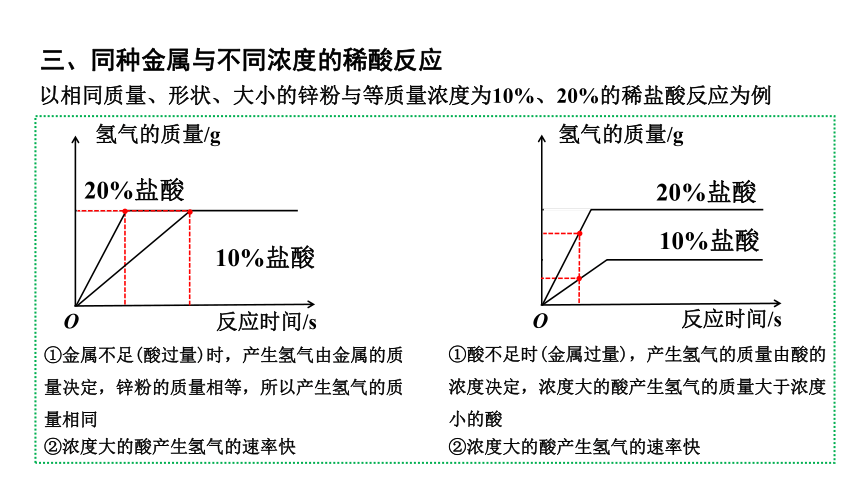
三、同种金属与不同浓度的稀酸反应
以相同质量、形状、大小的锌粉与等质量浓度为10%、20%的稀盐酸反应为例
氢气的质量/g
反应时间/s
20%盐酸
反应时间/s
20%盐酸
10%盐酸
①金属不足(酸过量)时,产生氢气由金属的质量决定,锌粉的质量相等,所以产生氢气的质量相同
氢气的质量/g
O
O
②浓度大的酸产生氢气的速率快
①酸不足时(金属过量),产生氢气的质量由酸的浓度决定,浓度大的酸产生氢气的质量大于浓度小的酸
②浓度大的酸产生氢气的速率快
10%盐酸
典例精析
1.如图所示图像能正确反映对应实验操作的是 ( )
反应时间/s
Mg
Al
氢气的质量/g
O
Zn
稀盐酸的质量/g
Fe
气体的质量/g
O
Zn
A B C D
A.分别向等质量的Al和Mg中滴加稀硫酸
B.如图表示向等质量、等质量分数的稀盐酸中分别加入镁粉和铝粉
C.向等质量的锌、铁中分别加入足量等浓度的稀盐酸
D.向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
反应时间/s
Mg
氢气的质量/g
O
Al
金属质量/g
Al
气体的质量/g
O
Mg
金属质量/g
Al
气体的质量/g
O
Mg
A.向等质量的Al和Mg中分别加入足量等浓度稀硫酸
反应时间/s
Mg
氢气的质量/g
O
Al
反应开始时酸不足,生成氢气的质量由酸决定,反应结束,金属不足,产生氢气的量由金属决定
产生氢气的质量:Al>Mg
生成氢气的速率由金属的活动性顺序决定,金属活动性顺序:Mg>Al
×
Mg
酸不足,产生氢气的量由酸决定产生,氢气的质量:Al=Mg
生成氢气的速率由金属的活动性顺序决定,金属活动性顺序:Mg>Al
B.如图表示向等质量、等质量分数的稀盐酸中分别加入镁粉和铝粉
×
Al
稀盐酸的质量/g
Fe
气体的质量/g
O
Zn
A B C
C.向等质量的锌、铁中分别加入足量等浓度的稀盐酸
√
Mg
Al
Zn
反应时间/s
氢气的质量/g
O
A
D.向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
设7.02g镁、铝、锌四种金属分别与足量稀盐酸反应,
产生氢气的质量分别为m(Mg)、m(Al)、m(Zn)
m(Mg)=
m(Al)=
m(Zn)=
由计算得出产生氢气质量大小的排序是m(Al)>m(Mg)>m(Zn),Al的平台最高,
所以D不正确,D 的正确图像应该是
Al
Mg
解析:
酸过量,产生氢气的质量由金属决定
请你试判断一下D选项,给出正确的图像
→氢气的质量=金属的质量×
C
1.如图所示图像能正确反映对应实验操作的是 ( )
反应时间/s
Mg
Al
氢气的质量/g
O
Zn
稀盐酸的质量/g
Fe
气体的质量/g
O
Zn
A B C D
A.分别向等质量的Al和Mg中滴加稀硫酸
B.如图表示向等质量、等质量分数的稀盐酸中分别加入镁粉和铝粉
C.向等质量的锌、铁中分别加入足量等浓度的稀盐酸
D.向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
反应时间/s
Mg
氢气的质量/g
O
Al
金属质量/g
Al
气体的质量/g
O
Mg
巩固练习
1.(2022河北逆袭卷)向等质量的镁粉、锌粉和铁粉中分别加入100 g相同质量分数的稀盐酸,产生气体的质量与加入稀盐酸的质量关系如图所示。下列说法正确的是( )
A. 反应后得到三种无色溶液
B. 曲线b表示的是镁粉和稀盐酸的反应
C. 反应结束后所得溶液的质量a>b>c
D. 若生成等质量的氢气,所需金属的质量a<b<c
×
FeCl2溶液为浅绿色
你能判断出BCD选项的正误吗?
B. 曲线b表示的是镁粉和稀盐酸的反应
C. 反应结束后所得溶液的质量a>b>c
D. 若生成等质量的氢气,所需金属的质量a<b<c
→金属相对原子质量:
镁(a)<铁(b)<锌(c)
等量金属足量酸,产生氢气的质量由金属的
相对原子质量决定
反应结束,产生气体的质量大小为:镁>铁>锌
根据质量守恒定律溶液的质量:锌(c)>铁(b)>镁(a)
等质量金属生成氢气的质量:镁>铁>锌
则生成等质量氢气镁消耗最小,其次是铁,最后是锌。
×
×
√
1.(2022河北逆袭卷)向等质量的镁粉、锌粉和铁粉中分别加入100 g相同质量分数的稀盐酸,产生气体的质量与加入稀盐酸的质量关系如图所示。下列说法正确的是( )
A. 反应后得到三种无色溶液
B. 曲线b表示的是镁粉和稀盐酸的反应
C. 反应结束后所得溶液的质量a>b>c
D. 若生成等质量的氢气,所需金属的质量a<b<c
D
2.某化学兴趣小组的同学将生锈的铁钉放入盛有稀盐酸的密闭容器中,利用压强传感器、数据采集器和计算机等数字化实验设备,测定容器内气体压强和反应时间的变化曲线如图,下列说法正确的是( )
A. CD段压强变化的主要因素是反应速度减慢
B. BC段的化学反应是: Fe+2HCl === FeCl2+H2↑
C. D点反应结束
D. E点温度大于A点
B
图像分析:
AB段:稀盐酸与铁锈反应
BC段:稀盐酸与铁钉发生反应,压强增大的原因:
1. 反应有气体生成 2. 反应放热导致密闭容器温度升高
CD段压强变化的原因是什么?
设15.12g镁、铝、锌、铁四种金属分别与足量稀盐酸反应,产生氢气的质量分别为m(Mg)、m(Al)、m(Zn)、m(Fe)
Mg+2HCl===MgCl2+H2↑
24 2
15.12g m(Mg)
2Al+6HCl===2AlCl3+3H2↑
54 6
15.12g m(Al)
Fe+2HCl===FeCl2+H2↑
56 2
15.12g m(Fe)
Zn+2HCl===ZnCl2+H2↑
65 2
15.12g m(Zn)
1.68g>1.26g>0.54g>0.46g
氢气的计算公式:
产生氢气质量大小的比较:
等质量镁、铝、锌、铁分别与足量等浓度的酸反应,产生氢气的质量:____________________________
m(Al)>m(Mg)>m(Fe)>m(Zn)
返 回
m(Mg)=
m(Al)=
m(Fe)=
m(Zn)=
氢气的质量
= 金属的质量×
设15.12g镁、铝、锌、铁四种金属分别与足量稀盐酸反应,消耗盐酸的质量分别为m(Mg)、m(Al)、m(Zn)、m(Fe)
Mg+2HCl===MgCl2+H2↑
24 73
15.12g m(Mg)
2Al+6HCl===2AlCl3+3H2↑
54 219
15.12g m(Al)
Fe + 2HCl===FeCl2+H2↑
56 73
15.12g m(Fe)
Zn+2HCl===ZnCl2+H2↑
65 73
15.12g m(Zn)
61.32g>45.99g>19.71g>16.98g
消耗酸质量大小的比较:
等质量镁、铝、锌分别与足量等浓度的酸反应,消耗酸的质量:____________________________
m(Al)>m(Mg)>m(Fe)>m(Zn)
返 回
m(Mg)=
m(Al)=
m(Fe)=
m(Zn)=
设2.19g盐酸与镁、铝、锌三种金属分反应,消耗金属的质量分别为m(Mg)、m(Al)、m(Zn)
Mg + 2HCl===MgCl2 + H2↑
24 73
m(Mg) 2.19g
2Al + 6HCl===2AlCl3 + 3H2↑
54 219
m(Al) 2.19g
Zn + 2HCl===ZnCl2 + H2↑
65 73
m(Zn) 2.19g
m(Mg)=
m(Al)=
m(Zn)=
1.95g>0.72g>0.54g
最终消耗金属的质量:
______________________
m(Al)>m(Mg)>m(Zn)
返 回
消耗金属质量大小的比较:
河北 化学
金属与酸反应的坐标曲线分析
2024中考备考重难专题课件
课件说明
一、课件设计初衷
基于老师在总复习过程中对重难题型有较大的需求,以及纸质图书和板书展示二次函数图象与几何图形等重难点效果不佳而设计了重难专题课件. 在制作过程中结合课件能使题图动态化且分步骤展示的特性,有助于学生题图结合梳理题意,理解平面图形的变化过程.
二、课件亮点
1.依据区域考情,针对性选题
按照本地区考情及考法选题,针对性强,有效提高老师备课效率
2.贴近学生实际解题情境,形式符合教学习惯
审题时对题目数字、符号、辅助线、动图等关键信息进行题图批注,帮助学生梳理关键信息,激发学生兴趣,调动积极性
3.含解题思路引导与方法总结,提高课堂互动性
通过问题启发式解题思路点拨,激发学生数学思考与探索. 方法总结使学生复习一类题,会一类题,取得有效的复习成果
三、课件使用场景
适用于中考专题复习或题位复习
1
分类突破
典例精析
2
巩固练习
3
一、等量金属足量酸(酸过量)
等质量的镁、铝、锌、铁与足量酸反应的坐标曲线图分析
1.当横坐标表示反应时间
(1)产生氢气的速率:
v(Mg)>v(Al)>v(Zn)>v(Fe)
分析:金属活动性________________
Mg>Al>Zn>Fe
氢气的质量/g
Mg
Al
Zn
反应时间/s
O
Fe
①根据四种金属的金属活动性顺序确定反应完全的时间
②根据四种氢气产生的质量大小排序确定“平台”,生成的氢气质量越大,平台越高,得到拐点,将O点与拐点连接,得到图像
分类突破
(2)产生氢气的质量计算比较:
m(Al)>m(Mg)>m(Fe)>m(Zn)
计算:
点击进入
③
2.当横坐标表示酸的质量
(1)产生氢气的质量计算比较:
m(Al)>m(Mg)>m(Fe)>m(Zn)
计算:
点击进入
m(Al)>m(Mg)>m(Fe)>m(Zn)
(2)消耗稀盐酸的质量:
氢气的质量/g
稀盐酸的质量/g
Mg
Al
Zn
③起始阶段,稀盐酸的质量不足,金属的质量过量,产生氢气的质量由稀盐酸的质量决定
O
④随着稀盐酸的不断滴加,稀盐酸逐渐过量,金属的量不足,四种金属依次被反应完
Fe
①根据四种氢气产生的质量大小排序确定“平台”
②根据四种金属反应完全需要消耗酸的质量,得到拐点,将O点与拐点连接,得到图像
③
④
二、足量金属等量酸(酸不足)
以镁、铝、锌三种金属与等质量、等浓度的盐酸反应为例
1. 当横坐标表示反应时间
三种金属与等质量、等浓度的盐酸反应时,哪种金属产生的氢气最多?
金属过量,酸不足,产生氢气的质量与金属质量无关,由酸决定。
所以三种金属与等质量、等浓度的盐酸反应产生氢气的质量是相等的。
设:参与反应的HCl的质量为7.3g, 与三种金属反应产生氢气的质量为x,结合反应的质量关系可知:
2HCl ~ H2↑
73 2
7.3g x
(2)产生氢气的质量:______
相等
v(Mg)>v(Al)>v(Zn)
氢气的质量/g
反应时间/s
Mg
Al
Zn
相同时间内产生氢气的质量越多,速率越快(也可从产生相同质量氢气所用时间来对比)
(1)产生氢气的速率:
O
分析:金属活动性____________
Mg>Al>Zn
2.当横坐标表示金属的质量
氢气的质量/g
金属的质量/g
Mg
Al
Zn
m(Zn)>m(Mg)>m(Al)
消耗金属的质量:
产生氢气的质量:
m(Al)=m(Mg)=m(Zn)
分析:
点击进入
①反应未完全时,产生氢气的质量由消耗金属的质量决定
O
②反应完全时,酸消耗完,最终生成氢气的质量由酸的质量决定
①
②
三、同种金属与不同浓度的稀酸反应
以相同质量、形状、大小的锌粉与等质量浓度为10%、20%的稀盐酸反应为例
氢气的质量/g
反应时间/s
20%盐酸
反应时间/s
20%盐酸
10%盐酸
①金属不足(酸过量)时,产生氢气由金属的质量决定,锌粉的质量相等,所以产生氢气的质量相同
氢气的质量/g
O
O
②浓度大的酸产生氢气的速率快
①酸不足时(金属过量),产生氢气的质量由酸的浓度决定,浓度大的酸产生氢气的质量大于浓度小的酸
②浓度大的酸产生氢气的速率快
10%盐酸
典例精析
1.如图所示图像能正确反映对应实验操作的是 ( )
反应时间/s
Mg
Al
氢气的质量/g
O
Zn
稀盐酸的质量/g
Fe
气体的质量/g
O
Zn
A B C D
A.分别向等质量的Al和Mg中滴加稀硫酸
B.如图表示向等质量、等质量分数的稀盐酸中分别加入镁粉和铝粉
C.向等质量的锌、铁中分别加入足量等浓度的稀盐酸
D.向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
反应时间/s
Mg
氢气的质量/g
O
Al
金属质量/g
Al
气体的质量/g
O
Mg
金属质量/g
Al
气体的质量/g
O
Mg
A.向等质量的Al和Mg中分别加入足量等浓度稀硫酸
反应时间/s
Mg
氢气的质量/g
O
Al
反应开始时酸不足,生成氢气的质量由酸决定,反应结束,金属不足,产生氢气的量由金属决定
产生氢气的质量:Al>Mg
生成氢气的速率由金属的活动性顺序决定,金属活动性顺序:Mg>Al
×
Mg
酸不足,产生氢气的量由酸决定产生,氢气的质量:Al=Mg
生成氢气的速率由金属的活动性顺序决定,金属活动性顺序:Mg>Al
B.如图表示向等质量、等质量分数的稀盐酸中分别加入镁粉和铝粉
×
Al
稀盐酸的质量/g
Fe
气体的质量/g
O
Zn
A B C
C.向等质量的锌、铁中分别加入足量等浓度的稀盐酸
√
Mg
Al
Zn
反应时间/s
氢气的质量/g
O
A
D.向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
设7.02g镁、铝、锌四种金属分别与足量稀盐酸反应,
产生氢气的质量分别为m(Mg)、m(Al)、m(Zn)
m(Mg)=
m(Al)=
m(Zn)=
由计算得出产生氢气质量大小的排序是m(Al)>m(Mg)>m(Zn),Al的平台最高,
所以D不正确,D 的正确图像应该是
Al
Mg
解析:
酸过量,产生氢气的质量由金属决定
请你试判断一下D选项,给出正确的图像
→氢气的质量=金属的质量×
C
1.如图所示图像能正确反映对应实验操作的是 ( )
反应时间/s
Mg
Al
氢气的质量/g
O
Zn
稀盐酸的质量/g
Fe
气体的质量/g
O
Zn
A B C D
A.分别向等质量的Al和Mg中滴加稀硫酸
B.如图表示向等质量、等质量分数的稀盐酸中分别加入镁粉和铝粉
C.向等质量的锌、铁中分别加入足量等浓度的稀盐酸
D.向足量的相同溶质质量分数的稀硫酸中分别加入等质量Zn粉、Al粉、Mg粉
反应时间/s
Mg
氢气的质量/g
O
Al
金属质量/g
Al
气体的质量/g
O
Mg
巩固练习
1.(2022河北逆袭卷)向等质量的镁粉、锌粉和铁粉中分别加入100 g相同质量分数的稀盐酸,产生气体的质量与加入稀盐酸的质量关系如图所示。下列说法正确的是( )
A. 反应后得到三种无色溶液
B. 曲线b表示的是镁粉和稀盐酸的反应
C. 反应结束后所得溶液的质量a>b>c
D. 若生成等质量的氢气,所需金属的质量a<b<c
×
FeCl2溶液为浅绿色
你能判断出BCD选项的正误吗?
B. 曲线b表示的是镁粉和稀盐酸的反应
C. 反应结束后所得溶液的质量a>b>c
D. 若生成等质量的氢气,所需金属的质量a<b<c
→金属相对原子质量:
镁(a)<铁(b)<锌(c)
等量金属足量酸,产生氢气的质量由金属的
相对原子质量决定
反应结束,产生气体的质量大小为:镁>铁>锌
根据质量守恒定律溶液的质量:锌(c)>铁(b)>镁(a)
等质量金属生成氢气的质量:镁>铁>锌
则生成等质量氢气镁消耗最小,其次是铁,最后是锌。
×
×
√
1.(2022河北逆袭卷)向等质量的镁粉、锌粉和铁粉中分别加入100 g相同质量分数的稀盐酸,产生气体的质量与加入稀盐酸的质量关系如图所示。下列说法正确的是( )
A. 反应后得到三种无色溶液
B. 曲线b表示的是镁粉和稀盐酸的反应
C. 反应结束后所得溶液的质量a>b>c
D. 若生成等质量的氢气,所需金属的质量a<b<c
D
2.某化学兴趣小组的同学将生锈的铁钉放入盛有稀盐酸的密闭容器中,利用压强传感器、数据采集器和计算机等数字化实验设备,测定容器内气体压强和反应时间的变化曲线如图,下列说法正确的是( )
A. CD段压强变化的主要因素是反应速度减慢
B. BC段的化学反应是: Fe+2HCl === FeCl2+H2↑
C. D点反应结束
D. E点温度大于A点
B
图像分析:
AB段:稀盐酸与铁锈反应
BC段:稀盐酸与铁钉发生反应,压强增大的原因:
1. 反应有气体生成 2. 反应放热导致密闭容器温度升高
CD段压强变化的原因是什么?
设15.12g镁、铝、锌、铁四种金属分别与足量稀盐酸反应,产生氢气的质量分别为m(Mg)、m(Al)、m(Zn)、m(Fe)
Mg+2HCl===MgCl2+H2↑
24 2
15.12g m(Mg)
2Al+6HCl===2AlCl3+3H2↑
54 6
15.12g m(Al)
Fe+2HCl===FeCl2+H2↑
56 2
15.12g m(Fe)
Zn+2HCl===ZnCl2+H2↑
65 2
15.12g m(Zn)
1.68g>1.26g>0.54g>0.46g
氢气的计算公式:
产生氢气质量大小的比较:
等质量镁、铝、锌、铁分别与足量等浓度的酸反应,产生氢气的质量:____________________________
m(Al)>m(Mg)>m(Fe)>m(Zn)
返 回
m(Mg)=
m(Al)=
m(Fe)=
m(Zn)=
氢气的质量
= 金属的质量×
设15.12g镁、铝、锌、铁四种金属分别与足量稀盐酸反应,消耗盐酸的质量分别为m(Mg)、m(Al)、m(Zn)、m(Fe)
Mg+2HCl===MgCl2+H2↑
24 73
15.12g m(Mg)
2Al+6HCl===2AlCl3+3H2↑
54 219
15.12g m(Al)
Fe + 2HCl===FeCl2+H2↑
56 73
15.12g m(Fe)
Zn+2HCl===ZnCl2+H2↑
65 73
15.12g m(Zn)
61.32g>45.99g>19.71g>16.98g
消耗酸质量大小的比较:
等质量镁、铝、锌分别与足量等浓度的酸反应,消耗酸的质量:____________________________
m(Al)>m(Mg)>m(Fe)>m(Zn)
返 回
m(Mg)=
m(Al)=
m(Fe)=
m(Zn)=
设2.19g盐酸与镁、铝、锌三种金属分反应,消耗金属的质量分别为m(Mg)、m(Al)、m(Zn)
Mg + 2HCl===MgCl2 + H2↑
24 73
m(Mg) 2.19g
2Al + 6HCl===2AlCl3 + 3H2↑
54 219
m(Al) 2.19g
Zn + 2HCl===ZnCl2 + H2↑
65 73
m(Zn) 2.19g
m(Mg)=
m(Al)=
m(Zn)=
1.95g>0.72g>0.54g
最终消耗金属的质量:
______________________
m(Al)>m(Mg)>m(Zn)
返 回
消耗金属质量大小的比较:
同课章节目录
