2024河北化学中考备考重难专题:溶解度及溶解度曲线分析 课件 (共20张PPT)
文档属性
| 名称 | 2024河北化学中考备考重难专题:溶解度及溶解度曲线分析 课件 (共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 08:49:20 | ||
图片预览





文档简介
(共20张PPT)
河北 化学
溶解度及溶解度曲线分析
2024中考备考重难专题课件
课件说明
一、课件设计初衷
基于老师在总复习过程中对重难题型有较大的需求,难易结合化学学科的重难点,为此设计重难专题复习课件,助力高效课堂
二、课件亮点
1.对专题知识体系的构建
侧重专题知识体系分解再构建,根据本区域近五年的中考真题提炼知识点,通过知识点讲授方法和技巧,并进一步形成对应体系,再让学生尝试应用已有体系中的方法与技巧去解决问题,在复习过程中构建自己的重难专题知识体系。会对难题进行分解,降低梯度,准确、高效攻克重难专题。
2.过程性分析设置分步动画
对方法讲解、解题步骤设置分步动画,按步骤播放,更清晰有条理。
三、课件使用场景
适用于中考二轮专题复习
1
溶解度曲线类
溶解度实物图类
2
巩固练习
3
溶解度曲线类
方法指导:
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
从下列图中你能获取哪些信息呢?
各物质溶解度的变化趋势;
各温度下溶解度大小的比较;
甲、乙,甲、丙两物质溶解度相等时的温度;
P、M、N三点对应的各物质在t2℃时溶液的状态
可直接观测
P点或M点的某溶液如何转化为饱和溶液/不饱和溶液?
溶液、溶剂、溶质质量(分数)如何计算?
温度发生变化时,P、M、N三点溶液中各种量是如何变化的?
怎么判断一个物质的提纯方法?
你能直接获取以下信息嘛?
分类突破
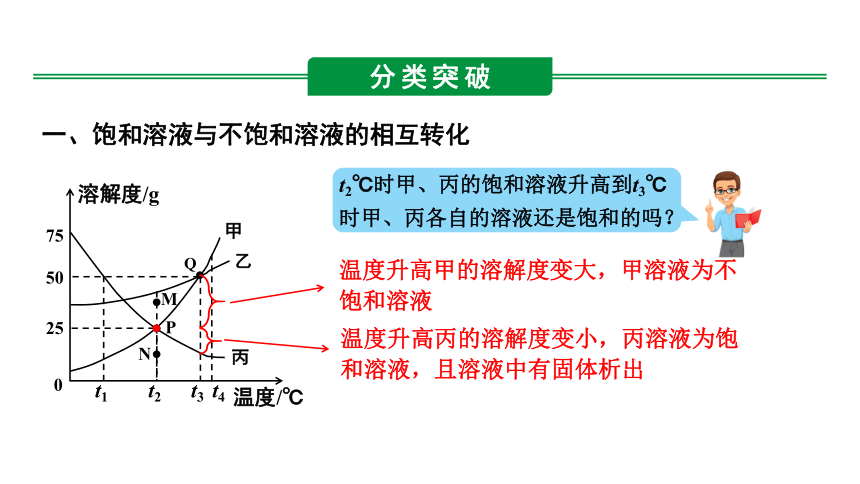
一、饱和溶液与不饱和溶液的相互转化
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
t2℃时甲、丙的饱和溶液升高到t3℃时甲、丙各自的溶液还是饱和的吗?
温度升高甲的溶解度变大,甲溶液为不饱和溶液
温度升高丙的溶解度变小,丙溶液为饱和溶液,且溶液中有固体析出
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
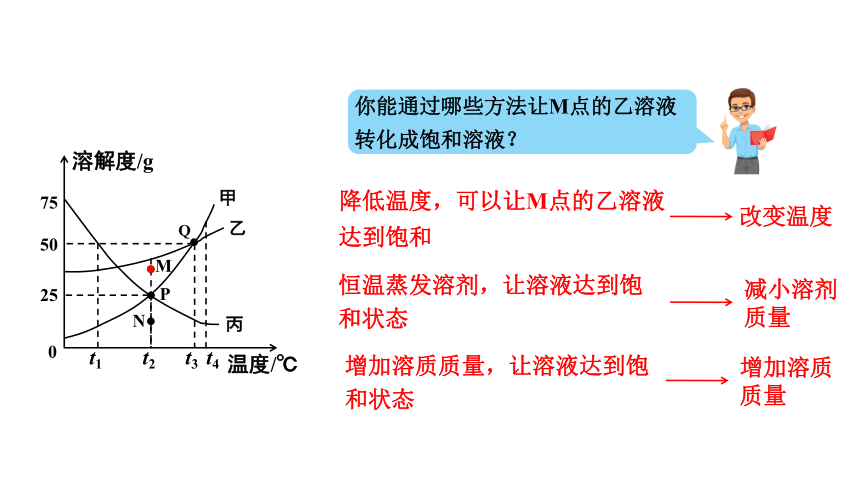
你能通过哪些方法让M点的乙溶液转化成饱和溶液?
降低温度,可以让M点的乙溶液达到饱和
改变温度
恒温蒸发溶剂,让溶液达到饱和状态
增加溶质质量,让溶液达到饱和状态
减小溶剂质量
增加溶质质量
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
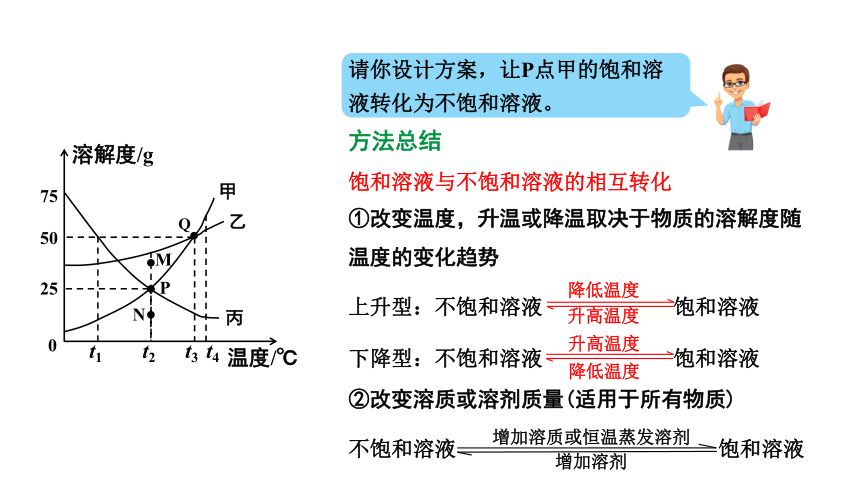
请你设计方案,让P点甲的饱和溶液转化为不饱和溶液。
方法总结
饱和溶液与不饱和溶液的相互转化
①改变温度,升温或降温取决于物质的溶解度随温度的变化趋势
上升型:不饱和溶液 饱和溶液
下降型:不饱和溶液 饱和溶液
②改变溶质或溶剂质量(适用于所有物质)
不饱和溶液 饱和溶液
降低温度
升高温度
升高温度
降低温度
增加溶质或恒温蒸发溶剂
增加溶剂
二、溶液、溶剂、溶质质量(分数)的计算与比较
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
t1℃时,将40 g丙加入到100 g水中,充分溶解,所得溶液的溶质质量分数是多少?
判断t1℃时,丙的溶解度
→50g
40g的丙可以完全溶解在100g的水中
溶质质量分数=
= ≈28.6%
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
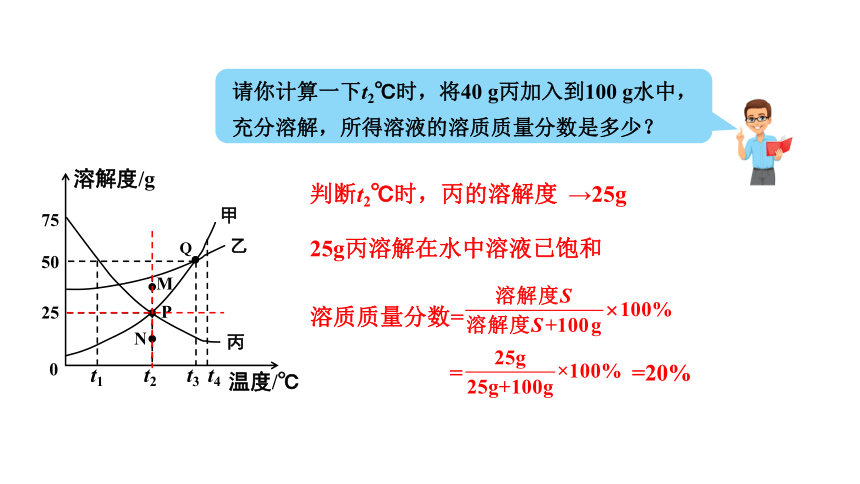
请你计算一下t2℃时,将40 g丙加入到100 g水中,充分溶解,所得溶液的溶质质量分数是多少?
判断t2℃时,丙的溶解度
→25g
25g丙溶解在水中溶液已饱和
溶质质量分数=
= =20%
你能总结出计算溶质质量分数的方法步骤吗?
溶液的溶质质量分数计算:
1. 判断溶液是饱和溶液还是不饱和溶液。
2. 若溶液为饱和溶液,溶质质量分数= ;
若溶液为不饱和溶液,溶质质量分数=
请你比较一下t4℃时,将等质量的甲、乙、丙三种物质分别配制成饱和溶液,谁所需的溶剂质量多?谁的溶液质量最大?
拓展设问:
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
t4℃时甲、乙、丙三种物质的溶解度甲>乙>丙,等质量的三种物质溶解度越低,配制成饱和溶液所需的溶剂就越多。
所需溶剂质量:丙>乙>甲
所得溶液质量:丙>乙>甲
三、改变温度时溶液中各种量的变化情况
将t1℃甲、乙、丙的饱和溶液从升温至t3℃,所得溶液的溶质质量分数如何变化?
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
丙的溶解度减小,丙析出晶体,丙一直是饱和溶液,溶质质量分数减小
甲、乙的溶解度增大,但是溶质的质量没有增加,溶质质量分数和t1℃一致
升温后所得溶液的溶质质量分数大小如何排序?
t3℃时丙的溶解度大于t1℃时甲的溶解度,所以,t3℃的溶质质量分数丙大于甲
所得溶液的溶质质量分数由大到小的顺序为:乙>丙>甲
分别将100 g甲、乙的饱和溶液由t4℃降温到t2℃,析出晶体较多的是哪种物质?
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
析出晶体甲
析出晶体乙
甲的溶解度随温度变化的趋势大,甲析出的晶体多。
温度改变,饱和溶液中的溶液、溶质和溶剂的质量以及溶质质量分数可以根据是否有晶体析出判断。
①有晶体析出时,溶质质量减小,溶剂质量不变,溶液质量减小,溶质质量分数减小;
②无晶体析出时,溶质、溶剂、溶液质量以及溶质质质量分数都不变。
方法总结
四、根据溶解度曲线的升降情况判断物质的提纯方法
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
少量丙
析出晶体甲
甲
t4℃时甲的饱和溶液中混有少量丙,可采用什么的方法提纯甲?
→降温结晶(或冷却热饱和溶液)
恒温蒸发,甲处于不饱和状态,存在于滤液中
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
恒温蒸发,乙处于饱和状态,溶剂减少,溶质乙析出
t3℃时乙的饱和溶液中混有少量甲 ,可采用什么的方法提纯甲?
蒸发结晶
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
析出晶体丙
少量甲
丙
请你思考t1℃时丙中混有少量甲,可采用什么的方法提纯丙?
→升温结晶
曲线走向 提纯方法
缓升型(如乙) 蒸发结晶
陡升型(如甲) 降温结晶或冷却热饱和溶液
下降型(如丙) 升温结晶
判断物质结晶或提纯的方法:
方法总结
溶解度实物图类
在一定温度下,向 100 g 水中依次加入 KCl 固体,充分溶解,实验记录如下:
(1)该温度下,KCl 的溶解度是___g。
(2)①得到的溶液是_______(填“饱和”或“不饱和”) 溶液。①②③中溶质质量分数大小关系为___________。
(3)已知KCl的溶解度随温度升高而增大,对③所得溶液升温出现的现象是___________________。
该温度下KCl的溶解度是40g,②中溶液已饱和
40
不饱和
②=③>①
③中溶液固体溶解
让KCl 固体溶解的方法有几种?
请你计算一下升温固体完全溶解后溶液中溶质质量分数
固体完全溶解后,溶液中溶质的质量为60g,溶剂质量为100g
溶质质量分数=
巩固练习
1.如图是 A 物质的溶液恒温蒸发水的实验操作,下列有关说法正确的是( )
A. A 物质在此温度时的溶解度是20 g
B. 向甲溶液中加入1 g A 物质,形成的溶液是该温度下的饱和溶液
C. A 物质在此温度时饱和溶液的溶质质量分数为10%
D. 甲、乙、丙、丁溶液中溶质的质量分数的大小关系是甲<乙<丙=丁
→蒸发10g水析出1g固体,A物质的溶解度=10g
→乙丙丁溶液均已饱和,溶质质量分数相等大于甲溶液
B
2.(2022河北逆袭卷)图1为硝酸钾和氯化铵的溶解度曲线,图2为小明对其中的固体之一进行的系列实验。下列分析正确的是 ( )
A. 图1中t3℃时,由N点溶液不能转变为M点
B. 图2中加入的固体物质是氯化铵
C. 图2中b的溶液是饱和状态
D. 图2中若要让d的溶液恰好达到饱和状态,
需继续加入该固体4 g
→恒温蒸发
溶剂
→t3℃时50 g 水中能够完全溶解 30 g 硝酸钾,不能完全溶解 30 g 氯化铵,因此图 2 中,加入的“某固体”是硝酸钾
t3℃ 时,硝酸钾的溶解度是 68 g,50 g 水中
能够完全溶解 34 g 硝酸钾,d的溶液中有30g硝酸钾,34-30=4g
D
河北 化学
溶解度及溶解度曲线分析
2024中考备考重难专题课件
课件说明
一、课件设计初衷
基于老师在总复习过程中对重难题型有较大的需求,难易结合化学学科的重难点,为此设计重难专题复习课件,助力高效课堂
二、课件亮点
1.对专题知识体系的构建
侧重专题知识体系分解再构建,根据本区域近五年的中考真题提炼知识点,通过知识点讲授方法和技巧,并进一步形成对应体系,再让学生尝试应用已有体系中的方法与技巧去解决问题,在复习过程中构建自己的重难专题知识体系。会对难题进行分解,降低梯度,准确、高效攻克重难专题。
2.过程性分析设置分步动画
对方法讲解、解题步骤设置分步动画,按步骤播放,更清晰有条理。
三、课件使用场景
适用于中考二轮专题复习
1
溶解度曲线类
溶解度实物图类
2
巩固练习
3
溶解度曲线类
方法指导:
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
从下列图中你能获取哪些信息呢?
各物质溶解度的变化趋势;
各温度下溶解度大小的比较;
甲、乙,甲、丙两物质溶解度相等时的温度;
P、M、N三点对应的各物质在t2℃时溶液的状态
可直接观测
P点或M点的某溶液如何转化为饱和溶液/不饱和溶液?
溶液、溶剂、溶质质量(分数)如何计算?
温度发生变化时,P、M、N三点溶液中各种量是如何变化的?
怎么判断一个物质的提纯方法?
你能直接获取以下信息嘛?
分类突破
一、饱和溶液与不饱和溶液的相互转化
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
t2℃时甲、丙的饱和溶液升高到t3℃时甲、丙各自的溶液还是饱和的吗?
温度升高甲的溶解度变大,甲溶液为不饱和溶液
温度升高丙的溶解度变小,丙溶液为饱和溶液,且溶液中有固体析出
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
你能通过哪些方法让M点的乙溶液转化成饱和溶液?
降低温度,可以让M点的乙溶液达到饱和
改变温度
恒温蒸发溶剂,让溶液达到饱和状态
增加溶质质量,让溶液达到饱和状态
减小溶剂质量
增加溶质质量
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
请你设计方案,让P点甲的饱和溶液转化为不饱和溶液。
方法总结
饱和溶液与不饱和溶液的相互转化
①改变温度,升温或降温取决于物质的溶解度随温度的变化趋势
上升型:不饱和溶液 饱和溶液
下降型:不饱和溶液 饱和溶液
②改变溶质或溶剂质量(适用于所有物质)
不饱和溶液 饱和溶液
降低温度
升高温度
升高温度
降低温度
增加溶质或恒温蒸发溶剂
增加溶剂
二、溶液、溶剂、溶质质量(分数)的计算与比较
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
t1℃时,将40 g丙加入到100 g水中,充分溶解,所得溶液的溶质质量分数是多少?
判断t1℃时,丙的溶解度
→50g
40g的丙可以完全溶解在100g的水中
溶质质量分数=
= ≈28.6%
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
M
N
P
Q
请你计算一下t2℃时,将40 g丙加入到100 g水中,充分溶解,所得溶液的溶质质量分数是多少?
判断t2℃时,丙的溶解度
→25g
25g丙溶解在水中溶液已饱和
溶质质量分数=
= =20%
你能总结出计算溶质质量分数的方法步骤吗?
溶液的溶质质量分数计算:
1. 判断溶液是饱和溶液还是不饱和溶液。
2. 若溶液为饱和溶液,溶质质量分数= ;
若溶液为不饱和溶液,溶质质量分数=
请你比较一下t4℃时,将等质量的甲、乙、丙三种物质分别配制成饱和溶液,谁所需的溶剂质量多?谁的溶液质量最大?
拓展设问:
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
t4℃时甲、乙、丙三种物质的溶解度甲>乙>丙,等质量的三种物质溶解度越低,配制成饱和溶液所需的溶剂就越多。
所需溶剂质量:丙>乙>甲
所得溶液质量:丙>乙>甲
三、改变温度时溶液中各种量的变化情况
将t1℃甲、乙、丙的饱和溶液从升温至t3℃,所得溶液的溶质质量分数如何变化?
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
丙的溶解度减小,丙析出晶体,丙一直是饱和溶液,溶质质量分数减小
甲、乙的溶解度增大,但是溶质的质量没有增加,溶质质量分数和t1℃一致
升温后所得溶液的溶质质量分数大小如何排序?
t3℃时丙的溶解度大于t1℃时甲的溶解度,所以,t3℃的溶质质量分数丙大于甲
所得溶液的溶质质量分数由大到小的顺序为:乙>丙>甲
分别将100 g甲、乙的饱和溶液由t4℃降温到t2℃,析出晶体较多的是哪种物质?
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
析出晶体甲
析出晶体乙
甲的溶解度随温度变化的趋势大,甲析出的晶体多。
温度改变,饱和溶液中的溶液、溶质和溶剂的质量以及溶质质量分数可以根据是否有晶体析出判断。
①有晶体析出时,溶质质量减小,溶剂质量不变,溶液质量减小,溶质质量分数减小;
②无晶体析出时,溶质、溶剂、溶液质量以及溶质质质量分数都不变。
方法总结
四、根据溶解度曲线的升降情况判断物质的提纯方法
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
少量丙
析出晶体甲
甲
t4℃时甲的饱和溶液中混有少量丙,可采用什么的方法提纯甲?
→降温结晶(或冷却热饱和溶液)
恒温蒸发,甲处于不饱和状态,存在于滤液中
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
恒温蒸发,乙处于饱和状态,溶剂减少,溶质乙析出
t3℃时乙的饱和溶液中混有少量甲 ,可采用什么的方法提纯甲?
蒸发结晶
温度/℃
溶解度/g
75
50
25
0
甲
乙
丙
t1
t2
t3
t4
析出晶体丙
少量甲
丙
请你思考t1℃时丙中混有少量甲,可采用什么的方法提纯丙?
→升温结晶
曲线走向 提纯方法
缓升型(如乙) 蒸发结晶
陡升型(如甲) 降温结晶或冷却热饱和溶液
下降型(如丙) 升温结晶
判断物质结晶或提纯的方法:
方法总结
溶解度实物图类
在一定温度下,向 100 g 水中依次加入 KCl 固体,充分溶解,实验记录如下:
(1)该温度下,KCl 的溶解度是___g。
(2)①得到的溶液是_______(填“饱和”或“不饱和”) 溶液。①②③中溶质质量分数大小关系为___________。
(3)已知KCl的溶解度随温度升高而增大,对③所得溶液升温出现的现象是___________________。
该温度下KCl的溶解度是40g,②中溶液已饱和
40
不饱和
②=③>①
③中溶液固体溶解
让KCl 固体溶解的方法有几种?
请你计算一下升温固体完全溶解后溶液中溶质质量分数
固体完全溶解后,溶液中溶质的质量为60g,溶剂质量为100g
溶质质量分数=
巩固练习
1.如图是 A 物质的溶液恒温蒸发水的实验操作,下列有关说法正确的是( )
A. A 物质在此温度时的溶解度是20 g
B. 向甲溶液中加入1 g A 物质,形成的溶液是该温度下的饱和溶液
C. A 物质在此温度时饱和溶液的溶质质量分数为10%
D. 甲、乙、丙、丁溶液中溶质的质量分数的大小关系是甲<乙<丙=丁
→蒸发10g水析出1g固体,A物质的溶解度=10g
→乙丙丁溶液均已饱和,溶质质量分数相等大于甲溶液
B
2.(2022河北逆袭卷)图1为硝酸钾和氯化铵的溶解度曲线,图2为小明对其中的固体之一进行的系列实验。下列分析正确的是 ( )
A. 图1中t3℃时,由N点溶液不能转变为M点
B. 图2中加入的固体物质是氯化铵
C. 图2中b的溶液是饱和状态
D. 图2中若要让d的溶液恰好达到饱和状态,
需继续加入该固体4 g
→恒温蒸发
溶剂
→t3℃时50 g 水中能够完全溶解 30 g 硝酸钾,不能完全溶解 30 g 氯化铵,因此图 2 中,加入的“某固体”是硝酸钾
t3℃ 时,硝酸钾的溶解度是 68 g,50 g 水中
能够完全溶解 34 g 硝酸钾,d的溶液中有30g硝酸钾,34-30=4g
D
同课章节目录
