人教版九年级化学下册第九单元溶液单元复习题(含解析)
文档属性
| 名称 | 人教版九年级化学下册第九单元溶液单元复习题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 85.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 00:00:00 | ||
图片预览



文档简介
人教版九年级化学下册第九单元溶液单元复习题
一、单选题
1.下列不属于溶液的是( )
A.蒸馏水 B.食盐水 C.石灰水 D.蔗糖水
2.新制的凉开水不宜养鱼,其主要原因是凉开水中几乎不含()
A.氧分子 B.氧原子 C.氧元素 D.病菌
3.下列清洗方法中,利用乳化原理的是( )
A.用自来水洗手 B.用汽油清洗油污
C.用食醋除水垢 D.用洗涤剂清洗餐具
4.把60℃的饱和硝酸钾溶液降温到20℃,下列说法中正确的是( )
①溶液的质量不变 ②溶质的质量不变 ③溶剂的质量不变 ④仍是饱和状态
A.①和② B.③和④ C.①和③ D.②和④
5.下列物质溶于水时,溶液温度明显下降的是 ( )
A.食盐 B.硝酸铵 C.白糖 D.氢氧化钠
6.小亮用固体氯化钠配制80g溶质质量分数为10%的氯化钠溶液,有关他的实验操作,下列说法正确的是( )
A.配制过程中使用到的玻璃仪器分别是漏斗、玻璃棒、酒精灯、量筒、胶头滴管
B.实验中发现氯化钠已经结块,为了较快地溶解,可以加入更多的水
C.溶解氯化钠固体时,不断用玻璃棒搅拌,其目的是增大氯化钠在水中的溶解度
D.若量取水时俯视读数,其他操作均正确,则所配制溶液的溶质质量分数偏大
7.将少量物质分别放入水中,充分搅拌后能形成溶液的是( )
A.泥土 B.面粉 C.白糖 D.汽油
8.有关如图溶解度曲线,下列说法正确的是( )
A.甲、乙、丙三种物质的溶解度关系为S甲>S乙>S丙
B.乙物质的溶解度随温度变化最大
C.27℃时,往26g丙里加 100g水,形成不饱和溶液
D.33℃时,甲、乙两种物质溶解度相等
9.某同学按下图所示步骤进行实验,溶解度曲线如下图,下列说法正确的是( )
A.I中KNO3的质量分数50%
B.Ⅱ中溶液是60℃时KNO3的饱和溶液
C.Ⅲ中有KNO3晶体析出
D.Ⅱ和Ⅲ中KNO3溶液的质量分数相同
10.碘单质有毒,它在下列三种不同溶剂中的溶解性如表所示:
溶质 碘
溶剂 水 酒精 苯(有毒)
溶解性 微溶 可溶 易溶
由表中提供的信息判断,实验室里除去试管内的碘最好选用( )
A.水 B.酒精
C.苯 D.加热使之升华
11.洗涤与生活密切相关。下列洗涤方法中利用了乳化原理的是( )
A.用洗洁精洗去餐具上的油污
B.用水洗去盘子中的水果渣
C.用酒精除去附着在试管壁内的碘
D.用汽油除去衣服上的油污
二、非选择题
12.阅读下列短文,回答问题。
“深海一号”能源站是由我国自主研发建造的全球首座10万吨级深水半潜式生产储油平台。2021年6月25日,该平台正式投产,标志着中国从装备技术到勘探开发能力全面实现从300来到1500米超深水的跨越。2022年2月13日,中国海洋石油集团有限公司对外宣布,该平台2021年6月25日正式投产以来,累计生产天然气超10亿立方米。在保供季为海南自贸港和粤港澳大湾区建设提供了重要清洁能源来源。
(1)天然气属于 (填“可再生”或“不可再生”)能源,天然气的主要成分是甲烷(CH4),甲烷是由 (填“分子”、“原子”或“离子”)构成;已知甲烷中氢元素的化合价是+1,则碳元素的化合价是 。
(2)天然气之所以被称为清洁能源,是因为它完全燃烧时不产生污染物。请写出甲烷完全燃烧时的化学方程式 。
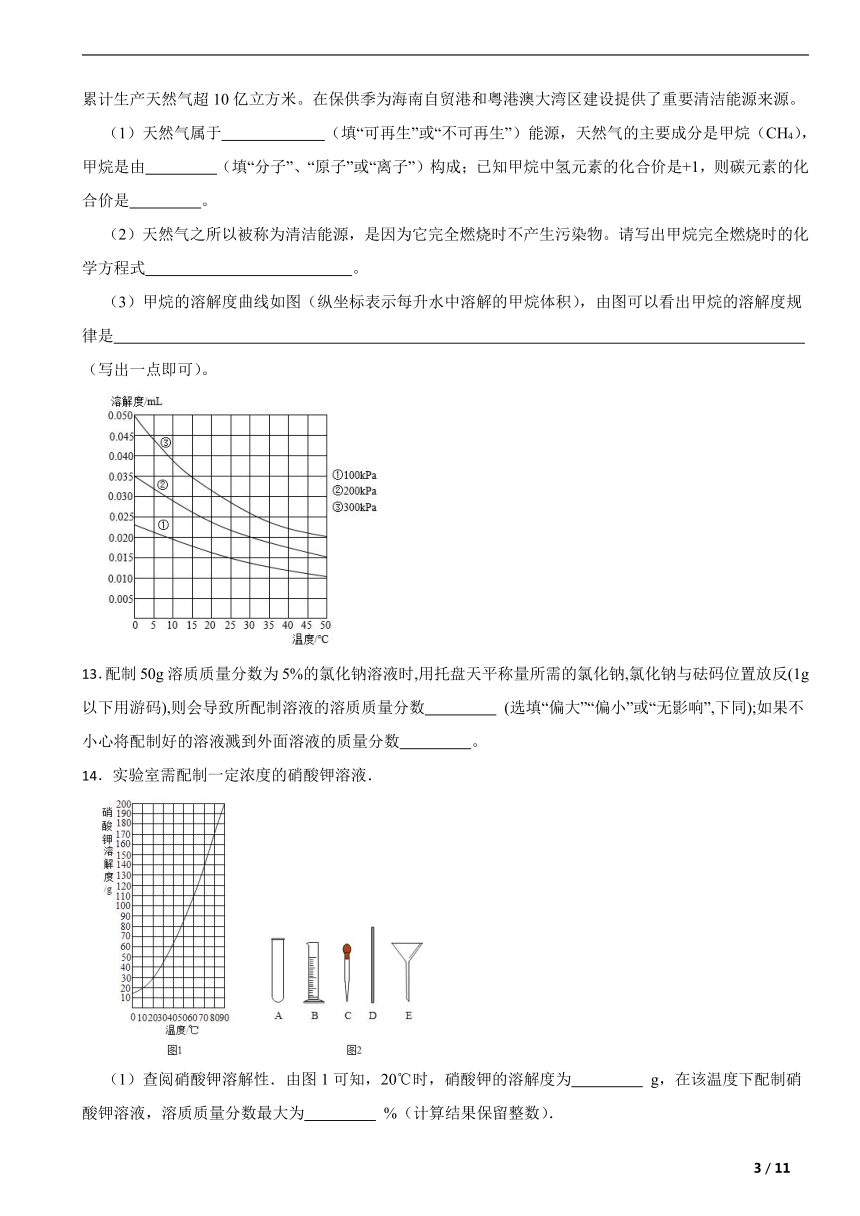
(3)甲烷的溶解度曲线如图(纵坐标表示每升水中溶解的甲烷体积),由图可以看出甲烷的溶解度规律是 (写出一点即可)。
13.配制50g溶质质量分数为5%的氯化钠溶液时,用托盘天平称量所需的氯化钠,氯化钠与砝码位置放反(1g以下用游码),则会导致所配制溶液的溶质质量分数 (选填“偏大”“偏小”或“无影响”,下同);如果不小心将配制好的溶液溅到外面溶液的质量分数 。
14.实验室需配制一定浓度的硝酸钾溶液.
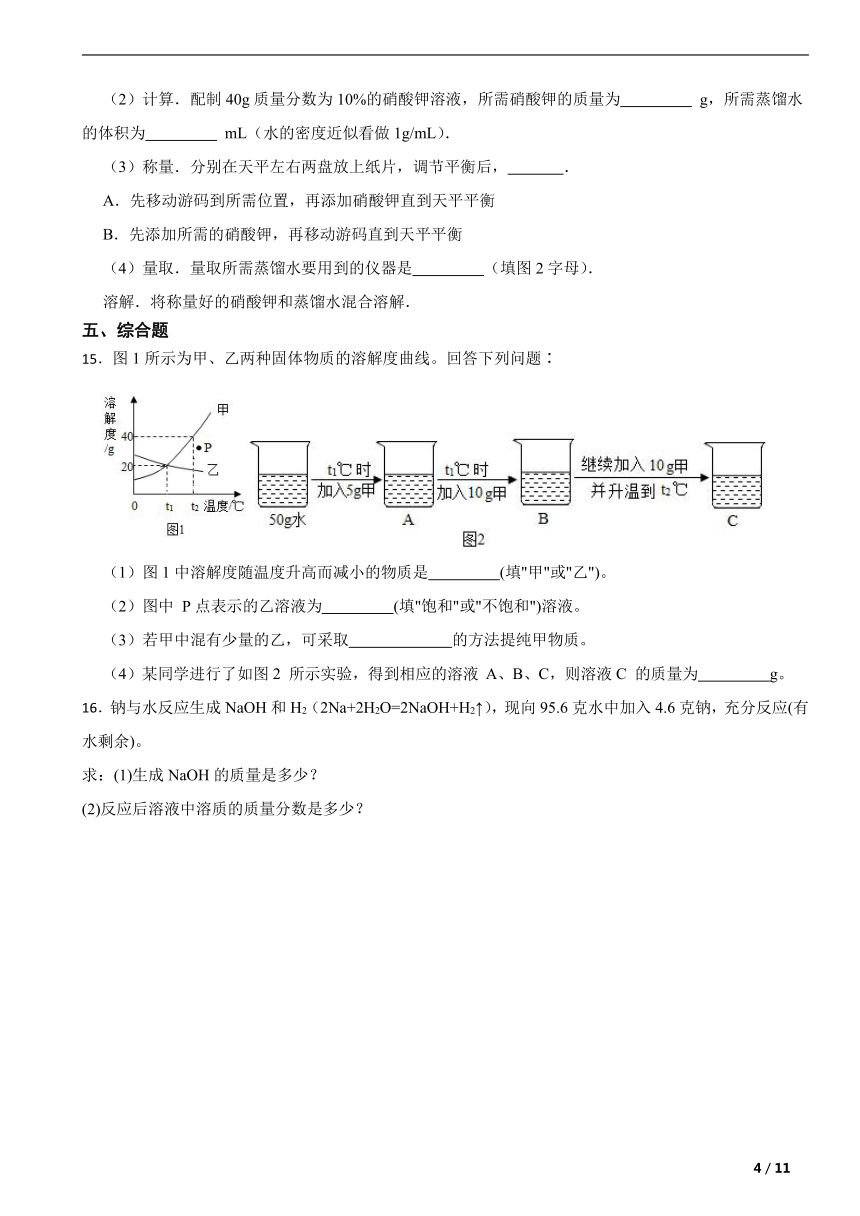
(1)查阅硝酸钾溶解性.由图1可知,20℃时,硝酸钾的溶解度为 g,在该温度下配制硝酸钾溶液,溶质质量分数最大为 %(计算结果保留整数).
(2)计算.配制40g质量分数为10%的硝酸钾溶液,所需硝酸钾的质量为 g,所需蒸馏水的体积为 mL(水的密度近似看做1g/mL).
(3)称量.分别在天平左右两盘放上纸片,调节平衡后, .
A.先移动游码到所需位置,再添加硝酸钾直到天平平衡
B.先添加所需的硝酸钾,再移动游码直到天平平衡
(4)量取.量取所需蒸馏水要用到的仪器是 (填图2字母).
溶解.将称量好的硝酸钾和蒸馏水混合溶解.
五、综合题
15.图1所示为甲、乙两种固体物质的溶解度曲线。回答下列问题∶
(1)图1中溶解度随温度升高而减小的物质是 (填"甲"或"乙")。
(2)图中
P点表示的乙溶液为 (填"饱和"或"不饱和")溶液。
(3)若甲中混有少量的乙,可采取 的方法提纯甲物质。
(4)某同学进行了如图2 所示实验,得到相应的溶液 A、B、C,则溶液C 的质量为 g。
16.钠与水反应生成NaOH和H2(2Na+2H2O=2NaOH+H2↑),现向95.6克水中加入4.6克钠,充分反应(有水剩余)。
求:(1)生成NaOH的质量是多少?
(2)反应后溶液中溶质的质量分数是多少?
答案解析部分
1.【答案】A
【解析】【解答】A. 蒸馏水是纯净物不属于溶液,故符合题意;
B. 食盐水是均一、稳定的混合物,属于溶液;
C. 石灰水是均一、稳定的混合物,属于溶液;
D. 蔗糖水是均一、稳定的混合物,属于溶液。
故答案为:A。
【分析】溶液是混合物,具有均一性,稳定性。
2.【答案】A
【解析】【解答】鱼在水中生存需要氧气,氧气是由氧分子构成的,凉开水不宜养鱼,其主要原因是凉开水中几乎不含氧气,观察选项,
故答案为:A。
【分析】根据氧气的溶解性及帮助呼吸的性质分析。
3.【答案】D
【解析】【解答】A. 用自来水洗手,使附着在手上的泥土等污物与水形成溶液或浊液而被冲洗掉,不属于乳化作用,故不符合题意;
B. 用汽油清洗油污,利用的是汽油能溶解油污,用汽油清洗油污不是利用乳化原理,故不符合题意;
C. 用食醋清除水垢,利用的是醋酸能与水垢的成分碳酸钙、氢氧化镁等反应生成易溶于水的物质,不是利用乳化原理,故不符合题意;
D. 用洗涤剂清洗餐具上的油污是利用了洗涤剂对油污的乳化作用,故符合题意。
故答案为:D。
【分析】洗涤剂有个特殊性质,它能把一个个小油滴包围起来,让它们均匀地分散在水中,这种作用叫“乳化作用”。
4.【答案】B
【解析】【解答】①硝酸钾的溶解度随着温度的降低而减小,把60℃的饱和硝酸钾溶液降温到20℃,有硝酸钾析出,溶质的质量减少,溶剂的质量不变,则溶液的质量减小,故选项说法错误。②硝酸钾的溶解度随着温度的降低而减小,把60℃的饱和硝酸钾溶液降温到20℃,有硝酸钾析出,溶质的质量减少,故选项说法错误。③硝酸钾的溶解度随着温度的降低而减小,把60℃的饱和硝酸钾溶液降温到20℃,有硝酸钾析出,溶质的质量减少,溶剂的质量不变,故选项说法正确。④硝酸钾的溶解度随着温度的降低而减小,把60℃的饱和硝酸钾溶液降温到20℃,有硝酸钾析出,不能继续溶解硝酸钾,仍是饱和状态,故选项说法正确。故③④说法正确.
故答案为:B.
【分析】60℃的硝酸钾饱和溶液降温到20℃,溶解度减小,溶质结晶析出,得到的溶液是20℃的饱和溶液,由于结晶,溶液中溶质减少,溶剂质量不变,溶液质量减少,溶质质量分数变小。
5.【答案】B
【解析】【解答】A. 食盐溶于水温度变化不大,故不符合题意。
B. 硝酸铵溶于水吸热,使溶液的温度明显下降,故符合题意。
C. 白糖溶于水温度变化不大,故不符合题意。
D. 氢氧化钠溶于放出大量的热,溶液温度明显升高,故不符合题意。
故答案为:B。
【分析】物质在溶解时经常伴随有吸热或放热现象,氢氧化钠固体、浓硫酸溶于放出大量的热,温度升高;硝酸铵固体溶于水吸热,温度降低;氯化钠、蔗糖等溶于水,温度变化不大。
6.【答案】D
【解析】【解答】A、 配制过程中使用到的玻璃仪器分别是烧杯、量筒、胶头滴管、玻璃棒,A不符合题意;
B、实验中发现氯化钠已经结块,为了较快地溶解,可以加入更多的水,则所配制溶液的溶质质量分数偏小,B不符合题意;
C、溶解氯化钠固体时,不断用玻璃棒搅拌,其目的是增大氯化钠在水中的溶解速率,C不符合题意;
D、若量取水时俯视读数,会导致实际量取水的体积偏小,则所配制溶液的溶质质量分数偏大,D符合题意。
故答案为:D。
【分析】A根据配置一定量溶质质量分数的溶液所需的仪器解答
B根据溶质质量等于溶液质量乘以溶质质量分数解,溶液质量等于溶质质量加水的质量解答
C根据溶解时玻璃棒的作用解答
D根据量取水时俯视读数会偏大解答
7.【答案】C
【解析】【解答】A、泥土不溶于水,不能和水形成均一、稳定的混合物,不能够形成溶液,A不符合题意;
B、面粉不溶于水,不能和水形成均一、稳定的混合物,不能够形成溶液,B不符合题意;
C、白糖易溶于水,形成均一、稳定的混合物,属于溶液,C符合题意;
D、汽油不溶于水,不能和水形成均一、稳定的混合物,不能够形成溶液,D不符合题意.
故答案为:C.
【分析】溶液是均一、稳定的混合物.
8.【答案】D
【解析】【解答】A. 在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度也不能确定,故A不符合题意;
B. 甲物质的溶解度曲线最陡,所以甲物质的溶解度随温度变化最大,故B不符合题意;
C. 27℃时,丙物质的溶解度是26g,所以往26g丙里加100g水,只能溶解26g的晶体,形成饱和溶液,故C不符合题意;
D. 通过分析溶解度曲线可知,33℃时,甲、乙两种物质溶解度相等,故D符合题意。
故答案为:D。
【分析】溶解度曲线上的点有三个方面的作用:根据已知温度查出有关物质的溶解度;根据物质的溶解度查出对应的温度;比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
9.【答案】C
【解析】【解答】A、60℃时,硝酸钾的溶解度为110g,则该温度下,10g水中最多可溶解溶质的质量为,则向水中加入5g硝酸钾,硝酸钾能全部溶解,则I中KNO3的质量分数为,该选项说法不符合题意;
B、Ⅱ中加入硝酸钾的质量共有5g+5g=10g<11g,则溶液为不饱和溶液,该选项说法不符合题意;
C、20℃时,硝酸钾的溶解度为31.6g,则该温度下10g水中最多可溶解硝酸钾的质量为,则Ⅲ中有KNO3晶体析出,该选项说法符合题意;
D、由前面分析可知,Ⅱ和Ⅲ中KNO3溶液的质量分数不同,该选项说法不符合题意。
故答案为:C。
【分析】A.60℃时硝酸钾的溶解度为110g;
B.60℃时硝酸钾的溶解度为110g,即10g水中溶解11g硝酸钾恰好饱和;
C.20℃时,硝酸钾的溶解度为31.6g;
D.根据计算。
10.【答案】B
【解析】【解答】A、碘微溶于水,不能用水清洗来清除碘,故选项错误;
B、碘可溶于酒精,能用于清洗碘;
C、碘易溶于苯,但是苯有毒,不能用于除去试管内的碘,故选项错误;
D、碘单质有毒,不能用加热使之升华的方法除去,故选项错误;
故实验室里除去试管内的碘最好选用酒精.
故选:B.
【分析】根据题意,结合碘在三种不同溶剂中的溶解性,结合碘单质有毒、苯(有毒),进行分析判断.
11.【答案】A
【解析】【解答】A、洗洁精能使油在水中分散成无数细小的液滴,而不聚集成大的油珠,油和水不再分层,利用了乳化的原理,故符合题意;
B、用水洗去水果渣没有利用乳化原理,故不符合题意;
C、碘可以溶解在酒精中,利用了溶解的原理,故不符合题意;
D、油污可以溶解在汽油中,利用了相似相溶的原理,故不符合题意。
故答案为:A
【分析】根据洗涤剂具有乳化功能分析
12.【答案】(1)不可再生;分子;-4
(2)
(3)气压一定时,温度越高,甲烷的溶解度越小(或温度一定时,气压越大,甲烷的溶解度越大)
【解析】【解答】(1)天然气是化石燃料,属于不可再生能源;
甲烷是由甲烷分子构成的;
化合物中各元素化合价代数和为零,设碳元素化合价为,,解得
(2)甲烷和氧气点燃生成二氧化碳和水,化学方程式为:
(3)由图像可判断温度升高曲线下滑,即气压一定时温度越高,甲烷的溶解度越小;同一温度时压强越大曲线的点越高即温度一定时,气压越大,甲烷的溶解度越大。
【分析】(1)根据天然气为不可再生能源,甲烷由分子构成,化合物中元素化合价代数和为0分析;
(2)根据甲烷和氧气点燃生成二氧化碳和水分析;
(3)根据图像中所给曲线随温度和压强的变化趋势分析。
13.【答案】偏小;无影响
【解析】【解答】用托盘天平称量所需的氯化钠,氯化钠与砝码位置放反(1g以下用游码),药品的实际质量=砝码质量-游码质量,则称得的氯化钠的质量变小,会导致所配制溶液的溶质质量分数偏小;由于溶液具有均一性,将配制好的溶液溅到外面,则溶液的质量分数不变。
【分析】托盘天平游码的质量永远加在右盘上。
14.【答案】(1)30;23
(2)4;36
(3)A
(4)BC
【解析】【解答】解:(1)由图1可知,20℃时,硝酸钾的溶解度为30g,在该温度下配制硝酸钾溶液,饱和溶液中溶质质量分数最大, ×100%≈23%;(2)配制40g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为40g×10%=4g,需要水的质量40g﹣4g=36g,由于水的密度是1g/mL,所以需要蒸馏水的体积是36mL;(3)要称量4g的硝酸钾,应分别在天平左右两盘放上纸片,防止药品沾在托盘上,调节平衡后,先移动游码到所需位置,再添加硝酸钾直到天平平衡;(4)量取所需蒸馏水要用到的仪器是量筒和胶头滴管;
故答案为:(1)30; 23;(2)4; 36;(3)A;(4)BC.
【分析】(1)据溶解度曲线可知某温度下物质的溶解度,饱和溶液中溶质的质量最大,计算式 ×100%分析解答;(2)溶质的质量=溶液的质量×溶质的质量分数,溶剂的质量=溶液的质量﹣溶质的质量,体积 ;(3)根据利用天平称量一定量物质的质量的步骤分析判断;(4)量取液体的体积要用到量筒和胶头滴管.
15.【答案】(1)乙
(2)饱和
(3)降温结晶
(4)70
【解析】【解答】(1)根据溶解度曲线图可以得出, 图1中溶解度随温度升高而减小的物是乙;
(2)P点在乙的溶解度曲线的上方,因此表示的乙溶液为饱和溶液;
(3)甲物质的溶解度随温度的升高而增大且受温度影响较大,乙物质的溶解度曲线随温度的升高而减小,若甲中混有少量的乙,可采取降温结晶的方法提纯甲物质;
(4)由图可知,t2℃时,甲物质的溶解度为40g,50g水中最多溶解20g,则形成溶液的质量为50g+20g=70g。
【分析】根据溶解度曲线可以得出,不同物质在同一温度下的溶解度,从而得出物质得出溶解性,同一物质在不同温度下的溶解度,从而得出物质的提纯方法,据此分析
16.【答案】解:设氢氧化钠的质量为xg,氢气的质量为yg.
2Na+2H2O=2NaOH+H2↑
46 80 2
4.6g x y
46:4.6g=80:x x=8.0g
46:4.6g=2:y y=0.2g
溶液中氢氧化钠的质量分数为:
答:氢氧化钠的质量是8.0g,反应后溶液中溶质的质量分数为8%。
【解析】【解答】这是一道利用化学方程式进行计算的试题,难度适中。非常明显,我们明白此反应没有在教材中出现过,但方程式已经给出了。只要牢记水是过量的,化学计算中是按照不过量的物质进行计算,所以(1)提出的氢氧化钠应该按照参与反应的金属钠的质量进行计算,列出相关的方程式和比例,不难可以求出氢氧化钠的质量为8.0g。关于溶质的质量分数,根据质量分数=溶质的质量/溶液的质量,此时水是过量的,我们无法再求水的质量就走弯路了,质量守恒定律告诉我们反应前后总质量不变,这个反应就产生了氢气,会使得溶液质量减少,故溶液的总质量=原来的总质量-氢气的质量,所以必须按照比例求出产生的氢气的质量为0.2g,所以溶液的质量是95.6+4.6-0.2=100g,这样就不难求得溶质的质量分数。详细解答过程如下:
解:设氢氧化钠的质量为xg,氢气的质量为yg.
2Na+2H2O=2NaOH+H2↑
46 80 2
4.6g x y
46:4.6g=80:x x=8.0g
46:4.6g=2:y y=0.2g
溶液中氢氧化钠的质量分数为:
答:氢氧化钠的质量是8.0g,反应后溶液中溶质的质量分数为8%。
【分析】巧妙地将化学方程式计算与溶质的质量分数联系起来,同学们一定要注意其中的质量关系。
1 / 1
一、单选题
1.下列不属于溶液的是( )
A.蒸馏水 B.食盐水 C.石灰水 D.蔗糖水
2.新制的凉开水不宜养鱼,其主要原因是凉开水中几乎不含()
A.氧分子 B.氧原子 C.氧元素 D.病菌
3.下列清洗方法中,利用乳化原理的是( )
A.用自来水洗手 B.用汽油清洗油污
C.用食醋除水垢 D.用洗涤剂清洗餐具
4.把60℃的饱和硝酸钾溶液降温到20℃,下列说法中正确的是( )
①溶液的质量不变 ②溶质的质量不变 ③溶剂的质量不变 ④仍是饱和状态
A.①和② B.③和④ C.①和③ D.②和④
5.下列物质溶于水时,溶液温度明显下降的是 ( )
A.食盐 B.硝酸铵 C.白糖 D.氢氧化钠
6.小亮用固体氯化钠配制80g溶质质量分数为10%的氯化钠溶液,有关他的实验操作,下列说法正确的是( )
A.配制过程中使用到的玻璃仪器分别是漏斗、玻璃棒、酒精灯、量筒、胶头滴管
B.实验中发现氯化钠已经结块,为了较快地溶解,可以加入更多的水
C.溶解氯化钠固体时,不断用玻璃棒搅拌,其目的是增大氯化钠在水中的溶解度
D.若量取水时俯视读数,其他操作均正确,则所配制溶液的溶质质量分数偏大
7.将少量物质分别放入水中,充分搅拌后能形成溶液的是( )
A.泥土 B.面粉 C.白糖 D.汽油
8.有关如图溶解度曲线,下列说法正确的是( )
A.甲、乙、丙三种物质的溶解度关系为S甲>S乙>S丙
B.乙物质的溶解度随温度变化最大
C.27℃时,往26g丙里加 100g水,形成不饱和溶液
D.33℃时,甲、乙两种物质溶解度相等
9.某同学按下图所示步骤进行实验,溶解度曲线如下图,下列说法正确的是( )
A.I中KNO3的质量分数50%
B.Ⅱ中溶液是60℃时KNO3的饱和溶液
C.Ⅲ中有KNO3晶体析出
D.Ⅱ和Ⅲ中KNO3溶液的质量分数相同
10.碘单质有毒,它在下列三种不同溶剂中的溶解性如表所示:
溶质 碘
溶剂 水 酒精 苯(有毒)
溶解性 微溶 可溶 易溶
由表中提供的信息判断,实验室里除去试管内的碘最好选用( )
A.水 B.酒精
C.苯 D.加热使之升华
11.洗涤与生活密切相关。下列洗涤方法中利用了乳化原理的是( )
A.用洗洁精洗去餐具上的油污
B.用水洗去盘子中的水果渣
C.用酒精除去附着在试管壁内的碘
D.用汽油除去衣服上的油污
二、非选择题
12.阅读下列短文,回答问题。
“深海一号”能源站是由我国自主研发建造的全球首座10万吨级深水半潜式生产储油平台。2021年6月25日,该平台正式投产,标志着中国从装备技术到勘探开发能力全面实现从300来到1500米超深水的跨越。2022年2月13日,中国海洋石油集团有限公司对外宣布,该平台2021年6月25日正式投产以来,累计生产天然气超10亿立方米。在保供季为海南自贸港和粤港澳大湾区建设提供了重要清洁能源来源。
(1)天然气属于 (填“可再生”或“不可再生”)能源,天然气的主要成分是甲烷(CH4),甲烷是由 (填“分子”、“原子”或“离子”)构成;已知甲烷中氢元素的化合价是+1,则碳元素的化合价是 。
(2)天然气之所以被称为清洁能源,是因为它完全燃烧时不产生污染物。请写出甲烷完全燃烧时的化学方程式 。
(3)甲烷的溶解度曲线如图(纵坐标表示每升水中溶解的甲烷体积),由图可以看出甲烷的溶解度规律是 (写出一点即可)。
13.配制50g溶质质量分数为5%的氯化钠溶液时,用托盘天平称量所需的氯化钠,氯化钠与砝码位置放反(1g以下用游码),则会导致所配制溶液的溶质质量分数 (选填“偏大”“偏小”或“无影响”,下同);如果不小心将配制好的溶液溅到外面溶液的质量分数 。
14.实验室需配制一定浓度的硝酸钾溶液.
(1)查阅硝酸钾溶解性.由图1可知,20℃时,硝酸钾的溶解度为 g,在该温度下配制硝酸钾溶液,溶质质量分数最大为 %(计算结果保留整数).
(2)计算.配制40g质量分数为10%的硝酸钾溶液,所需硝酸钾的质量为 g,所需蒸馏水的体积为 mL(水的密度近似看做1g/mL).
(3)称量.分别在天平左右两盘放上纸片,调节平衡后, .
A.先移动游码到所需位置,再添加硝酸钾直到天平平衡
B.先添加所需的硝酸钾,再移动游码直到天平平衡
(4)量取.量取所需蒸馏水要用到的仪器是 (填图2字母).
溶解.将称量好的硝酸钾和蒸馏水混合溶解.
五、综合题
15.图1所示为甲、乙两种固体物质的溶解度曲线。回答下列问题∶
(1)图1中溶解度随温度升高而减小的物质是 (填"甲"或"乙")。
(2)图中
P点表示的乙溶液为 (填"饱和"或"不饱和")溶液。
(3)若甲中混有少量的乙,可采取 的方法提纯甲物质。
(4)某同学进行了如图2 所示实验,得到相应的溶液 A、B、C,则溶液C 的质量为 g。
16.钠与水反应生成NaOH和H2(2Na+2H2O=2NaOH+H2↑),现向95.6克水中加入4.6克钠,充分反应(有水剩余)。
求:(1)生成NaOH的质量是多少?
(2)反应后溶液中溶质的质量分数是多少?
答案解析部分
1.【答案】A
【解析】【解答】A. 蒸馏水是纯净物不属于溶液,故符合题意;
B. 食盐水是均一、稳定的混合物,属于溶液;
C. 石灰水是均一、稳定的混合物,属于溶液;
D. 蔗糖水是均一、稳定的混合物,属于溶液。
故答案为:A。
【分析】溶液是混合物,具有均一性,稳定性。
2.【答案】A
【解析】【解答】鱼在水中生存需要氧气,氧气是由氧分子构成的,凉开水不宜养鱼,其主要原因是凉开水中几乎不含氧气,观察选项,
故答案为:A。
【分析】根据氧气的溶解性及帮助呼吸的性质分析。
3.【答案】D
【解析】【解答】A. 用自来水洗手,使附着在手上的泥土等污物与水形成溶液或浊液而被冲洗掉,不属于乳化作用,故不符合题意;
B. 用汽油清洗油污,利用的是汽油能溶解油污,用汽油清洗油污不是利用乳化原理,故不符合题意;
C. 用食醋清除水垢,利用的是醋酸能与水垢的成分碳酸钙、氢氧化镁等反应生成易溶于水的物质,不是利用乳化原理,故不符合题意;
D. 用洗涤剂清洗餐具上的油污是利用了洗涤剂对油污的乳化作用,故符合题意。
故答案为:D。
【分析】洗涤剂有个特殊性质,它能把一个个小油滴包围起来,让它们均匀地分散在水中,这种作用叫“乳化作用”。
4.【答案】B
【解析】【解答】①硝酸钾的溶解度随着温度的降低而减小,把60℃的饱和硝酸钾溶液降温到20℃,有硝酸钾析出,溶质的质量减少,溶剂的质量不变,则溶液的质量减小,故选项说法错误。②硝酸钾的溶解度随着温度的降低而减小,把60℃的饱和硝酸钾溶液降温到20℃,有硝酸钾析出,溶质的质量减少,故选项说法错误。③硝酸钾的溶解度随着温度的降低而减小,把60℃的饱和硝酸钾溶液降温到20℃,有硝酸钾析出,溶质的质量减少,溶剂的质量不变,故选项说法正确。④硝酸钾的溶解度随着温度的降低而减小,把60℃的饱和硝酸钾溶液降温到20℃,有硝酸钾析出,不能继续溶解硝酸钾,仍是饱和状态,故选项说法正确。故③④说法正确.
故答案为:B.
【分析】60℃的硝酸钾饱和溶液降温到20℃,溶解度减小,溶质结晶析出,得到的溶液是20℃的饱和溶液,由于结晶,溶液中溶质减少,溶剂质量不变,溶液质量减少,溶质质量分数变小。
5.【答案】B
【解析】【解答】A. 食盐溶于水温度变化不大,故不符合题意。
B. 硝酸铵溶于水吸热,使溶液的温度明显下降,故符合题意。
C. 白糖溶于水温度变化不大,故不符合题意。
D. 氢氧化钠溶于放出大量的热,溶液温度明显升高,故不符合题意。
故答案为:B。
【分析】物质在溶解时经常伴随有吸热或放热现象,氢氧化钠固体、浓硫酸溶于放出大量的热,温度升高;硝酸铵固体溶于水吸热,温度降低;氯化钠、蔗糖等溶于水,温度变化不大。
6.【答案】D
【解析】【解答】A、 配制过程中使用到的玻璃仪器分别是烧杯、量筒、胶头滴管、玻璃棒,A不符合题意;
B、实验中发现氯化钠已经结块,为了较快地溶解,可以加入更多的水,则所配制溶液的溶质质量分数偏小,B不符合题意;
C、溶解氯化钠固体时,不断用玻璃棒搅拌,其目的是增大氯化钠在水中的溶解速率,C不符合题意;
D、若量取水时俯视读数,会导致实际量取水的体积偏小,则所配制溶液的溶质质量分数偏大,D符合题意。
故答案为:D。
【分析】A根据配置一定量溶质质量分数的溶液所需的仪器解答
B根据溶质质量等于溶液质量乘以溶质质量分数解,溶液质量等于溶质质量加水的质量解答
C根据溶解时玻璃棒的作用解答
D根据量取水时俯视读数会偏大解答
7.【答案】C
【解析】【解答】A、泥土不溶于水,不能和水形成均一、稳定的混合物,不能够形成溶液,A不符合题意;
B、面粉不溶于水,不能和水形成均一、稳定的混合物,不能够形成溶液,B不符合题意;
C、白糖易溶于水,形成均一、稳定的混合物,属于溶液,C符合题意;
D、汽油不溶于水,不能和水形成均一、稳定的混合物,不能够形成溶液,D不符合题意.
故答案为:C.
【分析】溶液是均一、稳定的混合物.
8.【答案】D
【解析】【解答】A. 在比较物质的溶解度时,需要指明温度,温度不能确定,溶解度也不能确定,故A不符合题意;
B. 甲物质的溶解度曲线最陡,所以甲物质的溶解度随温度变化最大,故B不符合题意;
C. 27℃时,丙物质的溶解度是26g,所以往26g丙里加100g水,只能溶解26g的晶体,形成饱和溶液,故C不符合题意;
D. 通过分析溶解度曲线可知,33℃时,甲、乙两种物质溶解度相等,故D符合题意。
故答案为:D。
【分析】溶解度曲线上的点有三个方面的作用:根据已知温度查出有关物质的溶解度;根据物质的溶解度查出对应的温度;比较相同温度下不同物质溶解度的大小或者饱和溶液中溶质的质量分数的大小。
9.【答案】C
【解析】【解答】A、60℃时,硝酸钾的溶解度为110g,则该温度下,10g水中最多可溶解溶质的质量为,则向水中加入5g硝酸钾,硝酸钾能全部溶解,则I中KNO3的质量分数为,该选项说法不符合题意;
B、Ⅱ中加入硝酸钾的质量共有5g+5g=10g<11g,则溶液为不饱和溶液,该选项说法不符合题意;
C、20℃时,硝酸钾的溶解度为31.6g,则该温度下10g水中最多可溶解硝酸钾的质量为,则Ⅲ中有KNO3晶体析出,该选项说法符合题意;
D、由前面分析可知,Ⅱ和Ⅲ中KNO3溶液的质量分数不同,该选项说法不符合题意。
故答案为:C。
【分析】A.60℃时硝酸钾的溶解度为110g;
B.60℃时硝酸钾的溶解度为110g,即10g水中溶解11g硝酸钾恰好饱和;
C.20℃时,硝酸钾的溶解度为31.6g;
D.根据计算。
10.【答案】B
【解析】【解答】A、碘微溶于水,不能用水清洗来清除碘,故选项错误;
B、碘可溶于酒精,能用于清洗碘;
C、碘易溶于苯,但是苯有毒,不能用于除去试管内的碘,故选项错误;
D、碘单质有毒,不能用加热使之升华的方法除去,故选项错误;
故实验室里除去试管内的碘最好选用酒精.
故选:B.
【分析】根据题意,结合碘在三种不同溶剂中的溶解性,结合碘单质有毒、苯(有毒),进行分析判断.
11.【答案】A
【解析】【解答】A、洗洁精能使油在水中分散成无数细小的液滴,而不聚集成大的油珠,油和水不再分层,利用了乳化的原理,故符合题意;
B、用水洗去水果渣没有利用乳化原理,故不符合题意;
C、碘可以溶解在酒精中,利用了溶解的原理,故不符合题意;
D、油污可以溶解在汽油中,利用了相似相溶的原理,故不符合题意。
故答案为:A
【分析】根据洗涤剂具有乳化功能分析
12.【答案】(1)不可再生;分子;-4
(2)
(3)气压一定时,温度越高,甲烷的溶解度越小(或温度一定时,气压越大,甲烷的溶解度越大)
【解析】【解答】(1)天然气是化石燃料,属于不可再生能源;
甲烷是由甲烷分子构成的;
化合物中各元素化合价代数和为零,设碳元素化合价为,,解得
(2)甲烷和氧气点燃生成二氧化碳和水,化学方程式为:
(3)由图像可判断温度升高曲线下滑,即气压一定时温度越高,甲烷的溶解度越小;同一温度时压强越大曲线的点越高即温度一定时,气压越大,甲烷的溶解度越大。
【分析】(1)根据天然气为不可再生能源,甲烷由分子构成,化合物中元素化合价代数和为0分析;
(2)根据甲烷和氧气点燃生成二氧化碳和水分析;
(3)根据图像中所给曲线随温度和压强的变化趋势分析。
13.【答案】偏小;无影响
【解析】【解答】用托盘天平称量所需的氯化钠,氯化钠与砝码位置放反(1g以下用游码),药品的实际质量=砝码质量-游码质量,则称得的氯化钠的质量变小,会导致所配制溶液的溶质质量分数偏小;由于溶液具有均一性,将配制好的溶液溅到外面,则溶液的质量分数不变。
【分析】托盘天平游码的质量永远加在右盘上。
14.【答案】(1)30;23
(2)4;36
(3)A
(4)BC
【解析】【解答】解:(1)由图1可知,20℃时,硝酸钾的溶解度为30g,在该温度下配制硝酸钾溶液,饱和溶液中溶质质量分数最大, ×100%≈23%;(2)配制40g质量分数为10%的硝酸钾溶液,所需硝酸钾质量为40g×10%=4g,需要水的质量40g﹣4g=36g,由于水的密度是1g/mL,所以需要蒸馏水的体积是36mL;(3)要称量4g的硝酸钾,应分别在天平左右两盘放上纸片,防止药品沾在托盘上,调节平衡后,先移动游码到所需位置,再添加硝酸钾直到天平平衡;(4)量取所需蒸馏水要用到的仪器是量筒和胶头滴管;
故答案为:(1)30; 23;(2)4; 36;(3)A;(4)BC.
【分析】(1)据溶解度曲线可知某温度下物质的溶解度,饱和溶液中溶质的质量最大,计算式 ×100%分析解答;(2)溶质的质量=溶液的质量×溶质的质量分数,溶剂的质量=溶液的质量﹣溶质的质量,体积 ;(3)根据利用天平称量一定量物质的质量的步骤分析判断;(4)量取液体的体积要用到量筒和胶头滴管.
15.【答案】(1)乙
(2)饱和
(3)降温结晶
(4)70
【解析】【解答】(1)根据溶解度曲线图可以得出, 图1中溶解度随温度升高而减小的物是乙;
(2)P点在乙的溶解度曲线的上方,因此表示的乙溶液为饱和溶液;
(3)甲物质的溶解度随温度的升高而增大且受温度影响较大,乙物质的溶解度曲线随温度的升高而减小,若甲中混有少量的乙,可采取降温结晶的方法提纯甲物质;
(4)由图可知,t2℃时,甲物质的溶解度为40g,50g水中最多溶解20g,则形成溶液的质量为50g+20g=70g。
【分析】根据溶解度曲线可以得出,不同物质在同一温度下的溶解度,从而得出物质得出溶解性,同一物质在不同温度下的溶解度,从而得出物质的提纯方法,据此分析
16.【答案】解:设氢氧化钠的质量为xg,氢气的质量为yg.
2Na+2H2O=2NaOH+H2↑
46 80 2
4.6g x y
46:4.6g=80:x x=8.0g
46:4.6g=2:y y=0.2g
溶液中氢氧化钠的质量分数为:
答:氢氧化钠的质量是8.0g,反应后溶液中溶质的质量分数为8%。
【解析】【解答】这是一道利用化学方程式进行计算的试题,难度适中。非常明显,我们明白此反应没有在教材中出现过,但方程式已经给出了。只要牢记水是过量的,化学计算中是按照不过量的物质进行计算,所以(1)提出的氢氧化钠应该按照参与反应的金属钠的质量进行计算,列出相关的方程式和比例,不难可以求出氢氧化钠的质量为8.0g。关于溶质的质量分数,根据质量分数=溶质的质量/溶液的质量,此时水是过量的,我们无法再求水的质量就走弯路了,质量守恒定律告诉我们反应前后总质量不变,这个反应就产生了氢气,会使得溶液质量减少,故溶液的总质量=原来的总质量-氢气的质量,所以必须按照比例求出产生的氢气的质量为0.2g,所以溶液的质量是95.6+4.6-0.2=100g,这样就不难求得溶质的质量分数。详细解答过程如下:
解:设氢氧化钠的质量为xg,氢气的质量为yg.
2Na+2H2O=2NaOH+H2↑
46 80 2
4.6g x y
46:4.6g=80:x x=8.0g
46:4.6g=2:y y=0.2g
溶液中氢氧化钠的质量分数为:
答:氢氧化钠的质量是8.0g,反应后溶液中溶质的质量分数为8%。
【分析】巧妙地将化学方程式计算与溶质的质量分数联系起来,同学们一定要注意其中的质量关系。
1 / 1
同课章节目录
