第九单元 溶液 复习检测题 (含答案) 2023-2024学年人教版九年级化学下册
文档属性
| 名称 | 第九单元 溶液 复习检测题 (含答案) 2023-2024学年人教版九年级化学下册 |  | |
| 格式 | docx | ||
| 文件大小 | 225.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 19:29:28 | ||
图片预览


文档简介
第九单元 溶液 复习检测题
一、选择题
1.下列有关溶液的说法错误的是( )
A.溶液不一定是无色透明的 B.溶液是均一稳定的混合物
C.面粉与水混合不能形成溶液 D.不饱和溶液一定是稀溶液
2.小明向如图所示的烧杯中加入一种物质,充分搅拌后,发现烧杯底部的塑料片与烧杯粘在一起了。他加入的物质可能是( )
A.蔗糖
B.食盐
C.硝酸铵固体
D.浓硫酸
3.水是常用的溶剂,某同学进行如图物质溶解性的实验。下列关于该实验的说法错误的是( )
A.试管①中加入红墨水的目的是为了便于观察现象
B.振荡试管②后静置,观察到液体分层
C.对比试管②、③中的现象,可知溶剂种类影响物质的溶解性
D.由该实验可以得出溶质可以是固体或液体
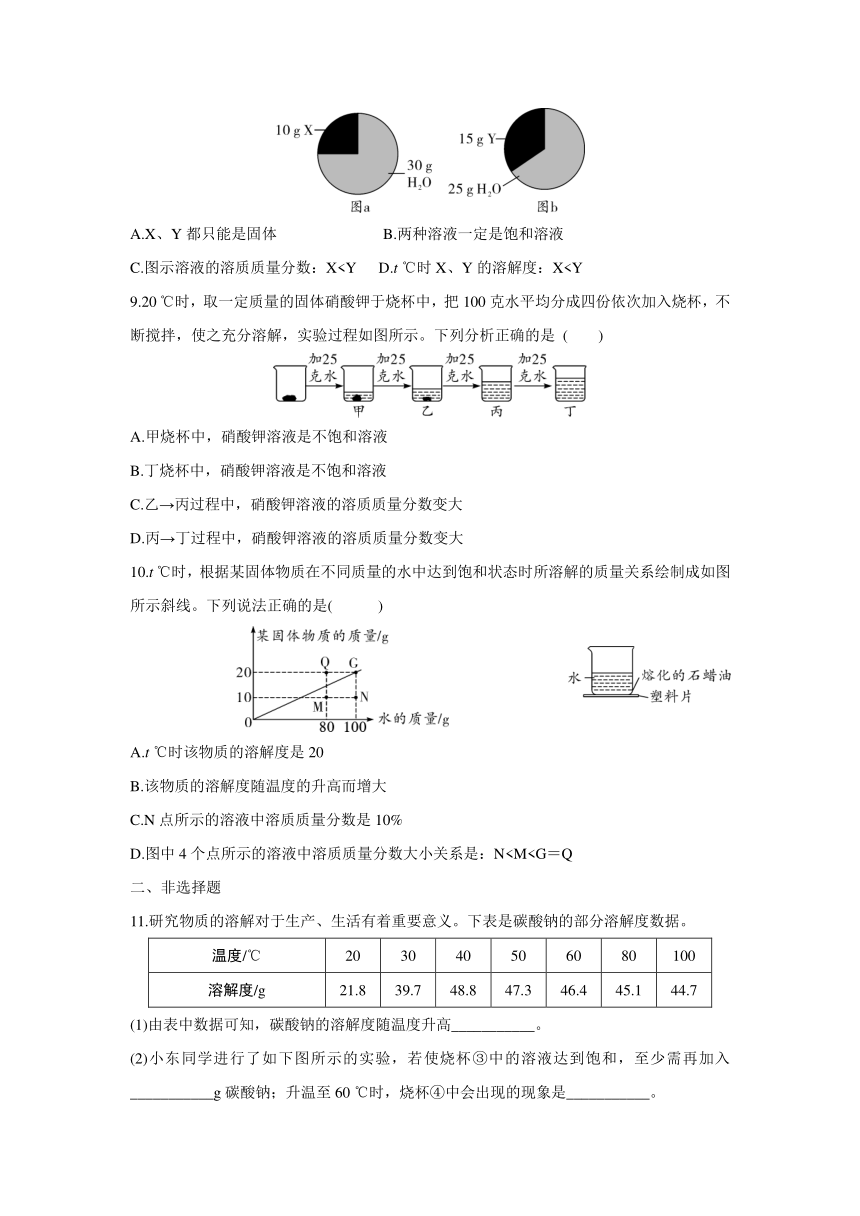
4.甲、乙两种固体的溶解度曲线如图所示。下列说法正确的是( )
A.甲和乙两种物质的溶解度相等
B.t1 ℃时甲溶液中溶质和溶剂的质量比为3:10
C.t2 ℃时,在100 g水中加入50 g乙物质能得到该物质的饱和溶液
D.将t1 ℃时甲、乙两种物质的饱和溶液升温至t2 ℃(溶剂量不变),所得溶液溶质质量分数大小关系为甲>乙
5.利用传统的海水晒盐工艺,可以得到氯化钠和氯化镁。如图是氯化钠和氯化镁的溶解度曲线,下列说法正确的是( )
A.将t ℃时氯化镁溶液降低温度,溶质质量可能不变
B.t ℃时,氯化镁饱和溶液中溶质的质量分数为70%
C.t ℃时,无法配制相同浓度的氯化镁溶液和氯化钠溶液
D.t ℃时,饱和氯化镁溶液中溶质质量比饱和氯化钠溶液中溶质质量大
6.20 ℃时,NaCl的溶解度为36 g。配制此温度下20 g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5 g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
7.T1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图一所示。硝酸钾和氯化钾的溶解度曲线如图二所示。下列说法错误的是( )
A.烧杯乙中上层清液是饱和溶液
B.烧杯甲中溶解的溶质是氯化钾
C.烧杯甲中溶液溶质的质量分数大于烧杯乙中溶液溶质的质量分数
D.将温度由T1 ℃升高到T2 ℃,充分搅拌,烧杯乙中固体不一定全部溶解
8.在t ℃时,将X、Y两种物质分别完全溶于水,溶液中X、Y与水的质量关系分别如图a、图b所示。下列说法正确的是 ( )
A.X、Y都只能是固体 B.两种溶液一定是饱和溶液
C.图示溶液的溶质质量分数:X9.20 ℃时,取一定质量的固体硝酸钾于烧杯中,把100克水平均分成四份依次加入烧杯,不断搅拌,使之充分溶解,实验过程如图所示。下列分析正确的是 ( )
A.甲烧杯中,硝酸钾溶液是不饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
10.t ℃时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量关系绘制成如图所示斜线。下列说法正确的是( )
A.t ℃时该物质的溶解度是20
B.该物质的溶解度随温度的升高而增大
C.N点所示的溶液中溶质质量分数是10%
D.图中4个点所示的溶液中溶质质量分数大小关系是:N二、非选择题
11.研究物质的溶解对于生产、生活有着重要意义。下表是碳酸钠的部分溶解度数据。
温度/℃ 20 30 40 50 60 80 100
溶解度/g 21.8 39.7 48.8 47.3 46.4 45.1 44.7
(1)由表中数据可知,碳酸钠的溶解度随温度升高___________。
(2)小东同学进行了如下图所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入___________g碳酸钠;升温至60 ℃时,烧杯④中会出现的现象是___________。
12.根据如图所示实验回答问题。
(1)甲是氯化钠溶解的实验,一段时间后氯化钠“消失”在水中,是因为氯化钠在溶液中以___________(填微粒符号)的形式存在。
(2)乙是验证温度对溶解速率影响的实验,两支试管中加入的溶剂应满足的条件是___________。
(3)丙是配制80 g 16%氯化钠溶液的实验,请指出该过程中的一处错误___________,此错误会导致所配制溶液的溶质质量分数________(填“偏大”“偏小”或“不变”)。
13.某校研究性学习小组的同学设计了一个对比实验,探究物质溶于水时是放出热量还是吸收热量。向下图A、B、C三个实验装置中盛有一定量水的小试管里依次加入固体NaCl、NH4NO3、NaOH(加入固体物质之前,三个实验装置中U形管两端的液面持平)。
(1)请你帮他们填写下表。
A B C
现象
原因
(2)从上述物质溶解于水的对比实验中你得出的初步结论是______________。
14.下图是小华配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
(1)上图中的玻璃仪器分别是广口瓶、量筒、 和玻璃棒,其中玻璃棒在此操作中的作用是 。
(2)指出图②中的一处错误操作 。
(3)通过计算确定需要水的质量是 g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。
(4)用上述图示的序号表示配制溶液的操作顺序 。
15.某同学用溶质质量分数为15%的稀盐酸和大理石反应来制取二氧化碳气体:
(1)用20.3 g溶质质量分数为37%的浓盐酸能配制上述稀盐酸___________g(结果精确到1 g)。
(2)若需收集10瓶(每瓶以125 mL计算)二氧化碳气体,问至少需要多少克上述稀盐酸与足量的大理石反应才能制得(实验条件下二氧化碳的密度为2 g/L)?(写出计算过程,结果精确到0.01 g)
参考答案
1.D 2.C 3.C 4.C 5.A 6.C 7.D 8.C 9.B 10.D
11.(1)先增大后减小 (2)1.8 有晶体析出(或变浑浊等合理即可)
12.(1)Na+、Cl- (2)体积相同,种类相同,温度不同且差距明显 (3)量取水时仰视读数(或称量时,天平左盘放砝码,右盘放药品) 偏小
13.(1)
A B C
现象 a、b两液面持平 C液面上升、d液面下降 E液面下降、f液面上升
原因 吸收热量等于放出热量,溶液温度不变 吸收热量大于放出热量,溶液温度降低 吸收热量小于放出热量,溶液温度升高
(2)物质溶解时通常伴随热量的变化(或温度的改变)
14.(1)烧杯 不断搅拌,加速溶解(其它合理答案也可) (2)物品与砝码放错位置(其它合理答案也可) (3)95 100 (4)④②①③⑤
15. (1)50
(2)10瓶二氧化碳的质量为125×10×0.001L×2g/L=2.5g
设需要稀盐酸的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
x×15% 2.5g
=
x=27.65g
答:需要27.65克15%的稀盐酸。
一、选择题
1.下列有关溶液的说法错误的是( )
A.溶液不一定是无色透明的 B.溶液是均一稳定的混合物
C.面粉与水混合不能形成溶液 D.不饱和溶液一定是稀溶液
2.小明向如图所示的烧杯中加入一种物质,充分搅拌后,发现烧杯底部的塑料片与烧杯粘在一起了。他加入的物质可能是( )
A.蔗糖
B.食盐
C.硝酸铵固体
D.浓硫酸
3.水是常用的溶剂,某同学进行如图物质溶解性的实验。下列关于该实验的说法错误的是( )
A.试管①中加入红墨水的目的是为了便于观察现象
B.振荡试管②后静置,观察到液体分层
C.对比试管②、③中的现象,可知溶剂种类影响物质的溶解性
D.由该实验可以得出溶质可以是固体或液体
4.甲、乙两种固体的溶解度曲线如图所示。下列说法正确的是( )
A.甲和乙两种物质的溶解度相等
B.t1 ℃时甲溶液中溶质和溶剂的质量比为3:10
C.t2 ℃时,在100 g水中加入50 g乙物质能得到该物质的饱和溶液
D.将t1 ℃时甲、乙两种物质的饱和溶液升温至t2 ℃(溶剂量不变),所得溶液溶质质量分数大小关系为甲>乙
5.利用传统的海水晒盐工艺,可以得到氯化钠和氯化镁。如图是氯化钠和氯化镁的溶解度曲线,下列说法正确的是( )
A.将t ℃时氯化镁溶液降低温度,溶质质量可能不变
B.t ℃时,氯化镁饱和溶液中溶质的质量分数为70%
C.t ℃时,无法配制相同浓度的氯化镁溶液和氯化钠溶液
D.t ℃时,饱和氯化镁溶液中溶质质量比饱和氯化钠溶液中溶质质量大
6.20 ℃时,NaCl的溶解度为36 g。配制此温度下20 g质量分数为5%的NaCl溶液,下列说法正确的是( )
A.配制该溶液需要5 g NaCl
B.该溶液为饱和溶液
C.将该溶液长时间敞口放置,最终有晶体析出
D.配溶液时,量取所需体积的水倒入烧杯,有少量水洒出,则所配溶液浓度小于5%
7.T1 ℃时,将等质量的硝酸钾和氯化钾分别加入到各盛有100 g水的两个烧杯中,充分搅拌后现象如图一所示。硝酸钾和氯化钾的溶解度曲线如图二所示。下列说法错误的是( )
A.烧杯乙中上层清液是饱和溶液
B.烧杯甲中溶解的溶质是氯化钾
C.烧杯甲中溶液溶质的质量分数大于烧杯乙中溶液溶质的质量分数
D.将温度由T1 ℃升高到T2 ℃,充分搅拌,烧杯乙中固体不一定全部溶解
8.在t ℃时,将X、Y两种物质分别完全溶于水,溶液中X、Y与水的质量关系分别如图a、图b所示。下列说法正确的是 ( )
A.X、Y都只能是固体 B.两种溶液一定是饱和溶液
C.图示溶液的溶质质量分数:X
A.甲烧杯中,硝酸钾溶液是不饱和溶液
B.丁烧杯中,硝酸钾溶液是不饱和溶液
C.乙→丙过程中,硝酸钾溶液的溶质质量分数变大
D.丙→丁过程中,硝酸钾溶液的溶质质量分数变大
10.t ℃时,根据某固体物质在不同质量的水中达到饱和状态时所溶解的质量关系绘制成如图所示斜线。下列说法正确的是( )
A.t ℃时该物质的溶解度是20
B.该物质的溶解度随温度的升高而增大
C.N点所示的溶液中溶质质量分数是10%
D.图中4个点所示的溶液中溶质质量分数大小关系是:N
11.研究物质的溶解对于生产、生活有着重要意义。下表是碳酸钠的部分溶解度数据。
温度/℃ 20 30 40 50 60 80 100
溶解度/g 21.8 39.7 48.8 47.3 46.4 45.1 44.7
(1)由表中数据可知,碳酸钠的溶解度随温度升高___________。
(2)小东同学进行了如下图所示的实验,若使烧杯③中的溶液达到饱和,至少需再加入___________g碳酸钠;升温至60 ℃时,烧杯④中会出现的现象是___________。
12.根据如图所示实验回答问题。
(1)甲是氯化钠溶解的实验,一段时间后氯化钠“消失”在水中,是因为氯化钠在溶液中以___________(填微粒符号)的形式存在。
(2)乙是验证温度对溶解速率影响的实验,两支试管中加入的溶剂应满足的条件是___________。
(3)丙是配制80 g 16%氯化钠溶液的实验,请指出该过程中的一处错误___________,此错误会导致所配制溶液的溶质质量分数________(填“偏大”“偏小”或“不变”)。
13.某校研究性学习小组的同学设计了一个对比实验,探究物质溶于水时是放出热量还是吸收热量。向下图A、B、C三个实验装置中盛有一定量水的小试管里依次加入固体NaCl、NH4NO3、NaOH(加入固体物质之前,三个实验装置中U形管两端的液面持平)。
(1)请你帮他们填写下表。
A B C
现象
原因
(2)从上述物质溶解于水的对比实验中你得出的初步结论是______________。
14.下图是小华配制100g溶质质量分数为5%的NaCl溶液的实验操作示意图:
(1)上图中的玻璃仪器分别是广口瓶、量筒、 和玻璃棒,其中玻璃棒在此操作中的作用是 。
(2)指出图②中的一处错误操作 。
(3)通过计算确定需要水的质量是 g,配制时应选择 (填10、50或100)mL的量筒量取所需要的水。
(4)用上述图示的序号表示配制溶液的操作顺序 。
15.某同学用溶质质量分数为15%的稀盐酸和大理石反应来制取二氧化碳气体:
(1)用20.3 g溶质质量分数为37%的浓盐酸能配制上述稀盐酸___________g(结果精确到1 g)。
(2)若需收集10瓶(每瓶以125 mL计算)二氧化碳气体,问至少需要多少克上述稀盐酸与足量的大理石反应才能制得(实验条件下二氧化碳的密度为2 g/L)?(写出计算过程,结果精确到0.01 g)
参考答案
1.D 2.C 3.C 4.C 5.A 6.C 7.D 8.C 9.B 10.D
11.(1)先增大后减小 (2)1.8 有晶体析出(或变浑浊等合理即可)
12.(1)Na+、Cl- (2)体积相同,种类相同,温度不同且差距明显 (3)量取水时仰视读数(或称量时,天平左盘放砝码,右盘放药品) 偏小
13.(1)
A B C
现象 a、b两液面持平 C液面上升、d液面下降 E液面下降、f液面上升
原因 吸收热量等于放出热量,溶液温度不变 吸收热量大于放出热量,溶液温度降低 吸收热量小于放出热量,溶液温度升高
(2)物质溶解时通常伴随热量的变化(或温度的改变)
14.(1)烧杯 不断搅拌,加速溶解(其它合理答案也可) (2)物品与砝码放错位置(其它合理答案也可) (3)95 100 (4)④②①③⑤
15. (1)50
(2)10瓶二氧化碳的质量为125×10×0.001L×2g/L=2.5g
设需要稀盐酸的质量为x。
CaCO3+2HCl=CaCl2+H2O+CO2↑
73 44
x×15% 2.5g
=
x=27.65g
答:需要27.65克15%的稀盐酸。
同课章节目录
