化学人教版(2019)修第二册6.2.1化学反应的速率(共36张ppt)
文档属性
| 名称 | 化学人教版(2019)修第二册6.2.1化学反应的速率(共36张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 33.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 00:00:00 | ||
图片预览











文档简介
(共36张PPT)
第六章
化学反应与能量
第二节 化学反应的速率与限度
课时1 化学反应的速率
学习目标
1. 掌握化学反应速率的概念和表示方法;
2.能够进行化学反应速率的简单计算。
思考讨论
在化学实验和日常生活中,我们经常观察到这样的现象:有的反应进行的快,有的进行的慢。
爆炸
牛奶变质
钢铁生锈
溶洞形成
哪个反应更快?
思考讨论
在化学实验中,有哪些观察化学反应快慢(定性)的方法
气泡的快慢
浑浊的快慢
固体消失的快慢
颜色的变化
在科学研究和实际应用中,
如何对化学反应进行的快慢进行定量的描述或比较?
化学反应速率
那么化学上又是如何判断一个化学反应的快慢的呢?
在物理中我们是如何定量地判断一个物体移动速度快慢的?
用速度来描述:单位时间内物体移动的距离的大小
v =
△s
△t
一、化学反应速率
1.表示:通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
(1)计算公式
(2)常用单位
mol/(L·min) 或 mol/(L·s)
或mol·L-1·min-1
60mol/(L·min) =1mol/(L·s)
思考讨论
思考1:在某一化学反应中,已知反应物A的浓度在10 s内从4 mol/L变成1 mol/L。则在这10 s内用A表示的化学反应速率为多少?
v(A)
c(A)
t
=
=
4 mol·L-1–1 mol·L-1
10 s
3 mol·L-1
10 s
0.3 mol·L-1·s-1
=
=
问:第10s的反应速率为多少?
无法确定
思考2: 一个化学反应的速率可以用任何一种反应物或生成物表示吗
提示:纯固体或纯液体的浓度变化为0,一般不能用来表示速率。
注意:1. 固体或纯液体(液态水、液溴等)浓度为常数Δc=0,不用固体或纯液体表示化学反应速率
2. 化学反应速率是一段时间内平均反应速率而不是某一时刻的瞬时速率
1. 判断正误,正确的划“√”,错误的划“ ”
(1)对于任何化学反应来说,反应速率越大,反应现象就越明显( )
(2)化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加( )
(3)化学反应速率为0.8mol·L-1·s-1是指1s时某物质的浓度为0.8mol·L-1( )
(4)由v=Δt(Δc)计算平均速率,反应物表示为正值,生成物表示为负值( )
×
×
×
×
△C (mol/L)
思考讨论
【例1】在1L的密闭容器中,加入8molN2和20mol H2,发生N2 + 3H2 2NH3,在5min末时,测得容器中含有6mol的N2,求该反应的化学反应速率。
N2 + 3H2 2NH3
起始浓度(mol/L) 8 20 0
5min末浓度(mol/L)
6
v(N2)= 2/5=0.4mol/(L·min)
v(H2)= 6/5=1.2mol/(L·min)
v(NH3)= 4/5=0.8mol/(L·min)
4
2
6
结论1: 同一反应的反应速率可以用不同的物质表示,其数值可能不同,但所表示的意义是相同的。在表示反应速率时,应注明是由哪种物质表示的。
思考讨论
【例1】在1L的密闭容器中,加入8molN2和20mol H2,发生N2 + 3H2 2NH3,在5min末时,测得容器中含有6mol的N2,求该反应的化学反应速率。
N2 + 3H2 2NH3
起始浓度(mol/L) 8 20 0
5min末浓度(mol/L)
6
v(N2)= 2/5=0.4mol/(L·min)
v(H2)= 6/5=1.2mol/(L·min)
v(NH3)= 4/5=0.8mol/(L·min)
4
2
△C (mol/L)
6
由以上可知∶ V(N2): V(H2 ): V(NH3)= 0.4 : 1.2 : 0.8 = 1 : 3 : 2
结论2: 同一反应中,各物质的反应速率之比等于其化学方程式中的化学计量数之比。即对于反应:aA+bB=cC+dD vA:vB:vC:vD = a : b : c : d
【例2】反应 A(g) + 3B(g) = 2C(g) + 2D (g) 在四种不同情况下的反应速率为:①v(A)=0.45mol·L-1·min-1 ②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1 ④v(D)=0.45mol·L-1·s-1
则该反应速率的快慢顺序为_____________________
归一法:先统一单位,换算成同一物质表示的反应速率,再比较数值的大小。
比值法:比较化学反应速率与化学计量数的比值,比值越大化学反应速率越大。
④>③=②>①
对于反应:aA+bB==dD+eE,用不同的物质表示速率满足关系:
v(A)∶v(B)∶v(D)∶v(E)=a∶b∶d∶e 即
方法指导:
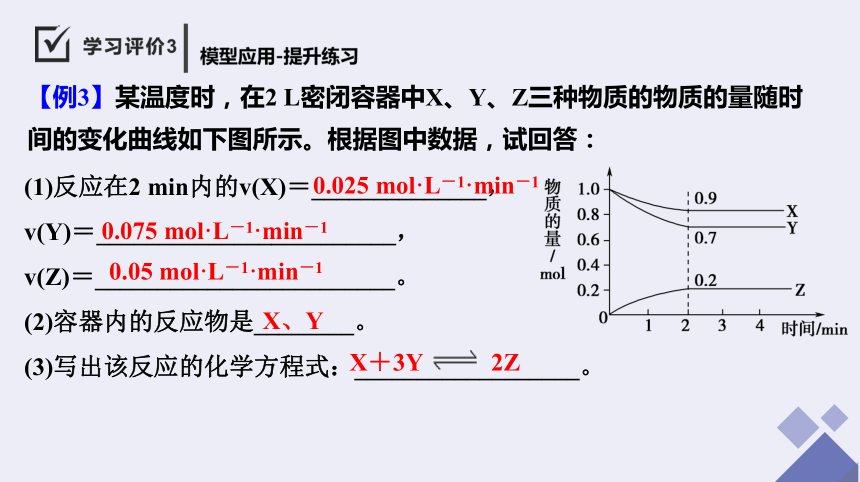
【例3】某温度时,在2 L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如下图所示。根据图中数据,试回答:
(1)反应在2 min内的v(X)=______________,
v(Y)=________________________,
v(Z)=________________________。
(2)容器内的反应物是________。
(3)写出该反应的化学方程式:__________________。
0.025 mol·L-1·min-1
0.075 mol·L-1·min-1
0.05 mol·L-1·min-1
X、Y
X+3Y 2Z
①化学反应速率是标量,反应速率都为正数。
②一段时间内的平均速率,而不是指瞬时速率。
③一般不用固体或纯液体(其浓度是常数)表示化学反应速率。
④用不同物质表示的化学反应速率之比等于化学计量数之比
反应:mA + nB == pC + qD
v(A): v(B): v(C): v(D)==m:n:p:q
⑤用不同物质表示的化学反应速率,其值不一定相同,但其表示反应的快慢程度相同——指明具体物质v(A)
化学反应速率
影响化学反应速率的因素
爆炸
牛奶变质
钢铁生锈
溶洞形成
如何减慢牛奶变质的速率?
对于有些化学反应,我们希望其越慢越好,如食物的变质、橡胶和塑料的老化、金属的锈蚀;有些则希望其快一些,如氨、硫酸等化工产品的生产。调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
影响化学反应速率的因素
在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,速率最快的是:A 镁 B 铝 C 钠 D 铁
1.内因:反应物本身的性质(决定因素)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
√
2.外因:
浓度?
温度?
压强?
催化剂?
物质的形状?
实验探究—温度对反应速率的影响
实验探究
实验探究—温度对反应速率的影响
【实验操作】
试管内均盛有 2mL 5% 的 H2O2溶液,并滴有 2 滴 1 mol/L FeCl3溶液
【实验现象】
两支试管中均有气泡产生,但热水中产生气泡更快
【实验结论】
其他条件相同时,升高温度,反应速率加快;降低温度,反应速率减小
不管吸热反应还是放热反应,升高温度,都加快反应速率
实验探究—温度对反应速率的影响
实验探究
实验探究—浓度对反应速率的影响
【实验现象】
两支试管中均有气泡产生,但装1 mol/L盐酸的试管产生气泡更快
【实验结论】
其他条件相同时,增大浓度,反应速率加快;降低浓度,反应速率减小
当其他条件相同时,增大反应物浓度,化学反应速率增大。
思考3:铁粉与一定浓度的稀盐酸反应时,增加铁粉的用量能否加快化学反应速率?
提示:不能。对于固态或纯液态物质。
实验探究—温度对反应速率的影响
实验探究
实验探究—催化剂对反应速率的影响
【实验现象】三支试管中均有气泡产生,产生气泡的速率:①>②>③
【实验结论】催化剂可以改变反应速率,不同催化剂催化效果不同
催化剂(正)能加快化学反应速率
压强对反应速率的影响
其他条件不变时,对于有气体参与的反应:
有气体参加的反应,改变压强时,只有导致参加反应的气体浓度改变,反应速率才会改变
思考讨论
思考4:对于恒温恒容密闭容器内有气体参加的化学反应,若充入Ar气,化学反应速率如何变化?
提示:若通入Ar气,容器内反应物的浓度不变,化学反应速率不变。
思考5:对于恒温恒压密闭容器内有气体参加的化学反应,若充入Ar气,化学反应速率如何变化?
提示:若通入Ar气,导致容器的体积增大,容器内反应物的浓度减小,化学反应速率减小。
化学反应速率的影响因素
5、固体反应物表面积对化学反应速率影响的探究
其他条件相同时,固体反应物表面积越大,反应速率越大
6、其他因素对化学反应速率影响的探究
光照、溶剂、形成原电池等,也能影响化学反应速率
影响因素 规律
内因 反应物本 身的性质 反应物的化学性质越活泼,化学反应速率越快;反之化学反应速率越慢
外因 浓度 增大反应物的浓度,化学反应速率增大;减小反应物的浓度,化学反应速率减小
温度 升高温度,化学反应速率增大;
降低温度,化学反应速率减小
催化剂 一般地,使用催化剂能极大地加快反应速率
固体的表面积 增大固体反应物的表面积,化学反应速率加快
其他 光照、溶剂、形成原电池等,也能影响化学反应速率
(1)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。
(2)把食物存放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期。
(3)做化学实验时,为加速反应的进行,通常将块状或颗粒状的固体药品研细并混匀,或者将固体试剂溶于水配成溶液后再进行实验。
(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。
(5)实验室用Zn和稀硫酸反应制取H2时,为了加快化学反应速率可滴入几滴硫酸铜溶液。
(6)在通常情况下,Na与水的反应比Mg与水的反应剧烈 。
参加反应的物质自身的性质是决定化学反应速率的主要原因。
思考讨论
下列调控反应速率的措施或实验中,
分别利用或体现了哪些影响反应速率的因素?
【例5】一定条件下,分别对反应C(s)+CO2(g)=2CO(g)进行如下操作:
①升高反应体系的温度;②减小CO2的浓度;③缩小反应体系的体积;④减小压强。
上述措施中一定能使反应速率显著变大的是( )
A.①②③④ B.①③④ C.①② D.①③
D
【例6】CaCO3与100 mL稀盐酸反应生成CO2的量与反应
时间的关系如图所示,下列结论不正确的是( )
A.反应在2~4 min内平均反应速率最大
B.反应在2~4 min内用盐酸表示的平均反应速率为v(HCl)=0.1 mol·L-1·min-1
C.反应开始阶段,反应速率逐渐增大是由于温度比浓度对反应速率的影响大
D.4 min后,反应速率减小的主要原因是c(H+)减小
B
【例7】等质量的铁与过量的盐酸在不同的实验条件下进行反应, 测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法一定不正确的是( )
D
组别 对应曲线 c(HCl)/(mol·L-1) 反应温度/℃ 铁的状态
① a 30 粉末状
② b 30 粉末状
③ c 2.5 块状
④ d 2.5 30 块状
A.第④组实验的反应速率最小 B.第①组实验中盐酸的浓度大于2.5 mol·L-1
C.第②组实验中盐酸的浓度等于2.5 mol·L-1 D.第③组实验的反应温度低于30 ℃
思维课堂·素养提升
碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数分子碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞
吉尔伯特·牛顿·路易斯
思维课堂·素养提升
碰撞理论
活化分子与活化能
能量
反应物
生成物
反应过程
活化能
E1
E2
活化分子变成生成物分子放出的能量
活化分子比普通分子多具有的能量
具有足够高的能量,能发生有效碰撞的分子
活化分子
思维课堂·素养提升
投篮那些事
碰撞理论
力道不足
——进不去球
取向不对
——进不去球
力道、取向恰好
——进球
思维课堂·素养提升
碰撞理论
其它条件不变时
增大反应物浓度
活化分子
浓度对化学反应速率的影响
在其它条件不变时,增大反应物浓度,单位体积内活化分子的数目增大,有效碰撞几率增大,化学反应速率加快;反之则慢
思维课堂·素养提升
碰撞理论
温度对化学反应速率的影响
其它条件不变时
升高温度
活化分子
其它条件不变时,升高温度,单位体积内活化分子的数目增大,有效碰撞几率增大,化学反应速率加快;反之则慢
思维课堂·素养提升
碰撞理论
催化剂对化学反应速率的影响
能量
反应物
生成物
活化分子
反应过程
活化能
E1
E2
活化分子变成生成物分子放出的能量
E3
E3:加入催化剂后反应物的活化能
降低活化能,增大活化分子百分数,加快化学反应速率
思维课堂·素养提升
碰撞理论
压强对化学反应速率的影响
容器的容积不变
压缩体积或充入气态反应物
活化分子
在其它条件不变时,增大气体反应体系压强,相当于压缩体积,反应物的浓度增大,单位体积内活化分子数目增大,化学反应速率加快;反之则慢。(有气体反应)
思维课堂·素养提升
碰撞理论
压强对化学反应速率的影响
在其它条件不变时,充入非反应气体→压强不变→体积增大→各物质浓度减小→反应速率减慢
活化分子
容器内压强不变
充入非反应气体
思维课堂·素养提升
碰撞理论
压强对化学反应速率的影响
活化分子
在其它条件不变时,充入非反应气体→压强增大,但各物质浓度不变→反应速率不变
容器的容积不变
充入非反应气体
第六章
化学反应与能量
第二节 化学反应的速率与限度
课时1 化学反应的速率
学习目标
1. 掌握化学反应速率的概念和表示方法;
2.能够进行化学反应速率的简单计算。
思考讨论
在化学实验和日常生活中,我们经常观察到这样的现象:有的反应进行的快,有的进行的慢。
爆炸
牛奶变质
钢铁生锈
溶洞形成
哪个反应更快?
思考讨论
在化学实验中,有哪些观察化学反应快慢(定性)的方法
气泡的快慢
浑浊的快慢
固体消失的快慢
颜色的变化
在科学研究和实际应用中,
如何对化学反应进行的快慢进行定量的描述或比较?
化学反应速率
那么化学上又是如何判断一个化学反应的快慢的呢?
在物理中我们是如何定量地判断一个物体移动速度快慢的?
用速度来描述:单位时间内物体移动的距离的大小
v =
△s
△t
一、化学反应速率
1.表示:通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)表示。
(1)计算公式
(2)常用单位
mol/(L·min) 或 mol/(L·s)
或mol·L-1·min-1
60mol/(L·min) =1mol/(L·s)
思考讨论
思考1:在某一化学反应中,已知反应物A的浓度在10 s内从4 mol/L变成1 mol/L。则在这10 s内用A表示的化学反应速率为多少?
v(A)
c(A)
t
=
=
4 mol·L-1–1 mol·L-1
10 s
3 mol·L-1
10 s
0.3 mol·L-1·s-1
=
=
问:第10s的反应速率为多少?
无法确定
思考2: 一个化学反应的速率可以用任何一种反应物或生成物表示吗
提示:纯固体或纯液体的浓度变化为0,一般不能用来表示速率。
注意:1. 固体或纯液体(液态水、液溴等)浓度为常数Δc=0,不用固体或纯液体表示化学反应速率
2. 化学反应速率是一段时间内平均反应速率而不是某一时刻的瞬时速率
1. 判断正误,正确的划“√”,错误的划“ ”
(1)对于任何化学反应来说,反应速率越大,反应现象就越明显( )
(2)化学反应速率是指一定时间内任何一种反应物浓度的减少或任何一种生成物浓度的增加( )
(3)化学反应速率为0.8mol·L-1·s-1是指1s时某物质的浓度为0.8mol·L-1( )
(4)由v=Δt(Δc)计算平均速率,反应物表示为正值,生成物表示为负值( )
×
×
×
×
△C (mol/L)
思考讨论
【例1】在1L的密闭容器中,加入8molN2和20mol H2,发生N2 + 3H2 2NH3,在5min末时,测得容器中含有6mol的N2,求该反应的化学反应速率。
N2 + 3H2 2NH3
起始浓度(mol/L) 8 20 0
5min末浓度(mol/L)
6
v(N2)= 2/5=0.4mol/(L·min)
v(H2)= 6/5=1.2mol/(L·min)
v(NH3)= 4/5=0.8mol/(L·min)
4
2
6
结论1: 同一反应的反应速率可以用不同的物质表示,其数值可能不同,但所表示的意义是相同的。在表示反应速率时,应注明是由哪种物质表示的。
思考讨论
【例1】在1L的密闭容器中,加入8molN2和20mol H2,发生N2 + 3H2 2NH3,在5min末时,测得容器中含有6mol的N2,求该反应的化学反应速率。
N2 + 3H2 2NH3
起始浓度(mol/L) 8 20 0
5min末浓度(mol/L)
6
v(N2)= 2/5=0.4mol/(L·min)
v(H2)= 6/5=1.2mol/(L·min)
v(NH3)= 4/5=0.8mol/(L·min)
4
2
△C (mol/L)
6
由以上可知∶ V(N2): V(H2 ): V(NH3)= 0.4 : 1.2 : 0.8 = 1 : 3 : 2
结论2: 同一反应中,各物质的反应速率之比等于其化学方程式中的化学计量数之比。即对于反应:aA+bB=cC+dD vA:vB:vC:vD = a : b : c : d
【例2】反应 A(g) + 3B(g) = 2C(g) + 2D (g) 在四种不同情况下的反应速率为:①v(A)=0.45mol·L-1·min-1 ②v(B)=0.6mol·L-1·s-1
③v(C)=0.4mol·L-1·s-1 ④v(D)=0.45mol·L-1·s-1
则该反应速率的快慢顺序为_____________________
归一法:先统一单位,换算成同一物质表示的反应速率,再比较数值的大小。
比值法:比较化学反应速率与化学计量数的比值,比值越大化学反应速率越大。
④>③=②>①
对于反应:aA+bB==dD+eE,用不同的物质表示速率满足关系:
v(A)∶v(B)∶v(D)∶v(E)=a∶b∶d∶e 即
方法指导:
【例3】某温度时,在2 L密闭容器中X、Y、Z三种物质的物质的量随时间的变化曲线如下图所示。根据图中数据,试回答:
(1)反应在2 min内的v(X)=______________,
v(Y)=________________________,
v(Z)=________________________。
(2)容器内的反应物是________。
(3)写出该反应的化学方程式:__________________。
0.025 mol·L-1·min-1
0.075 mol·L-1·min-1
0.05 mol·L-1·min-1
X、Y
X+3Y 2Z
①化学反应速率是标量,反应速率都为正数。
②一段时间内的平均速率,而不是指瞬时速率。
③一般不用固体或纯液体(其浓度是常数)表示化学反应速率。
④用不同物质表示的化学反应速率之比等于化学计量数之比
反应:mA + nB == pC + qD
v(A): v(B): v(C): v(D)==m:n:p:q
⑤用不同物质表示的化学反应速率,其值不一定相同,但其表示反应的快慢程度相同——指明具体物质v(A)
化学反应速率
影响化学反应速率的因素
爆炸
牛奶变质
钢铁生锈
溶洞形成
如何减慢牛奶变质的速率?
对于有些化学反应,我们希望其越慢越好,如食物的变质、橡胶和塑料的老化、金属的锈蚀;有些则希望其快一些,如氨、硫酸等化工产品的生产。调控化学反应速率常常是决定化学实验成败或化工生产成本的关键。
影响化学反应速率的因素
在相同条件下,等质量(金属颗粒大小相同)的下列金属与足量1mol/L 盐酸反应时,速率最快的是:A 镁 B 铝 C 钠 D 铁
1.内因:反应物本身的性质(决定因素)
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
√
2.外因:
浓度?
温度?
压强?
催化剂?
物质的形状?
实验探究—温度对反应速率的影响
实验探究
实验探究—温度对反应速率的影响
【实验操作】
试管内均盛有 2mL 5% 的 H2O2溶液,并滴有 2 滴 1 mol/L FeCl3溶液
【实验现象】
两支试管中均有气泡产生,但热水中产生气泡更快
【实验结论】
其他条件相同时,升高温度,反应速率加快;降低温度,反应速率减小
不管吸热反应还是放热反应,升高温度,都加快反应速率
实验探究—温度对反应速率的影响
实验探究
实验探究—浓度对反应速率的影响
【实验现象】
两支试管中均有气泡产生,但装1 mol/L盐酸的试管产生气泡更快
【实验结论】
其他条件相同时,增大浓度,反应速率加快;降低浓度,反应速率减小
当其他条件相同时,增大反应物浓度,化学反应速率增大。
思考3:铁粉与一定浓度的稀盐酸反应时,增加铁粉的用量能否加快化学反应速率?
提示:不能。对于固态或纯液态物质。
实验探究—温度对反应速率的影响
实验探究
实验探究—催化剂对反应速率的影响
【实验现象】三支试管中均有气泡产生,产生气泡的速率:①>②>③
【实验结论】催化剂可以改变反应速率,不同催化剂催化效果不同
催化剂(正)能加快化学反应速率
压强对反应速率的影响
其他条件不变时,对于有气体参与的反应:
有气体参加的反应,改变压强时,只有导致参加反应的气体浓度改变,反应速率才会改变
思考讨论
思考4:对于恒温恒容密闭容器内有气体参加的化学反应,若充入Ar气,化学反应速率如何变化?
提示:若通入Ar气,容器内反应物的浓度不变,化学反应速率不变。
思考5:对于恒温恒压密闭容器内有气体参加的化学反应,若充入Ar气,化学反应速率如何变化?
提示:若通入Ar气,导致容器的体积增大,容器内反应物的浓度减小,化学反应速率减小。
化学反应速率的影响因素
5、固体反应物表面积对化学反应速率影响的探究
其他条件相同时,固体反应物表面积越大,反应速率越大
6、其他因素对化学反应速率影响的探究
光照、溶剂、形成原电池等,也能影响化学反应速率
影响因素 规律
内因 反应物本 身的性质 反应物的化学性质越活泼,化学反应速率越快;反之化学反应速率越慢
外因 浓度 增大反应物的浓度,化学反应速率增大;减小反应物的浓度,化学反应速率减小
温度 升高温度,化学反应速率增大;
降低温度,化学反应速率减小
催化剂 一般地,使用催化剂能极大地加快反应速率
固体的表面积 增大固体反应物的表面积,化学反应速率加快
其他 光照、溶剂、形成原电池等,也能影响化学反应速率
(1)向炉膛内鼓风,用煤粉代替煤块可以使炉火更旺。
(2)把食物存放在冰箱里,在糕点包装内放置除氧剂可以延长食品保质期。
(3)做化学实验时,为加速反应的进行,通常将块状或颗粒状的固体药品研细并混匀,或者将固体试剂溶于水配成溶液后再进行实验。
(4)铁在空气中和在纯氧中反应的剧烈程度明显不同。
(5)实验室用Zn和稀硫酸反应制取H2时,为了加快化学反应速率可滴入几滴硫酸铜溶液。
(6)在通常情况下,Na与水的反应比Mg与水的反应剧烈 。
参加反应的物质自身的性质是决定化学反应速率的主要原因。
思考讨论
下列调控反应速率的措施或实验中,
分别利用或体现了哪些影响反应速率的因素?
【例5】一定条件下,分别对反应C(s)+CO2(g)=2CO(g)进行如下操作:
①升高反应体系的温度;②减小CO2的浓度;③缩小反应体系的体积;④减小压强。
上述措施中一定能使反应速率显著变大的是( )
A.①②③④ B.①③④ C.①② D.①③
D
【例6】CaCO3与100 mL稀盐酸反应生成CO2的量与反应
时间的关系如图所示,下列结论不正确的是( )
A.反应在2~4 min内平均反应速率最大
B.反应在2~4 min内用盐酸表示的平均反应速率为v(HCl)=0.1 mol·L-1·min-1
C.反应开始阶段,反应速率逐渐增大是由于温度比浓度对反应速率的影响大
D.4 min后,反应速率减小的主要原因是c(H+)减小
B
【例7】等质量的铁与过量的盐酸在不同的实验条件下进行反应, 测得在不同时间(t)内产生气体体积(V)的数据如图所示,根据图示分析实验条件,下列说法一定不正确的是( )
D
组别 对应曲线 c(HCl)/(mol·L-1) 反应温度/℃ 铁的状态
① a 30 粉末状
② b 30 粉末状
③ c 2.5 块状
④ d 2.5 30 块状
A.第④组实验的反应速率最小 B.第①组实验中盐酸的浓度大于2.5 mol·L-1
C.第②组实验中盐酸的浓度等于2.5 mol·L-1 D.第③组实验的反应温度低于30 ℃
思维课堂·素养提升
碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数分子碰撞才能发生化学反应。能引发化学反应的碰撞称之为有效碰撞
吉尔伯特·牛顿·路易斯
思维课堂·素养提升
碰撞理论
活化分子与活化能
能量
反应物
生成物
反应过程
活化能
E1
E2
活化分子变成生成物分子放出的能量
活化分子比普通分子多具有的能量
具有足够高的能量,能发生有效碰撞的分子
活化分子
思维课堂·素养提升
投篮那些事
碰撞理论
力道不足
——进不去球
取向不对
——进不去球
力道、取向恰好
——进球
思维课堂·素养提升
碰撞理论
其它条件不变时
增大反应物浓度
活化分子
浓度对化学反应速率的影响
在其它条件不变时,增大反应物浓度,单位体积内活化分子的数目增大,有效碰撞几率增大,化学反应速率加快;反之则慢
思维课堂·素养提升
碰撞理论
温度对化学反应速率的影响
其它条件不变时
升高温度
活化分子
其它条件不变时,升高温度,单位体积内活化分子的数目增大,有效碰撞几率增大,化学反应速率加快;反之则慢
思维课堂·素养提升
碰撞理论
催化剂对化学反应速率的影响
能量
反应物
生成物
活化分子
反应过程
活化能
E1
E2
活化分子变成生成物分子放出的能量
E3
E3:加入催化剂后反应物的活化能
降低活化能,增大活化分子百分数,加快化学反应速率
思维课堂·素养提升
碰撞理论
压强对化学反应速率的影响
容器的容积不变
压缩体积或充入气态反应物
活化分子
在其它条件不变时,增大气体反应体系压强,相当于压缩体积,反应物的浓度增大,单位体积内活化分子数目增大,化学反应速率加快;反之则慢。(有气体反应)
思维课堂·素养提升
碰撞理论
压强对化学反应速率的影响
在其它条件不变时,充入非反应气体→压强不变→体积增大→各物质浓度减小→反应速率减慢
活化分子
容器内压强不变
充入非反应气体
思维课堂·素养提升
碰撞理论
压强对化学反应速率的影响
活化分子
在其它条件不变时,充入非反应气体→压强增大,但各物质浓度不变→反应速率不变
容器的容积不变
充入非反应气体
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
