4.1.2周期表 核素 课件(共27张PPT) 高中化学人教版(2019)必修第一册
文档属性
| 名称 | 4.1.2周期表 核素 课件(共27张PPT) 高中化学人教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 15:43:38 | ||
图片预览







文档简介
(共27张PPT)
第四章 物质结构元素周期律
第一节原子结构与元素周期表
第2课时 元素周期表 核素
核心素养
发展目标
1.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导,提升微观探析能力。
2.了解元素周期表的发展历程及现行元素周期表的结构,培养严谨、求实的科学态度。
3.知道元素、核素、同位素、 的含义,并能比较它们的不同,促进“宏观辨识与微观探析”化学核心素养的发展。
元素周期表的编排原则与结构
一
1.元素周期表的发展历程(课本94第1,2段)
门捷列夫
相对原子质量
相对原子质量
核电荷数
2.元素周期表的编排原则(课本94倒数第1段)
(1)原子序数:按照元素 给元素编的序号。
(2)原子序数= = = 。
(3)横行原则:把 相同的元素,按 的顺序从左到右排列。
(4)纵列原则:把不同横行中 相同的元素,按__________的顺序由上而下排列。
在元素周期表中的顺序
核电荷数
质子数
核外电子数
电子层数目
原子序数递增
最外层电子数
电子层数递增
记!
记!
记!
3.元素周期表的结构(课本95第1,2段)
元素周期表有 个横行, 个纵列。每一个横行叫做一个 ,每一个纵列叫做一个 ( 三个纵列共同组成第 族)。
7
18
周期
族
8、9、10
Ⅷ
记!
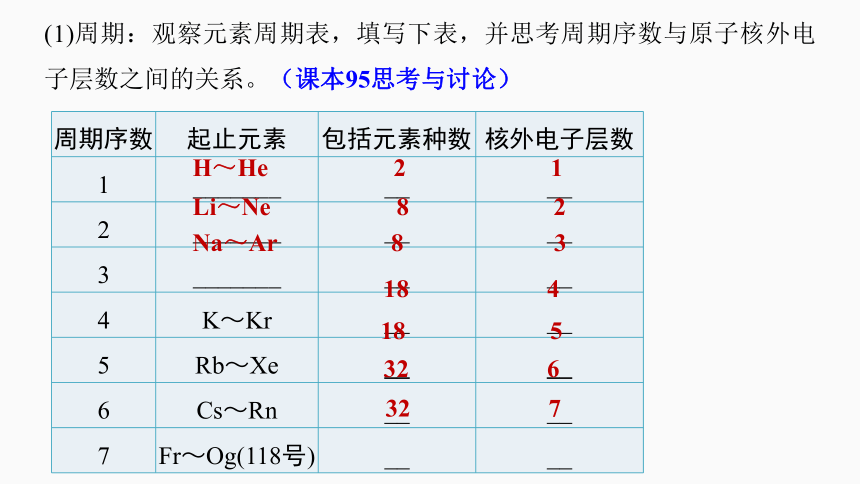
周期序数 起止元素 包括元素种数 核外电子层数
1 _______ __ __
2 _______ __ __
3 _______ __ __
4 K~Kr __ __
5 Rb~Xe __ __
6 Cs~Rn __ __
7 Fr~Og(118号) __ __
(1)周期:观察元素周期表,填写下表,并思考周期序数与原子核外电子层数之间的关系。(课本95思考与讨论)
H~He 2 1
Li~Ne 8 2
Na~Ar 8 3
18 4
18 5
32 6
32 7
由此可知: (课本95倒数第2段)
①周期序数=电子层数
②周期的分类
周期—
短周期:包括第 周期,分别有 种元素
长周期:包括第 周期,分别有____________
种元素
一、二、三
2、8、8
四、五、六、七
18、18、32、32
记!
(1)周期:观察元素周期表,填写下表,并思考周期序数与原子核外电子层数之间的关系。
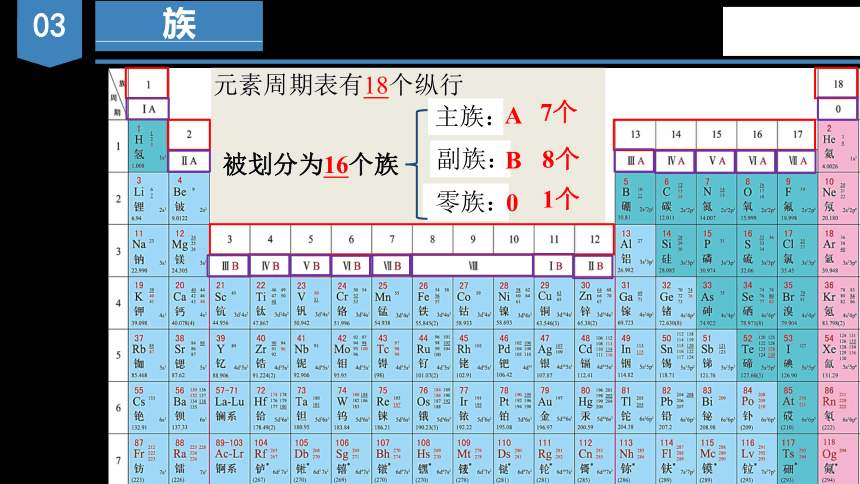
族
元素周期表有18个纵行
被划分为16个族
主族:
副族:
零族:
A
B
0
7个
8个
1个
特点 主族元素的族序数=______________ 分类 主族 共有 个,包括 ,由 周期和 周期元素共同构成。
副族 共有 个,包括____________________________________,完全由 周期元素构成。
0族 占据元素周期表的第 纵列,最外层电子数为 (He是2),很难与其他物质发生化学反应,化合价定为0价
(2)族(课本95倒数第1段)
①周期表中族的特点和划分(除Ⅷ外)
最外层电子数
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
7
短
长
18
8
长
记!
族 别名
第ⅠA族(除 外) 元素
第ⅦA族 元素
0族 稀有气体元素
②常见族的别称
氢
碱金属
卤族
4.元素周期表中方格里的符号的意义
原子序数
相对原子质量
元素符号
元素名称
记!
(3)同周期的第ⅡA、ⅢA族元素间原子序数差值可能为多少?并说明原因。
深度思考
第二、三周期元素,原子序数差为1
第四、五周期元素,原子序数差为11
第六、七周期元素,原子序数差为25
8
8
18
18
32
32
2种
8种
8种
18种
18种
32种
32种
2
8
8
18
18
32
4.同族,相邻周期原子序数差:
归纳总结
原子序数的定量关系
①同周期,第ⅡA族与第ⅢA族原子序数差可能为1、11、25;
②同族,相邻周期原子序数差:
第ⅠA族~第ⅡA族:上一周期元素种类数;
第ⅢA族~0族:下一周期元素种类数。如Na与K相差8,Cl与Br相差18。
③利用稀有气体元素的原子序数推断元素在周期表中的位置。
记!
核素 同位素
二
1.元素
(1)概念:具有相同 ( )的一类 的总称。
(2)决定元素种类的是 。
2.核素
(1)概念:具有一定数目 和一定数目 的一种原子。表示方法:
质子数
核电荷数
原子
质子数
质子
中子
例如:
1)质子数相同,中子数不同的同一元素的不同核素的互称为同位素
3.同位素
2)同位素的特征
①化学性质几乎相同;物理性质略有差异。
②在天然存在的某种元素里,同位素相互之间保持一定的 。
3)常见同位素的用途
①考古测定文物的年代的是_____;
②制造氢弹的是_________;
③利用放射性同位素释放的射线 、金属 、诊断和治疗疾病等。
比率
育种
探伤
归纳总结(步步高95)
(1)元素、核素、同位素与同素异形体的比较
元素 核素 同位素 同素异形体
概念 质子数相同的同一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的不同核素 同种元素形成的不同单质
举例 H、C、N三种元素 O2与O3互为同素异形体
归纳总结
(2)元素、核素、同位素、同素异形体的联系
返回
(1)任何原子都由质子、中子、电子构成( )
(2)23Na和23Mg互为同位素( )
(3)同位素原子的化学性质几乎相同,物理性质略有差异( )
(4)原子的种类大于元素的种类( )
×
×
√
正误判断
√
√
1.有 H2O、D2O ③O2和O3 ④H、D、T四组微粒或物质,回答下列问题:
(1)互为同位素的是_______(填序号,下同)。
(2)互为同素异形体的是_____。
(3)由①和④中微粒能结合成含三个原子的化合物分子,这些化合物中相对分子质量最大的是_______(填化学式)。
深度思考
①④
③
2.氯元素有两种稳定的核素,分别是 它们的相对原子质量分别是34.969、36.966,在自然界中的丰度分别是75.77%、24.23%。
计算:
(1)氯元素的相对原子质量。
34.969×75.77%+36.966×24.23%≈35.45
深度思考
(2)氯元素的近似相对原子质量。
35×75.77%+37×24.23%≈35.48
随堂演练 知识落实
1.下列关于元素周期表的叙述正确的是
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要
里程碑之一
B.元素所在周期数等于它的电子层数,所在的族序数等于它的最外层电
子数
C.元素周期表有7个横行即7个周期,18个纵列即18个族
D.某种元素的相对原子质量取整数值,就是其原子序数
√
1
2
3
4
2.意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,下列说法正确的是
A.O4和O2互为同位素
B.O4转化为O2是物理变化
C.18O是氧元素的一种核素,它的中子数是8
D.同温同压下,等体积的O4和O2含有相同的分子数
1
2
3
√
4
3.金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关
1
2
3
√
4
4.A、B、C为短周期元素,在周期表中所处的位置如表所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称____、____、____。
(2)B位于元素周期表中第______周期第______族。
(3)C的原子结构示意图为________。
1
2
3
返回
氮 硫 氟
A C
B
三 ⅥA
4
第四章 物质结构元素周期律
第一节原子结构与元素周期表
第2课时 元素周期表 核素
核心素养
发展目标
1.能从原子结构的角度理解元素周期表的编排原则,能进行元素在周期表中的位置与原子结构之间的相互推导,提升微观探析能力。
2.了解元素周期表的发展历程及现行元素周期表的结构,培养严谨、求实的科学态度。
3.知道元素、核素、同位素、 的含义,并能比较它们的不同,促进“宏观辨识与微观探析”化学核心素养的发展。
元素周期表的编排原则与结构
一
1.元素周期表的发展历程(课本94第1,2段)
门捷列夫
相对原子质量
相对原子质量
核电荷数
2.元素周期表的编排原则(课本94倒数第1段)
(1)原子序数:按照元素 给元素编的序号。
(2)原子序数= = = 。
(3)横行原则:把 相同的元素,按 的顺序从左到右排列。
(4)纵列原则:把不同横行中 相同的元素,按__________的顺序由上而下排列。
在元素周期表中的顺序
核电荷数
质子数
核外电子数
电子层数目
原子序数递增
最外层电子数
电子层数递增
记!
记!
记!
3.元素周期表的结构(课本95第1,2段)
元素周期表有 个横行, 个纵列。每一个横行叫做一个 ,每一个纵列叫做一个 ( 三个纵列共同组成第 族)。
7
18
周期
族
8、9、10
Ⅷ
记!
周期序数 起止元素 包括元素种数 核外电子层数
1 _______ __ __
2 _______ __ __
3 _______ __ __
4 K~Kr __ __
5 Rb~Xe __ __
6 Cs~Rn __ __
7 Fr~Og(118号) __ __
(1)周期:观察元素周期表,填写下表,并思考周期序数与原子核外电子层数之间的关系。(课本95思考与讨论)
H~He 2 1
Li~Ne 8 2
Na~Ar 8 3
18 4
18 5
32 6
32 7
由此可知: (课本95倒数第2段)
①周期序数=电子层数
②周期的分类
周期—
短周期:包括第 周期,分别有 种元素
长周期:包括第 周期,分别有____________
种元素
一、二、三
2、8、8
四、五、六、七
18、18、32、32
记!
(1)周期:观察元素周期表,填写下表,并思考周期序数与原子核外电子层数之间的关系。
族
元素周期表有18个纵行
被划分为16个族
主族:
副族:
零族:
A
B
0
7个
8个
1个
特点 主族元素的族序数=______________ 分类 主族 共有 个,包括 ,由 周期和 周期元素共同构成。
副族 共有 个,包括____________________________________,完全由 周期元素构成。
0族 占据元素周期表的第 纵列,最外层电子数为 (He是2),很难与其他物质发生化学反应,化合价定为0价
(2)族(课本95倒数第1段)
①周期表中族的特点和划分(除Ⅷ外)
最外层电子数
ⅠA、ⅡA、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA
7
短
长
18
8
长
记!
族 别名
第ⅠA族(除 外) 元素
第ⅦA族 元素
0族 稀有气体元素
②常见族的别称
氢
碱金属
卤族
4.元素周期表中方格里的符号的意义
原子序数
相对原子质量
元素符号
元素名称
记!
(3)同周期的第ⅡA、ⅢA族元素间原子序数差值可能为多少?并说明原因。
深度思考
第二、三周期元素,原子序数差为1
第四、五周期元素,原子序数差为11
第六、七周期元素,原子序数差为25
8
8
18
18
32
32
2种
8种
8种
18种
18种
32种
32种
2
8
8
18
18
32
4.同族,相邻周期原子序数差:
归纳总结
原子序数的定量关系
①同周期,第ⅡA族与第ⅢA族原子序数差可能为1、11、25;
②同族,相邻周期原子序数差:
第ⅠA族~第ⅡA族:上一周期元素种类数;
第ⅢA族~0族:下一周期元素种类数。如Na与K相差8,Cl与Br相差18。
③利用稀有气体元素的原子序数推断元素在周期表中的位置。
记!
核素 同位素
二
1.元素
(1)概念:具有相同 ( )的一类 的总称。
(2)决定元素种类的是 。
2.核素
(1)概念:具有一定数目 和一定数目 的一种原子。表示方法:
质子数
核电荷数
原子
质子数
质子
中子
例如:
1)质子数相同,中子数不同的同一元素的不同核素的互称为同位素
3.同位素
2)同位素的特征
①化学性质几乎相同;物理性质略有差异。
②在天然存在的某种元素里,同位素相互之间保持一定的 。
3)常见同位素的用途
①考古测定文物的年代的是_____;
②制造氢弹的是_________;
③利用放射性同位素释放的射线 、金属 、诊断和治疗疾病等。
比率
育种
探伤
归纳总结(步步高95)
(1)元素、核素、同位素与同素异形体的比较
元素 核素 同位素 同素异形体
概念 质子数相同的同一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的不同核素 同种元素形成的不同单质
举例 H、C、N三种元素 O2与O3互为同素异形体
归纳总结
(2)元素、核素、同位素、同素异形体的联系
返回
(1)任何原子都由质子、中子、电子构成( )
(2)23Na和23Mg互为同位素( )
(3)同位素原子的化学性质几乎相同,物理性质略有差异( )
(4)原子的种类大于元素的种类( )
×
×
√
正误判断
√
√
1.有 H2O、D2O ③O2和O3 ④H、D、T四组微粒或物质,回答下列问题:
(1)互为同位素的是_______(填序号,下同)。
(2)互为同素异形体的是_____。
(3)由①和④中微粒能结合成含三个原子的化合物分子,这些化合物中相对分子质量最大的是_______(填化学式)。
深度思考
①④
③
2.氯元素有两种稳定的核素,分别是 它们的相对原子质量分别是34.969、36.966,在自然界中的丰度分别是75.77%、24.23%。
计算:
(1)氯元素的相对原子质量。
34.969×75.77%+36.966×24.23%≈35.45
深度思考
(2)氯元素的近似相对原子质量。
35×75.77%+37×24.23%≈35.48
随堂演练 知识落实
1.下列关于元素周期表的叙述正确的是
A.元素周期表揭示了化学元素间的内在联系,是化学发展史上的重要
里程碑之一
B.元素所在周期数等于它的电子层数,所在的族序数等于它的最外层电
子数
C.元素周期表有7个横行即7个周期,18个纵列即18个族
D.某种元素的相对原子质量取整数值,就是其原子序数
√
1
2
3
4
2.意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,下列说法正确的是
A.O4和O2互为同位素
B.O4转化为O2是物理变化
C.18O是氧元素的一种核素,它的中子数是8
D.同温同压下,等体积的O4和O2含有相同的分子数
1
2
3
√
4
3.金属钛对人体体液无毒且能与肌肉和骨骼生长在一起,有“生物金属”之称。下列有关
1
2
3
√
4
4.A、B、C为短周期元素,在周期表中所处的位置如表所示。A、C两元素的原子核外电子数之和等于B原子的质子数。B原子核内质子数和中子数相等。
(1)写出A、B、C三种元素的名称____、____、____。
(2)B位于元素周期表中第______周期第______族。
(3)C的原子结构示意图为________。
1
2
3
返回
氮 硫 氟
A C
B
三 ⅥA
4
