8.3 酸和碱的反应 学案 2023-2024学年初中化学科粤版九年级下册(含答案)
文档属性
| 名称 | 8.3 酸和碱的反应 学案 2023-2024学年初中化学科粤版九年级下册(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 63.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 00:00:00 | ||
图片预览

文档简介
8.3 酸和碱的反应
学习目标
1.了解酸、碱、盐溶液的导电性及它们的组成。
2.理解中和反应的概念及其应用。
3.理解复分解反应的概念及特征。
4.了解酸雨的形成及危害。
◎素养要求:通过实验探究,初步学会判断化学反应是否发生的一些方法。通过讨论交流,培养学生处理信息的能力和良好的学习习惯。体会化学与社会的密切关系,感受化学来源于生活,并广泛地运用于生活。
评价任务
1.独立完成自主学习。
2.合作完成任务驱动一、二、三、四、五。
3.课后完成分层作业本。
【预习导学】
课时线索
酸、碱、盐溶液的导电性→中和反应→中和反应的应用
自主学习
1.酸有一些相似的化学性质,是因为酸溶液中都含 ;在不同的碱溶液中都含 ,所以碱也具有一些相似的化学性质。
2.我们把酸与碱作用生成盐和水的反应称为 。
3.由两种化合物互相交换成分,生成另外两种化合物的反应叫作 。
4.中和反应在实际生活中应用广泛:
(1)用 改良酸性土壤;(2)废水处理;(3)医药应用。
【答案】1.H+ OH-
2.中和反应
3.复分解反应
4.(1)熟石灰
【合作探究】
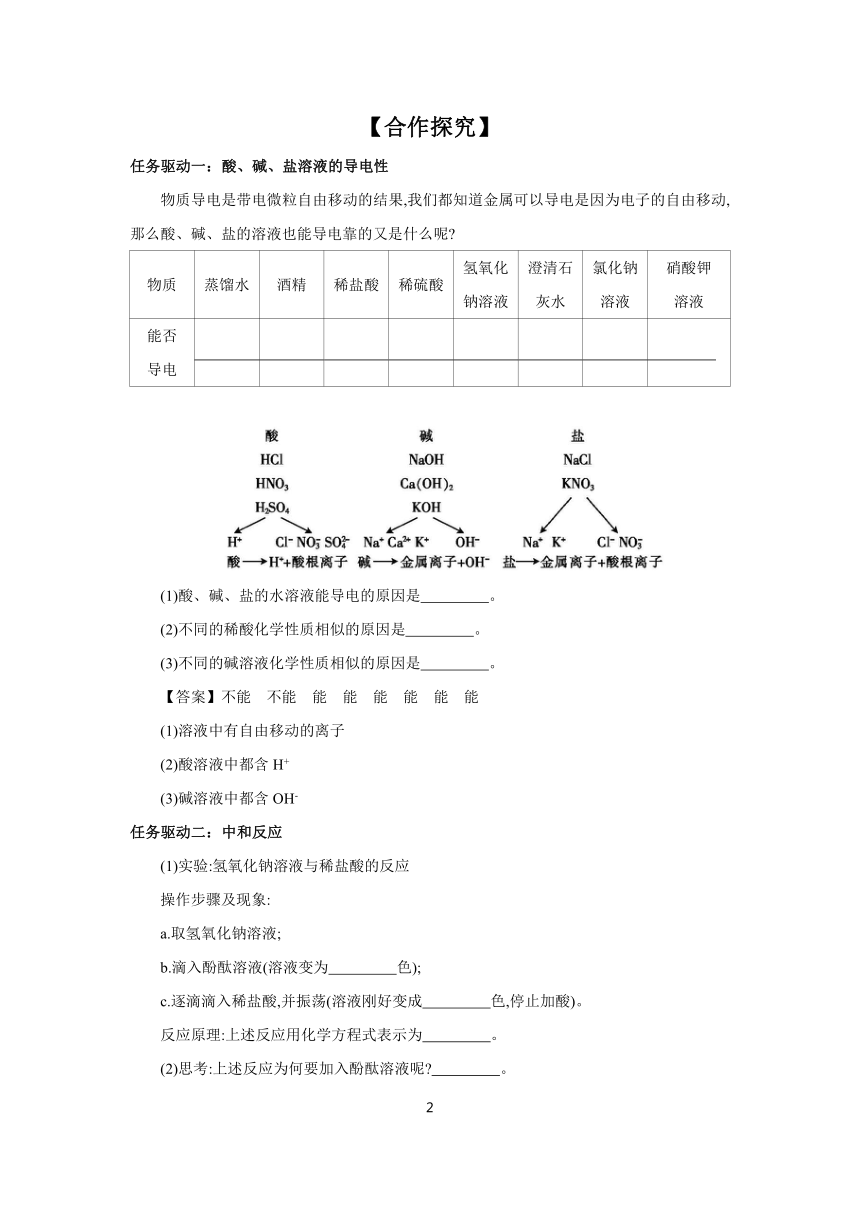
任务驱动一:酸、碱、盐溶液的导电性
物质导电是带电微粒自由移动的结果,我们都知道金属可以导电是因为电子的自由移动,那么酸、碱、盐的溶液也能导电靠的又是什么呢
物质 蒸馏水 酒精 稀盐酸 稀硫酸 氢氧化 钠溶液 澄清石 灰水 氯化钠 溶液 硝酸钾 溶液
能否 导电
(1)酸、碱、盐的水溶液能导电的原因是 。
(2)不同的稀酸化学性质相似的原因是 。
(3)不同的碱溶液化学性质相似的原因是 。
【答案】不能 不能 能 能 能 能 能 能
(1)溶液中有自由移动的离子
(2)酸溶液中都含H+
(3)碱溶液中都含OH-
任务驱动二:中和反应
(1)实验:氢氧化钠溶液与稀盐酸的反应
操作步骤及现象:
a.取氢氧化钠溶液;
b.滴入酚酞溶液(溶液变为 色);
c.逐滴滴入稀盐酸,并振荡(溶液刚好变成 色,停止加酸)。
反应原理:上述反应用化学方程式表示为 。
(2)思考:上述反应为何要加入酚酞溶液呢 。
(3)中和反应的概念: 跟 生成 和 的反应。
注意:①中和反应的产物是盐和水,但有盐和水生成的反应,不一定都是中和反应。如:H2SO4+CuOCuSO4+H2O,2NaOH+CO2Na2CO3+H2O都不是中和反应。
②中和反应不属于基本反应类型。
(4)中和反应的实质:
中和反应的实质是酸溶液中的 (填离子符号,下同)与碱溶液中的 结合生成H2O的过程。
(5)总结概括酸、碱的通性
酸(五点):
①酸与指示剂的作用:石蕊溶液遇酸 ;酚酞溶液遇酸 。
②酸+活泼金属盐+氢气,如稀盐酸与铁: 。
③酸+金属氧化物盐+水,如盐酸除锈: 。
④酸+碱盐+水,如硫酸与烧碱反应: 。
⑤酸+盐新盐+新酸,如硫酸与氯化钡反应: 。
碱(四点):
①碱溶液与指示剂的作用:石蕊溶液遇碱 ,酚酞溶液遇碱 。
②碱+非金属氧化物盐+水,如 。
③碱+酸盐+水,如 。
④碱+盐新盐+新碱,如 。
【答案】(1)b.红
c.无 HCl+NaOHNaCl+H2O
(2)便于观察中和反应的进行
(3)酸 碱 盐 水
(4)H+ OH-
(5)①变红 不变色
②Fe+2HClFeCl2+H2↑
③Fe2O3+6HCl2FeCl3+3H2O
④H2SO4+2NaOHNa2SO4+2H2O
⑤H2SO4+BaCl2BaSO4↓+2HCl
碱(四点):①变蓝 变红
②2NaOH+CO2Na2CO3+H2O
③HCl+NaOHNaCl+H2O
④2NaOH+CuSO4Cu(OH)2↓+Na2SO4
任务驱动三:复分解反应
(1)概念:由两种 互相 ,生成另外两种 的反应,叫复分解反应。
(2)特点:a.字母表达式:AB+CDAD+CB。
b.双交换价不变。
(3)注意:①两种化合物生成另外两种化合物的反应不一定是复分解反应。
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。
(4)它与化合反应、分解反应、置换反应同属于四种基本反应类型。
【答案】(1)化合物 交换成分 化合物
任务驱动四:中和反应的应用
(1)改良酸性或碱性土壤,如常用 改良酸性土壤。
(2)废水处理。
(3)医药应用。
a.如:蚊虫叮咬后感到酸痛,是因为蚊虫向人皮肤内“注射”了甲酸。此时我们可以涂抹些碱性的 、 、 减轻疼痛。
b.胃酸过多的病人可以口服碱性的“胃舒平”[主要成分为Al(OH)3]来中和过多的胃酸(主要成分为盐酸),其原理可以用化学方程式表示为 。
(4)调节溶液的酸碱性。
【答案】(1)熟石灰
(3)a.肥皂水 稀氨水 牙膏
b.3HCl+Al(OH)3AlCl3+3H2O
任务驱动五:酸雨
(1)正常的雨水因溶有CO2会略显酸性,但这不叫酸雨(CO2+H2OH2CO3)。
(2)pH小于5.6的雨水,才称为酸雨。
(3)形成原因:煤和石油燃烧后,产生的SO2、NO2等气体被云层吸收,形成酸雨。
(4)危害:腐蚀金属、侵蚀雕像和建筑物、破坏森林和农作物、污染水源。
(5)防治措施:减少煤和石油的使用,开发利用新能源,对煤进行脱硫处理。
2
学习目标
1.了解酸、碱、盐溶液的导电性及它们的组成。
2.理解中和反应的概念及其应用。
3.理解复分解反应的概念及特征。
4.了解酸雨的形成及危害。
◎素养要求:通过实验探究,初步学会判断化学反应是否发生的一些方法。通过讨论交流,培养学生处理信息的能力和良好的学习习惯。体会化学与社会的密切关系,感受化学来源于生活,并广泛地运用于生活。
评价任务
1.独立完成自主学习。
2.合作完成任务驱动一、二、三、四、五。
3.课后完成分层作业本。
【预习导学】
课时线索
酸、碱、盐溶液的导电性→中和反应→中和反应的应用
自主学习
1.酸有一些相似的化学性质,是因为酸溶液中都含 ;在不同的碱溶液中都含 ,所以碱也具有一些相似的化学性质。
2.我们把酸与碱作用生成盐和水的反应称为 。
3.由两种化合物互相交换成分,生成另外两种化合物的反应叫作 。
4.中和反应在实际生活中应用广泛:
(1)用 改良酸性土壤;(2)废水处理;(3)医药应用。
【答案】1.H+ OH-
2.中和反应
3.复分解反应
4.(1)熟石灰
【合作探究】
任务驱动一:酸、碱、盐溶液的导电性
物质导电是带电微粒自由移动的结果,我们都知道金属可以导电是因为电子的自由移动,那么酸、碱、盐的溶液也能导电靠的又是什么呢
物质 蒸馏水 酒精 稀盐酸 稀硫酸 氢氧化 钠溶液 澄清石 灰水 氯化钠 溶液 硝酸钾 溶液
能否 导电
(1)酸、碱、盐的水溶液能导电的原因是 。
(2)不同的稀酸化学性质相似的原因是 。
(3)不同的碱溶液化学性质相似的原因是 。
【答案】不能 不能 能 能 能 能 能 能
(1)溶液中有自由移动的离子
(2)酸溶液中都含H+
(3)碱溶液中都含OH-
任务驱动二:中和反应
(1)实验:氢氧化钠溶液与稀盐酸的反应
操作步骤及现象:
a.取氢氧化钠溶液;
b.滴入酚酞溶液(溶液变为 色);
c.逐滴滴入稀盐酸,并振荡(溶液刚好变成 色,停止加酸)。
反应原理:上述反应用化学方程式表示为 。
(2)思考:上述反应为何要加入酚酞溶液呢 。
(3)中和反应的概念: 跟 生成 和 的反应。
注意:①中和反应的产物是盐和水,但有盐和水生成的反应,不一定都是中和反应。如:H2SO4+CuOCuSO4+H2O,2NaOH+CO2Na2CO3+H2O都不是中和反应。
②中和反应不属于基本反应类型。
(4)中和反应的实质:
中和反应的实质是酸溶液中的 (填离子符号,下同)与碱溶液中的 结合生成H2O的过程。
(5)总结概括酸、碱的通性
酸(五点):
①酸与指示剂的作用:石蕊溶液遇酸 ;酚酞溶液遇酸 。
②酸+活泼金属盐+氢气,如稀盐酸与铁: 。
③酸+金属氧化物盐+水,如盐酸除锈: 。
④酸+碱盐+水,如硫酸与烧碱反应: 。
⑤酸+盐新盐+新酸,如硫酸与氯化钡反应: 。
碱(四点):
①碱溶液与指示剂的作用:石蕊溶液遇碱 ,酚酞溶液遇碱 。
②碱+非金属氧化物盐+水,如 。
③碱+酸盐+水,如 。
④碱+盐新盐+新碱,如 。
【答案】(1)b.红
c.无 HCl+NaOHNaCl+H2O
(2)便于观察中和反应的进行
(3)酸 碱 盐 水
(4)H+ OH-
(5)①变红 不变色
②Fe+2HClFeCl2+H2↑
③Fe2O3+6HCl2FeCl3+3H2O
④H2SO4+2NaOHNa2SO4+2H2O
⑤H2SO4+BaCl2BaSO4↓+2HCl
碱(四点):①变蓝 变红
②2NaOH+CO2Na2CO3+H2O
③HCl+NaOHNaCl+H2O
④2NaOH+CuSO4Cu(OH)2↓+Na2SO4
任务驱动三:复分解反应
(1)概念:由两种 互相 ,生成另外两种 的反应,叫复分解反应。
(2)特点:a.字母表达式:AB+CDAD+CB。
b.双交换价不变。
(3)注意:①两种化合物生成另外两种化合物的反应不一定是复分解反应。
②中和反应一定是复分解反应,但复分解反应不一定是中和反应。
(4)它与化合反应、分解反应、置换反应同属于四种基本反应类型。
【答案】(1)化合物 交换成分 化合物
任务驱动四:中和反应的应用
(1)改良酸性或碱性土壤,如常用 改良酸性土壤。
(2)废水处理。
(3)医药应用。
a.如:蚊虫叮咬后感到酸痛,是因为蚊虫向人皮肤内“注射”了甲酸。此时我们可以涂抹些碱性的 、 、 减轻疼痛。
b.胃酸过多的病人可以口服碱性的“胃舒平”[主要成分为Al(OH)3]来中和过多的胃酸(主要成分为盐酸),其原理可以用化学方程式表示为 。
(4)调节溶液的酸碱性。
【答案】(1)熟石灰
(3)a.肥皂水 稀氨水 牙膏
b.3HCl+Al(OH)3AlCl3+3H2O
任务驱动五:酸雨
(1)正常的雨水因溶有CO2会略显酸性,但这不叫酸雨(CO2+H2OH2CO3)。
(2)pH小于5.6的雨水,才称为酸雨。
(3)形成原因:煤和石油燃烧后,产生的SO2、NO2等气体被云层吸收,形成酸雨。
(4)危害:腐蚀金属、侵蚀雕像和建筑物、破坏森林和农作物、污染水源。
(5)防治措施:减少煤和石油的使用,开发利用新能源,对煤进行脱硫处理。
2
