5-2.1氮气和氮的氧化物课件 (共23张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5-2.1氮气和氮的氧化物课件 (共23张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 40.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 18:54:45 | ||
图片预览






文档简介
(共23张PPT)
第五章 化工生产中的重要非金属元素
5.2 氮及其化合物
第1课时 氮气与其氧化物
氮原子很难得失电子形成离子键,
一般与其他原子形成共用电子对
化合价: -3、 0、+1 、 +2、 +3、 +4、 +5
位置
第二周期、第ⅤA族
结构
性质
非金属性:O>N>C;N>P
硝酸的酸性比磷酸强
氮元素的位构性
+7
2
5
O
N
C
P
自然界的存在形式
一、氮气(N2)
1、氮气的物理性质
无色、无味、无毒的气体,难溶于水,比空气稍轻,熔沸点低。
思考:写出N2的电子式? 结构式 预测N2的化学性质?
:N :: N:
‥
N≡N
N2常温不活泼,很难与其它物质发生化学反应。----作保护气
(焊接金属、填充灯泡、保鲜食品等)
一、氮气(N2)
2、氮气的化学性质
1)常温不活泼,很难与其它物质发生化学反应。
2)高温或放电等条件下能与Mg、H2、O2等物质发生化合反应
N2的还原性
N2的氧化性
③与Mg反应:
N2+O2======== 2NO
放电
N2+3H2 2NH3
N2+3Mg === Mg3N2
①与O2反应:
②与H2反应:
高温、高压
催化剂
点燃
(或高温)
:N :: N:
‥
CO2+2Mg === 2MgO+C
点燃
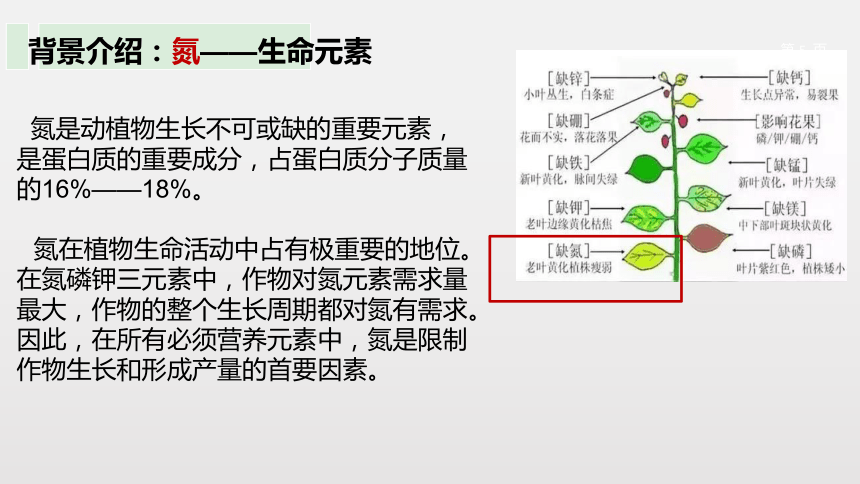
背景介绍:氮——生命元素
氮是动植物生长不可或缺的重要元素,是蛋白质的重要成分,占蛋白质分子质量的16%——18%。
氮在植物生命活动中占有极重要的地位。在氮磷钾三元素中,作物对氮元素需求量最大,作物的整个生长周期都对氮有需求。因此,在所有必须营养元素中,氮是限制作物生长和形成产量的首要因素。
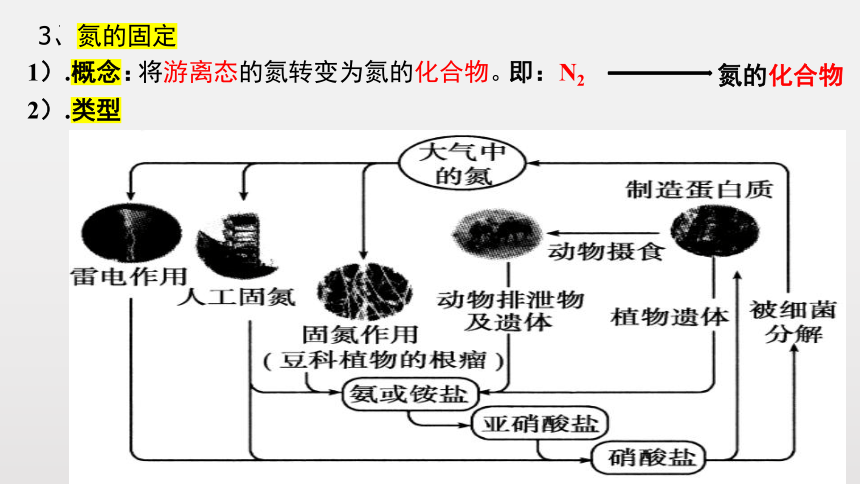
3、氮的固定
1).概念:
2).类型
将游离态的氮转变为氮的化合物。
(1)自然固氮
①雷电作用:
②生物固氮:
如豆科植物的根瘤菌固氮。
(2)人工固氮:
工业上合成氨。
N2+3H2
高温、高压
催化剂
2NH3
即:N2
氮的化合物
氮的固定
N2+O2=== 2NO
放电
哈伯
(F.Haber,1868-1934)
种豆子不上肥,
连种几年地更肥
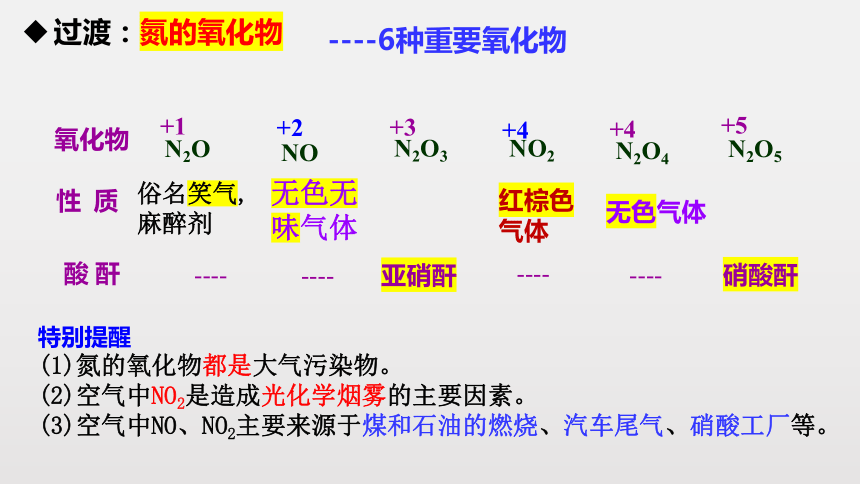
----6种重要氧化物
氧化物
性 质
N2O
NO
N2O3
NO2
N2O4
N2O5
+1
+2
+3
+4
+4
+5
----
亚硝酐
硝酸酐
----
----
----
酸 酐
俗名笑气,
麻醉剂
红棕色
气体
无色气体
无色无味气体
过渡:氮的氧化物
特别提醒
(1)氮的氧化物都是大气污染物。
(2)空气中NO2是造成光化学烟雾的主要因素。
(3)空气中NO、NO2主要来源于煤和石油的燃烧、汽车尾气、硝酸工厂等。
二、一氧化氮和二氧化氮
1. NO和NO2的物理性质
颜色 毒性 气味 水溶性
NO 无色 有 无味 不溶
NO2 红棕色 有 有刺激性气味 易溶
特别提醒:
① NO有毒,使人中毒原理与CO相似;
② NO不能与O2大量共存,收集气体只能用排水法;
③ NO2密度比空气大、易液化、易溶于水。
操作一:在一支50 mL的注射器里充入20mLNO,观察颜色,
然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器。操作二:打开弹簧夹,快速吸入10mL空气,夹上弹簧夹。
操作三:振荡注射器,再观察现象。
【实验5-5】
P13
操作 操作一 操作二 操作三
现象
原因
无色气体,
无明显变化
NO难溶于水
气体变为红棕色
2NO+O2 = 2NO2
红棕色消失,得到无色溶液,体积小于35mL
3NO2+H2O=2HNO3+NO
(工业制取硝酸)
操作一:在一支50 mL的注射器里充入20mLNO,观察颜色, 然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器。
操作二:打开弹簧夹,快速吸入10mL空气,夹上弹簧夹。
操作三:振荡注射器,再观察现象。
【实验5-5】
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
×3
×2
+)
4NO + 3O2 + 2H2O = 4HNO3
NO
将尾气(NO)中通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,可充分利用原料,并减少NO的排放,保护环境。
NH3
NO
NO2
HNO3+NO
O2
O2
H2O
O2
【思考与讨论】
实验5-5对工业生产硝酸有什么启示?
③
①
②
4NH3 + 5O2 4NO + 6H2O
Pt
△
3NO2 +H2O = 2HNO3 +NO
2NO +O2 = 2NO2
①
②
③
理论上,原料中每1molNH3可以制得1molHNO3
N2 + O2 ======= 2NO
放电或高温
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
探索节气背后的科学原理
硝酸与土壤中矿物质作用形成可溶性硝酸盐,成为氮肥被植物吸收.
(无色气体)
(红棕色气体)
3.氮氧化物对环境的污染
(1)光化学烟雾:NOx在紫外线作用下与碳氢化合物发生一系列光化学反应,产生光化学烟雾。
(2)酸雨:NOx排入大气中后,与水反应生成HNO3,随雨雪降到地面形成酸雨。
(3)破坏臭氧层:NO2(作催化剂)可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
(4)NO与血红蛋白结合使人中毒。
氮的氧化物都有毒,是大气污染物
2NO2+2NaOH= NaNO3+NaNO2+H2O
NO2+NO+2NaOH= 2NaNO2+H2O
(1)催化转化法→汽车尾气处理
8NH3+6NO2= 7N2+12H2O
2CO+2NO = N2+2CO2
4、NO、NO2废气处理方法
汽车尾气含有CO、NO、N2和CO2,其中主要污染成分包括CO、NO)排放也是目前人类面临的环境问题之一。有一种汽车尾气处理装置,
(2)碱液(NaOH)吸收法→化工厂废气处理
NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是: 。
n(NO2)≥n(NO)
【判断】NO2与溴蒸气的鉴别可用NaOH溶液吗?
Br2+2NaOH==NaBr +NaBrO+H2O(类Cl2)
二者与NaOH溶液反应均得无色溶液,所以NaOH溶液无法鉴别。
2NO2+2NaOH= NaNO3+NaNO2+H2O
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
×3
×2
+)
4NO + 3O2 + 2H2O = 4HNO3
思考:①如图,将充满NO的1L试管倒置于水槽中,不断通入O2,这个过程中要通入多少O2, NO才能完全转变成HNO3呢?
∴ V(NO):V(O2) = 4:3
NO
1L
5.相关计算
结论:
V(NO):V(O2)=4:3 恰好反应,无气体剩余
V(NO):V(O2)<4:3 O2过量,剩余O2
V(NO):V(O2)>4:3 NO过量,NO剩余
②若试管中盛的是NO2,在这个过程中又要通入多少的O2,NO2才能完全转变成HNO3呢?
NO2
1L
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
×2
4NO2 + O2 + 2H2O = 4HNO3
+)
∴ V(NO2):V(O2) = 4:1
5.相关计算
结论:
V(NO2):V(O2)=4:1 恰好反应,无气体剩余
V(NO2):V(O2)<4:1 O2过量,剩余O2
V(NO2):V(O2)>4:1 NO2过量,NO剩余
4NO2 + O2 + 2H2O = 4HNO3………②
4NO + 3O2 + 2H2O = 4HNO3……… ①
例题:将容积为20mL的收集满 NO 气体的试管,倒置于盛水的水槽中,再向试管中通入一定量的O2 ,充分反应后,试管中的水刚好是试管的一半,问通入的O2体积可能为多少?
3NO2 + H2O = 2HNO3 + NO………③
4NO + 3O2 + 2H2O = 4HNO3
1)若余10ml为NO ,
则V(O2)=
3
4
4 : 3
(20-10)
×
=7.5ml
2)若余10ml为O2 ,
则V(O2)=
3
4
20
×
+ 10
=25ml
5.相关计算
练习1:步步高大册16页,深度思考2.(2)
【判断】NO2与溴蒸气的鉴别可用NaOH溶液吗?
Br2+2NaOH==NaBr +NaBrO+H2O(类Cl2)
NO2+ NaOH —
二者与NaOH溶液反应均得无色溶液,所以NaOH溶液无法鉴别。
NO2
AgNO溶液:
Br2蒸气
水:
CCl4:
3NO2+H2O===2HNO3+NO
无色溶液
溴水,
橙色
不溶
可溶,
橙色
无色溶液
Br2+2NaOH==NaBr +NaBrO+H2O
淡黄色沉淀( AgBr )
鉴别
练习2:将容积为12mL的试管收集满 NO 和O2混合气体,倒置于盛水的水槽中,充分反应后,试管中余2ml气体,问其中O2体积可能为多少?
换:NO2和O2混合气体
4NO + 3O2 + 2H2O = 4HNO3
4NO2 + O2 + 2H2O = 4HNO3
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
N2 + O2 ======= 2NO
放电或高温
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
探索节气背后的科学原理
硝酸与土壤中矿物质作用形成可溶性硝酸盐,成为氮肥被植物吸收.
(无色气体)
(红棕色气体)
1:一个容积为18mL装满NO2气体的试管,倒立于装满水的水槽中,经过一段时间后,反应已进行完全,液面上升一段距离,问:试管中剩余哪种气体?体积为多少? 生成溶液的物质的量浓度为多少?
3、将盛有20mLNO气体的试管倒置于盛有水的水槽中,向试管中缓慢通入一定量的氧气后,最后试管里充满了水,问通入多少氧气?
2、将20mL NO2和O2的混合气体通入水中无剩余,则原混合气体中NO2和O2各为多少毫升?若剩余5mL气体呢?
第五章 化工生产中的重要非金属元素
5.2 氮及其化合物
第1课时 氮气与其氧化物
氮原子很难得失电子形成离子键,
一般与其他原子形成共用电子对
化合价: -3、 0、+1 、 +2、 +3、 +4、 +5
位置
第二周期、第ⅤA族
结构
性质
非金属性:O>N>C;N>P
硝酸的酸性比磷酸强
氮元素的位构性
+7
2
5
O
N
C
P
自然界的存在形式
一、氮气(N2)
1、氮气的物理性质
无色、无味、无毒的气体,难溶于水,比空气稍轻,熔沸点低。
思考:写出N2的电子式? 结构式 预测N2的化学性质?
:N :: N:
‥
N≡N
N2常温不活泼,很难与其它物质发生化学反应。----作保护气
(焊接金属、填充灯泡、保鲜食品等)
一、氮气(N2)
2、氮气的化学性质
1)常温不活泼,很难与其它物质发生化学反应。
2)高温或放电等条件下能与Mg、H2、O2等物质发生化合反应
N2的还原性
N2的氧化性
③与Mg反应:
N2+O2======== 2NO
放电
N2+3H2 2NH3
N2+3Mg === Mg3N2
①与O2反应:
②与H2反应:
高温、高压
催化剂
点燃
(或高温)
:N :: N:
‥
CO2+2Mg === 2MgO+C
点燃
背景介绍:氮——生命元素
氮是动植物生长不可或缺的重要元素,是蛋白质的重要成分,占蛋白质分子质量的16%——18%。
氮在植物生命活动中占有极重要的地位。在氮磷钾三元素中,作物对氮元素需求量最大,作物的整个生长周期都对氮有需求。因此,在所有必须营养元素中,氮是限制作物生长和形成产量的首要因素。
3、氮的固定
1).概念:
2).类型
将游离态的氮转变为氮的化合物。
(1)自然固氮
①雷电作用:
②生物固氮:
如豆科植物的根瘤菌固氮。
(2)人工固氮:
工业上合成氨。
N2+3H2
高温、高压
催化剂
2NH3
即:N2
氮的化合物
氮的固定
N2+O2=== 2NO
放电
哈伯
(F.Haber,1868-1934)
种豆子不上肥,
连种几年地更肥
----6种重要氧化物
氧化物
性 质
N2O
NO
N2O3
NO2
N2O4
N2O5
+1
+2
+3
+4
+4
+5
----
亚硝酐
硝酸酐
----
----
----
酸 酐
俗名笑气,
麻醉剂
红棕色
气体
无色气体
无色无味气体
过渡:氮的氧化物
特别提醒
(1)氮的氧化物都是大气污染物。
(2)空气中NO2是造成光化学烟雾的主要因素。
(3)空气中NO、NO2主要来源于煤和石油的燃烧、汽车尾气、硝酸工厂等。
二、一氧化氮和二氧化氮
1. NO和NO2的物理性质
颜色 毒性 气味 水溶性
NO 无色 有 无味 不溶
NO2 红棕色 有 有刺激性气味 易溶
特别提醒:
① NO有毒,使人中毒原理与CO相似;
② NO不能与O2大量共存,收集气体只能用排水法;
③ NO2密度比空气大、易液化、易溶于水。
操作一:在一支50 mL的注射器里充入20mLNO,观察颜色,
然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器。操作二:打开弹簧夹,快速吸入10mL空气,夹上弹簧夹。
操作三:振荡注射器,再观察现象。
【实验5-5】
P13
操作 操作一 操作二 操作三
现象
原因
无色气体,
无明显变化
NO难溶于水
气体变为红棕色
2NO+O2 = 2NO2
红棕色消失,得到无色溶液,体积小于35mL
3NO2+H2O=2HNO3+NO
(工业制取硝酸)
操作一:在一支50 mL的注射器里充入20mLNO,观察颜色, 然后吸入5mL水,用乳胶管和弹簧夹封住管口,振荡注射器。
操作二:打开弹簧夹,快速吸入10mL空气,夹上弹簧夹。
操作三:振荡注射器,再观察现象。
【实验5-5】
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
×3
×2
+)
4NO + 3O2 + 2H2O = 4HNO3
NO
将尾气(NO)中通入适量的氧气后再溶解于水,经过多次循环氧化、溶解,可充分利用原料,并减少NO的排放,保护环境。
NH3
NO
NO2
HNO3+NO
O2
O2
H2O
O2
【思考与讨论】
实验5-5对工业生产硝酸有什么启示?
③
①
②
4NH3 + 5O2 4NO + 6H2O
Pt
△
3NO2 +H2O = 2HNO3 +NO
2NO +O2 = 2NO2
①
②
③
理论上,原料中每1molNH3可以制得1molHNO3
N2 + O2 ======= 2NO
放电或高温
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
探索节气背后的科学原理
硝酸与土壤中矿物质作用形成可溶性硝酸盐,成为氮肥被植物吸收.
(无色气体)
(红棕色气体)
3.氮氧化物对环境的污染
(1)光化学烟雾:NOx在紫外线作用下与碳氢化合物发生一系列光化学反应,产生光化学烟雾。
(2)酸雨:NOx排入大气中后,与水反应生成HNO3,随雨雪降到地面形成酸雨。
(3)破坏臭氧层:NO2(作催化剂)可使平流层中的臭氧减少,导致地面紫外线辐射量增加。
(4)NO与血红蛋白结合使人中毒。
氮的氧化物都有毒,是大气污染物
2NO2+2NaOH= NaNO3+NaNO2+H2O
NO2+NO+2NaOH= 2NaNO2+H2O
(1)催化转化法→汽车尾气处理
8NH3+6NO2= 7N2+12H2O
2CO+2NO = N2+2CO2
4、NO、NO2废气处理方法
汽车尾气含有CO、NO、N2和CO2,其中主要污染成分包括CO、NO)排放也是目前人类面临的环境问题之一。有一种汽车尾气处理装置,
(2)碱液(NaOH)吸收法→化工厂废气处理
NO2、NO的混合气体能被足量烧碱溶液完全吸收的条件是: 。
n(NO2)≥n(NO)
【判断】NO2与溴蒸气的鉴别可用NaOH溶液吗?
Br2+2NaOH==NaBr +NaBrO+H2O(类Cl2)
二者与NaOH溶液反应均得无色溶液,所以NaOH溶液无法鉴别。
2NO2+2NaOH= NaNO3+NaNO2+H2O
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
×3
×2
+)
4NO + 3O2 + 2H2O = 4HNO3
思考:①如图,将充满NO的1L试管倒置于水槽中,不断通入O2,这个过程中要通入多少O2, NO才能完全转变成HNO3呢?
∴ V(NO):V(O2) = 4:3
NO
1L
5.相关计算
结论:
V(NO):V(O2)=4:3 恰好反应,无气体剩余
V(NO):V(O2)<4:3 O2过量,剩余O2
V(NO):V(O2)>4:3 NO过量,NO剩余
②若试管中盛的是NO2,在这个过程中又要通入多少的O2,NO2才能完全转变成HNO3呢?
NO2
1L
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
×2
4NO2 + O2 + 2H2O = 4HNO3
+)
∴ V(NO2):V(O2) = 4:1
5.相关计算
结论:
V(NO2):V(O2)=4:1 恰好反应,无气体剩余
V(NO2):V(O2)<4:1 O2过量,剩余O2
V(NO2):V(O2)>4:1 NO2过量,NO剩余
4NO2 + O2 + 2H2O = 4HNO3………②
4NO + 3O2 + 2H2O = 4HNO3……… ①
例题:将容积为20mL的收集满 NO 气体的试管,倒置于盛水的水槽中,再向试管中通入一定量的O2 ,充分反应后,试管中的水刚好是试管的一半,问通入的O2体积可能为多少?
3NO2 + H2O = 2HNO3 + NO………③
4NO + 3O2 + 2H2O = 4HNO3
1)若余10ml为NO ,
则V(O2)=
3
4
4 : 3
(20-10)
×
=7.5ml
2)若余10ml为O2 ,
则V(O2)=
3
4
20
×
+ 10
=25ml
5.相关计算
练习1:步步高大册16页,深度思考2.(2)
【判断】NO2与溴蒸气的鉴别可用NaOH溶液吗?
Br2+2NaOH==NaBr +NaBrO+H2O(类Cl2)
NO2+ NaOH —
二者与NaOH溶液反应均得无色溶液,所以NaOH溶液无法鉴别。
NO2
AgNO溶液:
Br2蒸气
水:
CCl4:
3NO2+H2O===2HNO3+NO
无色溶液
溴水,
橙色
不溶
可溶,
橙色
无色溶液
Br2+2NaOH==NaBr +NaBrO+H2O
淡黄色沉淀( AgBr )
鉴别
练习2:将容积为12mL的试管收集满 NO 和O2混合气体,倒置于盛水的水槽中,充分反应后,试管中余2ml气体,问其中O2体积可能为多少?
换:NO2和O2混合气体
4NO + 3O2 + 2H2O = 4HNO3
4NO2 + O2 + 2H2O = 4HNO3
3NO2 + H2O = 2HNO3 + NO
2NO + O2 = 2NO2
N2 + O2 ======= 2NO
放电或高温
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
探索节气背后的科学原理
硝酸与土壤中矿物质作用形成可溶性硝酸盐,成为氮肥被植物吸收.
(无色气体)
(红棕色气体)
1:一个容积为18mL装满NO2气体的试管,倒立于装满水的水槽中,经过一段时间后,反应已进行完全,液面上升一段距离,问:试管中剩余哪种气体?体积为多少? 生成溶液的物质的量浓度为多少?
3、将盛有20mLNO气体的试管倒置于盛有水的水槽中,向试管中缓慢通入一定量的氧气后,最后试管里充满了水,问通入多少氧气?
2、将20mL NO2和O2的混合气体通入水中无剩余,则原混合气体中NO2和O2各为多少毫升?若剩余5mL气体呢?
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
