第二章《化学反应的方向、限度与速率》测试题(含解析)2023--2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第二章《化学反应的方向、限度与速率》测试题(含解析)2023--2024学年上学期高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 22:19:03 | ||
图片预览




文档简介
第二章《化学反应的方向、限度与速率》测试题
一、单选题
1. ,当反应达到平衡时,改变一种反应条件,下列示意图正确的是
A B C D
表示随温度升高,平衡常数的变化 表示时刻加入催化剂,反应速率随时间的变化 表示恒压条件下,反应物的转化率随充入惰性气体体积的变化 表示CO的体积分数随充入量的变化
A.A B.B C.C D.D
2.对于可逆反应,下列叙述正确的是
A.达到化学平衡时,
B.若单位时间内生成的同时,消耗,则反应达到平衡状态
C.达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是
3.下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.对于2HI(g)H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
4.将E(s)和F(g)加入密闭容器中,在一定条件下发生反应:,已知该反应的平衡常数如表。下列说法正确的是:
温度/℃ 25 80 230
平衡常数/() 2
A.正反应是吸热反应
B.达到化学平衡时,
C.80℃时,测得某时刻F、G的浓度均为0.5mol/L,此时
D.25℃时,反应的平衡常数是
5.向K2S2O8和KI的混合溶液中滴加FeCl3溶液,反应过程中的能量变化如图所示,下列有关该反应的说法正确的是
A.反应过程中v() = v(I-) = v(I2)
B.Fe3+是该反应的催化剂,所以c(Fe3+)与反应速率无关
C.若不加FeCl3,则正反应的活化能比逆反应的活化能大
D.步骤① 2Fe3+(aq) + 2I-(aq) = I2(aq) + 2Fe2+(aq) ΔH1;步骤② 2Fe2+(aq) + (aq) = 2Fe3+ + 2 (aq) ΔH2 ,则ΔH1> ΔH2
6.下列说法中不正确的是
A.一个反应能否自发进行,与焓变和熵变的共同影响有关
B.若△H>0,△S<0,任何温度下都不能自发进行
C.2Na2O2+2H2O = 4NaOH+O2↑在常温下能自发进行,既能用焓判据解释又能又熵判据解释
D.2NO(g) +2CO(g) = N2(g) + 2CO2(g) 在常温下能自发进行,则该反应的△H>0
7.下列说法正确的是( )
A.H2(g)+I2(g) 2HI(g) ,其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g) H2(g)+CO(g) ,碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应 2A( )+B(g) 2C( ) 已达平衡,则AC 不能同时是气体
D.C(s)+H2O(g) H2(g)+CO(g) ,将固态碳粉碎,不可加快化学反应速率。
8.二氧化硫是一种重要的化工原料,可以制取硫酸等化工产品。其中,催化制取三氧化硫的热化学方程式为:,二氧化硫也是形成酸雨的主要污染物,可以通过氨气水溶液进行吸收。实验室可以用浓硫酸与铜加热制取少量二氧化硫。在恒温恒压的密闭容器中,二氧化硫转化成三氧化硫,下列相关说法正确的是
A.该反应中,反应物的总能量<产物的总能量
B.使用优质催化剂,平衡时体系中的值增大
C.相同时间内,当消耗同时生成时,反应处于平衡状态
D.升高温度,能加快反应速率,提高二氧化硫的平衡转化率
9.硫元素的几种化合物存在下列转化关系。下列说法正确的是
浓H2SO4SO2Na2SO3溶液Na2S2O3溶液S
A.反应①中生成的SO2具有漂白性,可使溴水褪色
B.反应②中若SO2少量,就会生成NaHSO3
C.反应④中生成 S 既是氧化产物,也是还原产物
D.反应④中当消耗 1mol 稀硫酸时,电子转移为2mol
10.温度为T,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是
A.T时,该反应的化学平衡常数为
B.图中c点所示条件下,v(正)>v(逆)
C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大
D.容器内的压强:Pa:Pb<6:7
11.在容积为1L恒容容器内进行反应4A(g)+3B(s)2C(g)+D(g),经2min后,A的浓度减少了0.8mol L-1。下列反应速率的表示正确的是
A.在这2min内,用单位时间内A的物质的量变化表示的平均反应速率是0.4mol L-1 min-1
B.2min末时的反应速率,用A表示为0.2mol L-1 min-1
C.在这2min内,用B表示的平均反应速率是0.3mol L-1 min-1
D.在这2min内,C的浓度变化量为0.6mol L-1
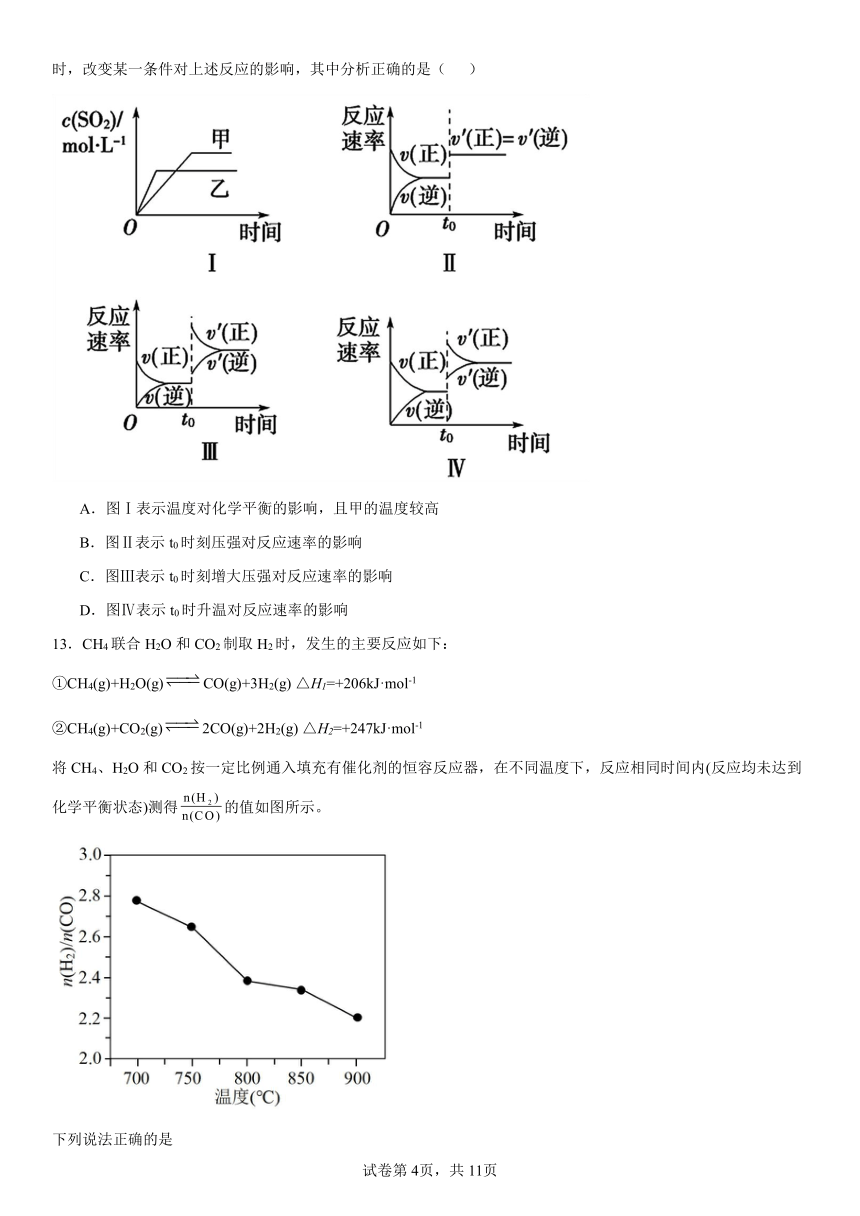
12.在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻压强对反应速率的影响
C.图Ⅲ表示t0时刻增大压强对反应速率的影响
D.图Ⅳ表示t0时升温对反应速率的影响
13.CH4联合H2O和CO2制取H2时,发生的主要反应如下:
①CH4(g)+H2O(g)CO(g)+3H2(g) △H1=+206kJ·mol-1
②CH4(g)+CO2(g)2CO(g)+2H2(g) △H2=+247kJ·mol-1
将CH4、H2O和CO2按一定比例通入填充有催化剂的恒容反应器,在不同温度下,反应相同时间内(反应均未达到化学平衡状态)测得的值如图所示。
下列说法正确的是
A.由①②可知,CO(g)+H2O(g)CO2(g)+H2(g) △H=+41kJ·mol-1
B.反应条件不变,若反应足够长时间,①比②先达到化学平衡状态
C.其他条件不变时,升高温度,①的化学反应速率减小,②的化学反应速率增大
D.其他条件不变时,增大原料中H2O的浓度可以提高产物中的值
14.甲烷和水蒸气催化制氢是未来解决能源危机的理想方法之一,其主要反应为:
i.
ii.
一定温度下,往刚性密闭容器中充入甲烧和水蒸气,发生催化反应。下列说法正确的是
A.反应i在任意条件下都可以自发
B.降低温度,反应ii的正化学反应速率升高、逆化学反应速率降低
C.选择合适的催化剂能提高的平衡转化率
D.达到平衡状态后,升高温度,的值变大
15.下列所示装置不能达到实验目的的是
A.图甲装置验证铁的吸氧腐蚀
B.图乙装置实验室制备
C.图丙装置制取无水氯化镁
D.图丁装置探究浓度对化学反应速率的影响
二、填空题
16.由于温室效应和资源短缺,如何降低大气中CO2的含量并加以开发利用等问题,引起了全世界的普遍重视。目前工业上用CO为原料生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。
(1)图甲是反应时CO和CH3OH的浓度随时间的变化情况。从反应开始到达到平衡状态,用CO浓度的变化表示反应的平均反应速率v(CO)= 。
(2)如图乙是该反应进行过程中能量的变化。曲线 (填“a”或“b”)表示不使用催化剂时反应的能量变化,不使用催化剂时该反应的逆反应的活化能为 kJ/mol。
(3)该反应的平衡常数K的表达式为 ,升高温度,平衡常数K (填“增大”“减小”或“不变”)。
(4)恒容条件下,下列措施能使 增大的有 。
A.升高温度 B.充入He C.再充入1 mol CO和2 mol H2 D.使用催化剂
17.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g);△H<0
其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
t/K 298 398 498 …
K/(mol·L-1)2 4.1×106 K1 K2 …
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.混合气体中氢气的质量不变
C.容器内压强保持不变
D.混合气体的密度保持不变
③某温度下,在一个10L的固定容器中充入2molN2和4molH2进行如下反应 N2(g)+3H2(g) 2NH3(g);△H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K= (mol/L)-2 ,平衡时NH3的体积分数为 。
(2)①肼(N2H4)高效清洁的火箭燃料。8g气态肼在氧气中完全燃烧生成氮气和气态水,放出133.5kJ热量,则肼燃烧的热化学方程式为 。
②盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,则盐酸肼中含有的化学键类型有 。
18.I.可逆反应∶mA(g)+nB(g) pC(g)+qD(s) H,试根据图回答∶
[A的转化率(%)表示为α(A)、A的含量(%)表示为φ(A)]
(1)压强P1 P2(填“>”,“<”或“=”下同)
(2)计量数(m+n) (p)
(3)温度t1℃ t2℃
(4)ΔH 0
II.反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(5)该反应是 反应(填“吸热”,“放热”);
(6)当反应达到平衡时,只升高温度,化学平衡向 (填“正反应方向”或“逆反应方向”)移动。
(7)反应体系中加入催化剂该反应的反应热 (填增大”“减小”“不变”);
19.合成氨是人类科技发展史上的一项重大突破,已知:25℃时,合成氨反应的热化学为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,请回答下列问题:
(1)其他条件不变时,升高温度,化学反应速率 (填“增大”或“减小”);
(2)25℃时,取1mol N2和3mol H2置于2L的密闭容器中,在催化剂存在下进行反应,达到平衡时放出的热量
A.大于92.4 kJ B.等于92.4 kJ C.小于92.4 kJ
(3)一定条件下,上述反应达到化学平衡状态的标志是 ;
A.N2、H2、NH3的浓度相等
B.容器内压强不再变化
C.单位时间内消耗amol N2,同时生成2amol NH3
(4)25℃时,上述反应平衡常数的表达式为:K= 。
20.某温度时,向某VL的密闭容器中充入3mol和3mol,发生反应:,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
(1)V= L。
(2)该反应达到最大限度的时间是 s,该时间内平均反应速率 。
(3)该反应达到平衡状态时, (填“吸收”或“放出”)的热量为 kJ。
(4)判断该反应达到平衡的依据是 (填序号)。
①H2消耗的速率和消耗的速率相等
②H2、I2、HI的浓度比为1:1:2
③H2、I2、HI的浓度都不再发生变化
④该条件下正、逆反应速率都为零
(5)增大压强平衡移动方向 (正向、逆向、不移动)。
21.运用化学反应原理研究化学反应有着非常重要的意义。
(一)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
①2SO2(g)+O2(g)2SO3(g)的ΔH 0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不”)。
②若反应进行到状态D时,v(正) v(逆)(填“>”“<”或“=”)。
(二)工业上合成氨技术叫哈伯法:N2(g)+3H2(g)2NH3(g) ΔH<0,此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 (填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)= 。
从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为 (填编号)。
A.a B.b C.c D.d
22.近几年全国各地都遭遇“十面霾伏”。其中机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
⑴ 汽车尾气净化的主要原理为:2NO(g) + 2CO(g)2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)一定条件下氮氧化物和碳氧化物可以反应,已知2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量。生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的倍。请写出该反应的热化学方程式 。
(3)电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。
① NO2、O2和熔融NaNO3可制作燃料电池,其原理见上方右图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为 。
② 电解NO制备NH4NO3原理如上方左图所示。石墨III为 极 ,石墨IV的电极反应式为 。为使电解产物完全转化为NH4NO3,需要补充的物质X的化学式为 。
23.血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb占总Hb或Mb的比例)和氧分压p(O2)密切相关。
I .Hb与氧气的结合能力还受到c(H+)的影响,平衡如下:
HbO2(aq)+H+(aq) HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
(1)图1中pH=7.6时的曲线为 (填“a”或“b”)。
(2)血液中还存在平衡:CO2+H2OH2CO3H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因 。
II.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
(3)若肌肉中Mb的初始浓度为c0 mol/L,结合度达到50%所需的时间为t min,此段时间内用MbO2表示的平均反应速率为 。
(4)图2中a随p(O2)增大而增大的原因是 。
(5) Mb与氧气结合的平衡常数的表达式K=,计算37℃时K= 。
(6) Mb与氧气结合达平衡时结合度a= [用含p(O2)和K的代数式表示]。
人正常呼吸时,温度约为37℃,空气中氧分压约为20.0kPa,计算此时Mb与氧气的最大结合度为 。
24.理论解释——有效碰撞理论
(1)活化分子、活化能、有效碰撞
①活化分子:能够发生有效碰撞的分子(必须具有足够的能量)。
②活化能:如图
图中:表示 ,使用催化剂时的活化能为 ,反应热为 (注:表示活化分子变成生成物分子放出的能量)
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
增大反应物的浓度 升高反应体系的温度
吸收能量
单位体积内 增加,活化分子 不变,活化分子数增加 单位时间内单位体积内有效碰撞次数增多 单位体积内 不变,活化分子 增加,活化分子数增加
降低活化能
增大气体压强 增大化学反应速率 使用催化剂
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.该反应为吸热反应,温度升高平衡正向移动,K增大,故A错误;
B.催化剂对速率的影响是瞬间改变正逆反应速率,对平衡无影响,因此速率不会逐渐增大,故B错误;
C.恒压条件下充入惰性气体,容器体积增大,等同于减压,平衡向气体分子数增大的正向移动,反应物的转化率增大,故C错误;
D.随着氯气的量的增大,总气体的物质的量增大,平衡逆向移动CO的物质的量减小,CO的体积分数减小,故D正确;
故选:D。
2.A
【详解】A.达到平衡状态时,不同物质的正逆反应速率之比等于其计量数之比,则达到平衡状态时,A正确;
B.无论是否达到平衡状态都存在单位时间内生成 n molNO的同时,消耗n molNH3,所以不能据此判断平衡状态,B错误;
C.达到平衡状态时,增加容器体积,各物质的物质的量浓度减小,物质的量浓度与化学反应速率成正比,所以正逆反应速率都减小,C错误;
D.反应达到平衡状态时,不同物质的正逆反应速率之比等于其计量数之比,如果反应达到平衡状态时存在,D错误;
故选A。
3.D
【详解】A项,啤酒瓶中存在平衡H2O+CO2H2CO3,打开啤酒瓶时,泛起大量泡沫,是因为压强降低,平衡向生成二氧化碳方向移动,可以用勒夏特列原理解释,故A正确;B项,合成氨反应为放热反应,降低温度平衡正向移动,可提高氨的产率,能用勒夏特列原理解释,故B正确;C项,工业上生产硫酸存在平衡2SO2+O22SO3,使用过量的空气,增大氧气的浓度,平衡正向移动,可以提高二氧化硫的利用率,能用勒夏特列原理解释,故C正确;D项,因为反应2HI(g)H2(g)+I2(g)是气体分子数不变的反应,缩小容器体积,平衡不移动,颜色变深是由体积变小使I2浓度增大引起的,不能用勒夏特利原理解释,故D错误。
点睛:本题考查勒夏特列原理的使用条件,化学平衡移动原理又称勒夏特列原理,使用勒夏特列原理分析问题的前提必须是可逆反应且存在平衡移动,否则不能用勒夏特列原理解释,例如题中A、B、C三项都涉及改变条件时可逆反应的平衡移动问题,而D项改变条件平衡不移动。
4.B
【详解】A.升高温度,K减小,说明平衡逆移,正反应为放热反应,故A错误;
B.达到化学平衡时正逆反应速率相等,,故B正确;
C.80℃时,测得某时刻F、G的浓度均为0.5mol/L,此时Qc==8>K=2,则平衡逆移,v逆>v正,故C错误;
D.由分析知25℃时,反应的平衡常数==2×10-5,故D错误;
故选B。
5.D
【分析】根据图象,反应①发生2I-+2Fe3+=2Fe2++I2,反应②发生+2Fe2+=2Fe3++2,总反应是2I-+=I2+2,Fe3+为催化剂,据此分析;
【详解】A.反应速率之比等于化学计量数之比,v(I-)=2v(I2)=2v(),故A错误;
B.根据上述分析,Fe3+是该反应的催化剂,化学反应速率与c(Fe3+)大小有关,c(Fe3+)大,催化效果更好,反应速率快,故B错误;
C.根据该图象,2I-+=I2+2为放热反应,正反应的活化能小于逆反应的活化能,焓变只与始态和终态有关,与反应途径无关,与有无催化剂无关,故C错误;
D.根据图象,反应①为吸热反应,即△H1>0,反应②为放热反应,即△H2<0,因此有△H1>△H2,故D正确;
答案为D。
6.D
【详解】A.△H-T△S<0的反应可自发进行,则反应能否自发进行与焓变和熵变的共同影响有关,故A正确;
B.若△H>0,△S<0,则△H-T△S>0,可知任何温度下都不能自发进行,故B正确;
C.2Na2O2+2H2O═4NaOH+O2↑该反应为是放热反应,而且熵增大,所以根据熵判据和焓判据都是自发反应,故C正确;
D.反应2NO(g) +2CO(g) = N2(g) + 2CO2(g)中气体减小,则反应的△S<0,若使△H-T△S<0,则△H<0,故D错误。
答案选D。
7.B
【详解】A. H2(g)+I2(g) 2HI(g),反应前后气体体积不变,缩小应容器体积,压强增大,正逆反应速率都增大,故A错误;
B. C(s)+H2O(g) H2(g)+CO(g) ,碳的质量不再改变时,说明正逆反应速率相等,反应达到平衡,故B正确;
C. 若压强不再改变说明反应达到平衡,表明反应前后气体的计量数不等,则A、C可以均为气体,故C错误;
D. 固态碳粉碎后增大了反应物的接触面积,可加快化学反应速率,故D错误;
正确答案是B。
【点睛】一、判断化学平衡状态的本质标志:
1、正逆反应速率相等,也就是v(正)=v(逆)
2、各组分的物质的量浓度保持一定,也就是不再发生改变。
二、判断化学平衡状态的等价标志(衍生标志)。
1、与v(正)=v(逆)等价的标志
(1)从物质的生成速率和消耗速率角度进行判断。
(2)从同一时间物质的变化角度进行判断。
(3)从正逆反应速率的变化角度进行判断。正逆反应速率不再发生改变。
(4)从物质的微观变化角度进行判断。
2、与各组分的物质的量浓度保持一致等价的标志
(1)从质量角度进行判断。
(2)从物质的量角度进行判断。
(3)对于有气体参加的反应,且反应前后气体体积发生改变的反应,还可以采用以下特殊的判断标志。如:总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)保持不变。
8.C
【详解】A. 该反应为放热反应,反应物的总能量>产物的总能量,A错误;
B. 使用优质催化剂,能加快反应速率,但不影响平衡、则平衡时体系中的值不变,B错误;
C. 相同时间内,当消耗同时生成时,即v逆(O2)= v正(SO2)=v正 (O2),则正反应速率和逆反应速率相等、反应处于平衡状态,C正确;
D.升高温度,能加快反应速率,因为正反应是放热反应、温度升高时平衡左移、则降低了二氧化硫的平衡转化率,D错误;
答案选C。
9.D
【详解】A.反应①中生成的二氧化硫与溴水反应生成硫酸和氢溴酸,反应中溴水褪色是二氧化硫表现还原性,故A错误;
B.反应②中少量二氧化硫与氢氧化钠溶液反应生成亚硫酸钠,不能生成亚硫酸氢钠,故B错误;
C.反应④中硫代硫酸钠溶液与稀硫酸反应生成硫酸钠、硫沉淀、二氧化硫气体和水,硫代硫酸钠转化为硫时,硫元素的化合价降低被还原,硫是反应的还原产物,故C错误;
D.反应④中硫代硫酸钠溶液与稀硫酸反应生成硫酸钠、硫沉淀、二氧化硫气体和水,反应的化学方程式为Na2S2O3+H2SO4(稀)=Na2SO4+S↓+SO2↑+H2O,由方程式可知,反应消耗 1mol 稀硫酸时,转移2mol电子,故D正确;
故选D。
10.B
【分析】图中b点NO2的转化率最高,则温度为T时,b点恰好达到平衡状态,由于ab曲线上对应容器的体积逐渐增大,NO2的起始浓度逐渐减小,但浓度均大于b点,NO2的浓度越大,反应速率越大,达到平衡的时间越短,所以ab曲线上反应均达到平衡状态,反应正向是气体体积增大的反应,随着容器体积的增大,NO2的转化率逐渐增大,b点达到最大;b点以后,随着容器体积的增大,压强越小,反应往正方向移动,NO2的起始浓度减小,反应速率减慢,达到平衡的时间延长,所以bc曲线上反应均未达到平衡状态,由于NO2的起始浓度低,则反应正向进行,利用化学平衡常数和等效平衡进行分析。
【详解】A.a点时反应达到平衡,NO2转化率为40%,则
T时,该反应的化学平衡常数K==,故A错误;
B.根据分析可知,图中c点还未达到平衡,反应往正方向进行,v(正)>v(逆),故B正确;
C.向a点平衡体系中充入一定量的NO2,等效于加压,平衡逆移,NO2的转化率降低,故C错误;
D.由A可知a点时容器内气体物质的量为1.2mol;b点时反应三段式为
则b点容器内气体物质的量为1.4mol,由于V1<V2,则Pa:Pb>6:7,故D错误;
答案选B。
11.A
【详解】A.经2min后,A的浓度减少了0.8mol/L,用单位时间内A的物质的量变化表示的平均反应速率是0.4mol min-1,选项A正确;
B.2min末时的反应速率为即时速率,用A表示为0.4 mol/(L min)是2min内的平均速率,选项B错误;
C.B物质是固体,浓度不变,不能用来表示反应速率,选项C 错误;
D.经2min后,A的浓度减少了0.8mol/L,化学反应速率之比等于计量数之比,故在这2min内,C的浓度变化量为0.4mol L-1,选项D错误;
答案选A。
12.C
【详解】A.正反应放热,升高温度,反应速率加快,平衡向逆反应方向移动,平衡时二氧化硫的含量减小,所以乙的温度较高,故A错误;
B.因为2SO2(g)+O2(g)2SO3(g),t0时刻增大压强,正逆反应速率都增大,但速率不等,平衡正向移动,故B错误;
C.因为2SO2(g)+O2(g)2SO3(g),t0时刻增大压强,正逆反应速率都增大,但速率不等,平衡正向移动,故C正确;
增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大;
D.因为2SO2(g)+O2(g)2SO3(g) ΔH<0。升温正逆速率都增大,平衡向吸热方向(逆方向)移动,故D错误;
故答案:D。
13.D
【分析】由图可得,在不同温度下,反应相同时间内(反应均未达到化学平衡状态)测得的值,随温度升高而减小。
【详解】A. ①CH4(g)+H2O(g)CO(g)+3H2(g) △H1=+206kJ·mol-1,②CH4(g)+CO2(g)2CO(g)+2H2(g) △H2=+247kJ·mol-1,由①-②可知,CO(g)+H2O(g)CO2(g)+H2(g) △H=206kJ·mol-1-247kJ·mol-1= -41kJ·mol-1,故A错误;
B. 反应条件不变,若反应足够长时间,无法确定2个反应的速率,无法确定谁先达到化学平衡状态,故B错误;
C. 其他条件不变时,升高温度,增大活化分子百分数,化学反应速率增大,①的化学反应速率增大,②的化学反应速率增大,故C错误;
D. 其他条件不变时,增大原料中H2O的浓度,①CH4(g)+H2O(g)CO(g)+3H2(g)平衡正向移动,氢气增大的幅度大于CO,可以提高产物中的值,故D正确;
故选D。
14.D
【详解】A.反应i的正反应是气体分子数增大的反应则 S>0,已知 H>0,由自发进行的判据 G= H-T S<0,反应在高温下才可以自发进行,A错误;
B.温度降低则正逆反应速率的化学反应速率都减慢,因此降低温度,反应ii的正化学反应速率率降低,B错误;
C.催化剂只能改变反应速率,不影响平衡移动,则选择合适的催化剂不能提高的平衡转化率,C错误;
D.根据盖斯定律,反应i+ii可得反应,该反应是吸热反应,则升高温度平衡正向移动,平衡常数增大,则升高温度,的值变大,D正确;
故选:D。
15.C
【详解】A.图甲装置中导气管形成一段水柱,说明试管中氧气被吸收,则验证铁的吸氧腐蚀,能达到实验目的,故A不符合题意;
B.图乙阳极铁失去电子变为亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,煤油可隔绝空气防止氢氧化亚铁被氧化,因此图乙装置是实验室制备,能达到实验目的,故B不符合题意;
C.由于镁离子水解,因此图丙装置应在HCl气流中加热制取无水氯化镁,图丙装置不能达到实验目的,故C符合题意;
D.图丁装置根据双氧水浓度得到3%的双氧水的冒气泡速率快,说明该装置是探究浓度对化学反应速率的影响,能达到实验目的,故D不符合题意。
综上所述,答案为C。
16. 0.075 mol/(L·min) a 510 K= 减小 C
【详解】(1)由图甲可知,反应进行至10min时达到平衡状态,,;
(2)使用催化剂可降低反应的活化能,从而明显加快反应速率,故图乙中曲线b表示使用催化剂时反应的能量变化,曲线a表示不使用催化剂时反应的能量变化,不使用催化剂时该反应的逆反应的活化能为510kJ/mol;
(3)该反应的平衡常数K表达式为,该反应属于放热反应,升高温度,平衡向左移动,平衡常数K减小;
(4) A.该反应属于放热反应,升高温度,平衡向左移动,n(CH3OH)减小,n(CO)增大,减小;
B.保持容器容积不变充入氦气,平衡不移动,不变;
C.保持容器容积不变再充入1molCO和2molH2,相当于增大压强,该反应气体分子总数减少,平衡向右移动,反应物的转化率增大,增大;
D.使用催化剂能加快反应速率,但不能改变平衡状态,不变;
答案选C。
17. > ABC 400 50% N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol 离子键、共价键
【详解】(1)①因为该反应是放热反应,所以温度升高,平衡常数减小,则K1>K2;
②A、2v(H2)(正)=3v(NH3)(逆)符合正逆反应速率相等,是平衡状态,正确;B、平衡时,各物质的质量均不变,所以氢气的质量不变时为平衡状态,正确;C、该反应是气体的物质的量发生变化的可逆反应,当压强不变时为平衡状态,正确;D、因为容器的体积不变,气体的总质量不变,所以气体的密度始终不变,则气体的密度不变的状态,不一定是平衡状态,错误,答案选ABC;
③平衡时氮气的浓度是2mol/10L×(1-50%)=0.1mol/L,消耗氮气的浓度也是0.1mol/L,则生成氨气的浓度是0.1mol/L×2=0.2mol/L,消耗氢气的浓度是0.1mol/L×3=0.3mol/L,则氢气的平衡浓度是4mol/10L-0.3mol/L=0.1mol/L,则平衡常数K=0.22/(0.13×0.1)=400;平衡时氨气的体积分数可用物质的量浓度来计算,为0.2mol/L/(0.2+0.1+0.1)mol/L×100%=50%;
(2)①8g气态肼的物质的量是1/4mol,所以1mol肼完全燃烧放出的热量是133.5kJ×4=534kJ,则肼燃烧的热化学方程式是N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol;
②盐酸肼是离子化合物,所以含有离子键,N与H原子之间以共价键结合,所以还含有共价键。
18.(1)<
(2)<
(3)>
(4)>
(5)放热
(6)逆反应方向
(7)不变
【详解】(1)由前图可知,P2较先达到平衡状态,则P2>P1,故答案为:<;
(2)P2>P1,压强越大,A的转化率越低,说明增大压强平衡向逆方向移动,则(m+n)<(p),故答案为:<;
(3)由后图可知t1先达到平衡状态,则t1>t2,故答案为:>。
(4)由图2知,温度从t1降低到t2,A的含量升高,说明平衡逆向移动,说明正反应方向为吸热反应,则ΔH>0,故答案为:>;
(5)由图示知,反应物的总能量高于生成物的总能量,该反应为放热反应,故答案为:放热;
(6)该反应为放热反应,根据勒夏特列原理,当反应达到平衡时,只升高温度,化学平衡向逆方向移动,故答案为:逆反应方向;
(7)加入催化剂只改变反应速率,反应的热效应不变,则体系中加入催化剂该反应的反应热不变,故答案为:不变。
19. 增大 C B
【分析】①影响化学反应速率的因素是增大物质浓度、升高温度、气体反应增大压强,增大接触面积等都可以加快反应速率;
②合成氨的反应为可逆反应,反应物不可能完全转化成生成物判断该反应放出的热量;
③当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,注意反应物与生成物的化学计量数关系;
④平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,固体和纯液体不写入表达式。
【详解】①其它条件不变时,升高温度,化学反应速率增大,正逆反应速率都增大,只是正逆反应速率增大程度不同;
②由N2(g)+3H2(g) 2NH3(g),△H=-92.4kJ/mol可知,生成2mol氨气放出92.4kJ热量,l molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,由于可逆反应不可能完全转化,所以生成氨气的物质的量小于2mol,放出的热量小于92.4kJ,故答案为:C;
③合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol.反应是气体体积减小的放热反应;
A.平衡时各物质的物质的浓度取决于起始配料比以及转化的程度,N2、H2、NH3的浓度相等,不能作为判断是否达到平衡状态的依据,故A错误;
B.反应物和生成物的物质的量不相等,当压强不变时,说明各物质的量不再发生变化,反应达到平衡状态,故B正确;
C.单位时间内消耗amol N2,同时生成2amol NH3,反应正向进行,正逆反应速率不相等,没有达到平衡状态,故C错误;
故答案为B;
④平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,N2(g)+3H2(g) 2NH3(g),反应的平衡常数=。
【点睛】反应达到平衡状态时,正逆反应速率相等,必须是同一物质的正逆反应速率相等;反应达到平衡状态时,平衡时各种物质的物质的量、浓度等不再发生变化,此类试题中容易发生错误的情况往往有:平衡时浓度不变,不是表示浓度之间有特定的大小关系;正逆反应速率相等,不表示是数值大小相等;对于密度、相对分子质量等是否不变,要具体情况具体分析等。
20.(1)3
(2) 5 0.316
(3) 放出 62.8
(4)③
(5)不移动
【详解】(1)H2或I2的初始物质的量浓度为1.00mol/L,则容器的体积,故答案为:3;
(2)当反应达到平衡状态时,各物质的浓度不变,由图可知,当反应物和生成物浓度不变时,时间为5s;由图可知, ,故答案为:5;;
(3)根据可知,该反应为放热反应,反应达到平衡状态时,c(HI)=1.58mol/L,则放出的热量为,故答案为:放出;62.8;
(4)可逆反应达到平衡状态时,正逆反应速率相等;
①H2消耗的速率和I2消耗的速率均表示正反应速率,因此当H2消耗的速率和I2消耗的速率相等,不能说明反应达到平衡状态,故①不符合题意;
②H2、I2、HI的浓度比恒为1:1:2,因此H2、I2、HI的浓度比为1:1:2不能说明反应达到平衡状态,故②不符合题意;
③H2、I2、HI的浓度都不再发生变化,说明正逆反应速率相等,则反应达到平衡状态,故③符合题意;
④反应达到平衡状态时正逆反应速率相等,但不为0,正、逆反应速率都为零,则该反应没有开始,一定没有达到平衡状态,故④不符合题意;
故答案为:③;
(5)该反应是气体总体积不变的反应,压强不影响平衡移动,因此增大压强平衡移动方向不移动,故答案为:不移动。
21. < 向左 > D 0.06mol·L-1·min-1 D
【分析】(一)①根据图象,可以判断出该反应是放热反应,则ΔH<0;若在恒温、恒压条件下向上述平衡体系中通入氦气,容器的体积增大,相当于恒容减小压强,则平衡向左移动;
(二)①根据平衡移动的速率图象分析即可;
②通过N2的反应速率来计算H2的反应速率,再通过平衡的移动来分析N2物质的量的变化趋势。
【详解】(一)①由图知,随着温度升高,体系中SO3的百分含量降低,说明平衡逆向移动,则该反应的正反应是放热反应,故ΔH<0;若在恒温、恒压条件下向上述平衡体系中通入氦气,容器的体积增大,相当于恒容减小压强,平衡向气体体积增大的方向进行,即平衡向左移动;
②T1℃时,D点的SO3的百分含量比A点(平衡时)低,则平衡向SO3的百分含量增大的方向进行,即平衡正向移动,故v(正)>v(逆);
(二)①A、使用催化剂,反应速率增大,但是平衡不移动,A错误;
B、该反应是放热反应,升高温度,反应速率增大,但是平衡逆向移动,B错误;
C、及时分离出氨气,降低了生成物的浓度,平衡正向移动,但是也会降低反应速率,C错误;
D、增大氮气的浓度,可加快反应速率,且平衡正向移动,D正确;
故选D;
②v(N2)==0.02mol·L-1·min-1,v(H2)=3v(N2)=3×0.02mol·L-1·min-1=0.06mol·L-1·min-1;从11min起,压缩容器体积,则体系压强增大,平衡正向移动,N2的浓度减小,故选D。
22. BD 4N2O(g)+2CO(g)==4N2(g)+2CO2(g) + O2(g) △H=-60b kJ·mol-1 NO2+NO3--e-═N2O5 阴 NO-3e-+2H2O=NO3-+4H+ NH3
【详解】试题分析:⑴根据平衡状态的定义分析;(2)氮氧化物和碳氧化物在点燃条件恰好完全反应生成的3种产物均为大气组成气体,分别是N2、CO2、 O2;(3)① 通入NO2的电极为阳极,发生氧化反应,Y是N2O5;石墨III电极 ,发生还原反应;石墨IV电极 ;根据电子守恒分析为使电解产物完全转化为NH4NO3,需要补充的物质X的化学式。
解析:⑴平衡时速率不再改变,故A不一定平衡;该反应在绝热、恒容的密闭体系中进行,平衡常数不变,说明温度不变,故B一定平衡;平衡时物质浓度不再改变,故C一定不平衡;NO的百分含量不变,故D一定平衡;(2)氮氧化物和碳氧化物在点燃条件恰好完全反应生成的3种产物均为大气组成气体,分别是N2、CO2、 O2,反应后气体的密度是反应前气体密度的倍,说明气体物质的量变为原来 ,设方程式为 ,若 ,则z=1;根据电子守恒 ,则x=4,y=2;所以方程式为4N2O+2CO = 4N2+2CO2 + O2,0.1 mol N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量,则6 mol混合气体放热60bkJ,故热化学方程式为4N2O(g)+2CO(g)==4N2(g)+2CO2(g) + O2(g) △H=-60b kJ·mol-1(3)① 通入NO2的电极为阳极,发生氧化反应,Y是N2O5,电极反应为NO2+NO3--e-═N2O5;石墨III电极 ,发生还原反应,石墨III电极为阴极;石墨IV电极 ,电极反应式为NO-3e-+2H2O=NO3-+4H+ ;根据电子守恒,两电极生成铵根和硝酸根离子的比为3:5,所以为使电解产物完全转化为NH4NO3,需要补充的物质X是NH3。
点睛:化学平衡状态是 ,反应体系中各物质浓度保持不变的状态。
23. a 氧气分压高,使反应①平衡向逆反应方向移动,c( H+) 增大,导致反应②平衡向逆反应方向移动,释放出更多的CO2 mol/(L min) 反应③正反应是气体体积缩小的反应,p(O2)增大,平衡向正反应方向移动 2.00 kPa-1 97.6%
【详解】(1)考查影响化学平衡的因素,pH越大,c(H+)越小,平衡向逆反应方向进行,与氧气的结合度越大,即a曲线是pH=7.6;(2)考查影响化学平衡的因素,氧气分压高,使平衡①向逆反应方向进行,增加与氧气的结合度,c(H+)增大,促使反应②向逆反应方向进行,因此有利于CO2排出体外;(3)考查化学反应速率的计算,结合度达到50%,说明生成的MbO2的浓度为c0×50%mol·L-1, v(MbO2)=c0/2tmol/(L·min);(4)考查影响化学平衡的移动,根据反应③的方程式,反应物的气体系数之和大于生成物的气体系数之和,增大压强,平衡向正反应方向移动;(5)本题考查化学平衡常数的计算,当p(O2)=2kPa,此时的结合度为80%,即c(MbO2)=c×80%mol·L-1,c(Mb)=c×20%mol·L-1,代入表达式,K=c×80%/(c×20%×2)=2.00kPa-1;(6)本题考查化学平衡常数的计算,根据(5)中化学平衡常数的表达式,有K=c(Mb)×a/[c(Mb)×(1-a)×p(O2)],解得a=,K只受温度的影响,温度不变,则K不变,因此K=2,p(O2)=20,代入上述表达式,即a=97.6%。
24.(1) 反应的活化能
(2) 分子总数 百分数 分子总数 百分数
【详解】(1)反应物转化为活化分子所吸收的能量为反应的活化能,则表示反应的活化能,使用催化剂降低反应的活化能,则使用催化剂时的活化能为,反应热等于正反应的活化能减去逆反应的活化能,则反应热为;
(2)增大反应物的浓度,单位体积内分子总数增加,活化分子数也增加,但活化分子百分数不变;升高反应体系的温度,单位体积内分子总数不变,有一部分普通分子吸收能量转化为活化分子,则活化分子百分数增加。
答案第1页,共2页
答案第1页,共2页
一、单选题
1. ,当反应达到平衡时,改变一种反应条件,下列示意图正确的是
A B C D
表示随温度升高,平衡常数的变化 表示时刻加入催化剂,反应速率随时间的变化 表示恒压条件下,反应物的转化率随充入惰性气体体积的变化 表示CO的体积分数随充入量的变化
A.A B.B C.C D.D
2.对于可逆反应,下列叙述正确的是
A.达到化学平衡时,
B.若单位时间内生成的同时,消耗,则反应达到平衡状态
C.达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是
3.下列事实不能用勒夏特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.合成氨反应,为提高氨的产率,理论上应采取降低温度的措施
C.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
D.对于2HI(g)H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
4.将E(s)和F(g)加入密闭容器中,在一定条件下发生反应:,已知该反应的平衡常数如表。下列说法正确的是:
温度/℃ 25 80 230
平衡常数/() 2
A.正反应是吸热反应
B.达到化学平衡时,
C.80℃时,测得某时刻F、G的浓度均为0.5mol/L,此时
D.25℃时,反应的平衡常数是
5.向K2S2O8和KI的混合溶液中滴加FeCl3溶液,反应过程中的能量变化如图所示,下列有关该反应的说法正确的是
A.反应过程中v() = v(I-) = v(I2)
B.Fe3+是该反应的催化剂,所以c(Fe3+)与反应速率无关
C.若不加FeCl3,则正反应的活化能比逆反应的活化能大
D.步骤① 2Fe3+(aq) + 2I-(aq) = I2(aq) + 2Fe2+(aq) ΔH1;步骤② 2Fe2+(aq) + (aq) = 2Fe3+ + 2 (aq) ΔH2 ,则ΔH1> ΔH2
6.下列说法中不正确的是
A.一个反应能否自发进行,与焓变和熵变的共同影响有关
B.若△H>0,△S<0,任何温度下都不能自发进行
C.2Na2O2+2H2O = 4NaOH+O2↑在常温下能自发进行,既能用焓判据解释又能又熵判据解释
D.2NO(g) +2CO(g) = N2(g) + 2CO2(g) 在常温下能自发进行,则该反应的△H>0
7.下列说法正确的是( )
A.H2(g)+I2(g) 2HI(g) ,其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g) H2(g)+CO(g) ,碳的质量不再改变说明反应已达平衡
C.若压强不再随时间变化能说明反应 2A( )+B(g) 2C( ) 已达平衡,则AC 不能同时是气体
D.C(s)+H2O(g) H2(g)+CO(g) ,将固态碳粉碎,不可加快化学反应速率。
8.二氧化硫是一种重要的化工原料,可以制取硫酸等化工产品。其中,催化制取三氧化硫的热化学方程式为:,二氧化硫也是形成酸雨的主要污染物,可以通过氨气水溶液进行吸收。实验室可以用浓硫酸与铜加热制取少量二氧化硫。在恒温恒压的密闭容器中,二氧化硫转化成三氧化硫,下列相关说法正确的是
A.该反应中,反应物的总能量<产物的总能量
B.使用优质催化剂,平衡时体系中的值增大
C.相同时间内,当消耗同时生成时,反应处于平衡状态
D.升高温度,能加快反应速率,提高二氧化硫的平衡转化率
9.硫元素的几种化合物存在下列转化关系。下列说法正确的是
浓H2SO4SO2Na2SO3溶液Na2S2O3溶液S
A.反应①中生成的SO2具有漂白性,可使溴水褪色
B.反应②中若SO2少量,就会生成NaHSO3
C.反应④中生成 S 既是氧化产物,也是还原产物
D.反应④中当消耗 1mol 稀硫酸时,电子转移为2mol
10.温度为T,向体积不等的恒容密闭容器中分别加入足量活性炭和1molNO2,发生反应:2C(s)+2NO2(g) N2(g)+2CO2(g)反应相同时间,测得各容器中NO2的转化率与容器体积的关系如图所示。下列说法正确的是
A.T时,该反应的化学平衡常数为
B.图中c点所示条件下,v(正)>v(逆)
C.向a点平衡体系中充入一定量的NO2,达到平衡时,NO2的转化率比原平衡大
D.容器内的压强:Pa:Pb<6:7
11.在容积为1L恒容容器内进行反应4A(g)+3B(s)2C(g)+D(g),经2min后,A的浓度减少了0.8mol L-1。下列反应速率的表示正确的是
A.在这2min内,用单位时间内A的物质的量变化表示的平均反应速率是0.4mol L-1 min-1
B.2min末时的反应速率,用A表示为0.2mol L-1 min-1
C.在这2min内,用B表示的平均反应速率是0.3mol L-1 min-1
D.在这2min内,C的浓度变化量为0.6mol L-1
12.在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B.图Ⅱ表示t0时刻压强对反应速率的影响
C.图Ⅲ表示t0时刻增大压强对反应速率的影响
D.图Ⅳ表示t0时升温对反应速率的影响
13.CH4联合H2O和CO2制取H2时,发生的主要反应如下:
①CH4(g)+H2O(g)CO(g)+3H2(g) △H1=+206kJ·mol-1
②CH4(g)+CO2(g)2CO(g)+2H2(g) △H2=+247kJ·mol-1
将CH4、H2O和CO2按一定比例通入填充有催化剂的恒容反应器,在不同温度下,反应相同时间内(反应均未达到化学平衡状态)测得的值如图所示。
下列说法正确的是
A.由①②可知,CO(g)+H2O(g)CO2(g)+H2(g) △H=+41kJ·mol-1
B.反应条件不变,若反应足够长时间,①比②先达到化学平衡状态
C.其他条件不变时,升高温度,①的化学反应速率减小,②的化学反应速率增大
D.其他条件不变时,增大原料中H2O的浓度可以提高产物中的值
14.甲烷和水蒸气催化制氢是未来解决能源危机的理想方法之一,其主要反应为:
i.
ii.
一定温度下,往刚性密闭容器中充入甲烧和水蒸气,发生催化反应。下列说法正确的是
A.反应i在任意条件下都可以自发
B.降低温度,反应ii的正化学反应速率升高、逆化学反应速率降低
C.选择合适的催化剂能提高的平衡转化率
D.达到平衡状态后,升高温度,的值变大
15.下列所示装置不能达到实验目的的是
A.图甲装置验证铁的吸氧腐蚀
B.图乙装置实验室制备
C.图丙装置制取无水氯化镁
D.图丁装置探究浓度对化学反应速率的影响
二、填空题
16.由于温室效应和资源短缺,如何降低大气中CO2的含量并加以开发利用等问题,引起了全世界的普遍重视。目前工业上用CO为原料生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。
(1)图甲是反应时CO和CH3OH的浓度随时间的变化情况。从反应开始到达到平衡状态,用CO浓度的变化表示反应的平均反应速率v(CO)= 。
(2)如图乙是该反应进行过程中能量的变化。曲线 (填“a”或“b”)表示不使用催化剂时反应的能量变化,不使用催化剂时该反应的逆反应的活化能为 kJ/mol。
(3)该反应的平衡常数K的表达式为 ,升高温度,平衡常数K (填“增大”“减小”或“不变”)。
(4)恒容条件下,下列措施能使 增大的有 。
A.升高温度 B.充入He C.再充入1 mol CO和2 mol H2 D.使用催化剂
17.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
(1)在一定体积的恒容密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g);△H<0
其化学平衡常数K与温度t的关系如下表,根据下表完成下列问题:
t/K 298 398 498 …
K/(mol·L-1)2 4.1×106 K1 K2 …
①比较K1、K2的大小:K1 K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是 (填序号)。
A.2v(H2)(正)=3v(NH3)(逆)
B.混合气体中氢气的质量不变
C.容器内压强保持不变
D.混合气体的密度保持不变
③某温度下,在一个10L的固定容器中充入2molN2和4molH2进行如下反应 N2(g)+3H2(g) 2NH3(g);△H<0一段时间达平衡后,N2的转化率为50%,求该温度下的平衡常数K= (mol/L)-2 ,平衡时NH3的体积分数为 。
(2)①肼(N2H4)高效清洁的火箭燃料。8g气态肼在氧气中完全燃烧生成氮气和气态水,放出133.5kJ热量,则肼燃烧的热化学方程式为 。
②盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,则盐酸肼中含有的化学键类型有 。
18.I.可逆反应∶mA(g)+nB(g) pC(g)+qD(s) H,试根据图回答∶
[A的转化率(%)表示为α(A)、A的含量(%)表示为φ(A)]
(1)压强P1 P2(填“>”,“<”或“=”下同)
(2)计量数(m+n) (p)
(3)温度t1℃ t2℃
(4)ΔH 0
II.反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
(5)该反应是 反应(填“吸热”,“放热”);
(6)当反应达到平衡时,只升高温度,化学平衡向 (填“正反应方向”或“逆反应方向”)移动。
(7)反应体系中加入催化剂该反应的反应热 (填增大”“减小”“不变”);
19.合成氨是人类科技发展史上的一项重大突破,已知:25℃时,合成氨反应的热化学为:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4kJ/mol,请回答下列问题:
(1)其他条件不变时,升高温度,化学反应速率 (填“增大”或“减小”);
(2)25℃时,取1mol N2和3mol H2置于2L的密闭容器中,在催化剂存在下进行反应,达到平衡时放出的热量
A.大于92.4 kJ B.等于92.4 kJ C.小于92.4 kJ
(3)一定条件下,上述反应达到化学平衡状态的标志是 ;
A.N2、H2、NH3的浓度相等
B.容器内压强不再变化
C.单位时间内消耗amol N2,同时生成2amol NH3
(4)25℃时,上述反应平衡常数的表达式为:K= 。
20.某温度时,向某VL的密闭容器中充入3mol和3mol,发生反应:,测得各物质的物质的量浓度与时间变化的关系如图所示。请回答下列问题:
(1)V= L。
(2)该反应达到最大限度的时间是 s,该时间内平均反应速率 。
(3)该反应达到平衡状态时, (填“吸收”或“放出”)的热量为 kJ。
(4)判断该反应达到平衡的依据是 (填序号)。
①H2消耗的速率和消耗的速率相等
②H2、I2、HI的浓度比为1:1:2
③H2、I2、HI的浓度都不再发生变化
④该条件下正、逆反应速率都为零
(5)增大压强平衡移动方向 (正向、逆向、不移动)。
21.运用化学反应原理研究化学反应有着非常重要的意义。
(一)硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g)2SO3(g),混合体系中SO3的百分含量和温度的关系如图1所示(曲线上任何一点都表示平衡状态)。
①2SO2(g)+O2(g)2SO3(g)的ΔH 0(填“>”或“<”);若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡 移动(填“向左”“向右”或“不”)。
②若反应进行到状态D时,v(正) v(逆)(填“>”“<”或“=”)。
(二)工业上合成氨技术叫哈伯法:N2(g)+3H2(g)2NH3(g) ΔH<0,此法达到平衡时反应物的转化率不高。
①能使该反应的反应速率增大,且平衡向正反应方向移动的措施是 (填编号)。
A.使用更高效的催化剂
B.升高温度
C.及时分离出氨气
D.充入氮气,增大氮气的浓度(保持容器体积不变)
②若在某温度下,2L的密闭容器中发生合成氨的反应,图2表示N2的物质的量随时间的变化曲线。用H2表示0~10min内该反应的平均速率v(H2)= 。
从11min起,压缩容器的体积为1L,则n(N2)的变化曲线为 (填编号)。
A.a B.b C.c D.d
22.近几年全国各地都遭遇“十面霾伏”。其中机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大。
⑴ 汽车尾气净化的主要原理为:2NO(g) + 2CO(g)2CO2(g)+ N2(g) △H<0
若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是 (填代号)。
(2)一定条件下氮氧化物和碳氧化物可以反应,已知2.24L(折算为标准状况)N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量。生成的3种产物均为大气组成气体,并测得反应后气体的密度是反应前气体密度的倍。请写出该反应的热化学方程式 。
(3)电解法处理氮氧化物废气有较高的环境效益和经济效益(图中电极均为石墨)。
① NO2、O2和熔融NaNO3可制作燃料电池,其原理见上方右图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为 。
② 电解NO制备NH4NO3原理如上方左图所示。石墨III为 极 ,石墨IV的电极反应式为 。为使电解产物完全转化为NH4NO3,需要补充的物质X的化学式为 。
23.血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb占总Hb或Mb的比例)和氧分压p(O2)密切相关。
I .Hb与氧气的结合能力还受到c(H+)的影响,平衡如下:
HbO2(aq)+H+(aq) HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
(1)图1中pH=7.6时的曲线为 (填“a”或“b”)。
(2)血液中还存在平衡:CO2+H2OH2CO3H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因 。
II.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
(3)若肌肉中Mb的初始浓度为c0 mol/L,结合度达到50%所需的时间为t min,此段时间内用MbO2表示的平均反应速率为 。
(4)图2中a随p(O2)增大而增大的原因是 。
(5) Mb与氧气结合的平衡常数的表达式K=,计算37℃时K= 。
(6) Mb与氧气结合达平衡时结合度a= [用含p(O2)和K的代数式表示]。
人正常呼吸时,温度约为37℃,空气中氧分压约为20.0kPa,计算此时Mb与氧气的最大结合度为 。
24.理论解释——有效碰撞理论
(1)活化分子、活化能、有效碰撞
①活化分子:能够发生有效碰撞的分子(必须具有足够的能量)。
②活化能:如图
图中:表示 ,使用催化剂时的活化能为 ,反应热为 (注:表示活化分子变成生成物分子放出的能量)
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
增大反应物的浓度 升高反应体系的温度
吸收能量
单位体积内 增加,活化分子 不变,活化分子数增加 单位时间内单位体积内有效碰撞次数增多 单位体积内 不变,活化分子 增加,活化分子数增加
降低活化能
增大气体压强 增大化学反应速率 使用催化剂
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.该反应为吸热反应,温度升高平衡正向移动,K增大,故A错误;
B.催化剂对速率的影响是瞬间改变正逆反应速率,对平衡无影响,因此速率不会逐渐增大,故B错误;
C.恒压条件下充入惰性气体,容器体积增大,等同于减压,平衡向气体分子数增大的正向移动,反应物的转化率增大,故C错误;
D.随着氯气的量的增大,总气体的物质的量增大,平衡逆向移动CO的物质的量减小,CO的体积分数减小,故D正确;
故选:D。
2.A
【详解】A.达到平衡状态时,不同物质的正逆反应速率之比等于其计量数之比,则达到平衡状态时,A正确;
B.无论是否达到平衡状态都存在单位时间内生成 n molNO的同时,消耗n molNH3,所以不能据此判断平衡状态,B错误;
C.达到平衡状态时,增加容器体积,各物质的物质的量浓度减小,物质的量浓度与化学反应速率成正比,所以正逆反应速率都减小,C错误;
D.反应达到平衡状态时,不同物质的正逆反应速率之比等于其计量数之比,如果反应达到平衡状态时存在,D错误;
故选A。
3.D
【详解】A项,啤酒瓶中存在平衡H2O+CO2H2CO3,打开啤酒瓶时,泛起大量泡沫,是因为压强降低,平衡向生成二氧化碳方向移动,可以用勒夏特列原理解释,故A正确;B项,合成氨反应为放热反应,降低温度平衡正向移动,可提高氨的产率,能用勒夏特列原理解释,故B正确;C项,工业上生产硫酸存在平衡2SO2+O22SO3,使用过量的空气,增大氧气的浓度,平衡正向移动,可以提高二氧化硫的利用率,能用勒夏特列原理解释,故C正确;D项,因为反应2HI(g)H2(g)+I2(g)是气体分子数不变的反应,缩小容器体积,平衡不移动,颜色变深是由体积变小使I2浓度增大引起的,不能用勒夏特利原理解释,故D错误。
点睛:本题考查勒夏特列原理的使用条件,化学平衡移动原理又称勒夏特列原理,使用勒夏特列原理分析问题的前提必须是可逆反应且存在平衡移动,否则不能用勒夏特列原理解释,例如题中A、B、C三项都涉及改变条件时可逆反应的平衡移动问题,而D项改变条件平衡不移动。
4.B
【详解】A.升高温度,K减小,说明平衡逆移,正反应为放热反应,故A错误;
B.达到化学平衡时正逆反应速率相等,,故B正确;
C.80℃时,测得某时刻F、G的浓度均为0.5mol/L,此时Qc==8>K=2,则平衡逆移,v逆>v正,故C错误;
D.由分析知25℃时,反应的平衡常数==2×10-5,故D错误;
故选B。
5.D
【分析】根据图象,反应①发生2I-+2Fe3+=2Fe2++I2,反应②发生+2Fe2+=2Fe3++2,总反应是2I-+=I2+2,Fe3+为催化剂,据此分析;
【详解】A.反应速率之比等于化学计量数之比,v(I-)=2v(I2)=2v(),故A错误;
B.根据上述分析,Fe3+是该反应的催化剂,化学反应速率与c(Fe3+)大小有关,c(Fe3+)大,催化效果更好,反应速率快,故B错误;
C.根据该图象,2I-+=I2+2为放热反应,正反应的活化能小于逆反应的活化能,焓变只与始态和终态有关,与反应途径无关,与有无催化剂无关,故C错误;
D.根据图象,反应①为吸热反应,即△H1>0,反应②为放热反应,即△H2<0,因此有△H1>△H2,故D正确;
答案为D。
6.D
【详解】A.△H-T△S<0的反应可自发进行,则反应能否自发进行与焓变和熵变的共同影响有关,故A正确;
B.若△H>0,△S<0,则△H-T△S>0,可知任何温度下都不能自发进行,故B正确;
C.2Na2O2+2H2O═4NaOH+O2↑该反应为是放热反应,而且熵增大,所以根据熵判据和焓判据都是自发反应,故C正确;
D.反应2NO(g) +2CO(g) = N2(g) + 2CO2(g)中气体减小,则反应的△S<0,若使△H-T△S<0,则△H<0,故D错误。
答案选D。
7.B
【详解】A. H2(g)+I2(g) 2HI(g),反应前后气体体积不变,缩小应容器体积,压强增大,正逆反应速率都增大,故A错误;
B. C(s)+H2O(g) H2(g)+CO(g) ,碳的质量不再改变时,说明正逆反应速率相等,反应达到平衡,故B正确;
C. 若压强不再改变说明反应达到平衡,表明反应前后气体的计量数不等,则A、C可以均为气体,故C错误;
D. 固态碳粉碎后增大了反应物的接触面积,可加快化学反应速率,故D错误;
正确答案是B。
【点睛】一、判断化学平衡状态的本质标志:
1、正逆反应速率相等,也就是v(正)=v(逆)
2、各组分的物质的量浓度保持一定,也就是不再发生改变。
二、判断化学平衡状态的等价标志(衍生标志)。
1、与v(正)=v(逆)等价的标志
(1)从物质的生成速率和消耗速率角度进行判断。
(2)从同一时间物质的变化角度进行判断。
(3)从正逆反应速率的变化角度进行判断。正逆反应速率不再发生改变。
(4)从物质的微观变化角度进行判断。
2、与各组分的物质的量浓度保持一致等价的标志
(1)从质量角度进行判断。
(2)从物质的量角度进行判断。
(3)对于有气体参加的反应,且反应前后气体体积发生改变的反应,还可以采用以下特殊的判断标志。如:总物质的量、总压强(恒温、恒容)、平均摩尔质量、混合气体的密度(恒温、恒压)保持不变。
8.C
【详解】A. 该反应为放热反应,反应物的总能量>产物的总能量,A错误;
B. 使用优质催化剂,能加快反应速率,但不影响平衡、则平衡时体系中的值不变,B错误;
C. 相同时间内,当消耗同时生成时,即v逆(O2)= v正(SO2)=v正 (O2),则正反应速率和逆反应速率相等、反应处于平衡状态,C正确;
D.升高温度,能加快反应速率,因为正反应是放热反应、温度升高时平衡左移、则降低了二氧化硫的平衡转化率,D错误;
答案选C。
9.D
【详解】A.反应①中生成的二氧化硫与溴水反应生成硫酸和氢溴酸,反应中溴水褪色是二氧化硫表现还原性,故A错误;
B.反应②中少量二氧化硫与氢氧化钠溶液反应生成亚硫酸钠,不能生成亚硫酸氢钠,故B错误;
C.反应④中硫代硫酸钠溶液与稀硫酸反应生成硫酸钠、硫沉淀、二氧化硫气体和水,硫代硫酸钠转化为硫时,硫元素的化合价降低被还原,硫是反应的还原产物,故C错误;
D.反应④中硫代硫酸钠溶液与稀硫酸反应生成硫酸钠、硫沉淀、二氧化硫气体和水,反应的化学方程式为Na2S2O3+H2SO4(稀)=Na2SO4+S↓+SO2↑+H2O,由方程式可知,反应消耗 1mol 稀硫酸时,转移2mol电子,故D正确;
故选D。
10.B
【分析】图中b点NO2的转化率最高,则温度为T时,b点恰好达到平衡状态,由于ab曲线上对应容器的体积逐渐增大,NO2的起始浓度逐渐减小,但浓度均大于b点,NO2的浓度越大,反应速率越大,达到平衡的时间越短,所以ab曲线上反应均达到平衡状态,反应正向是气体体积增大的反应,随着容器体积的增大,NO2的转化率逐渐增大,b点达到最大;b点以后,随着容器体积的增大,压强越小,反应往正方向移动,NO2的起始浓度减小,反应速率减慢,达到平衡的时间延长,所以bc曲线上反应均未达到平衡状态,由于NO2的起始浓度低,则反应正向进行,利用化学平衡常数和等效平衡进行分析。
【详解】A.a点时反应达到平衡,NO2转化率为40%,则
T时,该反应的化学平衡常数K==,故A错误;
B.根据分析可知,图中c点还未达到平衡,反应往正方向进行,v(正)>v(逆),故B正确;
C.向a点平衡体系中充入一定量的NO2,等效于加压,平衡逆移,NO2的转化率降低,故C错误;
D.由A可知a点时容器内气体物质的量为1.2mol;b点时反应三段式为
则b点容器内气体物质的量为1.4mol,由于V1<V2,则Pa:Pb>6:7,故D错误;
答案选B。
11.A
【详解】A.经2min后,A的浓度减少了0.8mol/L,用单位时间内A的物质的量变化表示的平均反应速率是0.4mol min-1,选项A正确;
B.2min末时的反应速率为即时速率,用A表示为0.4 mol/(L min)是2min内的平均速率,选项B错误;
C.B物质是固体,浓度不变,不能用来表示反应速率,选项C 错误;
D.经2min后,A的浓度减少了0.8mol/L,化学反应速率之比等于计量数之比,故在这2min内,C的浓度变化量为0.4mol L-1,选项D错误;
答案选A。
12.C
【详解】A.正反应放热,升高温度,反应速率加快,平衡向逆反应方向移动,平衡时二氧化硫的含量减小,所以乙的温度较高,故A错误;
B.因为2SO2(g)+O2(g)2SO3(g),t0时刻增大压强,正逆反应速率都增大,但速率不等,平衡正向移动,故B错误;
C.因为2SO2(g)+O2(g)2SO3(g),t0时刻增大压强,正逆反应速率都增大,但速率不等,平衡正向移动,故C正确;
增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大;
D.因为2SO2(g)+O2(g)2SO3(g) ΔH<0。升温正逆速率都增大,平衡向吸热方向(逆方向)移动,故D错误;
故答案:D。
13.D
【分析】由图可得,在不同温度下,反应相同时间内(反应均未达到化学平衡状态)测得的值,随温度升高而减小。
【详解】A. ①CH4(g)+H2O(g)CO(g)+3H2(g) △H1=+206kJ·mol-1,②CH4(g)+CO2(g)2CO(g)+2H2(g) △H2=+247kJ·mol-1,由①-②可知,CO(g)+H2O(g)CO2(g)+H2(g) △H=206kJ·mol-1-247kJ·mol-1= -41kJ·mol-1,故A错误;
B. 反应条件不变,若反应足够长时间,无法确定2个反应的速率,无法确定谁先达到化学平衡状态,故B错误;
C. 其他条件不变时,升高温度,增大活化分子百分数,化学反应速率增大,①的化学反应速率增大,②的化学反应速率增大,故C错误;
D. 其他条件不变时,增大原料中H2O的浓度,①CH4(g)+H2O(g)CO(g)+3H2(g)平衡正向移动,氢气增大的幅度大于CO,可以提高产物中的值,故D正确;
故选D。
14.D
【详解】A.反应i的正反应是气体分子数增大的反应则 S>0,已知 H>0,由自发进行的判据 G= H-T S<0,反应在高温下才可以自发进行,A错误;
B.温度降低则正逆反应速率的化学反应速率都减慢,因此降低温度,反应ii的正化学反应速率率降低,B错误;
C.催化剂只能改变反应速率,不影响平衡移动,则选择合适的催化剂不能提高的平衡转化率,C错误;
D.根据盖斯定律,反应i+ii可得反应,该反应是吸热反应,则升高温度平衡正向移动,平衡常数增大,则升高温度,的值变大,D正确;
故选:D。
15.C
【详解】A.图甲装置中导气管形成一段水柱,说明试管中氧气被吸收,则验证铁的吸氧腐蚀,能达到实验目的,故A不符合题意;
B.图乙阳极铁失去电子变为亚铁离子,亚铁离子和氢氧根离子反应生成氢氧化亚铁,煤油可隔绝空气防止氢氧化亚铁被氧化,因此图乙装置是实验室制备,能达到实验目的,故B不符合题意;
C.由于镁离子水解,因此图丙装置应在HCl气流中加热制取无水氯化镁,图丙装置不能达到实验目的,故C符合题意;
D.图丁装置根据双氧水浓度得到3%的双氧水的冒气泡速率快,说明该装置是探究浓度对化学反应速率的影响,能达到实验目的,故D不符合题意。
综上所述,答案为C。
16. 0.075 mol/(L·min) a 510 K= 减小 C
【详解】(1)由图甲可知,反应进行至10min时达到平衡状态,,;
(2)使用催化剂可降低反应的活化能,从而明显加快反应速率,故图乙中曲线b表示使用催化剂时反应的能量变化,曲线a表示不使用催化剂时反应的能量变化,不使用催化剂时该反应的逆反应的活化能为510kJ/mol;
(3)该反应的平衡常数K表达式为,该反应属于放热反应,升高温度,平衡向左移动,平衡常数K减小;
(4) A.该反应属于放热反应,升高温度,平衡向左移动,n(CH3OH)减小,n(CO)增大,减小;
B.保持容器容积不变充入氦气,平衡不移动,不变;
C.保持容器容积不变再充入1molCO和2molH2,相当于增大压强,该反应气体分子总数减少,平衡向右移动,反应物的转化率增大,增大;
D.使用催化剂能加快反应速率,但不能改变平衡状态,不变;
答案选C。
17. > ABC 400 50% N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol 离子键、共价键
【详解】(1)①因为该反应是放热反应,所以温度升高,平衡常数减小,则K1>K2;
②A、2v(H2)(正)=3v(NH3)(逆)符合正逆反应速率相等,是平衡状态,正确;B、平衡时,各物质的质量均不变,所以氢气的质量不变时为平衡状态,正确;C、该反应是气体的物质的量发生变化的可逆反应,当压强不变时为平衡状态,正确;D、因为容器的体积不变,气体的总质量不变,所以气体的密度始终不变,则气体的密度不变的状态,不一定是平衡状态,错误,答案选ABC;
③平衡时氮气的浓度是2mol/10L×(1-50%)=0.1mol/L,消耗氮气的浓度也是0.1mol/L,则生成氨气的浓度是0.1mol/L×2=0.2mol/L,消耗氢气的浓度是0.1mol/L×3=0.3mol/L,则氢气的平衡浓度是4mol/10L-0.3mol/L=0.1mol/L,则平衡常数K=0.22/(0.13×0.1)=400;平衡时氨气的体积分数可用物质的量浓度来计算,为0.2mol/L/(0.2+0.1+0.1)mol/L×100%=50%;
(2)①8g气态肼的物质的量是1/4mol,所以1mol肼完全燃烧放出的热量是133.5kJ×4=534kJ,则肼燃烧的热化学方程式是N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-534kJ/mol;
②盐酸肼是离子化合物,所以含有离子键,N与H原子之间以共价键结合,所以还含有共价键。
18.(1)<
(2)<
(3)>
(4)>
(5)放热
(6)逆反应方向
(7)不变
【详解】(1)由前图可知,P2较先达到平衡状态,则P2>P1,故答案为:<;
(2)P2>P1,压强越大,A的转化率越低,说明增大压强平衡向逆方向移动,则(m+n)<(p),故答案为:<;
(3)由后图可知t1先达到平衡状态,则t1>t2,故答案为:>。
(4)由图2知,温度从t1降低到t2,A的含量升高,说明平衡逆向移动,说明正反应方向为吸热反应,则ΔH>0,故答案为:>;
(5)由图示知,反应物的总能量高于生成物的总能量,该反应为放热反应,故答案为:放热;
(6)该反应为放热反应,根据勒夏特列原理,当反应达到平衡时,只升高温度,化学平衡向逆方向移动,故答案为:逆反应方向;
(7)加入催化剂只改变反应速率,反应的热效应不变,则体系中加入催化剂该反应的反应热不变,故答案为:不变。
19. 增大 C B
【分析】①影响化学反应速率的因素是增大物质浓度、升高温度、气体反应增大压强,增大接触面积等都可以加快反应速率;
②合成氨的反应为可逆反应,反应物不可能完全转化成生成物判断该反应放出的热量;
③当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不变,由此衍生的一些物理量也不变,注意反应物与生成物的化学计量数关系;
④平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,固体和纯液体不写入表达式。
【详解】①其它条件不变时,升高温度,化学反应速率增大,正逆反应速率都增大,只是正逆反应速率增大程度不同;
②由N2(g)+3H2(g) 2NH3(g),△H=-92.4kJ/mol可知,生成2mol氨气放出92.4kJ热量,l molN2和3molH2放在密闭容器中,在催化剂存在下进行反应,由于可逆反应不可能完全转化,所以生成氨气的物质的量小于2mol,放出的热量小于92.4kJ,故答案为:C;
③合成氨反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g)△H=-92.4kJ/mol.反应是气体体积减小的放热反应;
A.平衡时各物质的物质的浓度取决于起始配料比以及转化的程度,N2、H2、NH3的浓度相等,不能作为判断是否达到平衡状态的依据,故A错误;
B.反应物和生成物的物质的量不相等,当压强不变时,说明各物质的量不再发生变化,反应达到平衡状态,故B正确;
C.单位时间内消耗amol N2,同时生成2amol NH3,反应正向进行,正逆反应速率不相等,没有达到平衡状态,故C错误;
故答案为B;
④平衡常数等于生成物浓度幂之积除以反应物浓度幂之积,N2(g)+3H2(g) 2NH3(g),反应的平衡常数=。
【点睛】反应达到平衡状态时,正逆反应速率相等,必须是同一物质的正逆反应速率相等;反应达到平衡状态时,平衡时各种物质的物质的量、浓度等不再发生变化,此类试题中容易发生错误的情况往往有:平衡时浓度不变,不是表示浓度之间有特定的大小关系;正逆反应速率相等,不表示是数值大小相等;对于密度、相对分子质量等是否不变,要具体情况具体分析等。
20.(1)3
(2) 5 0.316
(3) 放出 62.8
(4)③
(5)不移动
【详解】(1)H2或I2的初始物质的量浓度为1.00mol/L,则容器的体积,故答案为:3;
(2)当反应达到平衡状态时,各物质的浓度不变,由图可知,当反应物和生成物浓度不变时,时间为5s;由图可知, ,故答案为:5;;
(3)根据可知,该反应为放热反应,反应达到平衡状态时,c(HI)=1.58mol/L,则放出的热量为,故答案为:放出;62.8;
(4)可逆反应达到平衡状态时,正逆反应速率相等;
①H2消耗的速率和I2消耗的速率均表示正反应速率,因此当H2消耗的速率和I2消耗的速率相等,不能说明反应达到平衡状态,故①不符合题意;
②H2、I2、HI的浓度比恒为1:1:2,因此H2、I2、HI的浓度比为1:1:2不能说明反应达到平衡状态,故②不符合题意;
③H2、I2、HI的浓度都不再发生变化,说明正逆反应速率相等,则反应达到平衡状态,故③符合题意;
④反应达到平衡状态时正逆反应速率相等,但不为0,正、逆反应速率都为零,则该反应没有开始,一定没有达到平衡状态,故④不符合题意;
故答案为:③;
(5)该反应是气体总体积不变的反应,压强不影响平衡移动,因此增大压强平衡移动方向不移动,故答案为:不移动。
21. < 向左 > D 0.06mol·L-1·min-1 D
【分析】(一)①根据图象,可以判断出该反应是放热反应,则ΔH<0;若在恒温、恒压条件下向上述平衡体系中通入氦气,容器的体积增大,相当于恒容减小压强,则平衡向左移动;
(二)①根据平衡移动的速率图象分析即可;
②通过N2的反应速率来计算H2的反应速率,再通过平衡的移动来分析N2物质的量的变化趋势。
【详解】(一)①由图知,随着温度升高,体系中SO3的百分含量降低,说明平衡逆向移动,则该反应的正反应是放热反应,故ΔH<0;若在恒温、恒压条件下向上述平衡体系中通入氦气,容器的体积增大,相当于恒容减小压强,平衡向气体体积增大的方向进行,即平衡向左移动;
②T1℃时,D点的SO3的百分含量比A点(平衡时)低,则平衡向SO3的百分含量增大的方向进行,即平衡正向移动,故v(正)>v(逆);
(二)①A、使用催化剂,反应速率增大,但是平衡不移动,A错误;
B、该反应是放热反应,升高温度,反应速率增大,但是平衡逆向移动,B错误;
C、及时分离出氨气,降低了生成物的浓度,平衡正向移动,但是也会降低反应速率,C错误;
D、增大氮气的浓度,可加快反应速率,且平衡正向移动,D正确;
故选D;
②v(N2)==0.02mol·L-1·min-1,v(H2)=3v(N2)=3×0.02mol·L-1·min-1=0.06mol·L-1·min-1;从11min起,压缩容器体积,则体系压强增大,平衡正向移动,N2的浓度减小,故选D。
22. BD 4N2O(g)+2CO(g)==4N2(g)+2CO2(g) + O2(g) △H=-60b kJ·mol-1 NO2+NO3--e-═N2O5 阴 NO-3e-+2H2O=NO3-+4H+ NH3
【详解】试题分析:⑴根据平衡状态的定义分析;(2)氮氧化物和碳氧化物在点燃条件恰好完全反应生成的3种产物均为大气组成气体,分别是N2、CO2、 O2;(3)① 通入NO2的电极为阳极,发生氧化反应,Y是N2O5;石墨III电极 ,发生还原反应;石墨IV电极 ;根据电子守恒分析为使电解产物完全转化为NH4NO3,需要补充的物质X的化学式。
解析:⑴平衡时速率不再改变,故A不一定平衡;该反应在绝热、恒容的密闭体系中进行,平衡常数不变,说明温度不变,故B一定平衡;平衡时物质浓度不再改变,故C一定不平衡;NO的百分含量不变,故D一定平衡;(2)氮氧化物和碳氧化物在点燃条件恰好完全反应生成的3种产物均为大气组成气体,分别是N2、CO2、 O2,反应后气体的密度是反应前气体密度的倍,说明气体物质的量变为原来 ,设方程式为 ,若 ,则z=1;根据电子守恒 ,则x=4,y=2;所以方程式为4N2O+2CO = 4N2+2CO2 + O2,0.1 mol N2O和CO的混合气体在点燃条件恰好完全反应,放出bkJ热量,则6 mol混合气体放热60bkJ,故热化学方程式为4N2O(g)+2CO(g)==4N2(g)+2CO2(g) + O2(g) △H=-60b kJ·mol-1(3)① 通入NO2的电极为阳极,发生氧化反应,Y是N2O5,电极反应为NO2+NO3--e-═N2O5;石墨III电极 ,发生还原反应,石墨III电极为阴极;石墨IV电极 ,电极反应式为NO-3e-+2H2O=NO3-+4H+ ;根据电子守恒,两电极生成铵根和硝酸根离子的比为3:5,所以为使电解产物完全转化为NH4NO3,需要补充的物质X是NH3。
点睛:化学平衡状态是 ,反应体系中各物质浓度保持不变的状态。
23. a 氧气分压高,使反应①平衡向逆反应方向移动,c( H+) 增大,导致反应②平衡向逆反应方向移动,释放出更多的CO2 mol/(L min) 反应③正反应是气体体积缩小的反应,p(O2)增大,平衡向正反应方向移动 2.00 kPa-1 97.6%
【详解】(1)考查影响化学平衡的因素,pH越大,c(H+)越小,平衡向逆反应方向进行,与氧气的结合度越大,即a曲线是pH=7.6;(2)考查影响化学平衡的因素,氧气分压高,使平衡①向逆反应方向进行,增加与氧气的结合度,c(H+)增大,促使反应②向逆反应方向进行,因此有利于CO2排出体外;(3)考查化学反应速率的计算,结合度达到50%,说明生成的MbO2的浓度为c0×50%mol·L-1, v(MbO2)=c0/2tmol/(L·min);(4)考查影响化学平衡的移动,根据反应③的方程式,反应物的气体系数之和大于生成物的气体系数之和,增大压强,平衡向正反应方向移动;(5)本题考查化学平衡常数的计算,当p(O2)=2kPa,此时的结合度为80%,即c(MbO2)=c×80%mol·L-1,c(Mb)=c×20%mol·L-1,代入表达式,K=c×80%/(c×20%×2)=2.00kPa-1;(6)本题考查化学平衡常数的计算,根据(5)中化学平衡常数的表达式,有K=c(Mb)×a/[c(Mb)×(1-a)×p(O2)],解得a=,K只受温度的影响,温度不变,则K不变,因此K=2,p(O2)=20,代入上述表达式,即a=97.6%。
24.(1) 反应的活化能
(2) 分子总数 百分数 分子总数 百分数
【详解】(1)反应物转化为活化分子所吸收的能量为反应的活化能,则表示反应的活化能,使用催化剂降低反应的活化能,则使用催化剂时的活化能为,反应热等于正反应的活化能减去逆反应的活化能,则反应热为;
(2)增大反应物的浓度,单位体积内分子总数增加,活化分子数也增加,但活化分子百分数不变;升高反应体系的温度,单位体积内分子总数不变,有一部分普通分子吸收能量转化为活化分子,则活化分子百分数增加。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
