3.4 配合物、超分子-2024年高二化学选择性必修2课件(配人教版)(共30张PPT)
文档属性
| 名称 | 3.4 配合物、超分子-2024年高二化学选择性必修2课件(配人教版)(共30张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 00:00:00 | ||
图片预览











文档简介
(共30张PPT)
第三章 晶体结构与性质
第四节 配合物与超分子
【课程目标】
1、通过熟悉的无水硫酸铜与其溶液颜色不同这一现象,认识配位键的特征,并能与共价键进行简单比较。
2、在配位键的基础上,认识配合物的存在、结构特点及常见配合物的制取等。
3、了解超分子与分子的区别、超分子的简单应用。
【情境引入】
观察下列溶液的颜色,有什么规律?
CuSO4溶液 CuCl2溶液 CuBr2溶液
K2SO4溶液无色 NaCl溶液无色 KBr溶液无色
共性:都有Cu2+
初步结论:Cu2+是蓝色的
相同阴离子的溶液对照:
蓝色不是由这些阴离子导致的
【观察思考】
观察下列物质的颜色
CuSO4溶液 CuCl2溶液 CuBr2溶液
蓝色 蓝色 蓝色
CuSO4晶体 CuCl2晶体 CuBr2晶体
白色 棕色 深褐色
固态二价铜盐不一定显蓝色
结论修正:Cu2+在水溶液中
常显蓝色
【观察思考】
CuSO4·5H2O晶体 CuCl2·2H2O晶体
蓝色 绿色
五水合硫酸铜也显蓝色
理论解释:Cu2+与水结合显蓝色
观察下列物质的颜色
【观察思考】
孤电子对
O
H
H
配体
中心离子
Cu2+
(具有空轨道)
Cu2+
OH2
H2O
H2O
H2O
配位键
Cu2+ + 4H2O Cu(H2O)4
2+
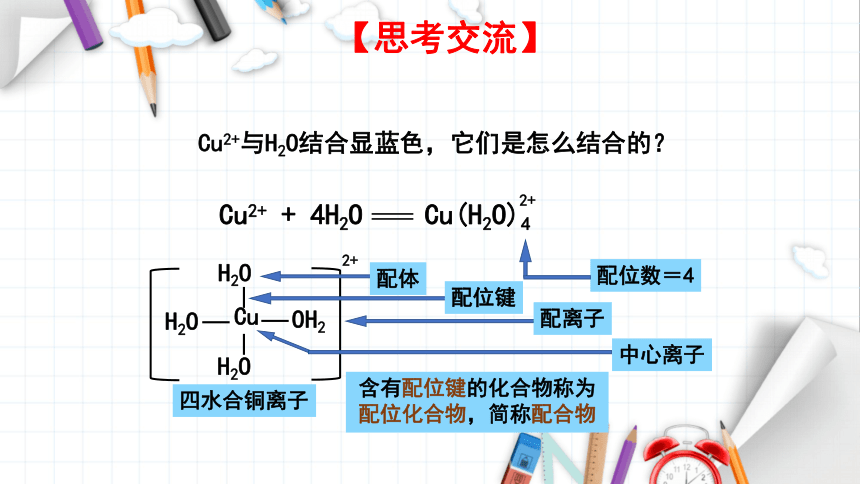
Cu2+与H2O结合显蓝色,它们是怎么结合的?
【思考交流】
Cu
OH2
H2O
H2O
H2O
2+
配体
配位键
配离子
中心离子
四水合铜离子
含有配位键的化合物称为配位化合物,简称配合物
配位数=4
Cu2+与H2O结合显蓝色,它们是怎么结合的?
Cu2+ + 4H2O Cu(H2O)4
2+
【思考交流】
定义:成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。
基本概念:
①中心原子(离子):提供空轨道,接受孤电子对。通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。
②配位体:提供孤电子对的离子或分子,如分子CO、NH3、H2O等,阴离子F-、CN-、CI-等。配位原子必须有孤电子对。
③配位数:直接同中心原子(离子)配位的分子或离子的数目叫中心原子(离子)的配位数。
【任务一:配位键】
配位键的形成条件①成键原子一方能提供孤电子对。如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。②成键原子另一方能提供空轨道。如H+、Al3+、B及过渡金属的原子或离子。
配位键同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
【任务一:配位键】
配位键的表示:(电子对给予体)A→B(电子对接受体)或A—B。例如H3O+
【任务一:配位键】
定义:通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
组成:配合物由中心离子或原子(提供空轨道)和配体(提供孤电子对)组成,分为内界和外界,以[Cu(NH3)4]SO4为例。
【任务二:配合物】
四氨合铜离子
Cu
NH3
NH3
H3N
NH3
2+
SO4
[Cu(NH3)4]SO4 硫酸四氨合铜
配体:NH3
2-
Cu(OH)2 + 4NH3 [Cu(NH3)4](OH)2
Cu2+ + 2NH3·H2O Cu(OH)2 + 2NH4
+
【任务三:了解更多的配合物】
实验3-3 制取 [Cu(NH3)4](OH)2
回想一下,如何检验Fe3+,思考:Fe3+与SCN-如何反应?
Fe3+ + SCN- Fe(SCN)2+
Fe(SCN)2+ + SCN- Fe(SCN)2
Fe(SCN)5 + SCN- Fe(SCN)6
…………
SCN-作为配体与Fe3+配位,显红色,用于检验Fe3+
硫氰化铁配离子的颜色
2-
3-
+
【任务三:了解更多的配合物】
化学方程式:AgCl+ 2NH3 [Ag(NH3)2]Cl
离子方程式:AgCl+ 2NH3 [Ag(NH3)2]+ + Cl-
Ag
NH3
H3N
+
二氨合银离子
配体:
中心离子:
配位数:
配体:NH3
中心离子:Ag+
配位数:2
向NaCl溶液中滴加AgNO3溶液和氨水
【任务三:了解更多的配合物】
实验3-5 制取[Ag(NH3)2]Cl
(1)对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
(2)颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
【配合物的形成对性质的影响】
在人和动物体内起输送氧气作用的血红素,是Fe的配合物。
配合物在生产和科学技术方面的应用也很广泛,例如,在医药科学、化学催化剂、新型分子材料等领域都有着广泛的应用。
【配合物的应用】
(1)下列物质中,不能作为配合物的配体的是( )。
A.NH3 B.NH4 C.H2O D.SCN-
+
(2)指出下列各配合物中的配离子、中心离子、
配位体、配位数和配位原子。
① K3[Fe(CN)6]
②(NH4)2[PtCl6]
③[Cd(NH3)4](OH)2
【课堂练习】
1.超分子——①DNA碱基配对
双螺旋DNA的两条分子链是通过什么结合的?
【任务四:超分子】
常见的DNA碱基配对结构
A T
G C
DNA碱基对是通过氢键相互识别并结合的
1.超分子——①DNA碱基配对
【任务四:超分子】
超分子是由两种或两种以上的分子(或离子)通过分子间相互作用形成的分子聚集体
氢键
1.超分子——①DNA碱基配对
【任务四:超分子】
超分子的特性
①分子间相互作用:通过非共价键结合,包括氢键、静电作用、疏水作用以及一些分子与金属离子形成的弱配位键等。
②分子聚集体大小:分子聚集体有的是有限的,有的是无限伸展的。
1.超分子——②杯酚与C60
杯酚与C60通过范德华力相结合,通过尺寸匹配实现分子识别
【任务四:超分子】
1.超分子——③冠醚与阳离子
冠醚
18-冠醚-6的结构
冠醚与金属阳离子通过配位作用相结合
【任务四:超分子】
冠醚 冠醚空腔直径/pm 合适的粒子(直径/pm)
12-冠-4 120~150 Li+(152)
15-冠-5 170~220 Na+(204)
18-冠-6 260~320 K+(276)
Rb+(304)
21-冠-7 340~430 Cs+(334)
不同冠醚的空腔尺寸不同,与不同的阳离子相匹配,从而实现选择性结合。
1.超分子——③冠醚与阳离子
【任务四:超分子】
超分子的特征之一:分子识别
2.超分子有序体
表面活性剂:从分子结构上说,也可以叫“两亲分子”,一端为亲水基团,另一端为疏水基团。
硬脂酸根(传统肥皂的有效成分之一)
十二烷基苯磺酸根
(合成洗涤剂中常用的表面活性剂)
【任务四:超分子】
低浓度时,优先在溶液表面形成单分子层,降低表面张力。
高浓度时,剩余的表面活性剂在溶液中形成胶束。
2.超分子有序体
【任务四:超分子】
相似相溶
亲水端倾向于与水相接触
疏水端倾向于不与水接触,彼此聚集
2.超分子有序体
【任务四:超分子】
超分子的特征之二:自组装
纯水 洗涤灵 胶束
2.超分子有序体
【任务四:超分子】
含义:研究超分子的化学叫超分子化学,是一门处于近代化学、材料化学和生命科学交汇点的新兴学科。
应用:在分子识别与人工酶、酶的功能、短肽和环核酸的组装体及其功能等领域有着广阔的应 用前景。
研究领域:环状配体组成的主客体体系;有序的分子聚集体;由两个或两个以上基团用柔性链或刚性链连接而成的超分子化合物。
【任务五:超分子化学】
【课堂小结】
第三章 晶体结构与性质
第四节 配合物与超分子
【课程目标】
1、通过熟悉的无水硫酸铜与其溶液颜色不同这一现象,认识配位键的特征,并能与共价键进行简单比较。
2、在配位键的基础上,认识配合物的存在、结构特点及常见配合物的制取等。
3、了解超分子与分子的区别、超分子的简单应用。
【情境引入】
观察下列溶液的颜色,有什么规律?
CuSO4溶液 CuCl2溶液 CuBr2溶液
K2SO4溶液无色 NaCl溶液无色 KBr溶液无色
共性:都有Cu2+
初步结论:Cu2+是蓝色的
相同阴离子的溶液对照:
蓝色不是由这些阴离子导致的
【观察思考】
观察下列物质的颜色
CuSO4溶液 CuCl2溶液 CuBr2溶液
蓝色 蓝色 蓝色
CuSO4晶体 CuCl2晶体 CuBr2晶体
白色 棕色 深褐色
固态二价铜盐不一定显蓝色
结论修正:Cu2+在水溶液中
常显蓝色
【观察思考】
CuSO4·5H2O晶体 CuCl2·2H2O晶体
蓝色 绿色
五水合硫酸铜也显蓝色
理论解释:Cu2+与水结合显蓝色
观察下列物质的颜色
【观察思考】
孤电子对
O
H
H
配体
中心离子
Cu2+
(具有空轨道)
Cu2+
OH2
H2O
H2O
H2O
配位键
Cu2+ + 4H2O Cu(H2O)4
2+
Cu2+与H2O结合显蓝色,它们是怎么结合的?
【思考交流】
Cu
OH2
H2O
H2O
H2O
2+
配体
配位键
配离子
中心离子
四水合铜离子
含有配位键的化合物称为配位化合物,简称配合物
配位数=4
Cu2+与H2O结合显蓝色,它们是怎么结合的?
Cu2+ + 4H2O Cu(H2O)4
2+
【思考交流】
定义:成键原子或离子一方提供空轨道,另一方提供孤电子对而形成的,这类“电子对给予-接受”键被称为配位键。
基本概念:
①中心原子(离子):提供空轨道,接受孤电子对。通常是过渡元素的原子或离子,如Fe、Ni、Fe3+、Cu2+、Zn2+、Ag+、Co3+、Cr3+等。
②配位体:提供孤电子对的离子或分子,如分子CO、NH3、H2O等,阴离子F-、CN-、CI-等。配位原子必须有孤电子对。
③配位数:直接同中心原子(离子)配位的分子或离子的数目叫中心原子(离子)的配位数。
【任务一:配位键】
配位键的形成条件①成键原子一方能提供孤电子对。如分子有NH3、H2O、HF、CO等;离子有Cl-、OH-、CN-、SCN-等。②成键原子另一方能提供空轨道。如H+、Al3+、B及过渡金属的原子或离子。
配位键同样具有饱和性和方向性。一般来说,多数过渡金属的原子或离子形成配位键的数目是基本不变的,如Ag+形成2个配位键;Cu2+形成4个配位键等。
【任务一:配位键】
配位键的表示:(电子对给予体)A→B(电子对接受体)或A—B。例如H3O+
【任务一:配位键】
定义:通常把金属离子或原子(称为中心离子或原子)与某些分子或离子(称为配体或配位体)以配位键结合形成的化合物称为配位化合物,简称配合物。
组成:配合物由中心离子或原子(提供空轨道)和配体(提供孤电子对)组成,分为内界和外界,以[Cu(NH3)4]SO4为例。
【任务二:配合物】
四氨合铜离子
Cu
NH3
NH3
H3N
NH3
2+
SO4
[Cu(NH3)4]SO4 硫酸四氨合铜
配体:NH3
2-
Cu(OH)2 + 4NH3 [Cu(NH3)4](OH)2
Cu2+ + 2NH3·H2O Cu(OH)2 + 2NH4
+
【任务三:了解更多的配合物】
实验3-3 制取 [Cu(NH3)4](OH)2
回想一下,如何检验Fe3+,思考:Fe3+与SCN-如何反应?
Fe3+ + SCN- Fe(SCN)2+
Fe(SCN)2+ + SCN- Fe(SCN)2
Fe(SCN)5 + SCN- Fe(SCN)6
…………
SCN-作为配体与Fe3+配位,显红色,用于检验Fe3+
硫氰化铁配离子的颜色
2-
3-
+
【任务三:了解更多的配合物】
化学方程式:AgCl+ 2NH3 [Ag(NH3)2]Cl
离子方程式:AgCl+ 2NH3 [Ag(NH3)2]+ + Cl-
Ag
NH3
H3N
+
二氨合银离子
配体:
中心离子:
配位数:
配体:NH3
中心离子:Ag+
配位数:2
向NaCl溶液中滴加AgNO3溶液和氨水
【任务三:了解更多的配合物】
实验3-5 制取[Ag(NH3)2]Cl
(1)对溶解性的影响
一些难溶于水的金属氢氧化物、氯化物、溴化物、碘化物、氰化物,可以溶解于氨水中,或依次溶解于含过量的OH-、Cl-、Br-、I-、CN-的溶液中,形成可溶性的配合物。
(2)颜色的改变
当简单离子形成配离子时,其性质往往有很大差异。颜色发生变化就是一种常见的现象,根据颜色的变化就可以判断是否有配离子生成。
(3)稳定性增强
配合物具有一定的稳定性,配合物中的配位键越强,配合物越稳定。当作为中心离子的金属离子相同时,配合物的稳定性与配体的性质有关。
【配合物的形成对性质的影响】
在人和动物体内起输送氧气作用的血红素,是Fe的配合物。
配合物在生产和科学技术方面的应用也很广泛,例如,在医药科学、化学催化剂、新型分子材料等领域都有着广泛的应用。
【配合物的应用】
(1)下列物质中,不能作为配合物的配体的是( )。
A.NH3 B.NH4 C.H2O D.SCN-
+
(2)指出下列各配合物中的配离子、中心离子、
配位体、配位数和配位原子。
① K3[Fe(CN)6]
②(NH4)2[PtCl6]
③[Cd(NH3)4](OH)2
【课堂练习】
1.超分子——①DNA碱基配对
双螺旋DNA的两条分子链是通过什么结合的?
【任务四:超分子】
常见的DNA碱基配对结构
A T
G C
DNA碱基对是通过氢键相互识别并结合的
1.超分子——①DNA碱基配对
【任务四:超分子】
超分子是由两种或两种以上的分子(或离子)通过分子间相互作用形成的分子聚集体
氢键
1.超分子——①DNA碱基配对
【任务四:超分子】
超分子的特性
①分子间相互作用:通过非共价键结合,包括氢键、静电作用、疏水作用以及一些分子与金属离子形成的弱配位键等。
②分子聚集体大小:分子聚集体有的是有限的,有的是无限伸展的。
1.超分子——②杯酚与C60
杯酚与C60通过范德华力相结合,通过尺寸匹配实现分子识别
【任务四:超分子】
1.超分子——③冠醚与阳离子
冠醚
18-冠醚-6的结构
冠醚与金属阳离子通过配位作用相结合
【任务四:超分子】
冠醚 冠醚空腔直径/pm 合适的粒子(直径/pm)
12-冠-4 120~150 Li+(152)
15-冠-5 170~220 Na+(204)
18-冠-6 260~320 K+(276)
Rb+(304)
21-冠-7 340~430 Cs+(334)
不同冠醚的空腔尺寸不同,与不同的阳离子相匹配,从而实现选择性结合。
1.超分子——③冠醚与阳离子
【任务四:超分子】
超分子的特征之一:分子识别
2.超分子有序体
表面活性剂:从分子结构上说,也可以叫“两亲分子”,一端为亲水基团,另一端为疏水基团。
硬脂酸根(传统肥皂的有效成分之一)
十二烷基苯磺酸根
(合成洗涤剂中常用的表面活性剂)
【任务四:超分子】
低浓度时,优先在溶液表面形成单分子层,降低表面张力。
高浓度时,剩余的表面活性剂在溶液中形成胶束。
2.超分子有序体
【任务四:超分子】
相似相溶
亲水端倾向于与水相接触
疏水端倾向于不与水接触,彼此聚集
2.超分子有序体
【任务四:超分子】
超分子的特征之二:自组装
纯水 洗涤灵 胶束
2.超分子有序体
【任务四:超分子】
含义:研究超分子的化学叫超分子化学,是一门处于近代化学、材料化学和生命科学交汇点的新兴学科。
应用:在分子识别与人工酶、酶的功能、短肽和环核酸的组装体及其功能等领域有着广阔的应 用前景。
研究领域:环状配体组成的主客体体系;有序的分子聚集体;由两个或两个以上基团用柔性链或刚性链连接而成的超分子化合物。
【任务五:超分子化学】
【课堂小结】
