2024年高考化学重点专题:化学实验综合(含答案)
文档属性
| 名称 | 2024年高考化学重点专题:化学实验综合(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 887.2KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-06 09:39:23 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024年高考化学重点专题:化学实验综合
一、选择题
1.配合物的制备步骤如下:
Ⅰ.称取,溶解于水中。
Ⅱ.称取,溶解于水中,80℃加热,得到砖红色溶液。
III.将步骤II配置的溶液加入到溶液中,加热搅拌约
IV.当溶液析出少量固体时,冷却,过滤,洗涤,烘干,称重。
下列说法错误的是( )
A.步骤II中可使用水浴加热
B.步骤III中为控制反应速率,应逐滴加入
C.步骤II中发生了水解
D.步骤IV中为提高纯度,可用热水洗涤
2.下图是一种改进的制备乙炔气体的装置。装置为自制仪器,下列仪器中与作用相同的是( )
A.漏斗 B.分液漏斗 C.滴液漏斗 D.布氏漏斗
A.A B.B C.C D.D
3.马来酸依那普利(记为X,摩尔质量为M,)是一种心血管疾病防治药物,结构式为:
通常使用以下两种方法滴定分析样品中X的质量分数:
方法一:将mg样品溶于有机溶剂中,以的溶液滴定,终点消耗,计量关系为;
方法二:将mg样品溶于水中,以的溶液滴定,终点消耗,计量关系为。
下列说法正确的是( )
A.方法一滴定终点时, B.方法一
C.方法二滴定终点时, D.方法二
4.以下探究目的对应的实验方案最合适的是( )
实验方案 探究目的
A 向溶液中加入金属 比较和的还原能力
B 分别向稀硝酸和稀醋酸中加入铜粉 比较稀硝酸和稀醋酸的酸性强弱
C 将浓硫酸滴入乙醇中,加热至,生成的气体通入酸性重铬酸钾溶液 验证乙烯具有还原性
D 向溶液中同时通入和 比较和的氧化能力
A.A B.B C.C D.D
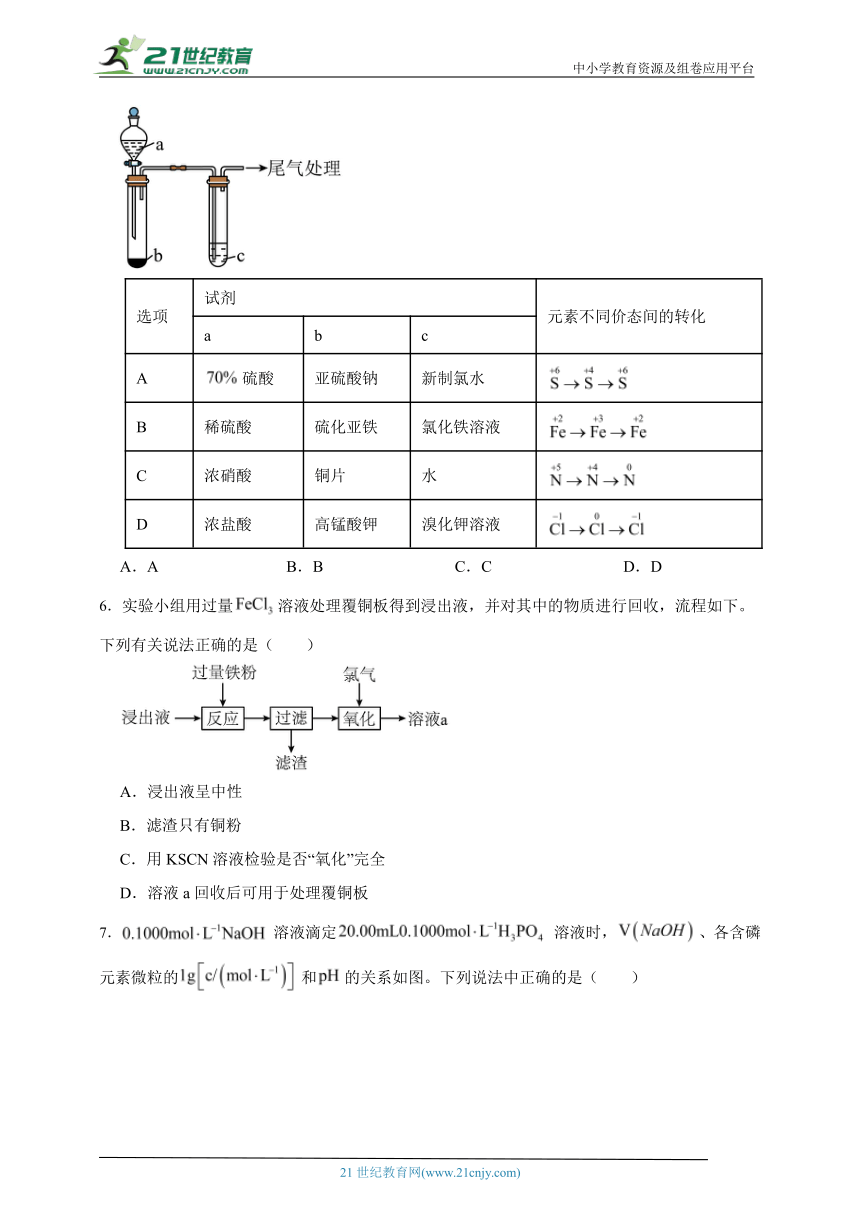
5.实验是探究元素化合物性质的重要方法。利用下列实验装置和试剂能实现相应元素不同价态间转化的是( )
选项 试剂 元素不同价态间的转化
a b c
A 硫酸 亚硫酸钠 新制氯水
B 稀硫酸 硫化亚铁 氯化铁溶液
C 浓硝酸 铜片 水
D 浓盐酸 高锰酸钾 溴化钾溶液
A.A B.B C.C D.D
6.实验小组用过量溶液处理覆铜板得到浸出液,并对其中的物质进行回收,流程如下。下列有关说法正确的是( )
A.浸出液呈中性
B.滤渣只有铜粉
C.用KSCN溶液检验是否“氧化”完全
D.溶液a回收后可用于处理覆铜板
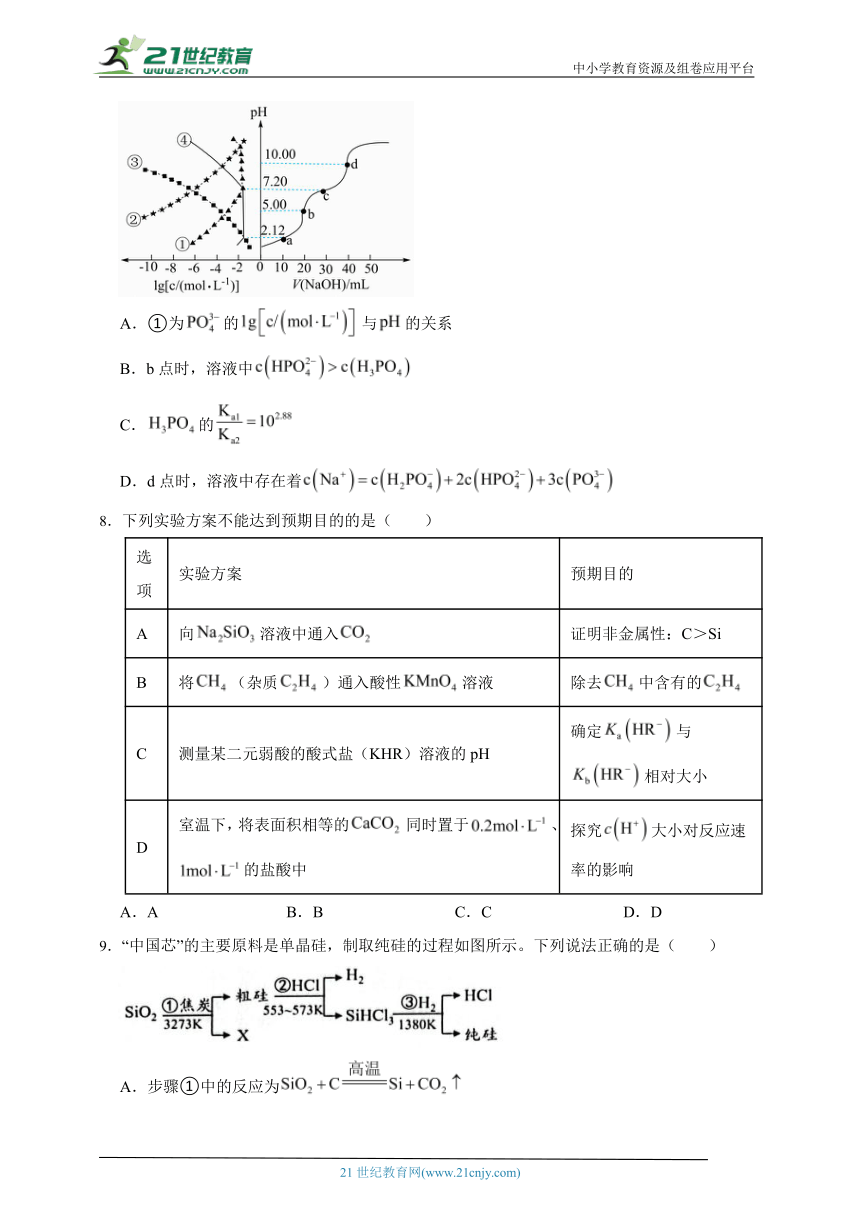
7.溶液滴定溶液时,、各含磷元素微粒的和的关系如图。下列说法中正确的是( )
A.①为的与的关系
B.b点时,溶液中
C.的
D.d点时,溶液中存在着
8.下列实验方案不能达到预期目的的是( )
选项 实验方案 预期目的
A 向溶液中通入 证明非金属性:C>Si
B 将(杂质)通入酸性溶液 除去中含有的
C 测量某二元弱酸的酸式盐(KHR)溶液的pH 确定与相对大小
D 室温下,将表面积相等的同时置于、的盐酸中 探究大小对反应速率的影响
A.A B.B C.C D.D
9.“中国芯”的主要原料是单晶硅,制取纯硅的过程如图所示。下列说法正确的是( )
A.步骤①中的反应为
B.二氧化硅是酸性氧化物,能与水反应生成硅酸
C.步骤②和③均属于置换反应
D.28g纯硅中含有4molSi-Si键
10.某同学用下列实验装置探究氨气与氧气的反应,观察到d中产生“白烟”。下列叙述不正确的是( )
A.装置连接顺序为a-c-b-d-e
B.实验前应先检查装置气密性
C.装置c的作用是干燥氨气
D.装置d中“白烟”为固体颗粒
二、非选择题
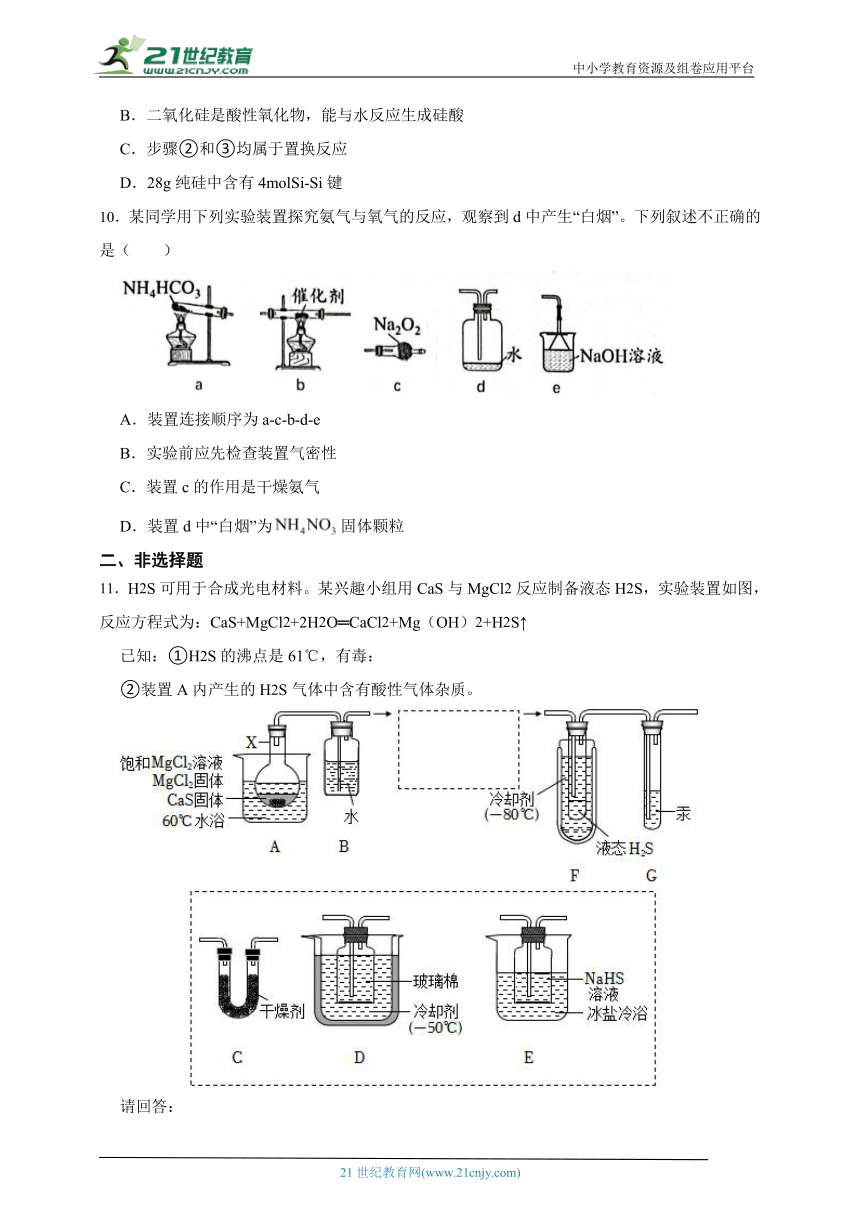
11.H2S可用于合成光电材料。某兴趣小组用CaS与MgCl2反应制备液态H2S,实验装置如图,反应方程式为:CaS+MgCl2+2H2O═CaCl2+Mg(OH)2+H2S↑
已知:①H2S的沸点是61℃,有毒:
②装置A内产生的H2S气体中含有酸性气体杂质。
请回答:
(1)仪器X的名称是 。
(2)完善虚框内的装置排序:A→B→ → → →F+G
(3)下列干燥剂,可用于装置C中的是 。
A.氢氧化钾 B.五氧化二磷 C.氯化钙 D.碱石灰
(4)装置G中汞的两个作用是:①平衡气压:② 。
(5)下列说法正确的是 。
A.该实验操作须在通风橱中进行
B.装置D的主要作用是预冷却H2S
C.加入的MgCl2固体,可使MgCl2溶液保持饱和,有利于平稳持续产生H2S
D.该实验产生的尾气可用硝酸吸收
(6)取0.680gH2S产品,与足量CuSO4溶液充分反应后,将生成的CuS置于已恒重、质量为31.230g的坩埚中,煅烧生成CuO,恒重后总质量为32.814g。产品的纯度为 。
12.铜(Ⅰ)配合物的制备及纯度分析步骤如下。
Ⅰ.制备
将乙腈、、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
Ⅱ.纯度分析
取mg产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成溶液。取溶液,加入指示剂后,再用标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。
已知:①沸点为81℃,酸性条件下遇水生成;
②较易被空气氧化;
③EDTA与形成1:1配合物;
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器a的作用是 ;b中应加入 作为最佳传热介质。
(2)加入过量铜粉能提高产物的纯度,可能的原因是 。
(3)“一系列操作”依次为 、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)与足量浓硝酸发生反应的离子方程式为 。
(5)加入醋酸钠溶液的主要目的是 。
(6)测得产品的纯度为 (用含m、c、V的代数式表示)。
(7)下列情况会导致产品纯度测定结果偏高的有____。
A.产品中含有 B.滴定终点时俯视读数
C.盛装EDTA溶液的滴定管未润洗 D.产品干燥不充分
13.某化学兴趣小组利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2等)为原料来制取氧化铁。
请回答下列问题:
(1)硫铁矿烧渣酸溶时,升高温度的原因是 ;步骤II的操作名称为 。
(2)检验步骤III反应后的溶液中金属阳离子的试剂是: 。
(3)步骤V中,FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5 mol/L,是判断所得FeCO3中是否混有Fe(OH)2 (填“是”或“否”),请通过简单计算说明理由(已知Ksp[Fe(OH)2]=4.9×10-17) 。
(4)步骤V的反应温度一般需要控制在35℃以下,其目的是 ;反应生成FeCO3的离子反应方程式: 。
(5)欲测定硫铁矿烧渣中Fe元素的质量分数,称取w g样品,充分酸溶、水溶后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称的残留固体为n g。该样品中Fe元素的质量分数为 (用w、n的代数式表示)
14.疫情防控中,含氯消毒剂发挥了重要作用。含氯消毒剂有多种,如、、NaClO、、。某化学兴趣小组利用NaOH溶液来制备含氯消毒剂。
(1)Ⅰ.配制一定物质的量浓度的NaOH溶液
配制250 mL 1.0 mol/L NaOH溶液,需用托盘天平称取 g NaOH固体。配制该溶液除用到量筒、烧杯、玻璃棒外,还需要的玻璃仪器是 。
(2)下列操作中,会造成所配溶液浓度偏低的是 。
a.容量瓶用蒸馏水洗涤后,没有经过干燥立即使用
b.溶液未经冷却立即转移到容量瓶中定容
c.没有洗涤烧杯和玻璃棒
d.向容量瓶加水定容时眼睛俯视观察刻度线
(3)Ⅱ.利用如图装置制备“84”消毒液
实验室安全图标不仅能够提醒潜在的危险因素,还能够引导实验人员采取相应的防护措施,以下制备“84”消毒液的实验不需要标记的图标有 (填标号)。
①护目镜 ②锐器 ③明火 ④热烫 ⑤排风 ⑥洗手
(4)仪器A的名称为 。
(5)装置①中二氧化锰和浓盐酸反应制取氯气的化学方程式为 。
(6)装置②中盛装的试剂为 ,用于除去中的HCl杂质。
(7)装置③中制得“84”消毒液,其有效成分是 (填化学式)。
(8)清洗卫生间时,“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,用离子方程式解释其原因为 。
(9)含氯消毒剂中有效氯含量,能反映含氯消毒剂消毒能力的大小,其定义是每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。则NaClO的有效氯含量为 (保留小数点后两位)。
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】B
4.【答案】D
5.【答案】D
6.【答案】D
7.【答案】B
8.【答案】B
9.【答案】C
10.【答案】C
11.【答案】(1)圆底烧瓶
(2)E;C;D
(3)B;C
(4)液封
(5)A;B;C
(6)99%
12.【答案】(1)冷凝回流;水
(2)能将反应中可能生成的二价铜还原为一价铜
(3)过滤分离出滤液
(4)
(5)为滴定提供碱性环境
(6)
(7)A;C
13.【答案】(1)提高酸浸时的速率;过滤
(2)K3[Fe(CN)6]溶液
(3)否;溶液中c(Fe2+) c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<4.9×10-17,故无Fe(OH)2沉淀生成
(4)防止NH4HCO3分解,减少Fe2+的水解;Fe2++2=FeCO3↓+CO2↑+H2O
(5)
14.【答案】(1)10.0;250mL容量瓶、胶头滴管
(2)c
(3)②
(4)分液漏斗
(5)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(6)饱和食盐水
(7)NaClO
(8)ClO-+Cl-+2H+=Cl2↑+H2O
(9)0.95
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年高考化学重点专题:化学实验综合
一、选择题
1.配合物的制备步骤如下:
Ⅰ.称取,溶解于水中。
Ⅱ.称取,溶解于水中,80℃加热,得到砖红色溶液。
III.将步骤II配置的溶液加入到溶液中,加热搅拌约
IV.当溶液析出少量固体时,冷却,过滤,洗涤,烘干,称重。
下列说法错误的是( )
A.步骤II中可使用水浴加热
B.步骤III中为控制反应速率,应逐滴加入
C.步骤II中发生了水解
D.步骤IV中为提高纯度,可用热水洗涤
2.下图是一种改进的制备乙炔气体的装置。装置为自制仪器,下列仪器中与作用相同的是( )
A.漏斗 B.分液漏斗 C.滴液漏斗 D.布氏漏斗
A.A B.B C.C D.D
3.马来酸依那普利(记为X,摩尔质量为M,)是一种心血管疾病防治药物,结构式为:
通常使用以下两种方法滴定分析样品中X的质量分数:
方法一:将mg样品溶于有机溶剂中,以的溶液滴定,终点消耗,计量关系为;
方法二:将mg样品溶于水中,以的溶液滴定,终点消耗,计量关系为。
下列说法正确的是( )
A.方法一滴定终点时, B.方法一
C.方法二滴定终点时, D.方法二
4.以下探究目的对应的实验方案最合适的是( )
实验方案 探究目的
A 向溶液中加入金属 比较和的还原能力
B 分别向稀硝酸和稀醋酸中加入铜粉 比较稀硝酸和稀醋酸的酸性强弱
C 将浓硫酸滴入乙醇中,加热至,生成的气体通入酸性重铬酸钾溶液 验证乙烯具有还原性
D 向溶液中同时通入和 比较和的氧化能力
A.A B.B C.C D.D
5.实验是探究元素化合物性质的重要方法。利用下列实验装置和试剂能实现相应元素不同价态间转化的是( )
选项 试剂 元素不同价态间的转化
a b c
A 硫酸 亚硫酸钠 新制氯水
B 稀硫酸 硫化亚铁 氯化铁溶液
C 浓硝酸 铜片 水
D 浓盐酸 高锰酸钾 溴化钾溶液
A.A B.B C.C D.D
6.实验小组用过量溶液处理覆铜板得到浸出液,并对其中的物质进行回收,流程如下。下列有关说法正确的是( )
A.浸出液呈中性
B.滤渣只有铜粉
C.用KSCN溶液检验是否“氧化”完全
D.溶液a回收后可用于处理覆铜板
7.溶液滴定溶液时,、各含磷元素微粒的和的关系如图。下列说法中正确的是( )
A.①为的与的关系
B.b点时,溶液中
C.的
D.d点时,溶液中存在着
8.下列实验方案不能达到预期目的的是( )
选项 实验方案 预期目的
A 向溶液中通入 证明非金属性:C>Si
B 将(杂质)通入酸性溶液 除去中含有的
C 测量某二元弱酸的酸式盐(KHR)溶液的pH 确定与相对大小
D 室温下,将表面积相等的同时置于、的盐酸中 探究大小对反应速率的影响
A.A B.B C.C D.D
9.“中国芯”的主要原料是单晶硅,制取纯硅的过程如图所示。下列说法正确的是( )
A.步骤①中的反应为
B.二氧化硅是酸性氧化物,能与水反应生成硅酸
C.步骤②和③均属于置换反应
D.28g纯硅中含有4molSi-Si键
10.某同学用下列实验装置探究氨气与氧气的反应,观察到d中产生“白烟”。下列叙述不正确的是( )
A.装置连接顺序为a-c-b-d-e
B.实验前应先检查装置气密性
C.装置c的作用是干燥氨气
D.装置d中“白烟”为固体颗粒
二、非选择题
11.H2S可用于合成光电材料。某兴趣小组用CaS与MgCl2反应制备液态H2S,实验装置如图,反应方程式为:CaS+MgCl2+2H2O═CaCl2+Mg(OH)2+H2S↑
已知:①H2S的沸点是61℃,有毒:
②装置A内产生的H2S气体中含有酸性气体杂质。
请回答:
(1)仪器X的名称是 。
(2)完善虚框内的装置排序:A→B→ → → →F+G
(3)下列干燥剂,可用于装置C中的是 。
A.氢氧化钾 B.五氧化二磷 C.氯化钙 D.碱石灰
(4)装置G中汞的两个作用是:①平衡气压:② 。
(5)下列说法正确的是 。
A.该实验操作须在通风橱中进行
B.装置D的主要作用是预冷却H2S
C.加入的MgCl2固体,可使MgCl2溶液保持饱和,有利于平稳持续产生H2S
D.该实验产生的尾气可用硝酸吸收
(6)取0.680gH2S产品,与足量CuSO4溶液充分反应后,将生成的CuS置于已恒重、质量为31.230g的坩埚中,煅烧生成CuO,恒重后总质量为32.814g。产品的纯度为 。
12.铜(Ⅰ)配合物的制备及纯度分析步骤如下。
Ⅰ.制备
将乙腈、、过量铜粉混合于圆底烧瓶,控温85℃、磁力搅拌,至反应完全(装置如图)。经一系列操作,得到白色固体产品。
Ⅱ.纯度分析
取mg产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成溶液。取溶液,加入指示剂后,再用标准溶液滴定至终点。平行滴定三次, 消耗EDTA溶液的平均体积为VmL。
已知:①沸点为81℃,酸性条件下遇水生成;
②较易被空气氧化;
③EDTA与形成1:1配合物;
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器a的作用是 ;b中应加入 作为最佳传热介质。
(2)加入过量铜粉能提高产物的纯度,可能的原因是 。
(3)“一系列操作”依次为 、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。
(4)与足量浓硝酸发生反应的离子方程式为 。
(5)加入醋酸钠溶液的主要目的是 。
(6)测得产品的纯度为 (用含m、c、V的代数式表示)。
(7)下列情况会导致产品纯度测定结果偏高的有____。
A.产品中含有 B.滴定终点时俯视读数
C.盛装EDTA溶液的滴定管未润洗 D.产品干燥不充分
13.某化学兴趣小组利用硫铁矿烧渣(主要成分为Fe3O4、Fe2O3、FeO、SiO2等)为原料来制取氧化铁。
请回答下列问题:
(1)硫铁矿烧渣酸溶时,升高温度的原因是 ;步骤II的操作名称为 。
(2)检验步骤III反应后的溶液中金属阳离子的试剂是: 。
(3)步骤V中,FeCO3达到沉淀溶解平衡时,室温下测得溶液的pH为8,c(Fe2+)为1.0×10-5 mol/L,是判断所得FeCO3中是否混有Fe(OH)2 (填“是”或“否”),请通过简单计算说明理由(已知Ksp[Fe(OH)2]=4.9×10-17) 。
(4)步骤V的反应温度一般需要控制在35℃以下,其目的是 ;反应生成FeCO3的离子反应方程式: 。
(5)欲测定硫铁矿烧渣中Fe元素的质量分数,称取w g样品,充分酸溶、水溶后过滤,向滤液中加入足量的H2O2,充分反应后加入NaOH溶液至不再产生沉淀,经过滤、洗涤、灼烧至固体恒重,冷却后称的残留固体为n g。该样品中Fe元素的质量分数为 (用w、n的代数式表示)
14.疫情防控中,含氯消毒剂发挥了重要作用。含氯消毒剂有多种,如、、NaClO、、。某化学兴趣小组利用NaOH溶液来制备含氯消毒剂。
(1)Ⅰ.配制一定物质的量浓度的NaOH溶液
配制250 mL 1.0 mol/L NaOH溶液,需用托盘天平称取 g NaOH固体。配制该溶液除用到量筒、烧杯、玻璃棒外,还需要的玻璃仪器是 。
(2)下列操作中,会造成所配溶液浓度偏低的是 。
a.容量瓶用蒸馏水洗涤后,没有经过干燥立即使用
b.溶液未经冷却立即转移到容量瓶中定容
c.没有洗涤烧杯和玻璃棒
d.向容量瓶加水定容时眼睛俯视观察刻度线
(3)Ⅱ.利用如图装置制备“84”消毒液
实验室安全图标不仅能够提醒潜在的危险因素,还能够引导实验人员采取相应的防护措施,以下制备“84”消毒液的实验不需要标记的图标有 (填标号)。
①护目镜 ②锐器 ③明火 ④热烫 ⑤排风 ⑥洗手
(4)仪器A的名称为 。
(5)装置①中二氧化锰和浓盐酸反应制取氯气的化学方程式为 。
(6)装置②中盛装的试剂为 ,用于除去中的HCl杂质。
(7)装置③中制得“84”消毒液,其有效成分是 (填化学式)。
(8)清洗卫生间时,“84”消毒液和洁厕灵(主要成分是稀盐酸)不能混合使用,用离子方程式解释其原因为 。
(9)含氯消毒剂中有效氯含量,能反映含氯消毒剂消毒能力的大小,其定义是每克含氯消毒剂的氧化能力相当于多少克氯气的氧化能力。则NaClO的有效氯含量为 (保留小数点后两位)。
答案解析部分
1.【答案】D
2.【答案】C
3.【答案】B
4.【答案】D
5.【答案】D
6.【答案】D
7.【答案】B
8.【答案】B
9.【答案】C
10.【答案】C
11.【答案】(1)圆底烧瓶
(2)E;C;D
(3)B;C
(4)液封
(5)A;B;C
(6)99%
12.【答案】(1)冷凝回流;水
(2)能将反应中可能生成的二价铜还原为一价铜
(3)过滤分离出滤液
(4)
(5)为滴定提供碱性环境
(6)
(7)A;C
13.【答案】(1)提高酸浸时的速率;过滤
(2)K3[Fe(CN)6]溶液
(3)否;溶液中c(Fe2+) c2(OH-)=1.0×10-5×(1×10-6)2=1.0×10-17<4.9×10-17,故无Fe(OH)2沉淀生成
(4)防止NH4HCO3分解,减少Fe2+的水解;Fe2++2=FeCO3↓+CO2↑+H2O
(5)
14.【答案】(1)10.0;250mL容量瓶、胶头滴管
(2)c
(3)②
(4)分液漏斗
(5)MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
(6)饱和食盐水
(7)NaClO
(8)ClO-+Cl-+2H+=Cl2↑+H2O
(9)0.95
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
