2024年高考化学重点专题:物质结构与性质(含答案)
文档属性
| 名称 | 2024年高考化学重点专题:物质结构与性质(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 831.4KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-06 09:41:40 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024年高考化学重点专题:物质结构与性质
一、选择题
1.下列表示不正确的是( )
A.中子数为10的氧原子:
B.SO2的价层电子对互斥(VSEPR)模型:
C.用电子式表示KCl的形成过程:
D.的名称:2﹣甲基4﹣乙基戊烷
2.磷酸聚合可以生成链状多磷酸和环状多磷酸,三分子磷酸聚合形成的链状三磷酸结构如图所示。下列说法正确的是( )
A.键能:
B.元素的电负性:
C.的空间构型:平面四边形
D.六元环状三磷酸的分子式:
3.镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,具有催化活性的是,图①和图②是晶胞的不同切面。下列说法错误的是( )
A.催化活性:①>②
B.镍酸镧晶体的化学式为
C.周围紧邻的O有4个
D.和的最短距离为
4.下列化学用语表述正确的是( )
A.的空间结构为V形
B.顺二溴乙烯结构式为
C.的电子式为
D.基态原子价电子排布式为
5.朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系型晶胞如下图所示,晶胞参数为anm,A原子的分数坐标为,阿伏加德罗常数的值为,下列说法正确的是( )
A.S的配位数是6
B.晶胞中B原子分数坐标为
C.该晶体的密度是
D.相邻两个Hg的最短距离为
6.甲酸甲酯作为潜在的储氢材料受到关注,科学家发现使用配合物催化剂可以使甲酸甲酯温和释氢,其可能的反应过程如下图所示。下列说法错误的是( )
A.为极性分子,为非极性分子
B.每消耗生成
C.总反应为
D.反应涉及键断裂和键形成
7.烟气脱硫可有效减少引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知时,几种酸的电离常数:,;,;(乳酸)。研究发现:乳酸和乙醇胺()作用得到的离子液体——乙醇胺乳酸盐(),既可脱硫,也可吸收CO2。下列说法错误的是( )
A.液态时的导电性:乳酸
B.乳酸和乙醇胺中均含有键、键和氢键
C.是直线形非极性分子,是形极性分子
D.相同条件下,能吸收气体的体积:
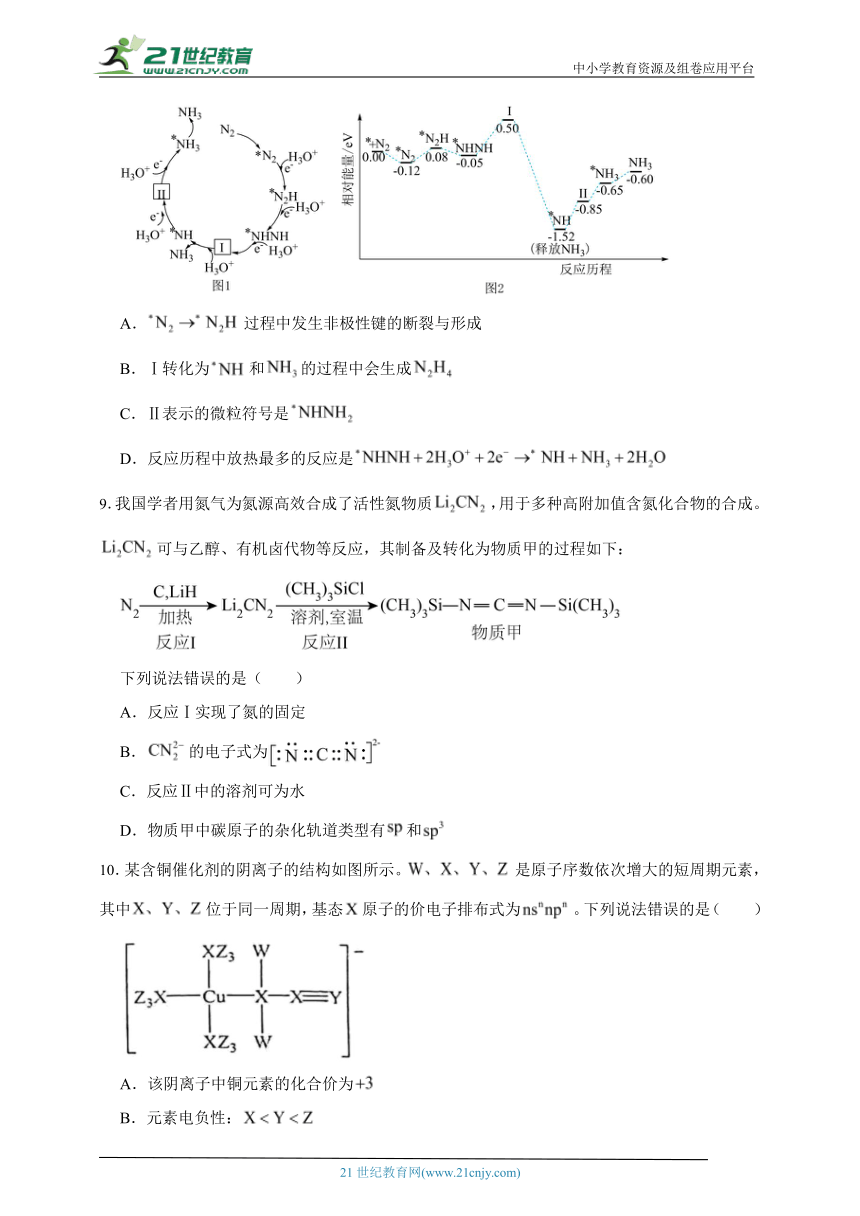
8.科研人员利用高压气流将水微滴喷射到涂覆催化剂的石墨网上,研究常温制氨,其反应历程中微粒转化关系如图1,相对能量变化关系如图2,图中*表示催化剂表面吸附位。下列说法正确的是( )
A.过程中发生非极性键的断裂与形成
B.Ⅰ转化为和的过程中会生成
C.Ⅱ表示的微粒符号是
D.反应历程中放热最多的反应是
9.我国学者用氮气为氮源高效合成了活性氮物质,用于多种高附加值含氮化合物的合成。可与乙醇、有机卤代物等反应,其制备及转化为物质甲的过程如下:
下列说法错误的是( )
A.反应Ⅰ实现了氮的固定
B.的电子式为
C.反应Ⅱ中的溶剂可为水
D.物质甲中碳原子的杂化轨道类型有和
10.某含铜催化剂的阴离子的结构如图所示。是原子序数依次增大的短周期元素,其中位于同一周期,基态原子的价电子排布式为。下列说法错误的是( )
A.该阴离子中铜元素的化合价为
B.元素电负性:
C.基态原子的第一电离能:
D.均位于元素周期表的区
二、非选择题
11.氮和氧是构建化合物的常见元素。
已知:
请回答:
(1)某化合物的晶胞如图,其化学式是 ,晶体类型是 。
(2)下列说法正确的是 。
A.电负性:B>N>O
B.离子半径:P3﹣<S2﹣<Cl﹣
C.第一电离能:Ge<Se<As
D.基态Cr的简化电子排布式:[Ar]3d4
(3)①H2N﹣NH2+H+→H2N﹣,其中﹣NH2的N原子杂化方式为 ;比较键角∠HNH:H2N﹣NH2中的﹣NH2 H2N﹣中的﹣(填“>”、“<”或“=”),请说明理由 。
②将HNO3与SO3按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是。比较氧化性强弱: HNO3(填“>”、“<”或“=”);写出A中阴离子的结构式 。
12.氧族元素及其化合物在生产、生活中发挥着重要的作用。回答如下问题:
(1)氧元素在元素周期表中的位置 。基态氧原子的价层电子轨道表示式为 ,电子占据最高能级的电子云轮廓图为 形。
(2)硫为 区元素,P、S、Cl的电负性由大到小的顺序为 。
(3)、、沸点由大到小的顺序为 。
(4)硫酸的结构式如图,比较酸性: (填“大于”“小于”或“等于”),并说明原因: 。
13.新型储氢合金的晶胞如图所示,该晶胞为立方体,晶胞棱长为a nm。
(1)基态Fe原子共有 种空间运动状态的电子;基态的价层电子排布式为 。
(2)下列说法正确的是____。
A.该晶胞与金刚石晶胞结构相似
B.铁原子之间最短距离为
C.该合金储氢过程是化学吸附
D.储氢后材料中存在离子键、共价键和分子间作用力
(3)该晶体化学式为 ;设阿伏加德罗常数的值为,则该晶胞密度为 。(只需列出计算的表达式)
(4)每个Fe周围与它最近且等距的Mg有 个。
14.、、、、是原子序数依次增大的五种短周期元素,其元素性质或原子结构如表。
元素 元素性质或原子结构
原子核外能级上的电子总数与能级上的电子总数相等,但第一电离能低于同周期相邻元素
在同周期元素中,原子半径最大
电离能()数据:;;;……
其价电子中,在不同形状的原子轨道中运动的电子数相等
只有一个不成对电子
(1)的元素符号为 、的基态原子价层电子轨道表示式为 。
(2)元素处于元素周期表中的 区(填“”或“”),其基态原子核外电子排布式为 。
(3)的元素符号为 ,元素的第一电离能 同周期相邻元素(填“高于”、“低于”或“等于”)。
(4)、和元素的电负性由大到小的顺序是 (填元素符号)。
(5)、的最高价氧化物的水化物酸性更强的是 (填化学式)。
(6)、和可以形成多种化合物,其中在室温下水溶液且的化合价为+1价的化合物是 (填化学式)。
答案解析部分
1.【答案】D
2.【答案】D
3.【答案】C
4.【答案】B
5.【答案】C
6.【答案】B
7.【答案】B
8.【答案】B
9.【答案】C
10.【答案】D
11.【答案】(1);分子晶体
(2)C
(3)sp3;<;-NH2中的N原子含有孤电子对,孤电子对对成键电子排斥力大,键角变小;>;
12.【答案】(1)第2(或二)周期ⅥA族;;哑铃或纺锤
(2)p;Cl>S>P
(3)
(4)大于;是推电子基团,烷基越长推电子效应越大,中羟基的极性越小,酸性越弱。
13.【答案】(1)15;
(2)B;C
(3)或;或
(4)8
14.【答案】(1)O;
(2)1s22s22p63s1;s
(3)Mg;高于
(4)Cl>Si>Na
(5)HClO4
(6)NaClO
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
2024年高考化学重点专题:物质结构与性质
一、选择题
1.下列表示不正确的是( )
A.中子数为10的氧原子:
B.SO2的价层电子对互斥(VSEPR)模型:
C.用电子式表示KCl的形成过程:
D.的名称:2﹣甲基4﹣乙基戊烷
2.磷酸聚合可以生成链状多磷酸和环状多磷酸,三分子磷酸聚合形成的链状三磷酸结构如图所示。下列说法正确的是( )
A.键能:
B.元素的电负性:
C.的空间构型:平面四边形
D.六元环状三磷酸的分子式:
3.镍酸镧电催化剂立方晶胞如图所示,晶胞参数为a,具有催化活性的是,图①和图②是晶胞的不同切面。下列说法错误的是( )
A.催化活性:①>②
B.镍酸镧晶体的化学式为
C.周围紧邻的O有4个
D.和的最短距离为
4.下列化学用语表述正确的是( )
A.的空间结构为V形
B.顺二溴乙烯结构式为
C.的电子式为
D.基态原子价电子排布式为
5.朱砂(硫化汞)在众多先秦考古遗址中均有发现,其立方晶系型晶胞如下图所示,晶胞参数为anm,A原子的分数坐标为,阿伏加德罗常数的值为,下列说法正确的是( )
A.S的配位数是6
B.晶胞中B原子分数坐标为
C.该晶体的密度是
D.相邻两个Hg的最短距离为
6.甲酸甲酯作为潜在的储氢材料受到关注,科学家发现使用配合物催化剂可以使甲酸甲酯温和释氢,其可能的反应过程如下图所示。下列说法错误的是( )
A.为极性分子,为非极性分子
B.每消耗生成
C.总反应为
D.反应涉及键断裂和键形成
7.烟气脱硫可有效减少引起的大气污染,同时还可得到有用产品。传统湿法脱硫多以碱性物质作吸收剂,新型脱硫方法选用离子液体(指在室温或接近室温时呈液态的盐类物质,由阴、阳离子组成)作吸收剂,通过物理和化学吸收实现脱硫。已知时,几种酸的电离常数:,;,;(乳酸)。研究发现:乳酸和乙醇胺()作用得到的离子液体——乙醇胺乳酸盐(),既可脱硫,也可吸收CO2。下列说法错误的是( )
A.液态时的导电性:乳酸
B.乳酸和乙醇胺中均含有键、键和氢键
C.是直线形非极性分子,是形极性分子
D.相同条件下,能吸收气体的体积:
8.科研人员利用高压气流将水微滴喷射到涂覆催化剂的石墨网上,研究常温制氨,其反应历程中微粒转化关系如图1,相对能量变化关系如图2,图中*表示催化剂表面吸附位。下列说法正确的是( )
A.过程中发生非极性键的断裂与形成
B.Ⅰ转化为和的过程中会生成
C.Ⅱ表示的微粒符号是
D.反应历程中放热最多的反应是
9.我国学者用氮气为氮源高效合成了活性氮物质,用于多种高附加值含氮化合物的合成。可与乙醇、有机卤代物等反应,其制备及转化为物质甲的过程如下:
下列说法错误的是( )
A.反应Ⅰ实现了氮的固定
B.的电子式为
C.反应Ⅱ中的溶剂可为水
D.物质甲中碳原子的杂化轨道类型有和
10.某含铜催化剂的阴离子的结构如图所示。是原子序数依次增大的短周期元素,其中位于同一周期,基态原子的价电子排布式为。下列说法错误的是( )
A.该阴离子中铜元素的化合价为
B.元素电负性:
C.基态原子的第一电离能:
D.均位于元素周期表的区
二、非选择题
11.氮和氧是构建化合物的常见元素。
已知:
请回答:
(1)某化合物的晶胞如图,其化学式是 ,晶体类型是 。
(2)下列说法正确的是 。
A.电负性:B>N>O
B.离子半径:P3﹣<S2﹣<Cl﹣
C.第一电离能:Ge<Se<As
D.基态Cr的简化电子排布式:[Ar]3d4
(3)①H2N﹣NH2+H+→H2N﹣,其中﹣NH2的N原子杂化方式为 ;比较键角∠HNH:H2N﹣NH2中的﹣NH2 H2N﹣中的﹣(填“>”、“<”或“=”),请说明理由 。
②将HNO3与SO3按物质的量之比1:2发生化合反应生成A,测得A由2种微粒构成,其中之一是。比较氧化性强弱: HNO3(填“>”、“<”或“=”);写出A中阴离子的结构式 。
12.氧族元素及其化合物在生产、生活中发挥着重要的作用。回答如下问题:
(1)氧元素在元素周期表中的位置 。基态氧原子的价层电子轨道表示式为 ,电子占据最高能级的电子云轮廓图为 形。
(2)硫为 区元素,P、S、Cl的电负性由大到小的顺序为 。
(3)、、沸点由大到小的顺序为 。
(4)硫酸的结构式如图,比较酸性: (填“大于”“小于”或“等于”),并说明原因: 。
13.新型储氢合金的晶胞如图所示,该晶胞为立方体,晶胞棱长为a nm。
(1)基态Fe原子共有 种空间运动状态的电子;基态的价层电子排布式为 。
(2)下列说法正确的是____。
A.该晶胞与金刚石晶胞结构相似
B.铁原子之间最短距离为
C.该合金储氢过程是化学吸附
D.储氢后材料中存在离子键、共价键和分子间作用力
(3)该晶体化学式为 ;设阿伏加德罗常数的值为,则该晶胞密度为 。(只需列出计算的表达式)
(4)每个Fe周围与它最近且等距的Mg有 个。
14.、、、、是原子序数依次增大的五种短周期元素,其元素性质或原子结构如表。
元素 元素性质或原子结构
原子核外能级上的电子总数与能级上的电子总数相等,但第一电离能低于同周期相邻元素
在同周期元素中,原子半径最大
电离能()数据:;;;……
其价电子中,在不同形状的原子轨道中运动的电子数相等
只有一个不成对电子
(1)的元素符号为 、的基态原子价层电子轨道表示式为 。
(2)元素处于元素周期表中的 区(填“”或“”),其基态原子核外电子排布式为 。
(3)的元素符号为 ,元素的第一电离能 同周期相邻元素(填“高于”、“低于”或“等于”)。
(4)、和元素的电负性由大到小的顺序是 (填元素符号)。
(5)、的最高价氧化物的水化物酸性更强的是 (填化学式)。
(6)、和可以形成多种化合物,其中在室温下水溶液且的化合价为+1价的化合物是 (填化学式)。
答案解析部分
1.【答案】D
2.【答案】D
3.【答案】C
4.【答案】B
5.【答案】C
6.【答案】B
7.【答案】B
8.【答案】B
9.【答案】C
10.【答案】D
11.【答案】(1);分子晶体
(2)C
(3)sp3;<;-NH2中的N原子含有孤电子对,孤电子对对成键电子排斥力大,键角变小;>;
12.【答案】(1)第2(或二)周期ⅥA族;;哑铃或纺锤
(2)p;Cl>S>P
(3)
(4)大于;是推电子基团,烷基越长推电子效应越大,中羟基的极性越小,酸性越弱。
13.【答案】(1)15;
(2)B;C
(3)或;或
(4)8
14.【答案】(1)O;
(2)1s22s22p63s1;s
(3)Mg;高于
(4)Cl>Si>Na
(5)HClO4
(6)NaClO
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
