5.1.3 硫酸根离子的检验 不同价态含硫物质的转化 课件 (共19张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 5.1.3 硫酸根离子的检验 不同价态含硫物质的转化 课件 (共19张PPT) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 12.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-05 23:10:02 | ||
图片预览





文档简介
(共19张PPT)
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第3 课时 硫酸根离子的检验和不同价态含硫物质的转化
【学习目标】
1.掌握硫酸根离子的检验方法,学会设计实验验证硫酸根离子;
2.了解硫元素之间的转化关系及其重要化合物的制备方法,掌握其主
要性质及其应用;
3.能利用氧化还原反应原理设计不同价态物质之间的相互转化。
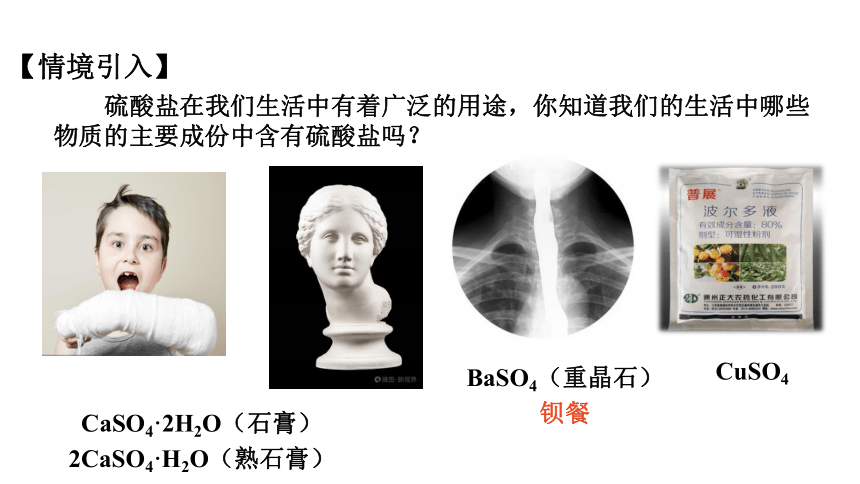
硫酸盐在我们生活中有着广泛的用途,你知道我们的生活中哪些物质的主要成份中含有硫酸盐吗?
【情境引入】
CaSO4·2H2O(石膏)
2CaSO4·H2O(熟石膏)
BaSO4(重晶石)
钡餐
CuSO4
KAl(SO4)2·12H2O(明矾)
净水剂
FeSO4·7H2O(绿矾)
补血剂
ZnSO4·7H2O(皓矾)
防腐剂、颜料
三、硫酸根离子的检验
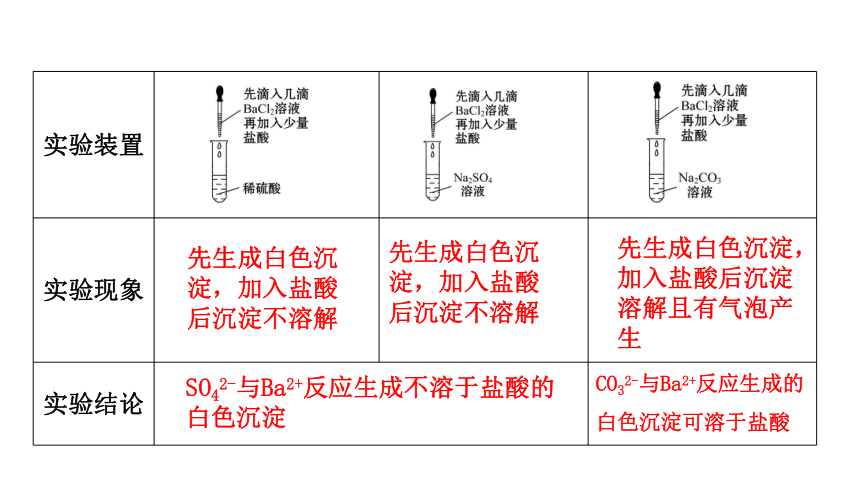
【实验5-4】在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。从这个实验中你能够得出什么结论?写出相关反应的离子方程式。
实验装置
实验现象
实验结论
先生成白色沉淀,加入盐酸后沉淀不溶解
先生成白色沉淀,加入盐酸后沉淀不溶解
先生成白色沉淀,加入盐酸后沉淀溶解且有气泡产生
SO42-与Ba2+反应生成不溶于盐酸的白色沉淀
CO32-与Ba2+反应生成的白色沉淀可溶于盐酸
1、SO42-离子的检验的试剂:
BaCl2溶液,稀盐酸
检验SO42-的正确操作规范描述:
取少量待测液于试管中,加入过量稀盐酸酸化,无明显现象,再加入氯化钡溶液,若有白色沉淀生成,则含有SO42-
先加稀盐酸的目的是:可排除Ag+、CO32-、SO32-离子的干扰
现在我们炒菜用的精盐又细又白,你知道精盐是由粗盐经过什么样的程序制得的吗?粗盐经溶解、过滤和蒸发后还含有硫酸盐及CaCl2、MgCl2等杂质。如何进行粗盐提纯吗?
粗盐
精盐
2、粗盐提纯
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
Na2CO3
NaOH
Mg2++2OH-===Mg(OH)2↓
(1) 如果按照下表所示顺序除去它们,应加入什么试剂?
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法
除去这些离子?
引入了Ba2+、CO32-、OH-
可以调整试剂的加入顺序
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑
哪些问题?
除杂试剂须过量,过量试剂须除去
SO42- +Ba2+===BaSO4↓
CO32- +Ca2+===CaCO3↓
①BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸
②NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸
③BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸
粗盐提纯的操作步骤:
①Na2CO3必须在BaCl2之后加入
②稀盐酸在过滤之后加入
自然界中的含硫物质在一定条件下能相互转化。
【思考】在实验室里,如何实现不同价态含硫物质的相互转化?
(1)下图是人们总结的不同价态硫元素的转化关系,尽可能多地列举每种价
态的硫元素所对应的物质,并根据硫元素化合价的变化,分析各种物质
在反应中表现的是氧化性还是还原性。
S
S
S
S
-2
0
+4
+6
H2S
Na2S
NaHS
FeS
CuS
S
SO2
H2SO3
Na2SO3
NaHSO3
CaSO3
HgS
SO3
H2SO4
Na2SO4
NaHSO4
CaSO4
BaSO4
强还原性
既有氧化性又有还原性
只有氧化性
(2)从上述转化关系中选择你感兴趣的一种获几种,设计实验实现其转化,
并填写下表。
已知:常用的氧化剂有浓硫酸、O2、 Cl2、KMnO4、FeCl3溶液、H2O2等,
还原剂有金属单质、H2、 H2S、 Na2S、Na2SO3等。
转化目标 转化前的含硫物质 选择试剂 预测转化后的含硫物质 实验现象
-2→0
H2S
Na2S
O2(不足)
H2O2
氯水
S
生成淡黄色固体
溶液黄绿色褪去,有淡黄色沉淀产生
0→-2
S
H2
H2S
产生臭鸡蛋气味气体
Na
Na2S
轻微的爆炸声
S
0→+4
O2
SO2
硫燃烧,发出淡蓝色火焰,产生有刺激气味的气体
+4→+6
+4→0
SO2
Na2SO3
氯水
酸性KMnO4溶液
H2SO4
Na2SO4
溶液黄绿色褪去
溶液紫色褪去
浓H2SO4
Cu
SO2
红色固体逐渐溶解,有刺激性气味的气体产生溶液紫色褪去
SO2
H2S
S
生成淡黄色固体
+6→+4
【思维建模】
不同价态含硫物质之间的转化,均属于氧化还原反应,需要选择合适的氧化剂或者还原剂。
①当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态(化合价只靠拢不交叉),即台阶式升降,可用下图表示:
硫单质及其化合物之间的转化规律
(1)邻位价态原则
②相邻价态的同种元素的微粒间不发生氧化还原反应,如S和H2S、S和
SO2、SO2和浓硫酸之间不发生氧化还原反应。
(2)归中规律:当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态。
如:2H2S+SO2===3S+2H2O,
2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O。
(4)含硫物质的连续氧化规律
(3)歧化反应:单质S和浓的强碱溶液共热,S单质既作氧化剂又作还原剂。
H2S
SO2
SO3
H2SO4
S
SO2
SO3
H2SO4
硫元素价类二维图
单质
氢化物
氧化物
含氧酸
物质的类别
-2
0
+4
+6
化合价
盐
SO2
SO3
H2S
S
H2SO3
H2SO4
SO32-
SO42-
Na2S
浓NaOH,△
Cl2、H2O2
Cu、C、HI、H2S
Cl2、H2O2、KMnO4、O2
O2、浓硫酸
H2S
H2
H2O
△
Cl2、O2、SO2、Fe3+、
O2
NaOH
稀硫酸
Na或浓NaOH,△
H2O
△
NaOH
稀硫酸
NaOH
THANKS
第五章 化工生产中的重要非金属元素
第一节 硫及其化合物
第3 课时 硫酸根离子的检验和不同价态含硫物质的转化
【学习目标】
1.掌握硫酸根离子的检验方法,学会设计实验验证硫酸根离子;
2.了解硫元素之间的转化关系及其重要化合物的制备方法,掌握其主
要性质及其应用;
3.能利用氧化还原反应原理设计不同价态物质之间的相互转化。
硫酸盐在我们生活中有着广泛的用途,你知道我们的生活中哪些物质的主要成份中含有硫酸盐吗?
【情境引入】
CaSO4·2H2O(石膏)
2CaSO4·H2O(熟石膏)
BaSO4(重晶石)
钡餐
CuSO4
KAl(SO4)2·12H2O(明矾)
净水剂
FeSO4·7H2O(绿矾)
补血剂
ZnSO4·7H2O(皓矾)
防腐剂、颜料
三、硫酸根离子的检验
【实验5-4】在三支试管中分别加入少量稀硫酸、Na2SO4溶液和Na2CO3溶液,然后各滴入几滴BaCl2溶液,观察现象。再分别加入少量稀盐酸,振荡,观察现象。从这个实验中你能够得出什么结论?写出相关反应的离子方程式。
实验装置
实验现象
实验结论
先生成白色沉淀,加入盐酸后沉淀不溶解
先生成白色沉淀,加入盐酸后沉淀不溶解
先生成白色沉淀,加入盐酸后沉淀溶解且有气泡产生
SO42-与Ba2+反应生成不溶于盐酸的白色沉淀
CO32-与Ba2+反应生成的白色沉淀可溶于盐酸
1、SO42-离子的检验的试剂:
BaCl2溶液,稀盐酸
检验SO42-的正确操作规范描述:
取少量待测液于试管中,加入过量稀盐酸酸化,无明显现象,再加入氯化钡溶液,若有白色沉淀生成,则含有SO42-
先加稀盐酸的目的是:可排除Ag+、CO32-、SO32-离子的干扰
现在我们炒菜用的精盐又细又白,你知道精盐是由粗盐经过什么样的程序制得的吗?粗盐经溶解、过滤和蒸发后还含有硫酸盐及CaCl2、MgCl2等杂质。如何进行粗盐提纯吗?
粗盐
精盐
2、粗盐提纯
杂质 加入的试剂 离子方程式
硫酸盐
CaCl2
MgCl2
BaCl2
Na2CO3
NaOH
Mg2++2OH-===Mg(OH)2↓
(1) 如果按照下表所示顺序除去它们,应加入什么试剂?
(2)加入你选择的试剂除去杂质后,有没有引入其他离子?用什么方法
除去这些离子?
引入了Ba2+、CO32-、OH-
可以调整试剂的加入顺序
(3)设计除去杂质的实验方案时,除了要考虑所加试剂的种类,还要考虑
哪些问题?
除杂试剂须过量,过量试剂须除去
SO42- +Ba2+===BaSO4↓
CO32- +Ca2+===CaCO3↓
①BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸
②NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸
③BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸
粗盐提纯的操作步骤:
①Na2CO3必须在BaCl2之后加入
②稀盐酸在过滤之后加入
自然界中的含硫物质在一定条件下能相互转化。
【思考】在实验室里,如何实现不同价态含硫物质的相互转化?
(1)下图是人们总结的不同价态硫元素的转化关系,尽可能多地列举每种价
态的硫元素所对应的物质,并根据硫元素化合价的变化,分析各种物质
在反应中表现的是氧化性还是还原性。
S
S
S
S
-2
0
+4
+6
H2S
Na2S
NaHS
FeS
CuS
S
SO2
H2SO3
Na2SO3
NaHSO3
CaSO3
HgS
SO3
H2SO4
Na2SO4
NaHSO4
CaSO4
BaSO4
强还原性
既有氧化性又有还原性
只有氧化性
(2)从上述转化关系中选择你感兴趣的一种获几种,设计实验实现其转化,
并填写下表。
已知:常用的氧化剂有浓硫酸、O2、 Cl2、KMnO4、FeCl3溶液、H2O2等,
还原剂有金属单质、H2、 H2S、 Na2S、Na2SO3等。
转化目标 转化前的含硫物质 选择试剂 预测转化后的含硫物质 实验现象
-2→0
H2S
Na2S
O2(不足)
H2O2
氯水
S
生成淡黄色固体
溶液黄绿色褪去,有淡黄色沉淀产生
0→-2
S
H2
H2S
产生臭鸡蛋气味气体
Na
Na2S
轻微的爆炸声
S
0→+4
O2
SO2
硫燃烧,发出淡蓝色火焰,产生有刺激气味的气体
+4→+6
+4→0
SO2
Na2SO3
氯水
酸性KMnO4溶液
H2SO4
Na2SO4
溶液黄绿色褪去
溶液紫色褪去
浓H2SO4
Cu
SO2
红色固体逐渐溶解,有刺激性气味的气体产生溶液紫色褪去
SO2
H2S
S
生成淡黄色固体
+6→+4
【思维建模】
不同价态含硫物质之间的转化,均属于氧化还原反应,需要选择合适的氧化剂或者还原剂。
①当硫元素的化合价升高或降低时,一般升高或降低到其相邻的价态(化合价只靠拢不交叉),即台阶式升降,可用下图表示:
硫单质及其化合物之间的转化规律
(1)邻位价态原则
②相邻价态的同种元素的微粒间不发生氧化还原反应,如S和H2S、S和
SO2、SO2和浓硫酸之间不发生氧化还原反应。
(2)归中规律:当硫元素的高价态粒子与低价态粒子反应时,一般生成中间价态。
如:2H2S+SO2===3S+2H2O,
2Na2S+Na2SO3+3H2SO4===3Na2SO4+3S↓+3H2O。
(4)含硫物质的连续氧化规律
(3)歧化反应:单质S和浓的强碱溶液共热,S单质既作氧化剂又作还原剂。
H2S
SO2
SO3
H2SO4
S
SO2
SO3
H2SO4
硫元素价类二维图
单质
氢化物
氧化物
含氧酸
物质的类别
-2
0
+4
+6
化合价
盐
SO2
SO3
H2S
S
H2SO3
H2SO4
SO32-
SO42-
Na2S
浓NaOH,△
Cl2、H2O2
Cu、C、HI、H2S
Cl2、H2O2、KMnO4、O2
O2、浓硫酸
H2S
H2
H2O
△
Cl2、O2、SO2、Fe3+、
O2
NaOH
稀硫酸
Na或浓NaOH,△
H2O
△
NaOH
稀硫酸
NaOH
THANKS
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
