3.1专项溶液PH的计算课件(共17张PPT)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 3.1专项溶液PH的计算课件(共17张PPT)2023-2024学年高二上学期化学鲁科版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 51.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-06 08:16:57 | ||
图片预览






文档简介
(共17张PPT)
3.1专项 溶液pH的计算
一、单一溶液pH的计算
(1)强酸溶液
对于强酸HnA,设浓度为c mol·L-1,则c(H+)=nc mol·L-1,pH=-lgc(H+)=-lg(nc)
(2)强碱溶液
一、单一溶液pH的计算
【学以致用】
2.某温度下,纯水中c(H+)=1.0 ×10-6 mol·L-1。该温度时,0.01mol·L-1的HCl溶液中,pH=_____;0.01mol·L-1的NaOH溶液中,pH=____。
【温馨提示】计算溶液的pH时,一定要注意溶液的温度是否是常温。若不是,应先计算该温度下的水的离子积。
2
10
二、酸/碱的稀释
(1)强酸的稀释
取1 mL pH=3的硫酸溶液加水稀释到100 mL,溶液的pH是_____。
解析:
c(H+)=
pH = -lgc(H+) = -lg10-5 = 5
10-3 mol·L-1×10-3 L
=10-5 mol·L-1
10-1 L
=
n(H+)
V[H2SO4(aq)]
5
二、酸/碱的稀释
(1)强酸的稀释
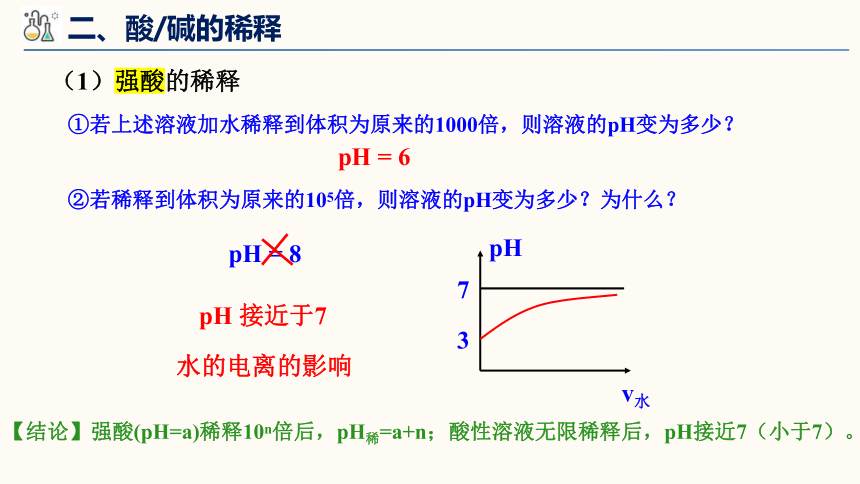
①若上述溶液加水稀释到体积为原来的1000倍,则溶液的pH变为多少?
②若稀释到体积为原来的105倍,则溶液的pH变为多少?为什么?
pH = 6
pH = 8
pH 接近于7
7
3
pH
v水
水的电离的影响
【结论】强酸(pH=a)稀释10n倍后,pH稀=a+n;酸性溶液无限稀释后,pH接近7(小于7)。
二、酸/碱的稀释
(2)强碱的稀释
c(H+)= = 1×10-9 mol·L-1
Kw
c(OH-)
常温下,取pH=11的NaOH溶液与水按1:99的体积比混合后,溶液的pH=____。
解析:
稀释前c(OH-) = 10-3 mol·L-1
稀释后c(OH-) =
pH = - lgc(H+) = - lg10-9 = 9
9
【结论】强碱(pH=a)稀释10n倍后,pH稀=a-n;碱性溶液无限稀释后,pH接近7(大于7)。
10-3 mol·L-1
=10-5 mol·L-1
1+99
二、酸/碱的稀释
(3)弱酸的稀释
(4)弱碱的稀释
例:pH=2的盐酸稀释10倍后pH?
pH=2的醋酸稀释10倍后pH?
pH<3
pH = 3
【结论】弱酸(pH=a)稀释10n倍后,pH稀 < a+n。
盐酸
醋酸
V水
3
2
pH
10倍
例:pH=12的NaOH溶液稀释10倍后pH?
pH=12的氨水稀释10倍后pH?
pH>11
pH=11
【结论】弱碱(pH=a)稀释10n倍后,pH稀 > a-n。
NaOH
氨水
V水
12
11
pH
10倍
盐酸
醋酸
V水
3
2
pH
10倍
稀释相同倍数时
pH:盐酸>醋酸
稀释到相同pH时
稀释的倍数:醋酸>盐酸
NaOH
氨水
V水
12
11
pH
10倍
稀释相同倍数时
pH:氨水>NaOH
稀释到相同pH时
稀释的倍数:氨水>NaOH
强酸、弱酸稀释对比
强碱、弱碱稀释对比
图象分析
酸、碱稀释后溶液的pH
【微点拨】对于酸溶液或碱溶液进行稀释,当酸/碱的浓度接近水电离的氢离子浓度时,水的电离不能忽略,即pH只能无限接近于7。
三、酸/碱的混合
(1)强酸与强酸的混合
在25℃时,1 L pH=1的盐酸溶液与1000LpH=4的盐酸溶液混合,混合后溶液的pH=______。
解:pH= - lgc(H+)
≈ - lg(2×10-4 )
= 4 - lg2
3.7
【提醒】当相加、减的两个量相差100倍以上时,小的量可忽略。
酸酸混合,先计算混合后的c(H+)。
lg2 ≈ 0.3
三、酸/碱的混合
(2)强碱与强碱的混合
=-lg(2×10-10 )
=10-lg2
≈ 9.7
pH=-lgKW/c(OH-)
[方法一]
pH=14-pOH
= 9.7
≈4.3
pOH=-lgc(OH-)
=-lg(5×10-5)=5-lg5
[方法二]
【关键】抓住OH-进行计算!再转化为H+。
25℃时,将pH=8的氢氧化钠溶液与pH=10的氢氧化钠溶液等体积混合,混合后溶液的pH=______。
9.7
【提示】c(OH-)= = 5×10-5 mol·L-1
碱碱混合,先计算混合后的c(OH-),再根据离子积计算c(H+)。
三、酸/碱的混合
(3)强酸与强碱的混合
在25℃时,100 mL 0.6 mol/L的盐酸与等体积0.4 mol/L的NaOH溶液混合后,溶液的pH等于_____。
【关键】酸过量,先计算反应后氢离子的浓度,再计算pH。
解析:NaOH + HCl = NaCl + H2O
0.06 mol
0.04 mol
pH=-lgc(H+)
=-lg10-1
= 1
1
三、酸/碱的混合
(3)强酸与强碱的混合
在25℃时,100 mL 0.4 mol·L-1的盐酸与等体积0.6 mol·L-1的NaOH溶液混合后,溶液的pH=_____。
【解题关键】碱过量,先计算反应后氢氧根离子的浓度,再根据离子积计算氢离子的浓度,后计算pH。
解析: NaOH + HCl = NaCl+H2O
0.06 mol
0.04 mol
pH =-lgc(H+)= 13
13
= 0.1 mol·L-1
c (OH-)=
c(H+) = KW/0.1=10-13 mol·L-1
(1)等体积强酸(pH1)和强碱(pH2)混合
补充
(2)强酸(pH1)与强碱(pH2)混合呈中性时,二者的体积关系规律
三、酸/碱的混合
【学以致用】
常温下,将pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是( )
A.11∶1 B.9∶1
C.1∶11 D.1∶9
D
常温时,溶液中由水电离的[H+]=10-9 mol/L,该溶液的PH?
由水电离的[H+]=10-9 mol/L,可知由水电离的[OH-]=10-9 mol/L,水的电离被抑制,溶液可能是酸性或者碱性。
思考题
(1)碱性:[OH-]= Kw / [H+] = 1×10-6 mol/L;PH=9
(2) 酸性:[H+]= Kw / [OH-] = 1×10-6 mol/L;PH=6
3.1专项 溶液pH的计算
一、单一溶液pH的计算
(1)强酸溶液
对于强酸HnA,设浓度为c mol·L-1,则c(H+)=nc mol·L-1,pH=-lgc(H+)=-lg(nc)
(2)强碱溶液
一、单一溶液pH的计算
【学以致用】
2.某温度下,纯水中c(H+)=1.0 ×10-6 mol·L-1。该温度时,0.01mol·L-1的HCl溶液中,pH=_____;0.01mol·L-1的NaOH溶液中,pH=____。
【温馨提示】计算溶液的pH时,一定要注意溶液的温度是否是常温。若不是,应先计算该温度下的水的离子积。
2
10
二、酸/碱的稀释
(1)强酸的稀释
取1 mL pH=3的硫酸溶液加水稀释到100 mL,溶液的pH是_____。
解析:
c(H+)=
pH = -lgc(H+) = -lg10-5 = 5
10-3 mol·L-1×10-3 L
=10-5 mol·L-1
10-1 L
=
n(H+)
V[H2SO4(aq)]
5
二、酸/碱的稀释
(1)强酸的稀释
①若上述溶液加水稀释到体积为原来的1000倍,则溶液的pH变为多少?
②若稀释到体积为原来的105倍,则溶液的pH变为多少?为什么?
pH = 6
pH = 8
pH 接近于7
7
3
pH
v水
水的电离的影响
【结论】强酸(pH=a)稀释10n倍后,pH稀=a+n;酸性溶液无限稀释后,pH接近7(小于7)。
二、酸/碱的稀释
(2)强碱的稀释
c(H+)= = 1×10-9 mol·L-1
Kw
c(OH-)
常温下,取pH=11的NaOH溶液与水按1:99的体积比混合后,溶液的pH=____。
解析:
稀释前c(OH-) = 10-3 mol·L-1
稀释后c(OH-) =
pH = - lgc(H+) = - lg10-9 = 9
9
【结论】强碱(pH=a)稀释10n倍后,pH稀=a-n;碱性溶液无限稀释后,pH接近7(大于7)。
10-3 mol·L-1
=10-5 mol·L-1
1+99
二、酸/碱的稀释
(3)弱酸的稀释
(4)弱碱的稀释
例:pH=2的盐酸稀释10倍后pH?
pH=2的醋酸稀释10倍后pH?
pH<3
pH = 3
【结论】弱酸(pH=a)稀释10n倍后,pH稀 < a+n。
盐酸
醋酸
V水
3
2
pH
10倍
例:pH=12的NaOH溶液稀释10倍后pH?
pH=12的氨水稀释10倍后pH?
pH>11
pH=11
【结论】弱碱(pH=a)稀释10n倍后,pH稀 > a-n。
NaOH
氨水
V水
12
11
pH
10倍
盐酸
醋酸
V水
3
2
pH
10倍
稀释相同倍数时
pH:盐酸>醋酸
稀释到相同pH时
稀释的倍数:醋酸>盐酸
NaOH
氨水
V水
12
11
pH
10倍
稀释相同倍数时
pH:氨水>NaOH
稀释到相同pH时
稀释的倍数:氨水>NaOH
强酸、弱酸稀释对比
强碱、弱碱稀释对比
图象分析
酸、碱稀释后溶液的pH
【微点拨】对于酸溶液或碱溶液进行稀释,当酸/碱的浓度接近水电离的氢离子浓度时,水的电离不能忽略,即pH只能无限接近于7。
三、酸/碱的混合
(1)强酸与强酸的混合
在25℃时,1 L pH=1的盐酸溶液与1000LpH=4的盐酸溶液混合,混合后溶液的pH=______。
解:pH= - lgc(H+)
≈ - lg(2×10-4 )
= 4 - lg2
3.7
【提醒】当相加、减的两个量相差100倍以上时,小的量可忽略。
酸酸混合,先计算混合后的c(H+)。
lg2 ≈ 0.3
三、酸/碱的混合
(2)强碱与强碱的混合
=-lg(2×10-10 )
=10-lg2
≈ 9.7
pH=-lgKW/c(OH-)
[方法一]
pH=14-pOH
= 9.7
≈4.3
pOH=-lgc(OH-)
=-lg(5×10-5)=5-lg5
[方法二]
【关键】抓住OH-进行计算!再转化为H+。
25℃时,将pH=8的氢氧化钠溶液与pH=10的氢氧化钠溶液等体积混合,混合后溶液的pH=______。
9.7
【提示】c(OH-)= = 5×10-5 mol·L-1
碱碱混合,先计算混合后的c(OH-),再根据离子积计算c(H+)。
三、酸/碱的混合
(3)强酸与强碱的混合
在25℃时,100 mL 0.6 mol/L的盐酸与等体积0.4 mol/L的NaOH溶液混合后,溶液的pH等于_____。
【关键】酸过量,先计算反应后氢离子的浓度,再计算pH。
解析:NaOH + HCl = NaCl + H2O
0.06 mol
0.04 mol
pH=-lgc(H+)
=-lg10-1
= 1
1
三、酸/碱的混合
(3)强酸与强碱的混合
在25℃时,100 mL 0.4 mol·L-1的盐酸与等体积0.6 mol·L-1的NaOH溶液混合后,溶液的pH=_____。
【解题关键】碱过量,先计算反应后氢氧根离子的浓度,再根据离子积计算氢离子的浓度,后计算pH。
解析: NaOH + HCl = NaCl+H2O
0.06 mol
0.04 mol
pH =-lgc(H+)= 13
13
= 0.1 mol·L-1
c (OH-)=
c(H+) = KW/0.1=10-13 mol·L-1
(1)等体积强酸(pH1)和强碱(pH2)混合
补充
(2)强酸(pH1)与强碱(pH2)混合呈中性时,二者的体积关系规律
三、酸/碱的混合
【学以致用】
常温下,将pH=13的强碱溶液与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比是( )
A.11∶1 B.9∶1
C.1∶11 D.1∶9
D
常温时,溶液中由水电离的[H+]=10-9 mol/L,该溶液的PH?
由水电离的[H+]=10-9 mol/L,可知由水电离的[OH-]=10-9 mol/L,水的电离被抑制,溶液可能是酸性或者碱性。
思考题
(1)碱性:[OH-]= Kw / [H+] = 1×10-6 mol/L;PH=9
(2) 酸性:[H+]= Kw / [OH-] = 1×10-6 mol/L;PH=6
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
