辽宁省沈阳市南昌初级中学2023-2024学年九年级下学期开学考试化学试卷(图片版 无答案)
文档属性
| 名称 | 辽宁省沈阳市南昌初级中学2023-2024学年九年级下学期开学考试化学试卷(图片版 无答案) |  | |
| 格式 | |||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-06 11:10:45 | ||
图片预览



文档简介
2023-2024 学年下学期九年级开学限时性作业
化学试卷
可能用到的相对原子质量:H-1 O-16 Fe-56
第一部分 选择题(共 10 分)
(本部分共包括 10 道小题,每小题 1 分。下列每小题只有一个最符合题目要求的选项)
1.益生菌能够维持皮肤上菌群平衡,它在酸性较弱的环境中利于生长。因此皮肤的酸碱度宜保
持在 ( )
A. < 0 B. 4.5 < < 6.5 C. 8 < < 10 D. > 10
2.将变瘪的乒乓球放在热水中能恢复原状,用分子的观点解释合理的是( )
A.分子质量增大 B.分子个数增多 C.分子间间隔变大 D.分子体积变大
3.下列固体物质加入适量水中,溶液的温度明显降低的是( )
A. 4 3 B. C. D.
4.南京理工大学胡丙成团队用新方法制得了 5·3 2 ,该化合物中含有 5等微粒,下列有
关说法正确的是 ( )
A. 5是一种单质 B.一个 5 带一个单位的正电荷
C.一个 5中共有 36 个质子 D.一个 5中共有 36 个电子
5.化学是一门以实验为基础的科学。下列有关实验现象的描述正确的是 ( )
A.铁丝在空气中剧烈燃烧,火星四射,放出大量热,生成黑色固体
B.在空气中加热铜丝,可以观察到其表面变黑
C.将镁条放入稀盐酸中,观察到固体逐渐溶解,产生大量氢气
D.将铁钉放入硫酸铜溶液中,观察到铁钉表面析出红色物质,得到黄色溶液
6.为制作叶脉书签,某同学在实验室配制 10%的 溶液,部分操作如下,其中正确的是 ( )
A. 取用 B. 称量
C. 量取所需的水 D. 读取水的体积
第 1页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
7.“中东有石油,中国有稀土”。某种稀土元素在元素周期表中的相关信息如图所示,下列说法
错误的是 ( )
A.铒属于金属元素 B.铒的元素符号是
C.铒的原子序数为 68 D.铒原子的质量为 167.3
8.从如图某化学反应的微观示意图中,获得的信息错误的是( )
A.参加反应的一种物质的化学式为 2 4
B.该反应的生成物为混合物
C.参加反应的两种物质的分子个数比为 1︰1
D. 中碳、氢、氧原子个数比为 2︰6︰1
9.用“ ”形管进行微型实验,如图所示,下列说法错误的是 ( )
A. 处实验结束时先停止通入 ,后停止加热
B. 处发生的反应不是置换反应
C. 处澄清石灰水变浑浊证明有二氧化碳生成
D.可利用点燃的方法进行尾气处理
10.甲、乙两种物质的溶解度曲线如图所示,下列有关说法错误的是( )
A.两种物质的溶解度都随温度升高而增大
B. 1℃时,甲、乙两物质的溶液中溶质质量分数一定相等
C.通常采用蒸发结晶的方法从乙的溶液中获得晶体
D. 2℃时,在 100 水中加入 25 甲,可形成甲的不饱和溶液
第 2页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
第二部分 非选择题(共 40 分)
(本部分共包括 4 道小题)
11、(9分)地球上的金属资源广泛存在于地壳和海洋中,除少数很不活泼的金属如金、银等
有单质形式存在外,其余都以化合物的形式存在。陆地上存在各种各样的金属矿藏。
矿石名称 赤铁矿 孔雀石 辉铜矿 铝土矿 白钨矿
图样
主要成分 Fe2O3 Cu2( )2CO3 Cu2S Al2 3 4
从矿石中制取金属单质的过程叫冶金,金属作为金属材料,其价值不仅取决于它在地壳中
的含量和独特的性能,在很大程度上还取决于其冶炼的难易程度。例如铝是人们熟悉的金属,
其蕴藏量居金属之首,应用广泛,但在 1886年以前,它的价格比黄金还高,其原因是冶炼成
本太高。 合金材料应用广泛。形状记忆合金是具有形状记忆效应的合金,人造卫星和宇宙飞
船上的天线是由钛镍形状记忆合金制造的,它具有形状记忆功能,可揉成一团放入卫星或宇宙
飞船舱内,需要时可在一定条件下恢复原来的抛物面形状。钛合金与人体具有很好的“相容性”,
因此可以用来制造人造骨等。
回答下列问题:
(1)根据材料可知,工业上可以用________(填矿石名称)来冶炼金属钨。
(2)孔雀石属于 _________ (填“纯净物”或“混合物”),它的主要成分中含有_______种元素。
(3)早在春秋战国时期,我国就开始生产和使用铁器。工业上可利用一氧化碳还原赤铁矿制得
金属铁,写出这个反应的化学方程式______________________________________________。
其中氧化铁中铁元素的化合价为 _________,铁和氧元素的质量比为___________;
(4)根据材料可知,______________________合金可用来制造卫星或宇宙飞船的天线。
(5)下列关于叙述正确的是________(填序号)。
A.工业上利用一氧化碳还原赤铁矿制得金属铁属于化合反应
B.钛合金与人体具有很好的“相容性”
C.合金的硬度比组成它的各种纯金属硬度大。
(6)目前工业冶炼铝的原理是:将铝土矿提纯后,在熔融状态下电解,生成铝和氧气。我们
还可以使用由废旧铝等含铝的废料重新熔化提炼的再生铝合金,这样做的意义在于 _________
________________。
第 3页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
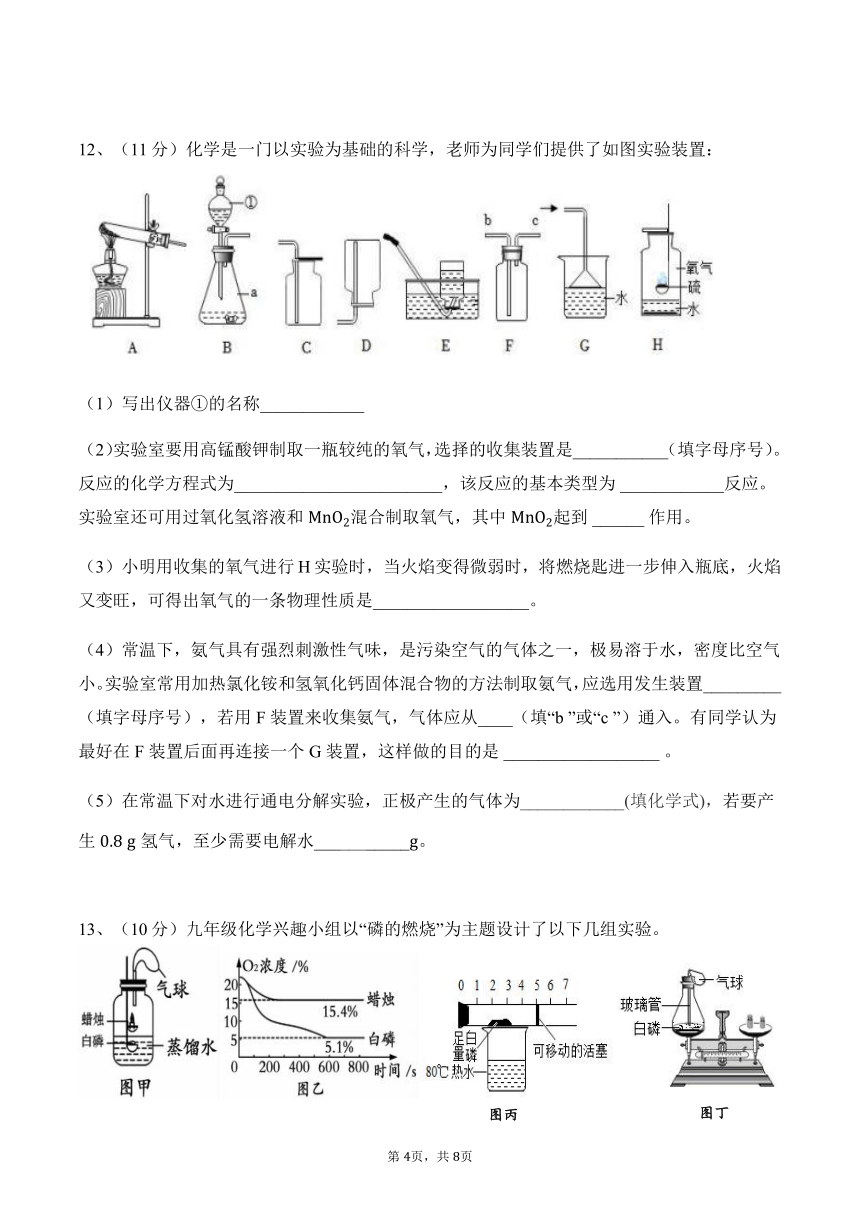
12、(11分)化学是一门以实验为基础的科学,老师为同学们提供了如图实验装置:
(1)写出仪器①的名称____________
(2)实验室要用高锰酸钾制取一瓶较纯的氧气,选择的收集装置是___________(填字母序号)。
反应的化学方程式为________________________,该反应的基本类型为 ____________反应。
实验室还可用过氧化氢溶液和 MnO2混合制取氧气,其中 MnO2起到 ______作用。
(3)小明用收集的氧气进行H实验时,当火焰变得微弱时,将燃烧匙进一步伸入瓶底,火焰
又变旺,可得出氧气的一条物理性质是__________________。
(4)常温下,氨气具有强烈刺激性气味,是污染空气的气体之一,极易溶于水,密度比空气
小。实验室常用加热氯化铵和氢氧化钙固体混合物的方法制取氨气,应选用发生装置_________
(填字母序号),若用 F装置来收集氨气,气体应从____(填“b ”或“c ”)通入。有同学认为
最好在 F装置后面再连接一个 G装置,这样做的目的是 __________________。
(5)在常温下对水进行通电分解实验,正极产生的气体为____________(填化学式),若要产
生 0.8 g 氢气,至少需要电解水___________g。
13、(10分)九年级化学兴趣小组以“磷的燃烧”为主题设计了以下几组实验。
图丙 图丁
第 4页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
【实验一】可燃物燃烧的条件
任务一、定性探究
步骤Ⅰ:组装仪器,____________,装入药品。
步骤Ⅱ:用高能激光笔对准燃烧匙中蜡烛的烛芯照射一段时间后,观察到蜡烛被点燃,之后过
一会儿熄灭。而这一过程中白磷始终不燃烧。
步骤Ⅲ:冷却至室温后,将装有白磷的燃烧匙提出水面,用高能激光笔照射一段时间后,观察
到白磷____________。
实验结论:蜡烛熄灭后,瓶内氧气仍有剩余。
实验反思:①步骤Ⅱ中白磷始终不燃烧的原因是 __________________。
②实验中图甲气球的作用是 __________________。
任务二、定量探究
小华对蜡烛熄灭后白磷还能继续燃烧的现象产生好奇,利用数字传感器分别测定了蜡烛、白磷
在密闭容器中燃烧时氧气浓度的变化,结果如图乙所示。
③根据图乙中数据分析可知白磷能够燃烧而蜡烛不燃烧的氧气浓度范围是 ____________。
④通过分析图乙中数据,写出你对可燃物燃烧需要氧气的新认识 ________________________。
【实验二】测定空气中氧气含量
(1)如图丙,实验开始前活塞停在刻度 5 处,白磷燃烧时,活塞会先向右移动,再向左移动,
原因是 ____________________________________________(2分);
(2)待燃烧结束,装置冷却至室温后,活塞最终停留在刻度 4 处,由此可得出氧气约占空气
总体积的 __________。
【实验三】验证质量守恒定律
如图丁,检查装置气密性良好后,将装有白磷的装置放在托盘天平上称量的质量为 1 ,取下
装置,点燃白磷,若燃烧结束后,未待装置冷却就直接称量的质量为 2 ,则 1______ 2(填
“>”或“<”或“=”)。
14、(10分)阅读下面科普短文,回答问题。
深受人们喜爱的早餐食品燕麦中常添加颗粒极小的铁粉,它既可以作为双吸剂(起到干燥
和减缓食品变质的作用),还可以作为补铁剂。要把铁粉变为人体需要的、能吸收的营养元素,
就离不开胃酸的帮助。我们的胃液呈酸性,是因为胃腺壁细胞能分泌出盐酸。胃酸在人体的消
化吸收中发挥着重要作用,比如为胃蛋白酶提供适宜的酸性环境,分解食物中的结缔组织和肌
第 5页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
纤维。使其易于被消化吸收。健康人胃液的 在 0.9~1.5,胃液的 不仅影响人的消化吸收
功能,还对伴随食物进入人胃内的各类病菌的繁殖有影响。
某医院对 99 位胃溃疡等患者胃液的 及胃液中病菌进行了检测,结果如下表所示。
表 1——人体胃液 pH 情况分析
分组胃液的 受检患者人数 胃液中检出病菌的人数及比例
≤ 2.0 7 0(0.0%)
2.0 4.0 13 3(23.1%)
4.0 6.0 26 17(65.4%)
> 6.0 53 45(84.9%)
胃酸过多会对胃黏膜产生侵蚀作用,并使人感觉反酸或胃灼热。治疗胃酸过多的药主要有
两大类:一是抑酸药,能抑制胃酸分泌,但本身不能和胃酸反应;二是抗酸药,能直接与胃酸
反应。常服用的抗酸药的药物有碳酸氢钠、氢氧化铝、氧化镁、氢氧化镁和碳酸钙等。
胃溃疡患者若服用不合适的抗酸药,会因胃内气体压力增大而引起胃穿孔。患者如长期
使用抗酸药,很可能刺激胃酸分泌过多。因此,应遵医嘱合理使用抗酸类和抑酸类药物。
(一)依据文章内容回答下列问题。
(1)碳酸氢钠、氢氧化铝、氧化镁、氢氯化镁和碳酸钙,属于氧化物的是 ______ (填化学式)。
(2)铁粉可以作为双吸剂,能起到干燥和减缓食品变质的作用,这是由于铁可以和空气中的
________________反应。
(3)燕麦中的铁粉遇到胃酸发生的化学反应,化学方程式是 __________________。
(4)分析表格数据,可以得出胃液 越 ______ (填“大”或“小”)越有利于病菌生存。
(5)下列说法正确的是 ____________ (填字母序号)。
A.治疗胃酸过多的药物都能与盐酸反应
B.部分燕麦片中含有极少量的铁单质
C.氢氧化铝、氢氧化镁可以治疗各种胃酸过多
D.选用碳酸钙治疗胃酸过多,同时还可以补钙
(二)胃酸过多会引起不适,不同病症需要服用不同的抗酸药。实验小组同学对抗酸药选择进行
探究。
【查阅资料】
第 6页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
1.抗酸药主要利用有效成分与胃液中的过量盐酸反应,药品用量一般为 1~2 片(约
= 0.5 ~1 )。
2.氧化镁和氧化铁均属于金属氧化物,与盐酸反应的原理相似。
3.胃蛋白酶是胃中唯一的消化性蛋白酶,当 为 3~5 时活性较好,当 超过 6 时,因变性
而失去活性。
4.理想抗酸药应具备起效快速,避免产生气体刺激溃疡面等特点。
【进行实验】
Ⅰ.是否引起胃内压强的变化
锥形瓶中模拟胃酸过多的环境。将气球中的抗酸药加入锥形瓶中。
1 1 氢氧化铝片 气球无明显变化
1 2 碳酸氢钠片 气球明显膨胀
1 3 铝碳酸镁咀嚼片 气球无明显变化
1 4 氧化镁粉末 气球无明显变化
Ⅱ.是否引起胃内温度和 的变化
利用图 1 进行实验。向 4 个烧瓶中分别加入抗酸药,打开恒压滴液漏斗,滴加 0.37%的足量
稀盐酸。传感器测得的相关结果见图 2、3、4。
第 7页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
【解释与结论】
(6)药品用量在 1~2 片内,针对“严重胃溃疡患者”不建议选用的抗酸药及理由是(写出一例即
可) ________________________________________________。(2 分)
(7)下列关于氧化镁粉末、氢氧化铝片分别与盐酸反应的叙述正确的是 ____________ (填序号)。
A.氧化镁粉末的反应会引起温度上升
B.反应后溶液均显碱性
C.氢氧化铝片的反应更快
D.均有水生成
(8)由上述实验可知,铝碳酸镁咀嚼片作为理想抗酸药的优势有 ________________________。
【反思与评价】
(9)通过查阅资料,发现Ⅰ中实验 1 3无明显现象是与铝碳酸镁咀嚼片的用量过少有关。为了
观察到明显的实验现象,小明同学增加了铝碳酸镁咀嚼片的用量与原实验进行对比:取 6片铝
碳酸镁咀嚼片于试管中,加入等体积的__________________,观察是否产生气泡。
第 8页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
化学试卷
可能用到的相对原子质量:H-1 O-16 Fe-56
第一部分 选择题(共 10 分)
(本部分共包括 10 道小题,每小题 1 分。下列每小题只有一个最符合题目要求的选项)
1.益生菌能够维持皮肤上菌群平衡,它在酸性较弱的环境中利于生长。因此皮肤的酸碱度宜保
持在 ( )
A. < 0 B. 4.5 < < 6.5 C. 8 < < 10 D. > 10
2.将变瘪的乒乓球放在热水中能恢复原状,用分子的观点解释合理的是( )
A.分子质量增大 B.分子个数增多 C.分子间间隔变大 D.分子体积变大
3.下列固体物质加入适量水中,溶液的温度明显降低的是( )
A. 4 3 B. C. D.
4.南京理工大学胡丙成团队用新方法制得了 5·3 2 ,该化合物中含有 5等微粒,下列有
关说法正确的是 ( )
A. 5是一种单质 B.一个 5 带一个单位的正电荷
C.一个 5中共有 36 个质子 D.一个 5中共有 36 个电子
5.化学是一门以实验为基础的科学。下列有关实验现象的描述正确的是 ( )
A.铁丝在空气中剧烈燃烧,火星四射,放出大量热,生成黑色固体
B.在空气中加热铜丝,可以观察到其表面变黑
C.将镁条放入稀盐酸中,观察到固体逐渐溶解,产生大量氢气
D.将铁钉放入硫酸铜溶液中,观察到铁钉表面析出红色物质,得到黄色溶液
6.为制作叶脉书签,某同学在实验室配制 10%的 溶液,部分操作如下,其中正确的是 ( )
A. 取用 B. 称量
C. 量取所需的水 D. 读取水的体积
第 1页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
7.“中东有石油,中国有稀土”。某种稀土元素在元素周期表中的相关信息如图所示,下列说法
错误的是 ( )
A.铒属于金属元素 B.铒的元素符号是
C.铒的原子序数为 68 D.铒原子的质量为 167.3
8.从如图某化学反应的微观示意图中,获得的信息错误的是( )
A.参加反应的一种物质的化学式为 2 4
B.该反应的生成物为混合物
C.参加反应的两种物质的分子个数比为 1︰1
D. 中碳、氢、氧原子个数比为 2︰6︰1
9.用“ ”形管进行微型实验,如图所示,下列说法错误的是 ( )
A. 处实验结束时先停止通入 ,后停止加热
B. 处发生的反应不是置换反应
C. 处澄清石灰水变浑浊证明有二氧化碳生成
D.可利用点燃的方法进行尾气处理
10.甲、乙两种物质的溶解度曲线如图所示,下列有关说法错误的是( )
A.两种物质的溶解度都随温度升高而增大
B. 1℃时,甲、乙两物质的溶液中溶质质量分数一定相等
C.通常采用蒸发结晶的方法从乙的溶液中获得晶体
D. 2℃时,在 100 水中加入 25 甲,可形成甲的不饱和溶液
第 2页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
第二部分 非选择题(共 40 分)
(本部分共包括 4 道小题)
11、(9分)地球上的金属资源广泛存在于地壳和海洋中,除少数很不活泼的金属如金、银等
有单质形式存在外,其余都以化合物的形式存在。陆地上存在各种各样的金属矿藏。
矿石名称 赤铁矿 孔雀石 辉铜矿 铝土矿 白钨矿
图样
主要成分 Fe2O3 Cu2( )2CO3 Cu2S Al2 3 4
从矿石中制取金属单质的过程叫冶金,金属作为金属材料,其价值不仅取决于它在地壳中
的含量和独特的性能,在很大程度上还取决于其冶炼的难易程度。例如铝是人们熟悉的金属,
其蕴藏量居金属之首,应用广泛,但在 1886年以前,它的价格比黄金还高,其原因是冶炼成
本太高。 合金材料应用广泛。形状记忆合金是具有形状记忆效应的合金,人造卫星和宇宙飞
船上的天线是由钛镍形状记忆合金制造的,它具有形状记忆功能,可揉成一团放入卫星或宇宙
飞船舱内,需要时可在一定条件下恢复原来的抛物面形状。钛合金与人体具有很好的“相容性”,
因此可以用来制造人造骨等。
回答下列问题:
(1)根据材料可知,工业上可以用________(填矿石名称)来冶炼金属钨。
(2)孔雀石属于 _________ (填“纯净物”或“混合物”),它的主要成分中含有_______种元素。
(3)早在春秋战国时期,我国就开始生产和使用铁器。工业上可利用一氧化碳还原赤铁矿制得
金属铁,写出这个反应的化学方程式______________________________________________。
其中氧化铁中铁元素的化合价为 _________,铁和氧元素的质量比为___________;
(4)根据材料可知,______________________合金可用来制造卫星或宇宙飞船的天线。
(5)下列关于叙述正确的是________(填序号)。
A.工业上利用一氧化碳还原赤铁矿制得金属铁属于化合反应
B.钛合金与人体具有很好的“相容性”
C.合金的硬度比组成它的各种纯金属硬度大。
(6)目前工业冶炼铝的原理是:将铝土矿提纯后,在熔融状态下电解,生成铝和氧气。我们
还可以使用由废旧铝等含铝的废料重新熔化提炼的再生铝合金,这样做的意义在于 _________
________________。
第 3页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
12、(11分)化学是一门以实验为基础的科学,老师为同学们提供了如图实验装置:
(1)写出仪器①的名称____________
(2)实验室要用高锰酸钾制取一瓶较纯的氧气,选择的收集装置是___________(填字母序号)。
反应的化学方程式为________________________,该反应的基本类型为 ____________反应。
实验室还可用过氧化氢溶液和 MnO2混合制取氧气,其中 MnO2起到 ______作用。
(3)小明用收集的氧气进行H实验时,当火焰变得微弱时,将燃烧匙进一步伸入瓶底,火焰
又变旺,可得出氧气的一条物理性质是__________________。
(4)常温下,氨气具有强烈刺激性气味,是污染空气的气体之一,极易溶于水,密度比空气
小。实验室常用加热氯化铵和氢氧化钙固体混合物的方法制取氨气,应选用发生装置_________
(填字母序号),若用 F装置来收集氨气,气体应从____(填“b ”或“c ”)通入。有同学认为
最好在 F装置后面再连接一个 G装置,这样做的目的是 __________________。
(5)在常温下对水进行通电分解实验,正极产生的气体为____________(填化学式),若要产
生 0.8 g 氢气,至少需要电解水___________g。
13、(10分)九年级化学兴趣小组以“磷的燃烧”为主题设计了以下几组实验。
图丙 图丁
第 4页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
【实验一】可燃物燃烧的条件
任务一、定性探究
步骤Ⅰ:组装仪器,____________,装入药品。
步骤Ⅱ:用高能激光笔对准燃烧匙中蜡烛的烛芯照射一段时间后,观察到蜡烛被点燃,之后过
一会儿熄灭。而这一过程中白磷始终不燃烧。
步骤Ⅲ:冷却至室温后,将装有白磷的燃烧匙提出水面,用高能激光笔照射一段时间后,观察
到白磷____________。
实验结论:蜡烛熄灭后,瓶内氧气仍有剩余。
实验反思:①步骤Ⅱ中白磷始终不燃烧的原因是 __________________。
②实验中图甲气球的作用是 __________________。
任务二、定量探究
小华对蜡烛熄灭后白磷还能继续燃烧的现象产生好奇,利用数字传感器分别测定了蜡烛、白磷
在密闭容器中燃烧时氧气浓度的变化,结果如图乙所示。
③根据图乙中数据分析可知白磷能够燃烧而蜡烛不燃烧的氧气浓度范围是 ____________。
④通过分析图乙中数据,写出你对可燃物燃烧需要氧气的新认识 ________________________。
【实验二】测定空气中氧气含量
(1)如图丙,实验开始前活塞停在刻度 5 处,白磷燃烧时,活塞会先向右移动,再向左移动,
原因是 ____________________________________________(2分);
(2)待燃烧结束,装置冷却至室温后,活塞最终停留在刻度 4 处,由此可得出氧气约占空气
总体积的 __________。
【实验三】验证质量守恒定律
如图丁,检查装置气密性良好后,将装有白磷的装置放在托盘天平上称量的质量为 1 ,取下
装置,点燃白磷,若燃烧结束后,未待装置冷却就直接称量的质量为 2 ,则 1______ 2(填
“>”或“<”或“=”)。
14、(10分)阅读下面科普短文,回答问题。
深受人们喜爱的早餐食品燕麦中常添加颗粒极小的铁粉,它既可以作为双吸剂(起到干燥
和减缓食品变质的作用),还可以作为补铁剂。要把铁粉变为人体需要的、能吸收的营养元素,
就离不开胃酸的帮助。我们的胃液呈酸性,是因为胃腺壁细胞能分泌出盐酸。胃酸在人体的消
化吸收中发挥着重要作用,比如为胃蛋白酶提供适宜的酸性环境,分解食物中的结缔组织和肌
第 5页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
纤维。使其易于被消化吸收。健康人胃液的 在 0.9~1.5,胃液的 不仅影响人的消化吸收
功能,还对伴随食物进入人胃内的各类病菌的繁殖有影响。
某医院对 99 位胃溃疡等患者胃液的 及胃液中病菌进行了检测,结果如下表所示。
表 1——人体胃液 pH 情况分析
分组胃液的 受检患者人数 胃液中检出病菌的人数及比例
≤ 2.0 7 0(0.0%)
2.0 4.0 13 3(23.1%)
4.0 6.0 26 17(65.4%)
> 6.0 53 45(84.9%)
胃酸过多会对胃黏膜产生侵蚀作用,并使人感觉反酸或胃灼热。治疗胃酸过多的药主要有
两大类:一是抑酸药,能抑制胃酸分泌,但本身不能和胃酸反应;二是抗酸药,能直接与胃酸
反应。常服用的抗酸药的药物有碳酸氢钠、氢氧化铝、氧化镁、氢氧化镁和碳酸钙等。
胃溃疡患者若服用不合适的抗酸药,会因胃内气体压力增大而引起胃穿孔。患者如长期
使用抗酸药,很可能刺激胃酸分泌过多。因此,应遵医嘱合理使用抗酸类和抑酸类药物。
(一)依据文章内容回答下列问题。
(1)碳酸氢钠、氢氧化铝、氧化镁、氢氯化镁和碳酸钙,属于氧化物的是 ______ (填化学式)。
(2)铁粉可以作为双吸剂,能起到干燥和减缓食品变质的作用,这是由于铁可以和空气中的
________________反应。
(3)燕麦中的铁粉遇到胃酸发生的化学反应,化学方程式是 __________________。
(4)分析表格数据,可以得出胃液 越 ______ (填“大”或“小”)越有利于病菌生存。
(5)下列说法正确的是 ____________ (填字母序号)。
A.治疗胃酸过多的药物都能与盐酸反应
B.部分燕麦片中含有极少量的铁单质
C.氢氧化铝、氢氧化镁可以治疗各种胃酸过多
D.选用碳酸钙治疗胃酸过多,同时还可以补钙
(二)胃酸过多会引起不适,不同病症需要服用不同的抗酸药。实验小组同学对抗酸药选择进行
探究。
【查阅资料】
第 6页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
1.抗酸药主要利用有效成分与胃液中的过量盐酸反应,药品用量一般为 1~2 片(约
= 0.5 ~1 )。
2.氧化镁和氧化铁均属于金属氧化物,与盐酸反应的原理相似。
3.胃蛋白酶是胃中唯一的消化性蛋白酶,当 为 3~5 时活性较好,当 超过 6 时,因变性
而失去活性。
4.理想抗酸药应具备起效快速,避免产生气体刺激溃疡面等特点。
【进行实验】
Ⅰ.是否引起胃内压强的变化
锥形瓶中模拟胃酸过多的环境。将气球中的抗酸药加入锥形瓶中。
1 1 氢氧化铝片 气球无明显变化
1 2 碳酸氢钠片 气球明显膨胀
1 3 铝碳酸镁咀嚼片 气球无明显变化
1 4 氧化镁粉末 气球无明显变化
Ⅱ.是否引起胃内温度和 的变化
利用图 1 进行实验。向 4 个烧瓶中分别加入抗酸药,打开恒压滴液漏斗,滴加 0.37%的足量
稀盐酸。传感器测得的相关结果见图 2、3、4。
第 7页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
【解释与结论】
(6)药品用量在 1~2 片内,针对“严重胃溃疡患者”不建议选用的抗酸药及理由是(写出一例即
可) ________________________________________________。(2 分)
(7)下列关于氧化镁粉末、氢氧化铝片分别与盐酸反应的叙述正确的是 ____________ (填序号)。
A.氧化镁粉末的反应会引起温度上升
B.反应后溶液均显碱性
C.氢氧化铝片的反应更快
D.均有水生成
(8)由上述实验可知,铝碳酸镁咀嚼片作为理想抗酸药的优势有 ________________________。
【反思与评价】
(9)通过查阅资料,发现Ⅰ中实验 1 3无明显现象是与铝碳酸镁咀嚼片的用量过少有关。为了
观察到明显的实验现象,小明同学增加了铝碳酸镁咀嚼片的用量与原实验进行对比:取 6片铝
碳酸镁咀嚼片于试管中,加入等体积的__________________,观察是否产生气泡。
第 8页,共 8页
{#{QQABIYSQggggAgAAAAgCQw24CAIQkBGACIoOwAAIoAIBSBNABAA=}#}
同课章节目录
