8.3海水“制碱”同步练习(含答案)鲁教版化学九年级下册
文档属性
| 名称 | 8.3海水“制碱”同步练习(含答案)鲁教版化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 447.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-06 00:00:00 | ||
图片预览



文档简介
8.3海水“制碱”
一、多选题
1.下列方法能达到实验目的是
A.用海水晒盐的方法获得粗盐
B.用带火星的木条区别氮气和空气
C.用溶解、过滤、蒸发结晶的方法除去氯化钠中混有的木炭粉
D.向未知溶液中滴加澄清石灰水,检验未知液是否含有
2.水垢中一般含 CaCO3、Mg(OH)2,可能含有 MgCO3(不考虑其他任何杂质)。某同学取不含结晶水的水垢样品进行研究(过程如图),下列说法正确的是
A.该水垢灼烧生成 CO2 气体 2.64 g
B.该水垢中一定含有 CaCO3、Mg(OH)2 ,一定不含 MgCO3
C.该水垢中一定含有 CaCO3、Mg(OH)2,可能含有 MgCO3
D.该水垢中一定含有 CaCO3、Mg(OH)2 和 MgCO3
3.可鉴别氢氧化钠溶液和碳酸钠溶液的试剂是
A.酚酞溶液 B.铁粉 C.氢氧化钡溶液 D.盐酸
4.实验室中有甲、乙、丙三瓶失去标签的无色溶液,只知道分别是稀硫酸、碳酸钾、氯化钡溶液中的各一种。为了鉴别三种溶液,各取适量两两混合,产生的现象如下表所述。下列依据实验现象做出的推断中,合理的是
甲+乙 乙+丙 甲+丙
实验现象 出现白色沉淀,加稀硝酸不溶解 出现白色沉淀,加稀硝酸溶解 有气泡冒出
A.甲溶液能使无色酚酞变红 B.乙是溶液
C.乙和丙反应生成的白色沉淀是 D.丙溶液与石灰水混合,无明显现象
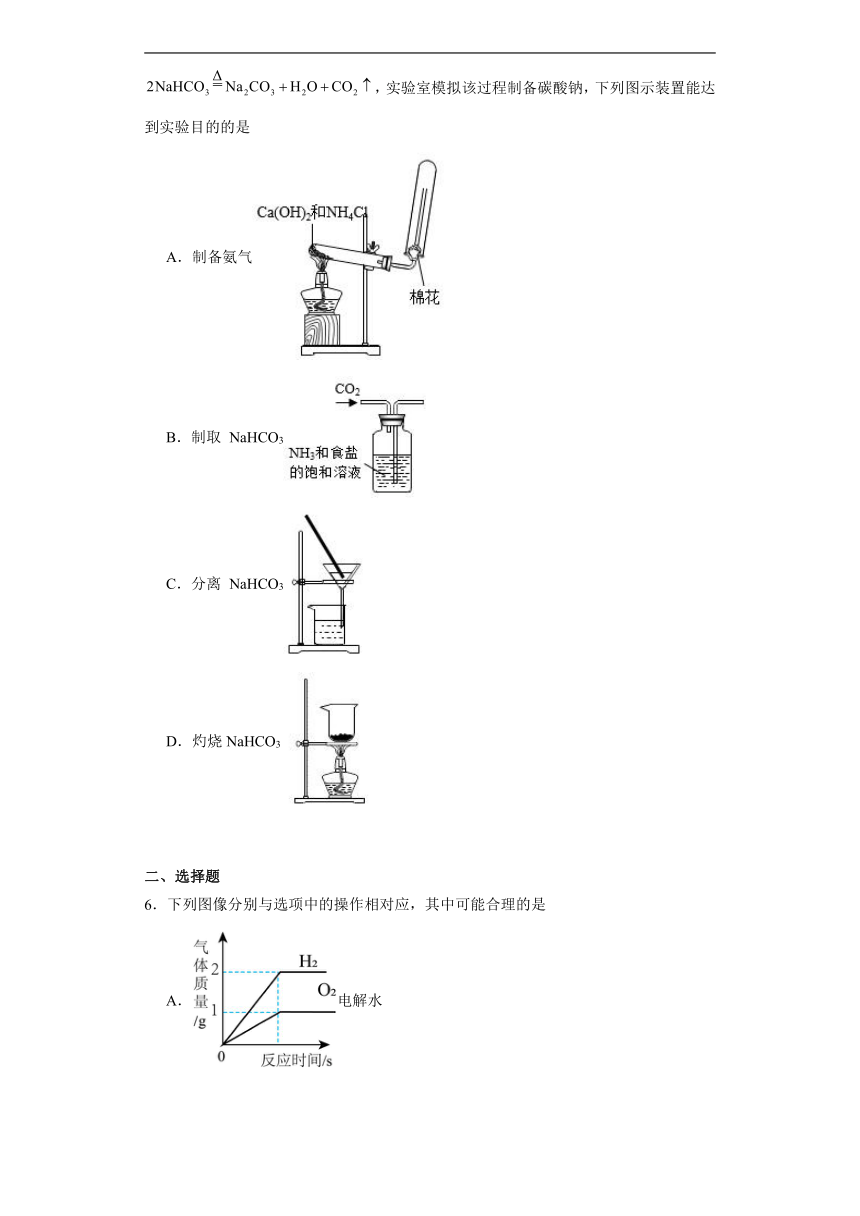
5.侯氏制碱法的原理为:,,实验室模拟该过程制备碳酸钠,下列图示装置能达到实验目的的是
A.制备氨气
B.制取 NaHCO3
C.分离 NaHCO3
D.灼烧NaHCO3
二、选择题
6.下列图像分别与选项中的操作相对应,其中可能合理的是
A.电解水
B.恒温蒸发一定质量氯化钠溶液
C.向含HCl的Na2SO4溶液中不断加入Ba(OH)2溶液
D.向含H2SO4的CuSO4溶液中不断加入NaOH溶液
7.下列物质的俗称、化学式、类别三者一致的是
A.石膏、CaSO4、盐 B.干冰、H2O、氧化物
C.生石灰、Ca(OH)2、碱 D.水银、Ag、单质
8.鉴别实验室中的下列物质,所用方法错误的是
A.氮气和二氧化碳→燃着的木条
B.空气和氧气→带火星的木条
C.水和食盐水→蒸发
D.酒精和糖水→闻气味
9.2018年11月,生态环境部全面启动第二批中央生态环境保护督察“回头看”。 现检测到某企业排放的废水为中性、无色透明,则该企业排放的废水中含有的离子可能是
A.Fe3+ 、NO3-、CI- B.H+、SO42-、NO3- C.Na+ 、SO42-、Cl- D.Na+ 、SO42- 、OH-
10.除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A.KCl固体(MnO2固体)——加水充分溶解,过滤,蒸发结晶
B.CO2气体(CO气体)——通入氧气
C.CaO固体(CaCO3固体)——加水充分溶解,过滤
D.KCl溶液(CaCl2溶液)——滴加碳酸钠溶液至恰好完全反应,过滤
11.MnO2是一种重要的无机功能材料。已知粗 MnO2中含有少量 MnCO3,某化学兴趣小 组在实验室中模拟提纯粗 MnO2的工业流程(如下图所示)。
下列有关该流程的说法中,正确的是
A.操作 A 和操作 B 都是蒸发
B.每一步反应中均有元素化合价发生变化
C.可以循环利用的物质是 H2SO4和 NaClO3
D.理论上经提纯得到的 MnO2质量等于粗MnO2样品中的MnO2质量
12.下列除杂所选用方法不正确的是
选项 物质(括号内为杂质) 除去杂质的方法
A NaCl(泥沙) 加水溶解、过滤、蒸发
B CO2(CO), 通过灼热CuO
C FeCl2溶液(CuCl2溶液) 加入足量镁粉,充分反应后,过滤
D NaCl(Na2CO3) 滴加稀盐酸至不再产生气泡
A.A B.B C.C D.D
13.下列物质用途与其物理性质有关的是
A.干冰用于人工降雨 B.氧气用于炼钢
C.熟石灰用于改良酸性土壤 D.碳酸氢钠用作发酵粉
14.只用一种试剂就可一次性鉴别稀硫酸、KOH溶液、CaCl2溶液的是
A.KCl溶液 B.K2CO3溶液 C.稀盐酸 D.NaNO3溶液
15.甲、乙、丙三种物质,具有如下图转化关系,下列推断不正确的是
A.甲、乙、丙可分别为Na2CO3、NaOH、NaNO3
B.若甲、乙是组成元素相同的两种液体,则丙可能为氧气
C.若乙、丙是组成元素相同的两种气体,则甲可能为氧气
D.若甲、乙都为钠盐,则丙可能二氧化碳气体
三、综合应用题
16.FeCO3是制备补血剂原料之一、已知FeCO3是一种白色晶体,易被氧化;
(一)实验室里制备FeCO3的流程如下图所示:
回答下列问题:
(1)写出“酸溶”时反应的化学方程式 。
(2)“酸溶”时,常采取加热或搅拌措施,其原因是 。
(3)写出“沉淀”时反应的化学方程式 。
(4)检验是否“洗涤”干净的方法是 。
(二)某兴趣小组设计如图实验装置制备FeCO3,进行以下两步操作:
第一步:打开活塞1、3,关闭活塞2,反应一段时间;
第二步:关闭活塞3,打开活塞2,发现B中有白色沉淀和气体生成。
(1)第一步骤的目的是 。
(2)装置C中可盛装适量的水,该装置作用是 。
17.黄铁矿(主要成分为FeS2,杂质高温下不反应。)是我国硫酸厂制取硫酸的主要原料。
某兴趣小组欲测定某黄铁矿中FeS2含量,设计了如下实验 (假设每步反应均完全)。
【查阅资料】 ①4FeS2+11O2 2Fe2O3+8SO2 ②Na2SO3+H2O2 =Na2SO4+H2 ③BaSO4为一种不溶于水、不溶于盐酸的沉淀。
【实验探究】
Ⅰ.称取4.80 g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
Ⅱ.反应结束后,将B瓶中的溶液按上图流程进行处理。
【问题讨论】
(1)Ⅰ中B瓶内发生反应的化学反应方程式是 和 ;
(2)Ⅰ中通入的空气中作用是 和 ;
(3)Ⅱ中加入盐酸溶液的目的是 ;
(4)Ⅱ中检验滤渣洗涤是否干净的方法是 。
【含量测定】
(5)另取4.80g黄铁矿样品在空气中加热,测出样品的固体残留率(×100%)随温度的变化如下图所示,计算该黄铁矿中FeS2的质量分数为 。(请写出计算过程)
18.实验三:兴趣小组为探究酸的化学性质,他们将一定量稀硫酸加入到盛有少量氧化铜的烧杯中,观察到黑色粉末全部溶解,溶液显 色
【拓展研究】兴趣小组同学又进行了如下实验:取124.5g该反应后溶液于烧杯中,然后将120g氢氧化钠溶液分6次加去其中,每次充分反应后称量所得溶液的质量,测量数据如下表所示:
第一次 第二次 第三次 第四次 第五次 第六次
加入氢氧化钠溶液的质量/g 20 20 20 20 20 20
反应后溶液的质量/g 144.5 164.5 179.6 189.8 200 220
产生沉淀的质量/g 0 0 m 9.8 9.8 9.8
请回答:
(1)第一次,第二次不产生沉淀的原因是:
(2)上述表格中产生沉淀的质量:m=
(3)请计算所加氢氧化钠溶液的溶质质量分数(要求写出具体的计算过程)
参考答案:
1.AC
2.AD
3.CD
4.BC
5.AC
6.B
7.A
8.A
9.C
10.A
11.C
12.C
13.A
14.B
15.A
16. 加快反应速率 取最后一次洗涤液,加适量盐酸至无明显现象,再滴入氯化钡溶液, 若未出现白色沉淀,则沉淀洗涤干净 使生成的氢气排出装置内的空气,排尽装置内的空气,防止碳酸亚铁被氧化 液封
17. CO2+2NaOH=Na2CO3+H2O SO2+2NaOH=Na2SO3+H2O; 提供反应所需的氧气 将生成的二氧化硫气体排入装置B中 除去产生的BaCO3沉淀; 取最后一次洗涤液1~2mL于试管中,向其中滴加硝酸银(或稀硫酸、碳酸钠)溶液,若无白色沉淀生成,则表明已洗涤干净。 75%
18. 蓝色 反应后溶液中硫酸有剩余,氢氧化钠先与硫酸反应 4.9 40%
一、多选题
1.下列方法能达到实验目的是
A.用海水晒盐的方法获得粗盐
B.用带火星的木条区别氮气和空气
C.用溶解、过滤、蒸发结晶的方法除去氯化钠中混有的木炭粉
D.向未知溶液中滴加澄清石灰水,检验未知液是否含有
2.水垢中一般含 CaCO3、Mg(OH)2,可能含有 MgCO3(不考虑其他任何杂质)。某同学取不含结晶水的水垢样品进行研究(过程如图),下列说法正确的是
A.该水垢灼烧生成 CO2 气体 2.64 g
B.该水垢中一定含有 CaCO3、Mg(OH)2 ,一定不含 MgCO3
C.该水垢中一定含有 CaCO3、Mg(OH)2,可能含有 MgCO3
D.该水垢中一定含有 CaCO3、Mg(OH)2 和 MgCO3
3.可鉴别氢氧化钠溶液和碳酸钠溶液的试剂是
A.酚酞溶液 B.铁粉 C.氢氧化钡溶液 D.盐酸
4.实验室中有甲、乙、丙三瓶失去标签的无色溶液,只知道分别是稀硫酸、碳酸钾、氯化钡溶液中的各一种。为了鉴别三种溶液,各取适量两两混合,产生的现象如下表所述。下列依据实验现象做出的推断中,合理的是
甲+乙 乙+丙 甲+丙
实验现象 出现白色沉淀,加稀硝酸不溶解 出现白色沉淀,加稀硝酸溶解 有气泡冒出
A.甲溶液能使无色酚酞变红 B.乙是溶液
C.乙和丙反应生成的白色沉淀是 D.丙溶液与石灰水混合,无明显现象
5.侯氏制碱法的原理为:,,实验室模拟该过程制备碳酸钠,下列图示装置能达到实验目的的是
A.制备氨气
B.制取 NaHCO3
C.分离 NaHCO3
D.灼烧NaHCO3
二、选择题
6.下列图像分别与选项中的操作相对应,其中可能合理的是
A.电解水
B.恒温蒸发一定质量氯化钠溶液
C.向含HCl的Na2SO4溶液中不断加入Ba(OH)2溶液
D.向含H2SO4的CuSO4溶液中不断加入NaOH溶液
7.下列物质的俗称、化学式、类别三者一致的是
A.石膏、CaSO4、盐 B.干冰、H2O、氧化物
C.生石灰、Ca(OH)2、碱 D.水银、Ag、单质
8.鉴别实验室中的下列物质,所用方法错误的是
A.氮气和二氧化碳→燃着的木条
B.空气和氧气→带火星的木条
C.水和食盐水→蒸发
D.酒精和糖水→闻气味
9.2018年11月,生态环境部全面启动第二批中央生态环境保护督察“回头看”。 现检测到某企业排放的废水为中性、无色透明,则该企业排放的废水中含有的离子可能是
A.Fe3+ 、NO3-、CI- B.H+、SO42-、NO3- C.Na+ 、SO42-、Cl- D.Na+ 、SO42- 、OH-
10.除去下列物质中混有的少量杂质(括号内为杂质),所用方法正确的是
A.KCl固体(MnO2固体)——加水充分溶解,过滤,蒸发结晶
B.CO2气体(CO气体)——通入氧气
C.CaO固体(CaCO3固体)——加水充分溶解,过滤
D.KCl溶液(CaCl2溶液)——滴加碳酸钠溶液至恰好完全反应,过滤
11.MnO2是一种重要的无机功能材料。已知粗 MnO2中含有少量 MnCO3,某化学兴趣小 组在实验室中模拟提纯粗 MnO2的工业流程(如下图所示)。
下列有关该流程的说法中,正确的是
A.操作 A 和操作 B 都是蒸发
B.每一步反应中均有元素化合价发生变化
C.可以循环利用的物质是 H2SO4和 NaClO3
D.理论上经提纯得到的 MnO2质量等于粗MnO2样品中的MnO2质量
12.下列除杂所选用方法不正确的是
选项 物质(括号内为杂质) 除去杂质的方法
A NaCl(泥沙) 加水溶解、过滤、蒸发
B CO2(CO), 通过灼热CuO
C FeCl2溶液(CuCl2溶液) 加入足量镁粉,充分反应后,过滤
D NaCl(Na2CO3) 滴加稀盐酸至不再产生气泡
A.A B.B C.C D.D
13.下列物质用途与其物理性质有关的是
A.干冰用于人工降雨 B.氧气用于炼钢
C.熟石灰用于改良酸性土壤 D.碳酸氢钠用作发酵粉
14.只用一种试剂就可一次性鉴别稀硫酸、KOH溶液、CaCl2溶液的是
A.KCl溶液 B.K2CO3溶液 C.稀盐酸 D.NaNO3溶液
15.甲、乙、丙三种物质,具有如下图转化关系,下列推断不正确的是
A.甲、乙、丙可分别为Na2CO3、NaOH、NaNO3
B.若甲、乙是组成元素相同的两种液体,则丙可能为氧气
C.若乙、丙是组成元素相同的两种气体,则甲可能为氧气
D.若甲、乙都为钠盐,则丙可能二氧化碳气体
三、综合应用题
16.FeCO3是制备补血剂原料之一、已知FeCO3是一种白色晶体,易被氧化;
(一)实验室里制备FeCO3的流程如下图所示:
回答下列问题:
(1)写出“酸溶”时反应的化学方程式 。
(2)“酸溶”时,常采取加热或搅拌措施,其原因是 。
(3)写出“沉淀”时反应的化学方程式 。
(4)检验是否“洗涤”干净的方法是 。
(二)某兴趣小组设计如图实验装置制备FeCO3,进行以下两步操作:
第一步:打开活塞1、3,关闭活塞2,反应一段时间;
第二步:关闭活塞3,打开活塞2,发现B中有白色沉淀和气体生成。
(1)第一步骤的目的是 。
(2)装置C中可盛装适量的水,该装置作用是 。
17.黄铁矿(主要成分为FeS2,杂质高温下不反应。)是我国硫酸厂制取硫酸的主要原料。
某兴趣小组欲测定某黄铁矿中FeS2含量,设计了如下实验 (假设每步反应均完全)。
【查阅资料】 ①4FeS2+11O2 2Fe2O3+8SO2 ②Na2SO3+H2O2 =Na2SO4+H2 ③BaSO4为一种不溶于水、不溶于盐酸的沉淀。
【实验探究】
Ⅰ.称取4.80 g黄铁矿样品放入下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。
Ⅱ.反应结束后,将B瓶中的溶液按上图流程进行处理。
【问题讨论】
(1)Ⅰ中B瓶内发生反应的化学反应方程式是 和 ;
(2)Ⅰ中通入的空气中作用是 和 ;
(3)Ⅱ中加入盐酸溶液的目的是 ;
(4)Ⅱ中检验滤渣洗涤是否干净的方法是 。
【含量测定】
(5)另取4.80g黄铁矿样品在空气中加热,测出样品的固体残留率(×100%)随温度的变化如下图所示,计算该黄铁矿中FeS2的质量分数为 。(请写出计算过程)
18.实验三:兴趣小组为探究酸的化学性质,他们将一定量稀硫酸加入到盛有少量氧化铜的烧杯中,观察到黑色粉末全部溶解,溶液显 色
【拓展研究】兴趣小组同学又进行了如下实验:取124.5g该反应后溶液于烧杯中,然后将120g氢氧化钠溶液分6次加去其中,每次充分反应后称量所得溶液的质量,测量数据如下表所示:
第一次 第二次 第三次 第四次 第五次 第六次
加入氢氧化钠溶液的质量/g 20 20 20 20 20 20
反应后溶液的质量/g 144.5 164.5 179.6 189.8 200 220
产生沉淀的质量/g 0 0 m 9.8 9.8 9.8
请回答:
(1)第一次,第二次不产生沉淀的原因是:
(2)上述表格中产生沉淀的质量:m=
(3)请计算所加氢氧化钠溶液的溶质质量分数(要求写出具体的计算过程)
参考答案:
1.AC
2.AD
3.CD
4.BC
5.AC
6.B
7.A
8.A
9.C
10.A
11.C
12.C
13.A
14.B
15.A
16. 加快反应速率 取最后一次洗涤液,加适量盐酸至无明显现象,再滴入氯化钡溶液, 若未出现白色沉淀,则沉淀洗涤干净 使生成的氢气排出装置内的空气,排尽装置内的空气,防止碳酸亚铁被氧化 液封
17. CO2+2NaOH=Na2CO3+H2O SO2+2NaOH=Na2SO3+H2O; 提供反应所需的氧气 将生成的二氧化硫气体排入装置B中 除去产生的BaCO3沉淀; 取最后一次洗涤液1~2mL于试管中,向其中滴加硝酸银(或稀硫酸、碳酸钠)溶液,若无白色沉淀生成,则表明已洗涤干净。 75%
18. 蓝色 反应后溶液中硫酸有剩余,氢氧化钠先与硫酸反应 4.9 40%
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
