山东省莱西市第一中学2023-2024学年高一下学期开学考试化学试卷(含答案)
文档属性
| 名称 | 山东省莱西市第一中学2023-2024学年高一下学期开学考试化学试卷(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 514.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-06 19:35:16 | ||
图片预览



文档简介
山东省莱西市第一中学2023-2024学年高一下学期开学考试化学试卷
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于元素周期表应用的说法正确的是( )
A.为元素性质的系统研究提供指导,为新元素的发现提供线索
B.在金属与非金属的交界处,寻找可作催化剂的合金材料
C.在ⅠA、ⅡA族元素中,寻找制造农药的主要元素
D.在过渡元素中,可以找到半导体材料
2.原子核裂变反应放出的能量是一种高效的优质能源。原子常用于核裂变反应,下列对其描述正确的是( )
A.中子数92 B.电子数143
C.核电荷数235 D.中子数与质子数之差51
3.迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称分别是:鉨、镆、鉝、钿、氟,下列有关推断正确的是( )
A.这5种元素均为主族元素
B.Nh的最高价氧化物是一种典型的两性氧化物
C.Ts的简单阴离子比同族上一周期元素的简单阴离子的还原性弱
D.根据这些元素的名称,可推测元素周期表118种元素中非金属元素共有24种
4.下列说法正确的是( )
A.F、Cl、Br原子的最外层电子数都是7,次外层电子数都是8
B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、 Br、I元素的非金属性递增的规律
C.卤素按F、Cl、Br、I的顺序,其非金属性逐渐减弱的原因是随着核电荷数的增大,电子层数逐渐增大
D.砹是第六周期的卤族元素,根据卤素性质的递变规律可知,砹单质易溶于水,难溶于
5.元素周期表中前七周期元素种数如下:
周期序数 一 二 三 四 五 六 七 八
元素种数 2 8 8 18 18 32 32
请分析周期序数与元素种类的关系,然后预言第八周期最多可能含有的元素种类为( )
A.18 B. 32 C. 50 D. 64
6.运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹为有色固体;HAt不稳定:既不溶于水也不溶于稀酸
C.硫酸锶是难溶于水的白色固体
D.硒化氢是无色、有毒、比稳定的气体
7.X、Y、Z、M、N都是短周期主族元素,且原子序数依次递增。X原子的最外层电子数是电子层数的2倍,Y与M同主族,且M的原子序数是Y的2倍,Z是短周期中金属性最强的元素。下列说法正确的是( )
A.简单离子的半径:
B.简单气态氢化物的热稳定性:
C.最高价氧化物对应水化物的酸性:
D.X与Y可以形成原子个数比为1:1和1:2的两种化合物
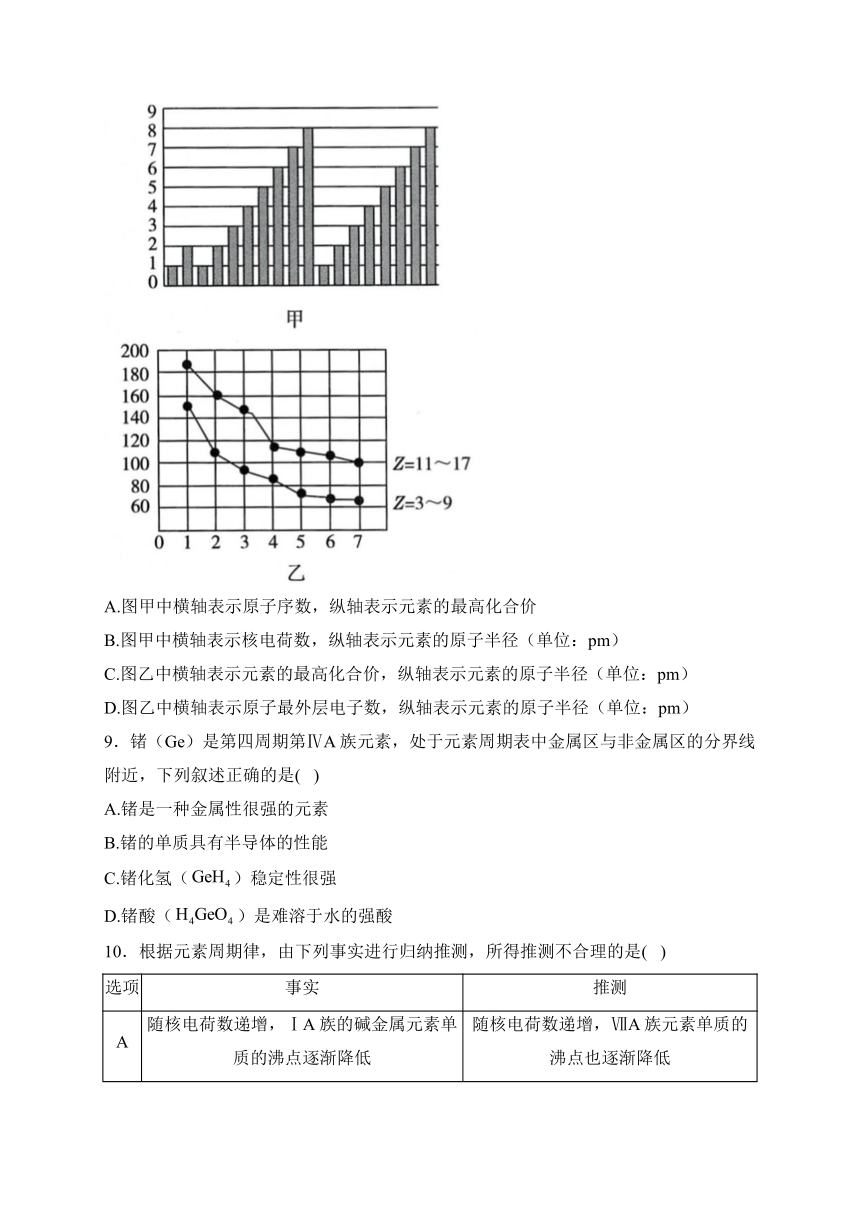
8.图甲和图乙表示短周期元素的某种性质的递变规律,下列说法正确的是( )
A.图甲中横轴表示原子序数,纵轴表示元素的最高化合价
B.图甲中横轴表示核电荷数,纵轴表示元素的原子半径(单位:pm)
C.图乙中横轴表示元素的最高化合价,纵轴表示元素的原子半径(单位:pm)
D.图乙中横轴表示原子最外层电子数,纵轴表示元素的原子半径(单位:pm)
9.锗(Ge)是第四周期第ⅣA族元素,处于元素周期表中金属区与非金属区的分界线附近,下列叙述正确的是( )
A.锗是一种金属性很强的元素
B.锗的单质具有半导体的性能
C.锗化氢()稳定性很强
D.锗酸()是难溶于水的强酸
10.根据元素周期律,由下列事实进行归纳推测,所得推测不合理的是( )
选项 事实 推测
A 随核电荷数递增,ⅠA族的碱金属元素单质的沸点逐渐降低 随核电荷数递增,ⅦA族元素单质的沸点也逐渐降低
B Na与Cl形成离子键,Al与Cl形成共价键 Si与Cl形成共价键
C HF是弱酸,HBr是强酸 HI是强酸
D 、均为强碱 (氢氧化锶)是强碱
A.A B.B C.C D.D
11.2021年6月11日国家航天局公布了由“祝融号”火星车拍摄的首批科学影像图。火星气体及岩石中富含X、Y、Z、W四种元素。已知:X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与热水反应后的溶液能使酚酞溶液变为浅红色,X、W为同一主族元素,Y是地球地壳中含量最多的元素,火星岩石中含有。下列判断错误的是( )
A.W位于元素周期表第3周期ⅣA族
B.X、W简单氢化物的稳定性:
C.原子半径:
D.火星气体中可能含有XY、
12.元素A的阳离子与元素B的阴离子具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是( )
①原子序数:A>B
②离子半径:
③原子半径:A④元素所在的周期序数:A>B
⑤A的最高化合价与B的最低化合价的绝对值相等
⑥
A.②③④ B.①②④ C.④⑤⑥ D.②⑤⑥
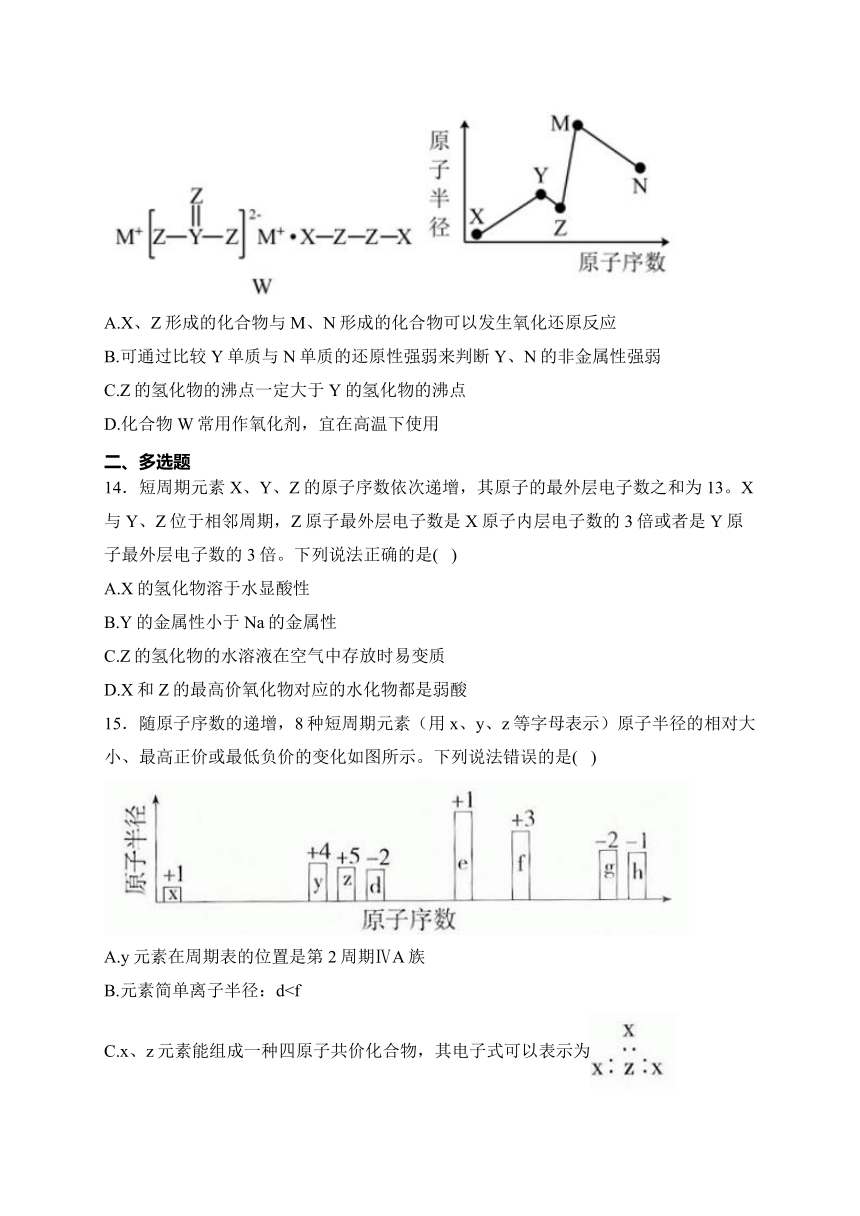
13.物质W常用作漂白剂和氧化剂,其构成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,N和Z的原子序数之差为8。下列说法正确的是( )
A.X、Z形成的化合物与M、N形成的化合物可以发生氧化还原反应
B.可通过比较Y单质与N单质的还原性强弱来判断Y、N的非金属性强弱
C.Z的氢化物的沸点一定大于Y的氢化物的沸点
D.化合物W常用作氧化剂,宜在高温下使用
二、多选题
14.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是( )
A.X的氢化物溶于水显酸性
B.Y的金属性小于Na的金属性
C.Z的氢化物的水溶液在空气中存放时易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
15.随原子序数的递增,8种短周期元素(用x、y、z等字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法错误的是( )
A.y元素在周期表的位置是第2周期ⅣA族
B.元素简单离子半径:dC.x、z元素能组成一种四原子共价化合物,其电子式可以表示为
D.e、f、g元素的最高价氧化物对应的水化物两两之间可以相互反应
三、填空题
16.铊元素的相关信息卡片如图所示:
(1)铊的原子序数为81,铊在元素周期表中位于第_____________周期_____________族。
(2)下列推断正确的是__________(填字母,下同)。
a.单质的还原性:
b.原子半径:
c.碱性:
d.氧化性:
(3)铊(Tl)是某超导材料的组成元素之一。与Ag在酸性介质中发生反应:。下列推断正确的是________。
a.最外层有1个电子
b.Tl能形成+3价和+1价的化合物
c.的氧化性比弱
d.的还原性比Ag强
17.下表为元素周期表中的一部分。
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 ⑥ ⑦
3 ① ③ ⑤ ⑧ ⑩
4 ② ④ ⑨
用化学式或元素符号回答下列问题:
(1)①③⑤元素的最高价氧化物对应的水化物,碱性最强的是_______________。
(2)②③④元素形成的简单离子半径由大到小的顺序是_______________(用离子符号表示)。
(3)元素①和⑨的最高价氧化物对应水化物的化学式分别为_______________和_______________。①和⑨两元素形成化合物的化学式为_______________,该化合物的溶液与元素⑧的单质反应的离子方程式为______________________________。
(4)⑧⑨ 三种元素形成的气态氢化物中最稳定的是_______________(填化学式),三种元素的非金属性的强弱顺序为_______________。
18.W、X、Y、Z是原子序数依次增大的同一短周期主族元素,W、X是金属元素,它们的最高价氧化物对应的水化物可以反应生成盐和水,Y、Z是非金属元素.
(1)W与Y可形成化合物,该化合物在溶液中与氯气发生反应的离子方程式为___________________________。
(2)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为___________________________。
(3)比较Y、Z气态氢化物的稳定性:______________>______________(用化学式表示)。
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是______________>______________>______________>_____________。
(5)Z的最高价氧化物为无色液体,该物质与一定量水混合得到一种稀溶液,写出该反应的化学方程式:___________________________。
19.X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲俗称苛性钠,由X、Z、Q三种元素组成。医学中常用QR配制生理盐水。化合物乙由X、R两种元素组成。请回答下列问题:
(1)Q的离子结构示意图为____________。
(2)Y元素的单质及其化合物能发生如图所示的转化,则Y元素为_____________(填元素符号)。在甲溶液中通入足量气体,该反应的离子方程式为__________________________。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应.常温下,将W的单质和甲溶液混合,发生反应的离子方程式为__________________________。
四、实验题
20.某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。利用如图装置可验证同主族元素非金属性的变化规律。
(1)仪器A的名称为__________,干燥管D的作用为______________________。
(2)若要证明非金属性:,C中为淀粉碘化钾混合溶液,B中装有固体,则A中试剂为___________,观察到C中溶液________________(填现象),即可证明非金属性:。从环境保护的角度考虑,此装置缺少尾气处理装置,可用________________吸收尾气。
(3)若要证明非金属性是,则在A中加盐酸、B中加、C中加溶液。观察到C中溶液____________________________(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________________________溶液的洗气瓶除去。
参考答案
1.答案:A
解析:
2.答案:D
解析:
3.答案:D
解析:A.118号Og元素为0族元素,不属于主族元素,故A错误;B.第Ⅲ主族Al的最高价氧化物三氧化二铝为两性氧化物,但同一主族元素从上到下金属性逐渐增强,故Nh的最高价氧化物是碱性氧化物,故B错误;C.117号Ts元素的非金属性比上一周期元素的弱,Ts的简单阴离子比同族上一周期元素的简单阴离子的还原性强,故C错误;D.由名称可知,117号Ts、118号Og元素为非金属元素,元素周期表中各族含有非金属元素数目依次为ⅠA族1种、ⅢA族1种、ⅣA族2种、ⅤA族3种、ⅥA族4种、ⅦA族6种、0族7种,故非金属元素共有24种,故D正确;故选:D。
4.答案:C
解析: F原子的次外层电子数为2,Br原子的次外层电子数为18,A错误;元素的非金属性强弱可以根据其最高价氧化物对应的水化物(最高价含氧酸而不是无氧酸)的酸性强弱比较,B错误;随着核电荷数增加,电子层数增大,原子核对最外层电子的吸引能力逐渐减弱,得电子能力逐渐减弱,非金属性逐渐减弱,C正确;同族元素性质相似,砹是卤族元素,由碘微溶于水,易溶于可推知,砹微溶于水,易溶于,D错误。
5.答案:C
解析:各周期的元素种数规律:一、二周期元素种类差为6 ;三、四周期元素种类差为10 ;五、六周期元素种类差 为14;6、10、14为等差数列,公差为4,因此七、八周期元素种类差应为18,即第八周期元素种类=32+18=50,故选C。
6.答案:D
解析:
7.答案:D
解析:X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,X的最外层电子数是其电子层数的2倍,结合原子序数可知X有2个电子层,最外层电子数为4,X为C;Y与M同主族,且M的原子序数是Y的2倍,则Y为O,M为S;Z是短周期中金属性最强的元素,Z为Na;N的原子序数比S大,则N是Cl。与的电子层数相同,核电荷数越大,离子半径越小,A错误:O和S位于同一主族,从上到下非金属性减弱,则非金属性:O>S,简单气态氢化物的热稳定性:Y>M,B错误:非金属性:,则最高价氧化物对应水化物的酸性:N>M,C错误;X与Y可以形成原子个数比为1:1和1:2的两种化合物CO、,D正确。
8.答案:D
解析:稀有气体元素的化合价一般为0价,氟元素没有正价,A、C项错误;同周期元素从左到右,主族元素原子半径逐渐减小,B项错误;同周期元素从左到右,主族元素原子最外层电子数由1到7,原子半径依次减小,D项正确。
9.答案:B
解析:A、锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,反应中既不易得电子,也不易失去电子,故A错误;B、锗处于金属区与非金属区的交界线上,既有金属性又有非金属性,常用于做半导体材料,所以B选项是正确的;C、锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,反应中既不易得电子,也不易失去电子,故C错误;锗和硅处于同一主族,主族元素的非金属性从上到下逐渐减弱,则硅的非金属性大于锗,非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性比硅酸弱,为弱酸,碳酸溶液水,硅酸不溶于水,推知锗酸()应难溶于水,故D错误;所以B选项是正确的。
10.答案:A
解析:随着核电荷数递增,ⅦA族元素的单质的分子间作用力增大,单质的沸点逐渐升高,推测不合理,A错误;同周期元素从左到右非金属性增强,金属性减弱,Na与Cl形成离子键,Al与Cl形成共价键,预测得到Si与Cl形成共价键,B正确;HF的极性较强,带负电的氟原子与带正电的氢原子吸引力较大,导致氢原子无法电离,HF是弱酸,HBr是强酸,可推测HI是强酸,C正确;同主族元素从上到下金属性增强,其最高价氧化物的水化物的碱性变强,由金属性:,已知、均为强碱,可推测是强碱,D正确。
11.答案:C
解析:已知:X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与热水反应后的溶液能使酚酞溶液变为浅红色,则Z为Mg元素;X、W为同一主族元素,Y是地球地壳中含量最多的元素,则Y为O元素;火星岩石中含有即,设其中W的化合价为+x,根据化合物中元素化合价代数和为零即,可得W的化合价为+4价,则W为Si元素,X为C元素.W为Si元素,位于元素周期表中第3周期ⅣA族,故A正确;X、W分别为C、Si,X的非金属性强于W,所以X、W简单氢化物的稳定性:X>W,故B正确;电子层越多,原子半径越大,同一周期从左到右原子半径逐渐减小,元素X、Y、Z、W分别为C、O、Mg、Si,则原子半径:,故C错误;XY、分别为CO、,故D正确。
12.答案:B
解析:根据题意可知,A元素位于B元素所在周期的下一周期,所以原子序数A>B,离子半径,原子半径A>B,周期序数A>B,A的最高化合价与B的最低化合价的绝对值不一定相等,a,b的关系为,①②④正确。
13.答案:A
解析:同周期从左到右主族元素的原子半径逐渐减小,根据原子半径与原子序数的关系可知,X、Y、Z、M、N依次为H、C、O、Na、S元素.X(H)、Z(O)形成的化合物有、,M(Na)、N(S)形成的化合物为,能与发生氧化还原反应,A正确;元素的非金属性强弱可以从其最高价氧化物的水化物的酸性强弱、与氢气生成气态氢化物的难易程度、气态氢化物的稳定性或单质氧化性的强弱来判断,不能通过单质还原性的强弱来判断,B错误;Z的氢化物有、,、常温下都呈液态,Y的氢化物为烃类,常温下碳原子数较多的烃类呈固态,其沸点高于、,C错误;W为,其中在高温下易分解,故不宜在高温下使用,D错误。
14.答案:BC
解析:因X、Y、Z为短周期元素,X与Y、Z处于相邻周期,Z原子的最外层电子数是X内层电子数的3倍或者是Y原子最外层电子数的3倍,故X位于第2周期,Y、Z位于第3周期,且Y、Z的最外层电子数分别为2、6,又X、Y、Z原子最外层电子数之和为13,则X的最外层电子数为5,所以X、Y、Z分别为N、Mg、S。X的氢化物是氨气,其水溶液呈碱性,A项错误;Z的氢化物为,其水溶液在空气中久置会变浑浊:,C项正确;X和Z的最高价氧化物对应的水化物分别是硝酸和硫酸,都是强酸,D项错误。
15.答案:BC
解析:根据8种短周期元素原子半径的相对大小、最高正价或最低负价的变化图可知,x、y、z、d、e、f、g、h分别对应H元素、C元素、N元素、O元素、Na元素、Al元素、S元素、Cl元素.C元素在周期表的位置是第2周期ⅣA族;A正确;元素简单离子半径,B错误;H元素与N元素能组成这种四原子化合物,其电子式可以表示为(即),C错误;Na、Al、S元素的最高价氧化物对应的水化物分别为、、,两两之间可以相互反应,D正确。
16.答案:(1)6;ⅢA
(2)a
(3)b
解析:
17.答案:(1)
(2)
(3);;;
(4);
解析:
18.答案:(1)
(2)
(3)
(4)
(5).
解析:
19.答案:(1)
(2)C;
(3)
解析:
20.答案:(1)分液漏斗;防止倒吸
(2)浓盐酸
解析:
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列关于元素周期表应用的说法正确的是( )
A.为元素性质的系统研究提供指导,为新元素的发现提供线索
B.在金属与非金属的交界处,寻找可作催化剂的合金材料
C.在ⅠA、ⅡA族元素中,寻找制造农药的主要元素
D.在过渡元素中,可以找到半导体材料
2.原子核裂变反应放出的能量是一种高效的优质能源。原子常用于核裂变反应,下列对其描述正确的是( )
A.中子数92 B.电子数143
C.核电荷数235 D.中子数与质子数之差51
3.迄今为止我国相关部门已经发布了113号Nh、115号Mc、116号Lv、117号Ts、118号Og等元素的中文名称分别是:鉨、镆、鉝、钿、氟,下列有关推断正确的是( )
A.这5种元素均为主族元素
B.Nh的最高价氧化物是一种典型的两性氧化物
C.Ts的简单阴离子比同族上一周期元素的简单阴离子的还原性弱
D.根据这些元素的名称,可推测元素周期表118种元素中非金属元素共有24种
4.下列说法正确的是( )
A.F、Cl、Br原子的最外层电子数都是7,次外层电子数都是8
B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、 Br、I元素的非金属性递增的规律
C.卤素按F、Cl、Br、I的顺序,其非金属性逐渐减弱的原因是随着核电荷数的增大,电子层数逐渐增大
D.砹是第六周期的卤族元素,根据卤素性质的递变规律可知,砹单质易溶于水,难溶于
5.元素周期表中前七周期元素种数如下:
周期序数 一 二 三 四 五 六 七 八
元素种数 2 8 8 18 18 32 32
请分析周期序数与元素种类的关系,然后预言第八周期最多可能含有的元素种类为( )
A.18 B. 32 C. 50 D. 64
6.运用元素周期律分析下面的推断,其中错误的是( )
A.铍(Be)的氧化物的水化物可能具有两性
B.砹为有色固体;HAt不稳定:既不溶于水也不溶于稀酸
C.硫酸锶是难溶于水的白色固体
D.硒化氢是无色、有毒、比稳定的气体
7.X、Y、Z、M、N都是短周期主族元素,且原子序数依次递增。X原子的最外层电子数是电子层数的2倍,Y与M同主族,且M的原子序数是Y的2倍,Z是短周期中金属性最强的元素。下列说法正确的是( )
A.简单离子的半径:
B.简单气态氢化物的热稳定性:
C.最高价氧化物对应水化物的酸性:
D.X与Y可以形成原子个数比为1:1和1:2的两种化合物
8.图甲和图乙表示短周期元素的某种性质的递变规律,下列说法正确的是( )
A.图甲中横轴表示原子序数,纵轴表示元素的最高化合价
B.图甲中横轴表示核电荷数,纵轴表示元素的原子半径(单位:pm)
C.图乙中横轴表示元素的最高化合价,纵轴表示元素的原子半径(单位:pm)
D.图乙中横轴表示原子最外层电子数,纵轴表示元素的原子半径(单位:pm)
9.锗(Ge)是第四周期第ⅣA族元素,处于元素周期表中金属区与非金属区的分界线附近,下列叙述正确的是( )
A.锗是一种金属性很强的元素
B.锗的单质具有半导体的性能
C.锗化氢()稳定性很强
D.锗酸()是难溶于水的强酸
10.根据元素周期律,由下列事实进行归纳推测,所得推测不合理的是( )
选项 事实 推测
A 随核电荷数递增,ⅠA族的碱金属元素单质的沸点逐渐降低 随核电荷数递增,ⅦA族元素单质的沸点也逐渐降低
B Na与Cl形成离子键,Al与Cl形成共价键 Si与Cl形成共价键
C HF是弱酸,HBr是强酸 HI是强酸
D 、均为强碱 (氢氧化锶)是强碱
A.A B.B C.C D.D
11.2021年6月11日国家航天局公布了由“祝融号”火星车拍摄的首批科学影像图。火星气体及岩石中富含X、Y、Z、W四种元素。已知:X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与热水反应后的溶液能使酚酞溶液变为浅红色,X、W为同一主族元素,Y是地球地壳中含量最多的元素,火星岩石中含有。下列判断错误的是( )
A.W位于元素周期表第3周期ⅣA族
B.X、W简单氢化物的稳定性:
C.原子半径:
D.火星气体中可能含有XY、
12.元素A的阳离子与元素B的阴离子具有相同的电子层结构。以下关于A、B元素性质的比较中,正确的是( )
①原子序数:A>B
②离子半径:
③原子半径:A
⑤A的最高化合价与B的最低化合价的绝对值相等
⑥
A.②③④ B.①②④ C.④⑤⑥ D.②⑤⑥
13.物质W常用作漂白剂和氧化剂,其构成元素均为短周期主族元素,各元素原子半径与原子序数的关系如图所示,N和Z的原子序数之差为8。下列说法正确的是( )
A.X、Z形成的化合物与M、N形成的化合物可以发生氧化还原反应
B.可通过比较Y单质与N单质的还原性强弱来判断Y、N的非金属性强弱
C.Z的氢化物的沸点一定大于Y的氢化物的沸点
D.化合物W常用作氧化剂,宜在高温下使用
二、多选题
14.短周期元素X、Y、Z的原子序数依次递增,其原子的最外层电子数之和为13。X与Y、Z位于相邻周期,Z原子最外层电子数是X原子内层电子数的3倍或者是Y原子最外层电子数的3倍。下列说法正确的是( )
A.X的氢化物溶于水显酸性
B.Y的金属性小于Na的金属性
C.Z的氢化物的水溶液在空气中存放时易变质
D.X和Z的最高价氧化物对应的水化物都是弱酸
15.随原子序数的递增,8种短周期元素(用x、y、z等字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。下列说法错误的是( )
A.y元素在周期表的位置是第2周期ⅣA族
B.元素简单离子半径:d
D.e、f、g元素的最高价氧化物对应的水化物两两之间可以相互反应
三、填空题
16.铊元素的相关信息卡片如图所示:
(1)铊的原子序数为81,铊在元素周期表中位于第_____________周期_____________族。
(2)下列推断正确的是__________(填字母,下同)。
a.单质的还原性:
b.原子半径:
c.碱性:
d.氧化性:
(3)铊(Tl)是某超导材料的组成元素之一。与Ag在酸性介质中发生反应:。下列推断正确的是________。
a.最外层有1个电子
b.Tl能形成+3价和+1价的化合物
c.的氧化性比弱
d.的还原性比Ag强
17.下表为元素周期表中的一部分。
周期 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA 0
2 ⑥ ⑦
3 ① ③ ⑤ ⑧ ⑩
4 ② ④ ⑨
用化学式或元素符号回答下列问题:
(1)①③⑤元素的最高价氧化物对应的水化物,碱性最强的是_______________。
(2)②③④元素形成的简单离子半径由大到小的顺序是_______________(用离子符号表示)。
(3)元素①和⑨的最高价氧化物对应水化物的化学式分别为_______________和_______________。①和⑨两元素形成化合物的化学式为_______________,该化合物的溶液与元素⑧的单质反应的离子方程式为______________________________。
(4)⑧⑨ 三种元素形成的气态氢化物中最稳定的是_______________(填化学式),三种元素的非金属性的强弱顺序为_______________。
18.W、X、Y、Z是原子序数依次增大的同一短周期主族元素,W、X是金属元素,它们的最高价氧化物对应的水化物可以反应生成盐和水,Y、Z是非金属元素.
(1)W与Y可形成化合物,该化合物在溶液中与氯气发生反应的离子方程式为___________________________。
(2)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为___________________________。
(3)比较Y、Z气态氢化物的稳定性:______________>______________(用化学式表示)。
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是______________>______________>______________>_____________。
(5)Z的最高价氧化物为无色液体,该物质与一定量水混合得到一种稀溶液,写出该反应的化学方程式:___________________________。
19.X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲俗称苛性钠,由X、Z、Q三种元素组成。医学中常用QR配制生理盐水。化合物乙由X、R两种元素组成。请回答下列问题:
(1)Q的离子结构示意图为____________。
(2)Y元素的单质及其化合物能发生如图所示的转化,则Y元素为_____________(填元素符号)。在甲溶液中通入足量气体,该反应的离子方程式为__________________________。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应.常温下,将W的单质和甲溶液混合,发生反应的离子方程式为__________________________。
四、实验题
20.某同学为探究元素周期表中元素性质的递变规律,设计了如下实验。利用如图装置可验证同主族元素非金属性的变化规律。
(1)仪器A的名称为__________,干燥管D的作用为______________________。
(2)若要证明非金属性:,C中为淀粉碘化钾混合溶液,B中装有固体,则A中试剂为___________,观察到C中溶液________________(填现象),即可证明非金属性:。从环境保护的角度考虑,此装置缺少尾气处理装置,可用________________吸收尾气。
(3)若要证明非金属性是,则在A中加盐酸、B中加、C中加溶液。观察到C中溶液____________________________(填现象),即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有________________________溶液的洗气瓶除去。
参考答案
1.答案:A
解析:
2.答案:D
解析:
3.答案:D
解析:A.118号Og元素为0族元素,不属于主族元素,故A错误;B.第Ⅲ主族Al的最高价氧化物三氧化二铝为两性氧化物,但同一主族元素从上到下金属性逐渐增强,故Nh的最高价氧化物是碱性氧化物,故B错误;C.117号Ts元素的非金属性比上一周期元素的弱,Ts的简单阴离子比同族上一周期元素的简单阴离子的还原性强,故C错误;D.由名称可知,117号Ts、118号Og元素为非金属元素,元素周期表中各族含有非金属元素数目依次为ⅠA族1种、ⅢA族1种、ⅣA族2种、ⅤA族3种、ⅥA族4种、ⅦA族6种、0族7种,故非金属元素共有24种,故D正确;故选:D。
4.答案:C
解析: F原子的次外层电子数为2,Br原子的次外层电子数为18,A错误;元素的非金属性强弱可以根据其最高价氧化物对应的水化物(最高价含氧酸而不是无氧酸)的酸性强弱比较,B错误;随着核电荷数增加,电子层数增大,原子核对最外层电子的吸引能力逐渐减弱,得电子能力逐渐减弱,非金属性逐渐减弱,C正确;同族元素性质相似,砹是卤族元素,由碘微溶于水,易溶于可推知,砹微溶于水,易溶于,D错误。
5.答案:C
解析:各周期的元素种数规律:一、二周期元素种类差为6 ;三、四周期元素种类差为10 ;五、六周期元素种类差 为14;6、10、14为等差数列,公差为4,因此七、八周期元素种类差应为18,即第八周期元素种类=32+18=50,故选C。
6.答案:D
解析:
7.答案:D
解析:X、Y、Z、M、N为短周期主族元素,且原子序数依次增大,X的最外层电子数是其电子层数的2倍,结合原子序数可知X有2个电子层,最外层电子数为4,X为C;Y与M同主族,且M的原子序数是Y的2倍,则Y为O,M为S;Z是短周期中金属性最强的元素,Z为Na;N的原子序数比S大,则N是Cl。与的电子层数相同,核电荷数越大,离子半径越小,A错误:O和S位于同一主族,从上到下非金属性减弱,则非金属性:O>S,简单气态氢化物的热稳定性:Y>M,B错误:非金属性:,则最高价氧化物对应水化物的酸性:N>M,C错误;X与Y可以形成原子个数比为1:1和1:2的两种化合物CO、,D正确。
8.答案:D
解析:稀有气体元素的化合价一般为0价,氟元素没有正价,A、C项错误;同周期元素从左到右,主族元素原子半径逐渐减小,B项错误;同周期元素从左到右,主族元素原子最外层电子数由1到7,原子半径依次减小,D项正确。
9.答案:B
解析:A、锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,反应中既不易得电子,也不易失去电子,故A错误;B、锗处于金属区与非金属区的交界线上,既有金属性又有非金属性,常用于做半导体材料,所以B选项是正确的;C、锗处于金属区与非金属区的交界线上,元素金属性和非金属性都较弱,反应中既不易得电子,也不易失去电子,故C错误;锗和硅处于同一主族,主族元素的非金属性从上到下逐渐减弱,则硅的非金属性大于锗,非金属性越强,对应的最高价氧化物的水化物的酸性越强,所以酸性比硅酸弱,为弱酸,碳酸溶液水,硅酸不溶于水,推知锗酸()应难溶于水,故D错误;所以B选项是正确的。
10.答案:A
解析:随着核电荷数递增,ⅦA族元素的单质的分子间作用力增大,单质的沸点逐渐升高,推测不合理,A错误;同周期元素从左到右非金属性增强,金属性减弱,Na与Cl形成离子键,Al与Cl形成共价键,预测得到Si与Cl形成共价键,B正确;HF的极性较强,带负电的氟原子与带正电的氢原子吸引力较大,导致氢原子无法电离,HF是弱酸,HBr是强酸,可推测HI是强酸,C正确;同主族元素从上到下金属性增强,其最高价氧化物的水化物的碱性变强,由金属性:,已知、均为强碱,可推测是强碱,D正确。
11.答案:C
解析:已知:X、Y、Z、W为原子序数递增的四种短周期元素,其中Z为金属元素,其单质与热水反应后的溶液能使酚酞溶液变为浅红色,则Z为Mg元素;X、W为同一主族元素,Y是地球地壳中含量最多的元素,则Y为O元素;火星岩石中含有即,设其中W的化合价为+x,根据化合物中元素化合价代数和为零即,可得W的化合价为+4价,则W为Si元素,X为C元素.W为Si元素,位于元素周期表中第3周期ⅣA族,故A正确;X、W分别为C、Si,X的非金属性强于W,所以X、W简单氢化物的稳定性:X>W,故B正确;电子层越多,原子半径越大,同一周期从左到右原子半径逐渐减小,元素X、Y、Z、W分别为C、O、Mg、Si,则原子半径:,故C错误;XY、分别为CO、,故D正确。
12.答案:B
解析:根据题意可知,A元素位于B元素所在周期的下一周期,所以原子序数A>B,离子半径,原子半径A>B,周期序数A>B,A的最高化合价与B的最低化合价的绝对值不一定相等,a,b的关系为,①②④正确。
13.答案:A
解析:同周期从左到右主族元素的原子半径逐渐减小,根据原子半径与原子序数的关系可知,X、Y、Z、M、N依次为H、C、O、Na、S元素.X(H)、Z(O)形成的化合物有、,M(Na)、N(S)形成的化合物为,能与发生氧化还原反应,A正确;元素的非金属性强弱可以从其最高价氧化物的水化物的酸性强弱、与氢气生成气态氢化物的难易程度、气态氢化物的稳定性或单质氧化性的强弱来判断,不能通过单质还原性的强弱来判断,B错误;Z的氢化物有、,、常温下都呈液态,Y的氢化物为烃类,常温下碳原子数较多的烃类呈固态,其沸点高于、,C错误;W为,其中在高温下易分解,故不宜在高温下使用,D错误。
14.答案:BC
解析:因X、Y、Z为短周期元素,X与Y、Z处于相邻周期,Z原子的最外层电子数是X内层电子数的3倍或者是Y原子最外层电子数的3倍,故X位于第2周期,Y、Z位于第3周期,且Y、Z的最外层电子数分别为2、6,又X、Y、Z原子最外层电子数之和为13,则X的最外层电子数为5,所以X、Y、Z分别为N、Mg、S。X的氢化物是氨气,其水溶液呈碱性,A项错误;Z的氢化物为,其水溶液在空气中久置会变浑浊:,C项正确;X和Z的最高价氧化物对应的水化物分别是硝酸和硫酸,都是强酸,D项错误。
15.答案:BC
解析:根据8种短周期元素原子半径的相对大小、最高正价或最低负价的变化图可知,x、y、z、d、e、f、g、h分别对应H元素、C元素、N元素、O元素、Na元素、Al元素、S元素、Cl元素.C元素在周期表的位置是第2周期ⅣA族;A正确;元素简单离子半径,B错误;H元素与N元素能组成这种四原子化合物,其电子式可以表示为(即),C错误;Na、Al、S元素的最高价氧化物对应的水化物分别为、、,两两之间可以相互反应,D正确。
16.答案:(1)6;ⅢA
(2)a
(3)b
解析:
17.答案:(1)
(2)
(3);;;
(4);
解析:
18.答案:(1)
(2)
(3)
(4)
(5).
解析:
19.答案:(1)
(2)C;
(3)
解析:
20.答案:(1)分液漏斗;防止倒吸
(2)浓盐酸
解析:
同课章节目录
