湖南省衡阳市衡阳县井头镇大云中学2023-2024学年九年级下学期开学摸底考试化学试卷(含解析)
文档属性
| 名称 | 湖南省衡阳市衡阳县井头镇大云中学2023-2024学年九年级下学期开学摸底考试化学试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 536.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-06 22:05:24 | ||
图片预览



文档简介
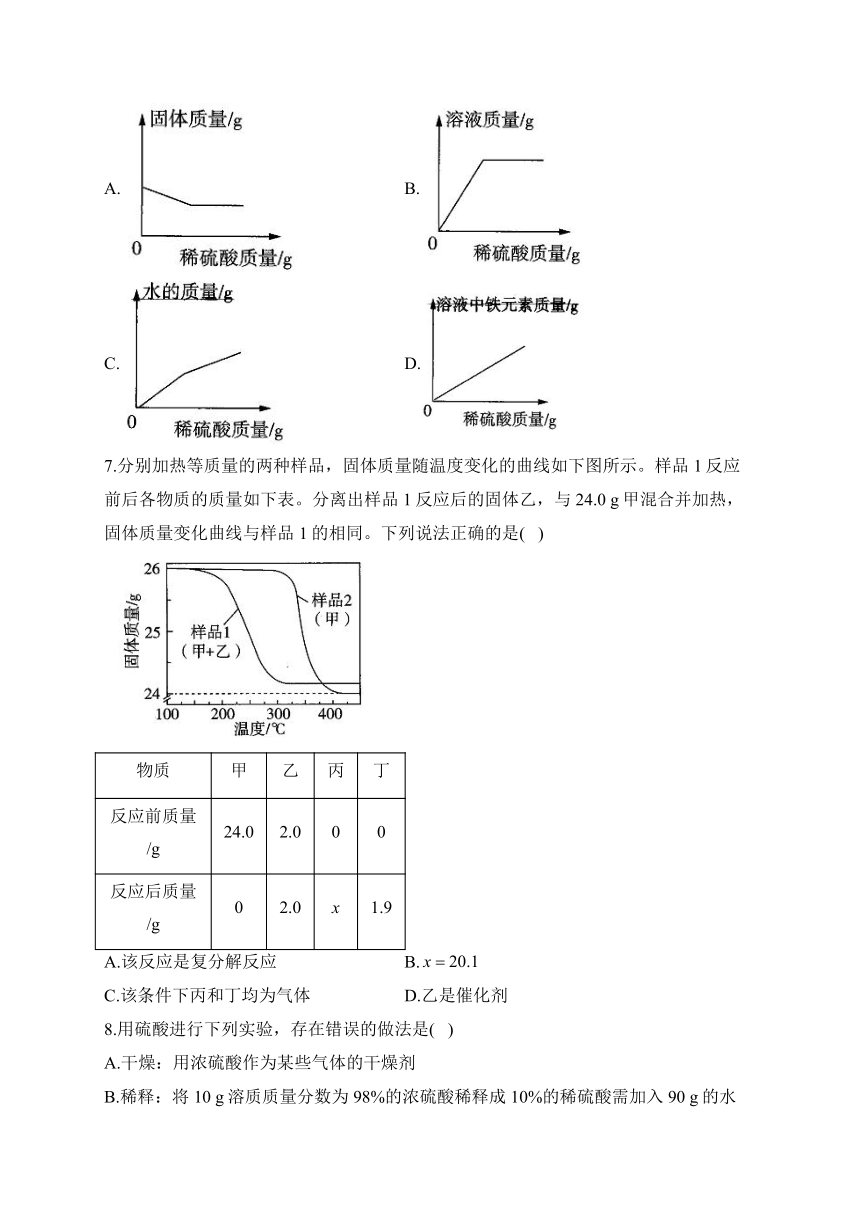
2023-2024学年九年级下学期开学摸底考试化学试卷
一、单选题。每小题3分,共45分。
1.井冈山红色研学之旅体验的下列项目中,发生化学变化的是( )
A.稻草编鞋 B.粗布裁衣 C.竹子制筒 D.红米煮饭
2.在“氧气的实验室制取与性质”实验中,下列装置或操作不正确的是( )
A. B. C. D.
3.《天工开物》中记载:“凡石灰经火焚炼为用”。“石灰”主要成分为氧化钙,下列说法错误的是( )
A.“石灰”与石灰石成分相同 B.“石灰”含有钙、氧元素
C.“石灰”与水反应会放热 D.“石灰”可用作干燥剂
4.夏季下雨之前,天气闷热,水中的含氧量降低,养鱼池中的鱼往往会浮出水面。下列有关说法错误的是( )
A.氧气的溶解度会随压强的减小而减小
B.氧气的溶解度会随温度的升高而增大
C.为了增加养鱼池中的含氧量,可以向养鱼池中通入空气
D.为了增加养鱼池中的含氧量,可以把养鱼池的水喷向空中
5.科学思维是化学核心素养的重要组成部分,下列示例说法错误的是( )
A.比较:金刚石和石墨的组成元素相同,故两者的物理性质相同
B.分类:塑料跳绳、橡胶排球和尼龙球网的主要材料均属于合成材料
C.分析:稀有气体用于霓虹灯,因为通电时稀有气体能发出不同颜色的光
D.推理:分子是由原子构成的,所以氧分子是由氧原子构成的
6.向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,烧杯中有关量的变化见下图,其中正确的是( )
A. B.
C. D.
7.分别加热等质量的两种样品,固体质量随温度变化的曲线如下图所示。样品1反应前后各物质的质量如下表。分离出样品1反应后的固体乙,与24.0 g甲混合并加热,固体质量变化曲线与样品1的相同。下列说法正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 24.0 2.0 0 0
反应后质量/g 0 2.0 x 1.9
A.该反应是复分解反应 B.
C.该条件下丙和丁均为气体 D.乙是催化剂
8.用硫酸进行下列实验,存在错误的做法是( )
A.干燥:用浓硫酸作为某些气体的干燥剂
B.稀释:将10 g溶质质量分数为98%的浓硫酸稀释成10%的稀硫酸需加入90 g的水
C.制备:用稀硫酸与锌粒反应来制取氢气
D.除锈:用适量的稀硫酸除去铁钉表面的铁锈
9.下列实验,不能证明氢氧化钠与稀盐酸发生化学反应的是( )
A.向滴有酚酞试液的稀盐酸中,逐滴加入稀氢氧化钠溶液
B.向滴有酚酞试液的稀氢氧化钠溶液中,逐滴加入足量的稀盐酸
C.取稀氢氧化钠溶液和稀盐酸混合后的溶液,蒸干得到白色固体
D.向稀氢氧化钠溶液中逐滴加入足量的稀盐酸,并不断测定混合溶液的pH
10.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 鉴别硫酸铵和氯化铵 取样,分别加入熟石灰研磨后闻气味
B 除去氯化钠中少量的碳酸钠 加入过量的氯化钙溶液,过滤;滤液蒸发结晶
C 检验氢氧化钠固体部分变质 取样,加入足量氢氧化钡溶液,过滤;滤液中加酚酞
D 分离二氧化锰和氯化钾固体 加入足量水溶解,过滤,洗涤滤渣、干燥;滤液蒸发结晶
A.A B.B C.C D.D
11.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法一定正确的是( )
A.时,等质量的甲、乙、丙的溶液降温到时,析出晶体最多的是甲的溶液
B.时,将25 g乙加入到50 g水中,再降温到,所得溶液的溶质质量分数约为33.3%
C.时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙
D.时,甲、乙、丙的饱和溶液中,所含溶质质量的大小关系为:乙>甲=丙
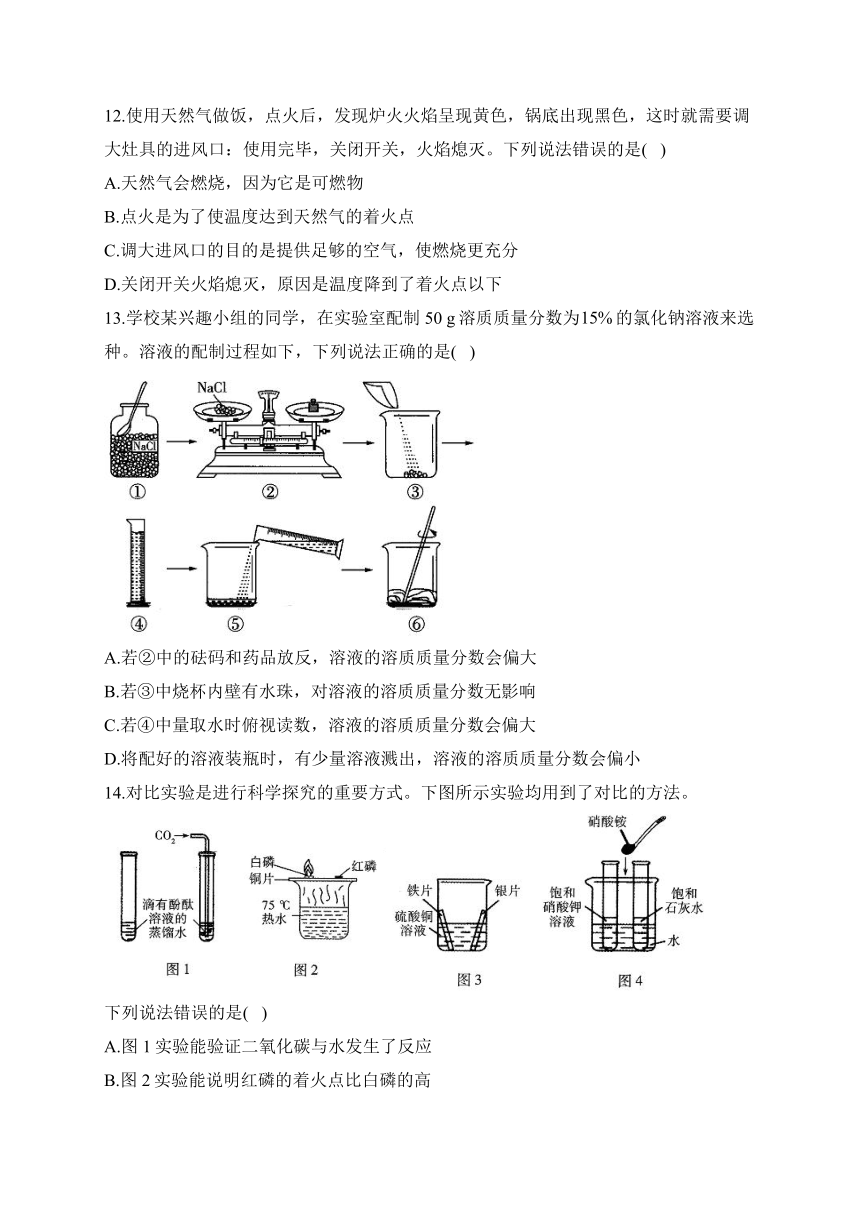
12.使用天然气做饭,点火后,发现炉火火焰呈现黄色,锅底出现黑色,这时就需要调大灶具的进风口:使用完毕,关闭开关,火焰熄灭。下列说法错误的是( )
A.天然气会燃烧,因为它是可燃物
B.点火是为了使温度达到天然气的着火点
C.调大进风口的目的是提供足够的空气,使燃烧更充分
D.关闭开关火焰熄灭,原因是温度降到了着火点以下
13.学校某兴趣小组的同学,在实验室配制50 g溶质质量分数为的氯化钠溶液来选种。溶液的配制过程如下,下列说法正确的是( )
A.若②中的砝码和药品放反,溶液的溶质质量分数会偏大
B.若③中烧杯内壁有水珠,对溶液的溶质质量分数无影响
C.若④中量取水时俯视读数,溶液的溶质质量分数会偏大
D.将配好的溶液装瓶时,有少量溶液溅出,溶液的溶质质量分数会偏小
14.对比实验是进行科学探究的重要方式。下图所示实验均用到了对比的方法。
下列说法错误的是( )
A.图1实验能验证二氧化碳与水发生了反应
B.图2实验能说明红磷的着火点比白磷的高
C.图3实验能验证金属活动性顺序为Fe>Cu>Ag
D.图4实验能说明硝酸铵固体溶于水会吸收热量
15.向三个烧杯中分别放入足量的Mg、Al、Fe粉末,同时加入质量分数相同的100 g稀盐酸,充分反应。反应的有关图像错误的是( )
A. B.
C. D.
二、填空题,共55分。
16.(5分)化学与生活息息相关。请用下列物质的序号填空。
①水
②氖气
③干冰
④熟石灰
⑤活性炭
(1)可用于制作霓虹灯的是_________;
(2)可用作溶剂的是_________;
(3)可用作吸附剂的是_________;
(4)可用于人工降雨的是_________;
(5)可用于改良酸性土壤的是_________。
17.(14分)化学兴趣小组进行稀硫酸化学性质的探究。回答下列问题:
(1)将稀硫酸分别加入上图的试管中,无明显现象的是_______(填字母序号),要证明该试管中已发生了化学反应,以下方案可行的是_______(填数字序号)。
①滴入酚酞溶液无明显现象
②测得试管中溶液的pH小于7
③滴入溶液有白色沉淀出现
④滴入溶液无蓝色沉淀出现
(2)上述实验结束后,化学兴趣小组继续探究。
实验步骤 实验现象
步骤1:将试管A中物质全部倒入试管E中 产生气泡且白色沉淀增加
步骤2:过滤,得到滤液
步骤3:向滤液中逐滴滴加氢氧化钠溶液 开始无明显现象,一段时间后出现白色沉淀
①步骤2滤液中,溶质的所有可能组合是______(填化学式)。
②步骤3中,产生白色沉淀之前,一定会发生的反应的化学方程式是______。
18.(17分)化学是一门以实验为基础的学科。请结合图示回答问题:
(1)仪器①的名称为_______。
(2)实验室用高锰酸钾制取氧气的化学方程式为_______,
应选择的发生装置和收集装置为_______。
(3)若采用E装置收集某种气体,当_______时开始收集。
(4)利用如图装置制取并研究的性质。将Y形管倾斜,使N中试剂流入M中至完全反应,然后向M中注入足量溶液。
①整个实验过程中,气球的变化情况是_______;
②注入足量溶液充分反应后,M中的现象是_______,产生此现象的原因是_______。
19.(12分)柠檬酸亚铁是一种易被吸收的补血剂。利用硫酸厂的废渣(主要含,还有少量)制备柠檬酸亚铁,该工艺流程如图所示,回答下列问题:
资料1:
资料2:不溶于水,也不与稀硫酸反应。
(1)柠檬酸亚铁进入人体肠道后以_______(填阳离子符号)的形式被吸收,达到补血效果。
(2)固体C的成分是_______。
(3)步骤①②③④中涉及置换反应的是_______(填数字序号)。
(4)步骤③中发生反应的化学方程式是_______。
(5)“一系列操作”中,将柠檬酸亚铁晶体与溶液分离的操作是_______。
20.(7分)过氧化尿素(化学式为,简称UP,相对分子质量是94)因其可消毒杀菌而广泛应用于洗涤剂中;UP在空气中或遇水缓慢分解,,能催化该反应,化学方程式如下: ,为测定某品牌洗涤剂中UP的含量,取100 g该洗涤剂样品溶于一定量的水中,再加大2 g ,共产生0.32 g 。
(1)计算该洗涤剂中UP的质量分数(请写出计算过程)
(2)上述实验测定结果比该洗涤到标示的UP质量分数低,可能的原因是________(填字母号)
A.实际称量的洗涤剂样品多于100 g B.实际称量的多于2 g
C.实验前该样品暴露在空气中时间过长 D.实验产生的未完全逸出
答案以及解析
1.答案:D
解析:稻草编鞋、粗布裁衣、竹子制筒过程中都只涉及物质形状的改变,无其他物质生成,属于物理变化。红米煮饭时涉及燃烧、米饭由生变熟的过程,有其他物质生成,属于化学变化。
2.答案:C
解析:氧气的密度比空气大,用向上排空气法收集,收集时导管应伸至集气瓶底部。
3.答案:A
解析:根据题意可知,“石灰”的主要成分是CaO。
A(×)石灰石的主要成分是,两者不同。
B(√)氧化钙由钙、氧两种元素组成。
C(√)氧化钙与水反应,放出大量的热,如常用于自热火锅。
D(√)因氧化钙能与水反应,故可作干燥剂,生活中常用作食品干燥剂。
4.答案:B
解析:
选项 正误 分析
A √ 氧气的溶解度随压强的减小而减小
B × 夏季气温升高,养鱼池中的含氧量减小,养鱼池中的鱼会浮出水面,说明氧气的溶解度随温度的升高而减小
C √ 空气中含有氧气,向养鱼池中通入空气,可以增加养鱼池中的含氧量
D √ 把养鱼池的水喷向空中,增大了水和氧气的接触面积,可以增加养鱼池中的含氧量
5.答案:A
解析:虽然金刚石和石墨都是由碳元素组成的单质,但构成它们的原子排列方式不同,故物理性质差异很大,如金刚石硬度很大,石墨硬度很小;石墨导电性良好,金刚石不导电。
6.答案:C
解析:向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,会发生反应:。横轴代表的是滴入的稀硫酸的质量。
A(×)随着稀硫酸的加入,固体质量不断减小,最后为零。
B(×)氧化铁是固体,随着反应的进行,固体逐渐“溶解”在稀硫酸中,溶液质量增大。反应结束后,溶液质量继续增大。
D(×)随着反应进行,溶液中铁元素的质量逐渐增大,反应结束后,溶液中铁元素的质量不再改变。
A、B、D的正确图像如下:
7.答案:D
解析:A(×)由表格信息可知,该反应过程为:甲丙+丁,则该反应符合“一变多”的特征,属于分解反应。
B(×)由质量守恒定律可知,化学反应前后物质的总质量不变,则。
C(×)由样品2的固体质量变化曲线可知,反应前后,固体质量减少约2.0 g,则该条件下物质丙是固体,物质丁是气体。
D(√)由表格数据可知,反应前后丁的质量不变(为2.0 g),且题干中明确指出“分离出样品1反应后的固体乙,与24.0 g甲混合并加热,固体质量变化曲线与样品1的相同”,说明乙的化学性质在该反应前后未发生改变。对比样品1、2的曲线知,加入乙反应速率更快,则说明乙为该反应的催化剂。
8.答案:B
解析:A(√)浓硫酸具有吸水性,可做某些气体(如等)的干燥剂。
B(×)根据稀释前后,溶液中溶质的质量不变,可知将10 g溶质质量分数为98%的浓硫酸稀释成10%的稀硫酸需加入水的质量为。
C(√)稀硫酸和锌反应生成硫酸锌和氢气,实验室常用稀硫酸和锌粒反应制取氢气。
D(√)铁锈的主要成分是氧化铁,稀硫酸和氧化铁反应生成可溶性的硫酸铁和水,能除去铁钉表面的铁锈。
9.答案:C
解析:向滴有酚酞试液的稀盐酸中,逐滴加入稀氢氧化钠溶液,一开始显无色,说明滴加的氢氧化钠和稀盐酸发生了化学反应;滴有酚酞试液的氢氧化钠溶液显红色,无色酚酞试液遇酸性溶液不变色,遇碱性溶液变红,逐滴滴入稀盐酸,至恰好完全反应,溶液显中性,溶液由红色变为无色,证明盐酸和氢氧化钠发生了化学反应;取稀氢氧化钠溶液和稀盐酸混合后的溶液,蒸干得到白色固体,不能证明氢氧化钠与稀盐酸发生化学反应,稀氢氧化钠溶液蒸干也会得到白色固体;向稀氢氧化钠溶液中逐滴加入足量的稀盐酸,并不断测定混合溶液的pH,溶液的pH由大于7逐渐减小,说明氢氧化钠和稀盐酸发生了化学反应。
10.答案:D
解析:A(不能)和均能与熟石灰反应生成有刺激性气味的,无法达到实验目的。
B(不能)能与反应生成沉淀和NaCl,能除去,但过量的会成为新的杂质。
C(不能)部分变质的NaOH固体中含有和反应生成沉淀和NaOH,有白色沉淀产生,证明样品中含有;滤液中加入酚酞,若溶液变红色,则证明滤液中含有碱性物质,但是加入的溶液引入了,无法证明NaOH的存在。正确的方法是加入足量的[或]溶液,若产生白色沉淀且滤液中加入酚酞后变红,说明NaOH固体部分变质,若产生白色沉淀但滤液中加入酚酞后不变红,说明NaOH固体完全变质。
D(能)KCl易溶于水,难溶于水,加入足量水溶解,过滤,洗涤滤渣,干燥,得到二氧化锰;对滤液蒸发结晶,得到氯化钾。
11.答案:C
解析:A(×)由降温到时,甲物质的溶解度减小的幅度最大,但没有指明溶液是否饱和,不能确定析出晶体最多的一定是甲的溶液。
B(×)时,乙的溶解度为50 g,即100 g水最多溶解50 g乙,则时,将25 g乙加入50 g水中,恰好形成饱和溶液,所得溶液的溶质质量分数为;再降温到,乙的溶解度减小,有部分溶质析出,所得溶液的溶质质量分数小于33.3%。
C(√)时,甲、乙、丙三种物质的溶解度大小关系为乙>甲=丙,故时,将等质量的甲、乙、丙分别溶于水配成饱和溶液所需水的质量大小关系为乙<甲=丙。
D(×)没有指明饱和溶液的质量,无法确定时甲、乙、丙的饱和溶液中所含溶质的质量大小关系。
12.答案:D
解析:A、因为天然气是可燃物,所以会燃烧,故选项A说法正确;
B、点火是为了使温度达到天然气的着火点,故选项B说法正确;
C、调大进风口的目的是提供足够的空气,使燃烧更充分,故选项C说法正确;
D、关闭开关火焰熄灭,原因是清除了可燃物,故选项D说法错误;
故选:D。
13.答案:C
解析:A(×)需要称量氯化钠的质量为7.5 g,会用到游码,若②中的砝码和药品放反,会使称得的药品的质量偏小,造成所配溶液的溶质质量分数偏小。
B(×)若③中烧杯内壁有水珠,会使溶剂水的量偏多,造成所配溶液的溶质质量分数偏小。
C(√)若④中量取水时俯视读数,会使得量取的水的量偏少,导致所配溶液的溶质质量分数偏大。
D(×)溶液具有均一性,将配好的溶液装瓶时,有少量溶液溅出,对溶液的溶质质量分数无影响。
14.答案:A
解析:A(×)酚酞遇酸性溶液和中性溶液均不变色,图1中两支试管中均无明显现象,无法验证二氧化碳与水发生了反应。
B(√)图2中只有可燃物的种类不同,观察到白磷燃烧而红磷未燃烧,说明红磷的着火点比白磷的高。
C(√)图3中铁片表面有红色固体析出,银片表面无明显现象,可验证金属活动性:Fe>Cu>Ag。
D(√)
15.答案:D
解析:足量的Mg、Al、Fe三种金属与质量分数相同的100 g稀盐酸反应,稀盐酸完全反应时,消耗的稀盐酸的质量相等,参与反应及生成的各物质的质量关系分别为:
A(√)质量分数相同的100 g稀盐酸,溶剂的质量相等且反应前后不变,溶质由反应前的HCl分别变为,参与反应的HCl质量相等,由以上关系可得出:三种生成物的质量大小关系为:,则反应后溶液增加的质量关系为。
B(√)参与反应的金属质量相同时,Fe、Mg、Al消耗的HCl的质量关系为,所以质量相同的三种金属消耗的稀盐酸的质量关系为:Al>Mg>Fe。
C(√)Fe、Mg、Al三种金属的活动性顺序为Mg>Al>Fe,则它们与盐酸反应的速率大小关系为:Mg>Al>Fe,盐酸未完全反应时,镁反应的速率最快,相同的时间内产生氢气的质量最大,铁反应的速率最慢,相同的时间内产生氢气的质量最少。稀盐酸不足时,产生氢气的质量由酸的质量决定,三种金属产生氢气的质量相等。
D(×)反应结束后,三种金属消耗的稀盐酸质量相等,由以上质量关系可得出:完全反应后消耗的金属质量关系为,所以参加反应的Fe的质量最大,Mg次之,Al最小。
16.答案:(1)②(1分)
(2)①(1分)
(3)⑤(1分)
(4)③(1分)
(5)④(1分)
17.答案:(1)C(2分);①②④(2分)
(2)①(2分);(2分);(2分)
②(4分)
解析:(1)题图试管中发生的反应及现象如下:
,固体溶解,有气泡产生。
,黑色固体逐渐溶解,溶液由无色变为蓝色。
,无明显现象。,有气泡产生。,有白色沉淀产生。
要验证C中发生了反应:①滴入酚酞溶液无明显现象,说明试管中已无NaOH,可推断出NaOH与发生了反应,方案可行;②NaOH溶液的pH大于7,若测得试管中溶液的pH小于7,说明试管中已无NaOH,方案可行;③NaOH和反应生成和,但和都能和溶液反应生成白色沉淀,无法判断试管中溶液是否含有,方案不可行;④NaOH和反应生成蓝色沉淀,滴入溶液无蓝色沉淀出现,说明试管中已无NaOH,方案可行。
(2)①将试管A中物质倒入试管E中,产生气泡说明A中Mg粉过量,则试管A中的物质是Mg和;白色沉淀增加说明E中过量,则试管E中的物质是、HCl和沉淀。A与E试管中物质混合发生反应的化学方程式为:,所以步骤2滤液中一定含有,向滤液中逐滴滴加氢氧化钠溶液,开始无明显现象,一段时间后出现白色沉淀,说明滤液中一定有HCl。如果和恰好完全反应,则二者均不存在于滤液中,如有一种物质过量,则存在于滤液中。②产生白色沉淀之前是HCl与NaOH反应生成NaCl和,化学方程式是。
18.答案:(1)试管(2分)
(2)(4分);BD(或BE)(2分)
(3)导管口有气泡连续均匀冒出(2分)
(4)①先变大后变小(2分)
②产生白色沉淀(2分)
③碳酸钙和盐酸反应生成氯化钙,产生的二氧化碳和氢氧化钠反应生成碳酸钠,氯化钙与碳酸钠反应生成碳酸钙沉淀(答出氯化钙与碳酸钠反应即可)(3分)
解析:(2)实验室用高锰酸钾制取氧气,反应物为固体,反应条件为加热,应选择固固加热型发生装置B;氧气不易溶于水且密度比空气的大,可用排水法或向上排空气法收集,收集装置可选择E或D。
(3)若采用E装置排水法收集某种气体,由于刚开始排出的气体是空气,故应待气泡连续均匀冒出时再开始收集。
(4)①将Y形管倾斜,N中的稀盐酸与M中的接触,发生反应生成氯化钙、二氧化碳和水,Y形管内气体增多,压强增大,气球变大;然后向M中注入足量NaOH溶液,二氧化碳与氢氧化钠反应生成碳酸钠和水,Y形管内气体减少,压强减小,气球变小。故整个实验过程中,气球先变大后变小。
19.答案:(1)(2分)
(2)和Fe粉(2分)
(3)②(2分)
(4)(4分)
(5)过滤(2分)
解析:(2)不溶于水,也不与稀硫酸反应,且步骤②中Fe粉过量,故固体C中的物质是和Fe粉。
(3)步骤①中,发生反应:;加入过量铁粉,步骤②中发生反应:。步骤②中铁粉过量,则气体A为氢气,溶液B中的溶质为。步骤③中和是盐和盐之间的反应,属于复分解反应,化学方程式为:,所得固体D为。步骤④中和柠檬酸之间的反应是盐和酸之间的反应,属于复分解反应。只有步骤②中Fe粉与稀硫酸的反应是置换反应。
(5)将柠檬酸亚铁晶体与溶液分离的操作是过滤。
20.答案:(1)解:设该洗涤剂中UP的质量为x(5分)
该洗涤剂中UP的质量分数为
答:该洗涤剂中UP的质量分数为1.88%。
(2)CD(2分)
解析:(1)解析见答案
(2)A.实际称量的洗涤剂样品多于100 g,所得溶液的质量分数偏大,故A错误;
B.实际称量的的多与少不影响溶液质量分数的大小,故B错误;
C.实验前该样品暴露在空气中时间过长会分解,溶质质量减小,溶质质量分数减小,故C正确;
D.实验产生的未完全逸出会导致所计算的UP的质量偏小,质量分数偏小,故D正确。
故选CD。
一、单选题。每小题3分,共45分。
1.井冈山红色研学之旅体验的下列项目中,发生化学变化的是( )
A.稻草编鞋 B.粗布裁衣 C.竹子制筒 D.红米煮饭
2.在“氧气的实验室制取与性质”实验中,下列装置或操作不正确的是( )
A. B. C. D.
3.《天工开物》中记载:“凡石灰经火焚炼为用”。“石灰”主要成分为氧化钙,下列说法错误的是( )
A.“石灰”与石灰石成分相同 B.“石灰”含有钙、氧元素
C.“石灰”与水反应会放热 D.“石灰”可用作干燥剂
4.夏季下雨之前,天气闷热,水中的含氧量降低,养鱼池中的鱼往往会浮出水面。下列有关说法错误的是( )
A.氧气的溶解度会随压强的减小而减小
B.氧气的溶解度会随温度的升高而增大
C.为了增加养鱼池中的含氧量,可以向养鱼池中通入空气
D.为了增加养鱼池中的含氧量,可以把养鱼池的水喷向空中
5.科学思维是化学核心素养的重要组成部分,下列示例说法错误的是( )
A.比较:金刚石和石墨的组成元素相同,故两者的物理性质相同
B.分类:塑料跳绳、橡胶排球和尼龙球网的主要材料均属于合成材料
C.分析:稀有气体用于霓虹灯,因为通电时稀有气体能发出不同颜色的光
D.推理:分子是由原子构成的,所以氧分子是由氧原子构成的
6.向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,烧杯中有关量的变化见下图,其中正确的是( )
A. B.
C. D.
7.分别加热等质量的两种样品,固体质量随温度变化的曲线如下图所示。样品1反应前后各物质的质量如下表。分离出样品1反应后的固体乙,与24.0 g甲混合并加热,固体质量变化曲线与样品1的相同。下列说法正确的是( )
物质 甲 乙 丙 丁
反应前质量/g 24.0 2.0 0 0
反应后质量/g 0 2.0 x 1.9
A.该反应是复分解反应 B.
C.该条件下丙和丁均为气体 D.乙是催化剂
8.用硫酸进行下列实验,存在错误的做法是( )
A.干燥:用浓硫酸作为某些气体的干燥剂
B.稀释:将10 g溶质质量分数为98%的浓硫酸稀释成10%的稀硫酸需加入90 g的水
C.制备:用稀硫酸与锌粒反应来制取氢气
D.除锈:用适量的稀硫酸除去铁钉表面的铁锈
9.下列实验,不能证明氢氧化钠与稀盐酸发生化学反应的是( )
A.向滴有酚酞试液的稀盐酸中,逐滴加入稀氢氧化钠溶液
B.向滴有酚酞试液的稀氢氧化钠溶液中,逐滴加入足量的稀盐酸
C.取稀氢氧化钠溶液和稀盐酸混合后的溶液,蒸干得到白色固体
D.向稀氢氧化钠溶液中逐滴加入足量的稀盐酸,并不断测定混合溶液的pH
10.下列实验方案能达到实验目的的是( )
选项 实验目的 实验方案
A 鉴别硫酸铵和氯化铵 取样,分别加入熟石灰研磨后闻气味
B 除去氯化钠中少量的碳酸钠 加入过量的氯化钙溶液,过滤;滤液蒸发结晶
C 检验氢氧化钠固体部分变质 取样,加入足量氢氧化钡溶液,过滤;滤液中加酚酞
D 分离二氧化锰和氯化钾固体 加入足量水溶解,过滤,洗涤滤渣、干燥;滤液蒸发结晶
A.A B.B C.C D.D
11.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法一定正确的是( )
A.时,等质量的甲、乙、丙的溶液降温到时,析出晶体最多的是甲的溶液
B.时,将25 g乙加入到50 g水中,再降温到,所得溶液的溶质质量分数约为33.3%
C.时,将等质量的甲、乙、丙分别溶于水,配成饱和溶液,所需水的质量大小关系为乙<甲=丙
D.时,甲、乙、丙的饱和溶液中,所含溶质质量的大小关系为:乙>甲=丙
12.使用天然气做饭,点火后,发现炉火火焰呈现黄色,锅底出现黑色,这时就需要调大灶具的进风口:使用完毕,关闭开关,火焰熄灭。下列说法错误的是( )
A.天然气会燃烧,因为它是可燃物
B.点火是为了使温度达到天然气的着火点
C.调大进风口的目的是提供足够的空气,使燃烧更充分
D.关闭开关火焰熄灭,原因是温度降到了着火点以下
13.学校某兴趣小组的同学,在实验室配制50 g溶质质量分数为的氯化钠溶液来选种。溶液的配制过程如下,下列说法正确的是( )
A.若②中的砝码和药品放反,溶液的溶质质量分数会偏大
B.若③中烧杯内壁有水珠,对溶液的溶质质量分数无影响
C.若④中量取水时俯视读数,溶液的溶质质量分数会偏大
D.将配好的溶液装瓶时,有少量溶液溅出,溶液的溶质质量分数会偏小
14.对比实验是进行科学探究的重要方式。下图所示实验均用到了对比的方法。
下列说法错误的是( )
A.图1实验能验证二氧化碳与水发生了反应
B.图2实验能说明红磷的着火点比白磷的高
C.图3实验能验证金属活动性顺序为Fe>Cu>Ag
D.图4实验能说明硝酸铵固体溶于水会吸收热量
15.向三个烧杯中分别放入足量的Mg、Al、Fe粉末,同时加入质量分数相同的100 g稀盐酸,充分反应。反应的有关图像错误的是( )
A. B.
C. D.
二、填空题,共55分。
16.(5分)化学与生活息息相关。请用下列物质的序号填空。
①水
②氖气
③干冰
④熟石灰
⑤活性炭
(1)可用于制作霓虹灯的是_________;
(2)可用作溶剂的是_________;
(3)可用作吸附剂的是_________;
(4)可用于人工降雨的是_________;
(5)可用于改良酸性土壤的是_________。
17.(14分)化学兴趣小组进行稀硫酸化学性质的探究。回答下列问题:
(1)将稀硫酸分别加入上图的试管中,无明显现象的是_______(填字母序号),要证明该试管中已发生了化学反应,以下方案可行的是_______(填数字序号)。
①滴入酚酞溶液无明显现象
②测得试管中溶液的pH小于7
③滴入溶液有白色沉淀出现
④滴入溶液无蓝色沉淀出现
(2)上述实验结束后,化学兴趣小组继续探究。
实验步骤 实验现象
步骤1:将试管A中物质全部倒入试管E中 产生气泡且白色沉淀增加
步骤2:过滤,得到滤液
步骤3:向滤液中逐滴滴加氢氧化钠溶液 开始无明显现象,一段时间后出现白色沉淀
①步骤2滤液中,溶质的所有可能组合是______(填化学式)。
②步骤3中,产生白色沉淀之前,一定会发生的反应的化学方程式是______。
18.(17分)化学是一门以实验为基础的学科。请结合图示回答问题:
(1)仪器①的名称为_______。
(2)实验室用高锰酸钾制取氧气的化学方程式为_______,
应选择的发生装置和收集装置为_______。
(3)若采用E装置收集某种气体,当_______时开始收集。
(4)利用如图装置制取并研究的性质。将Y形管倾斜,使N中试剂流入M中至完全反应,然后向M中注入足量溶液。
①整个实验过程中,气球的变化情况是_______;
②注入足量溶液充分反应后,M中的现象是_______,产生此现象的原因是_______。
19.(12分)柠檬酸亚铁是一种易被吸收的补血剂。利用硫酸厂的废渣(主要含,还有少量)制备柠檬酸亚铁,该工艺流程如图所示,回答下列问题:
资料1:
资料2:不溶于水,也不与稀硫酸反应。
(1)柠檬酸亚铁进入人体肠道后以_______(填阳离子符号)的形式被吸收,达到补血效果。
(2)固体C的成分是_______。
(3)步骤①②③④中涉及置换反应的是_______(填数字序号)。
(4)步骤③中发生反应的化学方程式是_______。
(5)“一系列操作”中,将柠檬酸亚铁晶体与溶液分离的操作是_______。
20.(7分)过氧化尿素(化学式为,简称UP,相对分子质量是94)因其可消毒杀菌而广泛应用于洗涤剂中;UP在空气中或遇水缓慢分解,,能催化该反应,化学方程式如下: ,为测定某品牌洗涤剂中UP的含量,取100 g该洗涤剂样品溶于一定量的水中,再加大2 g ,共产生0.32 g 。
(1)计算该洗涤剂中UP的质量分数(请写出计算过程)
(2)上述实验测定结果比该洗涤到标示的UP质量分数低,可能的原因是________(填字母号)
A.实际称量的洗涤剂样品多于100 g B.实际称量的多于2 g
C.实验前该样品暴露在空气中时间过长 D.实验产生的未完全逸出
答案以及解析
1.答案:D
解析:稻草编鞋、粗布裁衣、竹子制筒过程中都只涉及物质形状的改变,无其他物质生成,属于物理变化。红米煮饭时涉及燃烧、米饭由生变熟的过程,有其他物质生成,属于化学变化。
2.答案:C
解析:氧气的密度比空气大,用向上排空气法收集,收集时导管应伸至集气瓶底部。
3.答案:A
解析:根据题意可知,“石灰”的主要成分是CaO。
A(×)石灰石的主要成分是,两者不同。
B(√)氧化钙由钙、氧两种元素组成。
C(√)氧化钙与水反应,放出大量的热,如常用于自热火锅。
D(√)因氧化钙能与水反应,故可作干燥剂,生活中常用作食品干燥剂。
4.答案:B
解析:
选项 正误 分析
A √ 氧气的溶解度随压强的减小而减小
B × 夏季气温升高,养鱼池中的含氧量减小,养鱼池中的鱼会浮出水面,说明氧气的溶解度随温度的升高而减小
C √ 空气中含有氧气,向养鱼池中通入空气,可以增加养鱼池中的含氧量
D √ 把养鱼池的水喷向空中,增大了水和氧气的接触面积,可以增加养鱼池中的含氧量
5.答案:A
解析:虽然金刚石和石墨都是由碳元素组成的单质,但构成它们的原子排列方式不同,故物理性质差异很大,如金刚石硬度很大,石墨硬度很小;石墨导电性良好,金刚石不导电。
6.答案:C
解析:向盛有一定量氧化铁的烧杯中不断滴入稀硫酸,会发生反应:。横轴代表的是滴入的稀硫酸的质量。
A(×)随着稀硫酸的加入,固体质量不断减小,最后为零。
B(×)氧化铁是固体,随着反应的进行,固体逐渐“溶解”在稀硫酸中,溶液质量增大。反应结束后,溶液质量继续增大。
D(×)随着反应进行,溶液中铁元素的质量逐渐增大,反应结束后,溶液中铁元素的质量不再改变。
A、B、D的正确图像如下:
7.答案:D
解析:A(×)由表格信息可知,该反应过程为:甲丙+丁,则该反应符合“一变多”的特征,属于分解反应。
B(×)由质量守恒定律可知,化学反应前后物质的总质量不变,则。
C(×)由样品2的固体质量变化曲线可知,反应前后,固体质量减少约2.0 g,则该条件下物质丙是固体,物质丁是气体。
D(√)由表格数据可知,反应前后丁的质量不变(为2.0 g),且题干中明确指出“分离出样品1反应后的固体乙,与24.0 g甲混合并加热,固体质量变化曲线与样品1的相同”,说明乙的化学性质在该反应前后未发生改变。对比样品1、2的曲线知,加入乙反应速率更快,则说明乙为该反应的催化剂。
8.答案:B
解析:A(√)浓硫酸具有吸水性,可做某些气体(如等)的干燥剂。
B(×)根据稀释前后,溶液中溶质的质量不变,可知将10 g溶质质量分数为98%的浓硫酸稀释成10%的稀硫酸需加入水的质量为。
C(√)稀硫酸和锌反应生成硫酸锌和氢气,实验室常用稀硫酸和锌粒反应制取氢气。
D(√)铁锈的主要成分是氧化铁,稀硫酸和氧化铁反应生成可溶性的硫酸铁和水,能除去铁钉表面的铁锈。
9.答案:C
解析:向滴有酚酞试液的稀盐酸中,逐滴加入稀氢氧化钠溶液,一开始显无色,说明滴加的氢氧化钠和稀盐酸发生了化学反应;滴有酚酞试液的氢氧化钠溶液显红色,无色酚酞试液遇酸性溶液不变色,遇碱性溶液变红,逐滴滴入稀盐酸,至恰好完全反应,溶液显中性,溶液由红色变为无色,证明盐酸和氢氧化钠发生了化学反应;取稀氢氧化钠溶液和稀盐酸混合后的溶液,蒸干得到白色固体,不能证明氢氧化钠与稀盐酸发生化学反应,稀氢氧化钠溶液蒸干也会得到白色固体;向稀氢氧化钠溶液中逐滴加入足量的稀盐酸,并不断测定混合溶液的pH,溶液的pH由大于7逐渐减小,说明氢氧化钠和稀盐酸发生了化学反应。
10.答案:D
解析:A(不能)和均能与熟石灰反应生成有刺激性气味的,无法达到实验目的。
B(不能)能与反应生成沉淀和NaCl,能除去,但过量的会成为新的杂质。
C(不能)部分变质的NaOH固体中含有和反应生成沉淀和NaOH,有白色沉淀产生,证明样品中含有;滤液中加入酚酞,若溶液变红色,则证明滤液中含有碱性物质,但是加入的溶液引入了,无法证明NaOH的存在。正确的方法是加入足量的[或]溶液,若产生白色沉淀且滤液中加入酚酞后变红,说明NaOH固体部分变质,若产生白色沉淀但滤液中加入酚酞后不变红,说明NaOH固体完全变质。
D(能)KCl易溶于水,难溶于水,加入足量水溶解,过滤,洗涤滤渣,干燥,得到二氧化锰;对滤液蒸发结晶,得到氯化钾。
11.答案:C
解析:A(×)由降温到时,甲物质的溶解度减小的幅度最大,但没有指明溶液是否饱和,不能确定析出晶体最多的一定是甲的溶液。
B(×)时,乙的溶解度为50 g,即100 g水最多溶解50 g乙,则时,将25 g乙加入50 g水中,恰好形成饱和溶液,所得溶液的溶质质量分数为;再降温到,乙的溶解度减小,有部分溶质析出,所得溶液的溶质质量分数小于33.3%。
C(√)时,甲、乙、丙三种物质的溶解度大小关系为乙>甲=丙,故时,将等质量的甲、乙、丙分别溶于水配成饱和溶液所需水的质量大小关系为乙<甲=丙。
D(×)没有指明饱和溶液的质量,无法确定时甲、乙、丙的饱和溶液中所含溶质的质量大小关系。
12.答案:D
解析:A、因为天然气是可燃物,所以会燃烧,故选项A说法正确;
B、点火是为了使温度达到天然气的着火点,故选项B说法正确;
C、调大进风口的目的是提供足够的空气,使燃烧更充分,故选项C说法正确;
D、关闭开关火焰熄灭,原因是清除了可燃物,故选项D说法错误;
故选:D。
13.答案:C
解析:A(×)需要称量氯化钠的质量为7.5 g,会用到游码,若②中的砝码和药品放反,会使称得的药品的质量偏小,造成所配溶液的溶质质量分数偏小。
B(×)若③中烧杯内壁有水珠,会使溶剂水的量偏多,造成所配溶液的溶质质量分数偏小。
C(√)若④中量取水时俯视读数,会使得量取的水的量偏少,导致所配溶液的溶质质量分数偏大。
D(×)溶液具有均一性,将配好的溶液装瓶时,有少量溶液溅出,对溶液的溶质质量分数无影响。
14.答案:A
解析:A(×)酚酞遇酸性溶液和中性溶液均不变色,图1中两支试管中均无明显现象,无法验证二氧化碳与水发生了反应。
B(√)图2中只有可燃物的种类不同,观察到白磷燃烧而红磷未燃烧,说明红磷的着火点比白磷的高。
C(√)图3中铁片表面有红色固体析出,银片表面无明显现象,可验证金属活动性:Fe>Cu>Ag。
D(√)
15.答案:D
解析:足量的Mg、Al、Fe三种金属与质量分数相同的100 g稀盐酸反应,稀盐酸完全反应时,消耗的稀盐酸的质量相等,参与反应及生成的各物质的质量关系分别为:
A(√)质量分数相同的100 g稀盐酸,溶剂的质量相等且反应前后不变,溶质由反应前的HCl分别变为,参与反应的HCl质量相等,由以上关系可得出:三种生成物的质量大小关系为:,则反应后溶液增加的质量关系为。
B(√)参与反应的金属质量相同时,Fe、Mg、Al消耗的HCl的质量关系为,所以质量相同的三种金属消耗的稀盐酸的质量关系为:Al>Mg>Fe。
C(√)Fe、Mg、Al三种金属的活动性顺序为Mg>Al>Fe,则它们与盐酸反应的速率大小关系为:Mg>Al>Fe,盐酸未完全反应时,镁反应的速率最快,相同的时间内产生氢气的质量最大,铁反应的速率最慢,相同的时间内产生氢气的质量最少。稀盐酸不足时,产生氢气的质量由酸的质量决定,三种金属产生氢气的质量相等。
D(×)反应结束后,三种金属消耗的稀盐酸质量相等,由以上质量关系可得出:完全反应后消耗的金属质量关系为,所以参加反应的Fe的质量最大,Mg次之,Al最小。
16.答案:(1)②(1分)
(2)①(1分)
(3)⑤(1分)
(4)③(1分)
(5)④(1分)
17.答案:(1)C(2分);①②④(2分)
(2)①(2分);(2分);(2分)
②(4分)
解析:(1)题图试管中发生的反应及现象如下:
,固体溶解,有气泡产生。
,黑色固体逐渐溶解,溶液由无色变为蓝色。
,无明显现象。,有气泡产生。,有白色沉淀产生。
要验证C中发生了反应:①滴入酚酞溶液无明显现象,说明试管中已无NaOH,可推断出NaOH与发生了反应,方案可行;②NaOH溶液的pH大于7,若测得试管中溶液的pH小于7,说明试管中已无NaOH,方案可行;③NaOH和反应生成和,但和都能和溶液反应生成白色沉淀,无法判断试管中溶液是否含有,方案不可行;④NaOH和反应生成蓝色沉淀,滴入溶液无蓝色沉淀出现,说明试管中已无NaOH,方案可行。
(2)①将试管A中物质倒入试管E中,产生气泡说明A中Mg粉过量,则试管A中的物质是Mg和;白色沉淀增加说明E中过量,则试管E中的物质是、HCl和沉淀。A与E试管中物质混合发生反应的化学方程式为:,所以步骤2滤液中一定含有,向滤液中逐滴滴加氢氧化钠溶液,开始无明显现象,一段时间后出现白色沉淀,说明滤液中一定有HCl。如果和恰好完全反应,则二者均不存在于滤液中,如有一种物质过量,则存在于滤液中。②产生白色沉淀之前是HCl与NaOH反应生成NaCl和,化学方程式是。
18.答案:(1)试管(2分)
(2)(4分);BD(或BE)(2分)
(3)导管口有气泡连续均匀冒出(2分)
(4)①先变大后变小(2分)
②产生白色沉淀(2分)
③碳酸钙和盐酸反应生成氯化钙,产生的二氧化碳和氢氧化钠反应生成碳酸钠,氯化钙与碳酸钠反应生成碳酸钙沉淀(答出氯化钙与碳酸钠反应即可)(3分)
解析:(2)实验室用高锰酸钾制取氧气,反应物为固体,反应条件为加热,应选择固固加热型发生装置B;氧气不易溶于水且密度比空气的大,可用排水法或向上排空气法收集,收集装置可选择E或D。
(3)若采用E装置排水法收集某种气体,由于刚开始排出的气体是空气,故应待气泡连续均匀冒出时再开始收集。
(4)①将Y形管倾斜,N中的稀盐酸与M中的接触,发生反应生成氯化钙、二氧化碳和水,Y形管内气体增多,压强增大,气球变大;然后向M中注入足量NaOH溶液,二氧化碳与氢氧化钠反应生成碳酸钠和水,Y形管内气体减少,压强减小,气球变小。故整个实验过程中,气球先变大后变小。
19.答案:(1)(2分)
(2)和Fe粉(2分)
(3)②(2分)
(4)(4分)
(5)过滤(2分)
解析:(2)不溶于水,也不与稀硫酸反应,且步骤②中Fe粉过量,故固体C中的物质是和Fe粉。
(3)步骤①中,发生反应:;加入过量铁粉,步骤②中发生反应:。步骤②中铁粉过量,则气体A为氢气,溶液B中的溶质为。步骤③中和是盐和盐之间的反应,属于复分解反应,化学方程式为:,所得固体D为。步骤④中和柠檬酸之间的反应是盐和酸之间的反应,属于复分解反应。只有步骤②中Fe粉与稀硫酸的反应是置换反应。
(5)将柠檬酸亚铁晶体与溶液分离的操作是过滤。
20.答案:(1)解:设该洗涤剂中UP的质量为x(5分)
该洗涤剂中UP的质量分数为
答:该洗涤剂中UP的质量分数为1.88%。
(2)CD(2分)
解析:(1)解析见答案
(2)A.实际称量的洗涤剂样品多于100 g,所得溶液的质量分数偏大,故A错误;
B.实际称量的的多与少不影响溶液质量分数的大小,故B错误;
C.实验前该样品暴露在空气中时间过长会分解,溶质质量减小,溶质质量分数减小,故C正确;
D.实验产生的未完全逸出会导致所计算的UP的质量偏小,质量分数偏小,故D正确。
故选CD。
同课章节目录
