1.2.2元素周期律课件(共22张PPT) 人教版(2019)选择性必修2
文档属性
| 名称 | 1.2.2元素周期律课件(共22张PPT) 人教版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 17.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-06 00:00:00 | ||
图片预览



文档简介
(共22张PPT)
第一章
第2节 原子结构与元素的性质
物质的结构
和性质
第2课时 原子结构与元素周期律
知识回顾
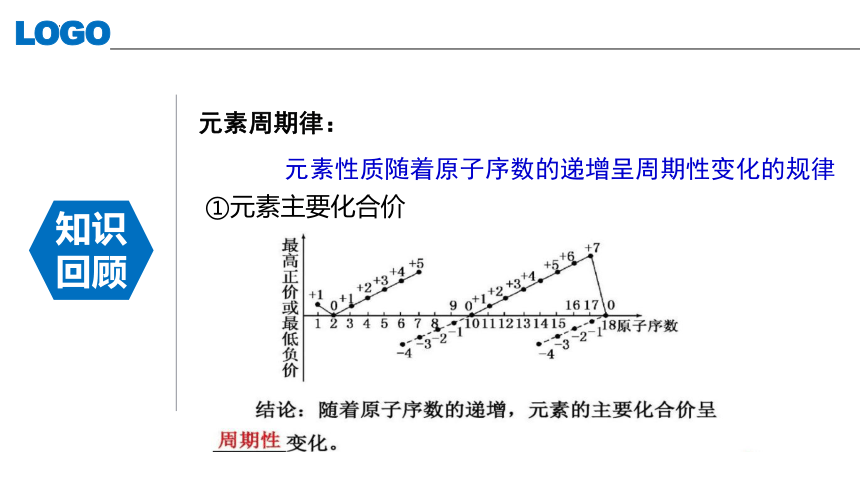
元素周期律:
元素性质随着原子序数的递增呈周期性变化的规律
①元素主要化合价
知识回顾
元素周期律:
元素性质随着原子序数的递增呈周期性变化的规律
②原子半径
知识回顾
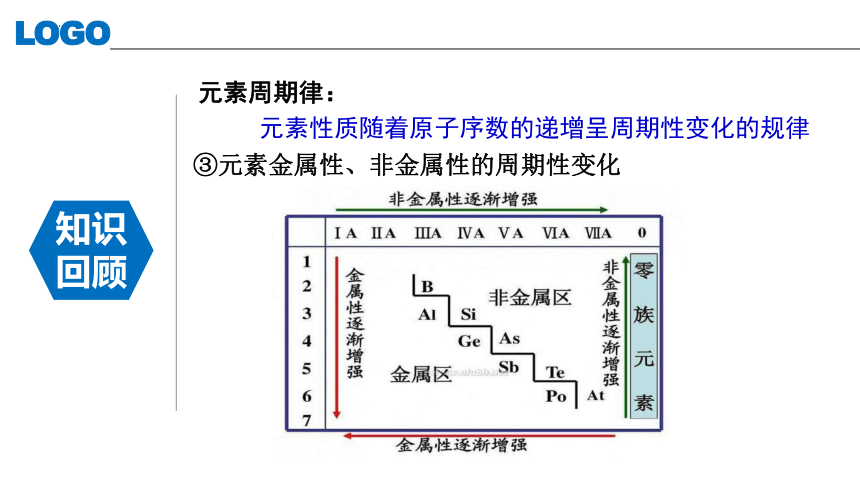
元素周期律:
元素性质随着原子序数的递增呈周期性变化的规律
③元素金属性、非金属性的周期性变化
知识回顾
元素周期律内涵丰富多样,除了以上几点,还有……
位置
性质
结构
战
一
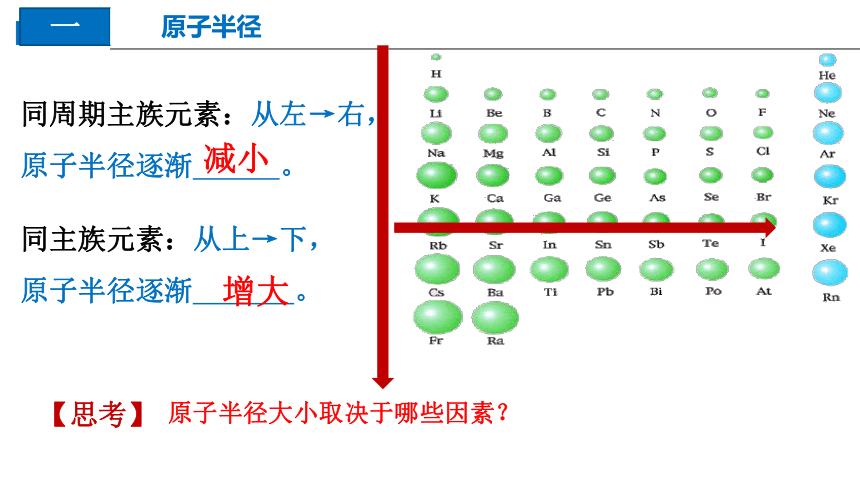
原子半径
原子半径大小取决于哪些因素?
【思考】
同周期主族元素:从左→右,
原子半径逐渐 。
同主族元素:从上→下,
原子半径逐渐 。
增大
减小
战
一
原子半径
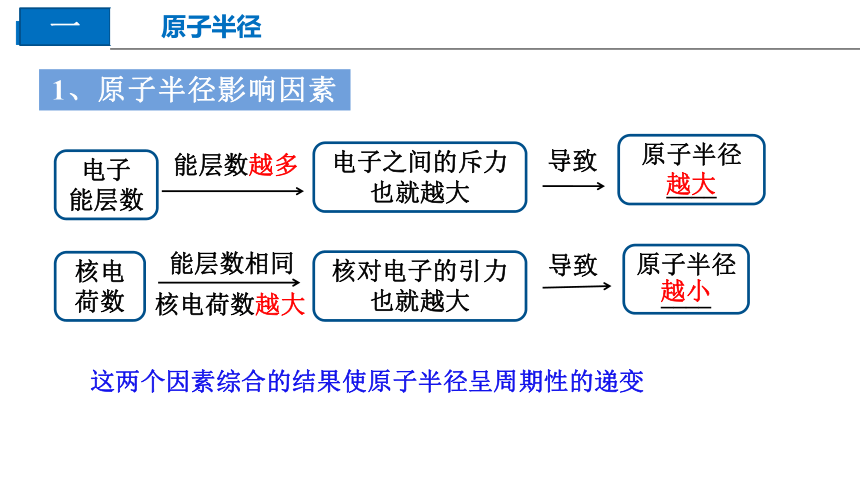
电子
能层数
核电荷数
电子之间的斥力也就越大
核对电子的引力也就越大
原子半径____
原子半径____
能层数越多
能层数相同
核电荷数越大
导致
导致
越大
越小
这两个因素综合的结果使原子半径呈周期性的递变
1、原子半径影响因素
【思考】
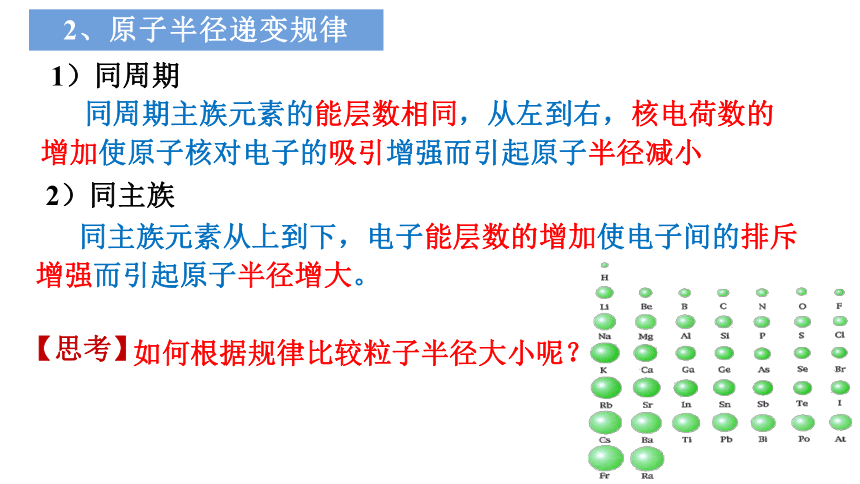
如何根据规律比较粒子半径大小呢?
1)同周期
同主族元素从上到下,电子能层数的增加使电子间的排斥增强而引起原子半径增大。
同周期主族元素的能层数相同,从左到右,核电荷数的增加使原子核对电子的吸引增强而引起原子半径减小
2)同主族
2、原子半径递变规律
战
一
原子半径
微粒半径大小比较方法
一看电子层数
二看核电荷数
三看电子数
一般规律:
(1) 电子层数越多:原子半径越大。
(2) 电子层数相同时:核电核数越大,原子半径越小。
(3) 电子层数、核电荷数都相同时:电子数越多,原子半径越大。
“价高径小”
“ 三看”
战
一
原子半径
1、 四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3
③1s22s22p3 ④1s22s22p5,
则四种原子的半径按由大到小的顺序排列正确的是( )。
A.①>②>③>④ B.②>①>③>④
C.②>①>④>③ D.①>②>④>③
B
战
二
电离能
第一电离能
气态基态电中性原子失去一个电子转化为气态基态正离子所需要的最低能量。
从气态基态一价正离子失去一个电子转化为气态基态二价正离子所需要的最低能量。
第二电离能
第n电离能(In)
……
用符号 I1 表示,单位:kJ /mol 。
M+(g)-e- =M2+(g) I2(第二电离能)
…… ……
表示方法:
M(g)-e-=M+(g) I1(第一电离能)
能量最低的保证条件
思考
讨论
根据下图分析,原子的第一电离能随核电荷数递增有什么规律?
二
电离能
ⅠA族元素I1最低,
零族元素I1最高。
规律1:同周期元素从左到右,第一电离能呈增大趋势
反常ⅡA>ⅢA,ⅤA>ⅥA
第二周期I1大小:Li< B < Be < C< O < N < F第三周期 I1大小:Na 思考
讨论
根据下图分析,原子的第一电离能随核电荷数递增有什么规律?
二
电离能
规律2:同主族元素,从上到下,第一电离能逐渐减小
结论:电离能呈现周期性的递变。
思考
讨论
如何从原子结构角度解释这样的规律?
同周期元素,原子半径逐渐减小,原子核对最外层电子的吸引力逐渐增大,失去电子逐渐减弱,第一电离能逐渐增大。
同主族元素,原子半径逐渐增大,原子核对最外层电子的吸引力逐渐减小,失电子逐渐增强,第一电离能逐渐减小。
二
电离能
思考
讨论
为何ⅡA>ⅢA,ⅤA>ⅥA?
从洪特规则特例方面(主要因素):
Be、Mg的2s、3s能级有2个电子,为全充满的稳定结构,所以第一电离能是Be比B大,Mg比Al大。
二
电离能
通常情况下,当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)、全满(p6、d10、f14)结构时,原子的能量较低,原子更稳定,越难失去一个电子,该元素具有特大的第一电离能。
Be:1s22s2
B:1s22s22p1
Mg:1s22s22p63s2
Al:1s22s22p63s23p1
N、P的2p、3p能级分别有3个电子,为半充满的稳定结构,所以第一电离能是N比O大,P比S大。
N:1s22s22p3
O:1s22s22p4
P:[Ne] 3S23P3
S:[Ne] 3S23P4
电离能的应用
①
第一电离能越小,气态时该原子失去电子越 ,即 ___性越强;
第一电离能越大,气态时该原子失去电子 ,即______性越弱。
容易
金属
金属
越难
第一电离能可以衡量元素的气态原子失去一个电子的难易程度。
下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
(1)你能从表中发现什么规律?为什么会有这种现象?
规律:一个原子的逐级电离能逐渐增大:I1 < I2 < I3 ……,且存在突变现象
二
电离能
思考
讨论
逐级电离能:气态基态一价正离子再失去一个电子成为气态基态二价正离子所需的最低能量叫作第二电离能。依次还有I3、I4.
元素 Na Mg Al
各级 电离能 (kJ·mol-1) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10 540 11 575
13 353 13 630 14 830
16 610 17 995 18 376
20 114 21 703 23 293
4066
713
6282
1239
928
8830
思考
讨论
原子的逐级电离能为什么越来越大,且存在突变现象?
原子失去电子时,首先失去的是能量最高的电子,故第一电离能较小,以后再失去的电子都是能量较低的电子,所需的能量增强;随着电子的逐个失去,阳离子所带的正电荷数越来越大,再要失去一个电子需克服的引力也越来越大,消耗的能量也越来越多,所以原子的逐级电离能越来越大。
随着电子的逐个失去,阳离子核外电子逐渐达到稀有气体的稳定结构,再要失去电子需克服的引力消耗能量更大(突跃变化)
二
电离能
02
这些数据跟钠、镁、铝的化合价有什么联系?
化合价数=电离能突变前电离能组数
二
电离能
电离能的应用
② 判断元素的化合价
Na 1s2 2s22p6 3s1
Mg 1s2 2s22p6 3s2
Al 1s2 2s22p6 3s23p1
Al3+ 1s2 2s22p6
Na+ 1s2 2s22p6
Mg2+ 1s2 2s22p6
元素 Na Mg Al
各级 电离能 (kJ·mol-1) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10 540 11 575
13 353 13 630 14 830
16 610 17 995 18 376
20 114 21 703 23 293
4066
713
6282
1239
928
8830
电离能的应用
①判断元素金属性的强弱
规律:若某元素的In 到In+1发生突变,则该元素的常见化合价为+n价。
②判断元素的化合价(I1、I2……表示各级电离能)
一般地,I1越大,元素的非金属性越强;I1越小,元素的金属性越强。
二
电离能
1.下列各组粒子半径大小的比较错误的是( )
A.K>Na>Li B.Na+>Mg2+>Al3+
C.Mg2+>Na+>F- D.Cl->F->F
C
课堂练习
2.具有下列价电子构型的原子中,第一电离能最小的是( )
A.2s22p4 B.3s23p4
C.4s24p4 D.5s25p4
D
3.某主族元素的第一、二、三、四电离能依次为899 kJ·mol-1、1 757 kJ·mol-1、14 840 kJ·mol-1、18 025 kJ·mol-1,则该元素在元素周期表中位于( )
A.第ⅠA族 B.第ⅡA族
C.第ⅢA族 D.第ⅣA族
B
课堂小结
元素周期律
原子半径
电离能
同周期:从左到右,元素的第一电离能整体趋势_____。
增大
ⅡA>ⅢA ;ⅤA>ⅥA
同主族:从上到下,元素的第一电离能整体趋势_____。
减小
元素的逐级电离能越来越大
同周期:从左→右,原子半径逐渐 。
同主族:从上→下,原子半径逐渐 。
增大
减小
影响因素
1)电子的能层数
2)核电荷数
第一章
第2节 原子结构与元素的性质
物质的结构
和性质
第2课时 原子结构与元素周期律
知识回顾
元素周期律:
元素性质随着原子序数的递增呈周期性变化的规律
①元素主要化合价
知识回顾
元素周期律:
元素性质随着原子序数的递增呈周期性变化的规律
②原子半径
知识回顾
元素周期律:
元素性质随着原子序数的递增呈周期性变化的规律
③元素金属性、非金属性的周期性变化
知识回顾
元素周期律内涵丰富多样,除了以上几点,还有……
位置
性质
结构
战
一
原子半径
原子半径大小取决于哪些因素?
【思考】
同周期主族元素:从左→右,
原子半径逐渐 。
同主族元素:从上→下,
原子半径逐渐 。
增大
减小
战
一
原子半径
电子
能层数
核电荷数
电子之间的斥力也就越大
核对电子的引力也就越大
原子半径____
原子半径____
能层数越多
能层数相同
核电荷数越大
导致
导致
越大
越小
这两个因素综合的结果使原子半径呈周期性的递变
1、原子半径影响因素
【思考】
如何根据规律比较粒子半径大小呢?
1)同周期
同主族元素从上到下,电子能层数的增加使电子间的排斥增强而引起原子半径增大。
同周期主族元素的能层数相同,从左到右,核电荷数的增加使原子核对电子的吸引增强而引起原子半径减小
2)同主族
2、原子半径递变规律
战
一
原子半径
微粒半径大小比较方法
一看电子层数
二看核电荷数
三看电子数
一般规律:
(1) 电子层数越多:原子半径越大。
(2) 电子层数相同时:核电核数越大,原子半径越小。
(3) 电子层数、核电荷数都相同时:电子数越多,原子半径越大。
“价高径小”
“ 三看”
战
一
原子半径
1、 四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3
③1s22s22p3 ④1s22s22p5,
则四种原子的半径按由大到小的顺序排列正确的是( )。
A.①>②>③>④ B.②>①>③>④
C.②>①>④>③ D.①>②>④>③
B
战
二
电离能
第一电离能
气态基态电中性原子失去一个电子转化为气态基态正离子所需要的最低能量。
从气态基态一价正离子失去一个电子转化为气态基态二价正离子所需要的最低能量。
第二电离能
第n电离能(In)
……
用符号 I1 表示,单位:kJ /mol 。
M+(g)-e- =M2+(g) I2(第二电离能)
…… ……
表示方法:
M(g)-e-=M+(g) I1(第一电离能)
能量最低的保证条件
思考
讨论
根据下图分析,原子的第一电离能随核电荷数递增有什么规律?
二
电离能
ⅠA族元素I1最低,
零族元素I1最高。
规律1:同周期元素从左到右,第一电离能呈增大趋势
反常ⅡA>ⅢA,ⅤA>ⅥA
第二周期I1大小:Li< B < Be < C< O < N < F
讨论
根据下图分析,原子的第一电离能随核电荷数递增有什么规律?
二
电离能
规律2:同主族元素,从上到下,第一电离能逐渐减小
结论:电离能呈现周期性的递变。
思考
讨论
如何从原子结构角度解释这样的规律?
同周期元素,原子半径逐渐减小,原子核对最外层电子的吸引力逐渐增大,失去电子逐渐减弱,第一电离能逐渐增大。
同主族元素,原子半径逐渐增大,原子核对最外层电子的吸引力逐渐减小,失电子逐渐增强,第一电离能逐渐减小。
二
电离能
思考
讨论
为何ⅡA>ⅢA,ⅤA>ⅥA?
从洪特规则特例方面(主要因素):
Be、Mg的2s、3s能级有2个电子,为全充满的稳定结构,所以第一电离能是Be比B大,Mg比Al大。
二
电离能
通常情况下,当原子核外电子排布在能量相等的轨道上形成全空(p0、d0、f0)、半满(p3、d5、f7)、全满(p6、d10、f14)结构时,原子的能量较低,原子更稳定,越难失去一个电子,该元素具有特大的第一电离能。
Be:1s22s2
B:1s22s22p1
Mg:1s22s22p63s2
Al:1s22s22p63s23p1
N、P的2p、3p能级分别有3个电子,为半充满的稳定结构,所以第一电离能是N比O大,P比S大。
N:1s22s22p3
O:1s22s22p4
P:[Ne] 3S23P3
S:[Ne] 3S23P4
电离能的应用
①
第一电离能越小,气态时该原子失去电子越 ,即 ___性越强;
第一电离能越大,气态时该原子失去电子 ,即______性越弱。
容易
金属
金属
越难
第一电离能可以衡量元素的气态原子失去一个电子的难易程度。
下表的数据从上到下是钠、镁、铝逐级失去电子的电离能。
(1)你能从表中发现什么规律?为什么会有这种现象?
规律:一个原子的逐级电离能逐渐增大:I1 < I2 < I3 ……,且存在突变现象
二
电离能
思考
讨论
逐级电离能:气态基态一价正离子再失去一个电子成为气态基态二价正离子所需的最低能量叫作第二电离能。依次还有I3、I4.
元素 Na Mg Al
各级 电离能 (kJ·mol-1) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10 540 11 575
13 353 13 630 14 830
16 610 17 995 18 376
20 114 21 703 23 293
4066
713
6282
1239
928
8830
思考
讨论
原子的逐级电离能为什么越来越大,且存在突变现象?
原子失去电子时,首先失去的是能量最高的电子,故第一电离能较小,以后再失去的电子都是能量较低的电子,所需的能量增强;随着电子的逐个失去,阳离子所带的正电荷数越来越大,再要失去一个电子需克服的引力也越来越大,消耗的能量也越来越多,所以原子的逐级电离能越来越大。
随着电子的逐个失去,阳离子核外电子逐渐达到稀有气体的稳定结构,再要失去电子需克服的引力消耗能量更大(突跃变化)
二
电离能
02
这些数据跟钠、镁、铝的化合价有什么联系?
化合价数=电离能突变前电离能组数
二
电离能
电离能的应用
② 判断元素的化合价
Na 1s2 2s22p6 3s1
Mg 1s2 2s22p6 3s2
Al 1s2 2s22p6 3s23p1
Al3+ 1s2 2s22p6
Na+ 1s2 2s22p6
Mg2+ 1s2 2s22p6
元素 Na Mg Al
各级 电离能 (kJ·mol-1) 496 738 578
4562 1451 1817
6912 7733 2745
9543 10 540 11 575
13 353 13 630 14 830
16 610 17 995 18 376
20 114 21 703 23 293
4066
713
6282
1239
928
8830
电离能的应用
①判断元素金属性的强弱
规律:若某元素的In 到In+1发生突变,则该元素的常见化合价为+n价。
②判断元素的化合价(I1、I2……表示各级电离能)
一般地,I1越大,元素的非金属性越强;I1越小,元素的金属性越强。
二
电离能
1.下列各组粒子半径大小的比较错误的是( )
A.K>Na>Li B.Na+>Mg2+>Al3+
C.Mg2+>Na+>F- D.Cl->F->F
C
课堂练习
2.具有下列价电子构型的原子中,第一电离能最小的是( )
A.2s22p4 B.3s23p4
C.4s24p4 D.5s25p4
D
3.某主族元素的第一、二、三、四电离能依次为899 kJ·mol-1、1 757 kJ·mol-1、14 840 kJ·mol-1、18 025 kJ·mol-1,则该元素在元素周期表中位于( )
A.第ⅠA族 B.第ⅡA族
C.第ⅢA族 D.第ⅣA族
B
课堂小结
元素周期律
原子半径
电离能
同周期:从左到右,元素的第一电离能整体趋势_____。
增大
ⅡA>ⅢA ;ⅤA>ⅥA
同主族:从上到下,元素的第一电离能整体趋势_____。
减小
元素的逐级电离能越来越大
同周期:从左→右,原子半径逐渐 。
同主族:从上→下,原子半径逐渐 。
增大
减小
影响因素
1)电子的能层数
2)核电荷数
