课题3 溶液的浓度-(共36张PPT)2023-2024学年九年级化学下册同步优质课件(人教版)
文档属性
| 名称 | 课题3 溶液的浓度-(共36张PPT)2023-2024学年九年级化学下册同步优质课件(人教版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-07 00:00:00 | ||
图片预览







文档简介
(共36张PPT)
课题3
溶液的浓度
第九单元 溶液
PART
01
PART
02
认识溶质质量分数的含义
能根据溶质和溶剂质量,计算溶质质量分数
学习目标
PART
03
能配制一定溶质质量分数的溶液
在两杯等量的水中分别加入1勺糖和2勺糖时,完全溶解后两杯糖水的甜度是不同的,通俗地说就是这两杯糖水的浓度不同。那么,在化学中如何定量地表示溶液的浓稀呢?
温故知新
溶液的组成
(3)溶剂:溶解溶质的物质
(2)溶质:被溶解的物质叫溶质
(溶质可以是固体、气体、液体)
在溶液中: M液=M剂+M质
溶液
(1)溶液的特征:均一、稳定、混合物
一、溶质的质量分数
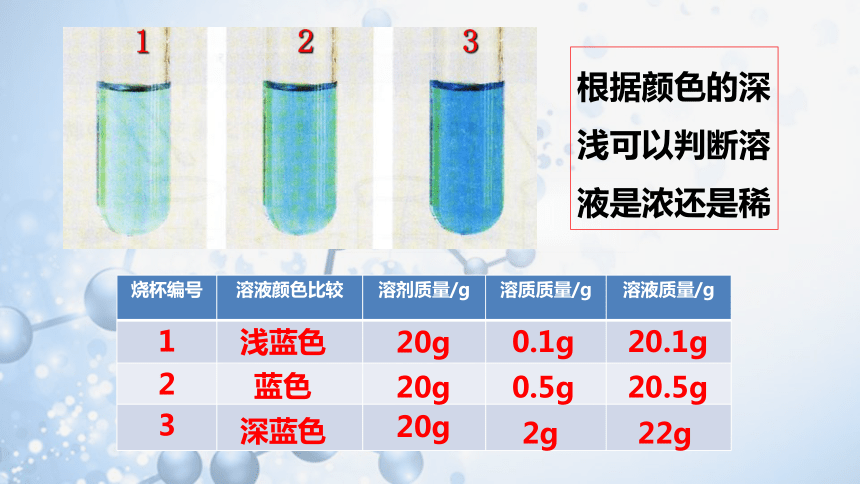
【实验9-7】在室温下,向三个小
烧杯中各加入20 mL水,然后分
别加入0.1 g、0.5 g、2 g无水硫
酸铜,振荡,使硫酸铜全部溶解,
比较三种硫酸铜溶液的颜色。在这
三种溶液中,哪种最浓?哪种溶液最稀?你判断的依据是什么?
烧杯编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g
1
2
3
20g
浅蓝色
蓝色
深蓝色
0.1g
20.1g
20g
0.5g
20.5g
20g
2g
22g
1
2
3
根据颜色的深浅可以判断溶液是浓还是稀
将溶液分为浓溶液和稀溶液,这种分发比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。在实际生活中,常常要准确知道一定量的溶液里所含溶质的量,即溶液的浓度。
生理盐水的浓度为0.9%,是一种无菌的溶液。0.9%的生理盐水是与人体血浆具有相近渗透压的溶液,可以作为静脉注射的基液。高于或低于0.9%的生理盐水作为基液输入人体,会严重危及到患者的生命。
1.溶液浓度的表示方法——溶质的质量分数
(1)概念:溶质质量与溶液质量之比
(2)计算公式:
溶质质量
溶液质量
溶质的质量分数
ⅹ100%
溶质质量
溶质的质量分数
溶液的质量
溶质质量
溶液质量ⅹ溶质的质量分数
练一练
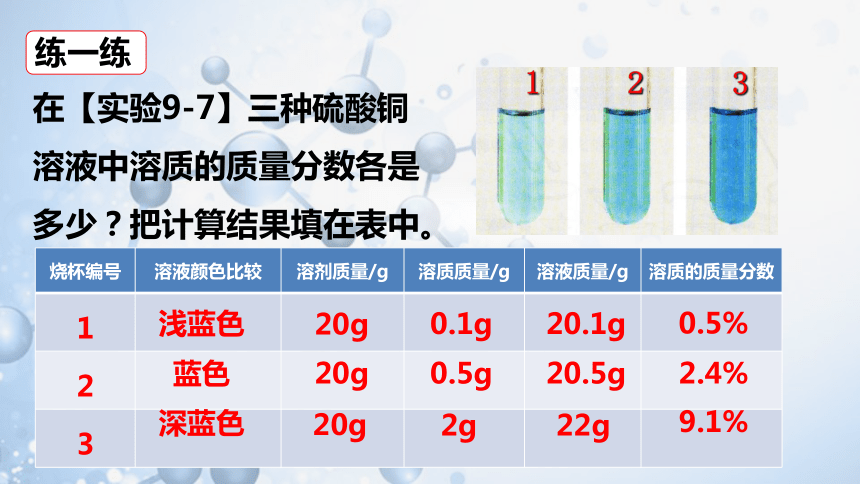
在【实验9-7】三种硫酸铜
溶液中溶质的质量分数各是
多少?把计算结果填在表中。
烧杯编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g 溶质的质量分数
1
2
3
20g
浅蓝色
蓝色
深蓝色
0.1g
20.1g
20g
0.5g
20.5g
20g
2g
22g
0.5%
2.4%
9.1%
1
2
3
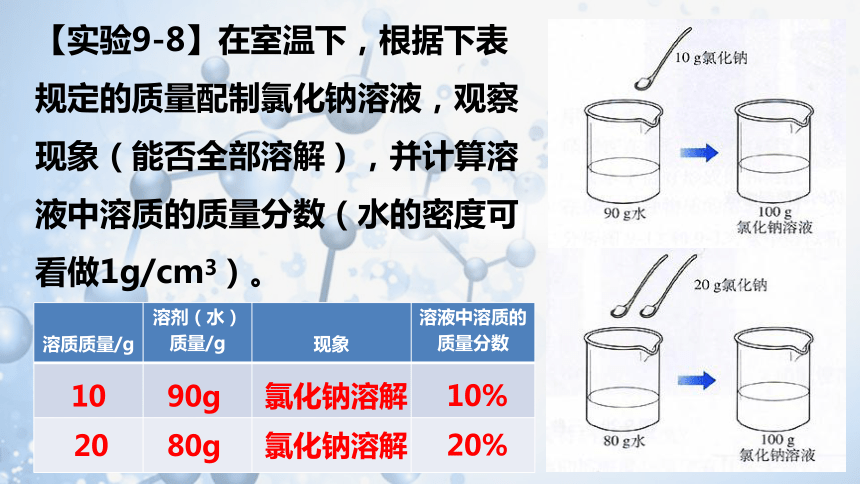
【实验9-8】在室温下,根据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数(水的密度可看做1g/cm3)。
溶质质量/g 溶剂(水) 质量/g 现象 溶液中溶质的
质量分数
90g
10
20
氯化钠溶解
10%
80g
氯化钠溶解
20%
讨论
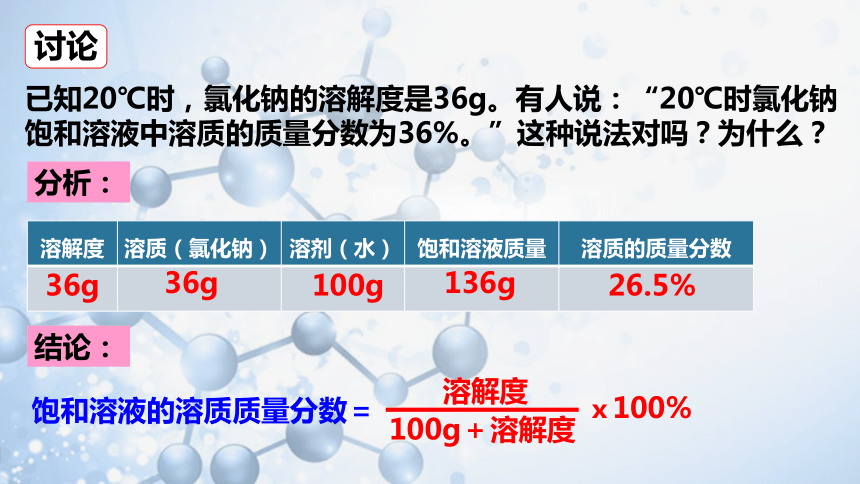
已知20℃时,氯化钠的溶解度是36g。有人说:“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
分析:
饱和溶液的溶质质量分数=
溶解度
100g+溶解度
结论:
溶解度 溶质(氯化钠) 溶剂(水) 饱和溶液质量 溶质的质量分数
36g
36g
100g
136g
26.5%
ⅹ100%
溶质质量 溶剂质量 溶液质量 溶质的质量分数
取出部分溶液
增加溶质
增加溶剂
减少溶质 (降温结晶)
蒸发溶剂
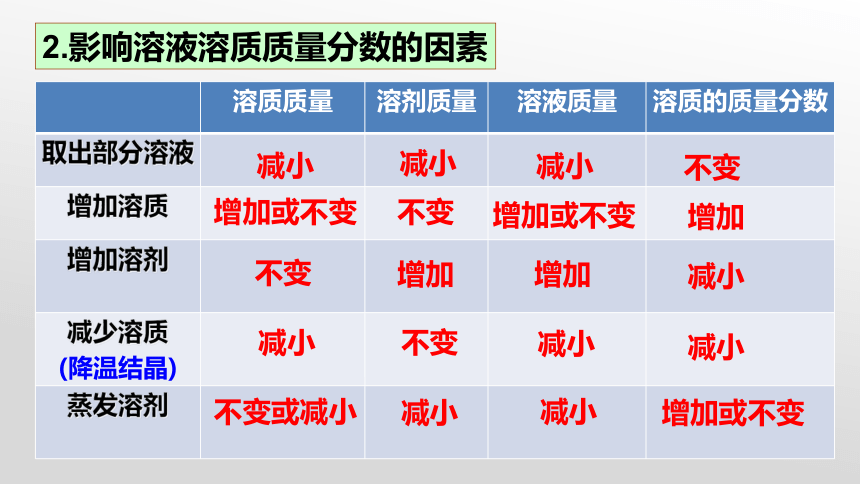
2.影响溶液溶质质量分数的因素
减小
减小
减小
不变
增加或不变
不变
增加或不变
增加
不变
增加
增加
减小
减小
不变
减小
减小
不变或减小
减小
减小
增加或不变
3.饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
饱和溶液
不饱和溶液
稀溶液
(1)不饱和溶液不一定是稀溶液,饱和溶液不一定是浓溶液;
(2)同一种溶质,在一定温度下,饱和溶液比不饱和溶液浓。
浓溶液
二、有关溶质的质量分数的计算
【例题1】在农业生产上,常需要用质量分数为16%的氯化钠溶液选种。现要配制150 kg这种溶液,需要氯化钠和水的质量各是多少?
【题型一】有关溶质、溶剂和溶液之间的换算
提示:溶质质量=溶液质量×溶质质量分数
溶剂质量=溶液质量-溶质质量
溶质质量=溶液质量×溶质的质量分数
=150 kg×16%
=24 kg
溶剂质量=溶液质量—溶质质量
=150 kg-24 kg
=126 kg
答:配制150 kg质量分数为16%的氯化钠溶液需24 kg氯化钠和126 kg水。
溶质质量
溶液质量
解:溶质的质量分数= ×100%
【练习1】若实验需要20g氢氧化钠来吸收有毒的二氧化硫气体,则至少需要10%的氢氧化钠溶液的质量是多少?
解:溶液的质量=溶质的质量÷溶质的质量分数
=20g÷10%=200g
答:至少需要10%的氢氧化钠溶液200g。
【题型二】有关溶液稀释的计算
提示:溶液稀释前后溶质的质量不变
m浓 × a%(浓) =m稀× b%(稀)
m浓 × a%(浓) =(m浓+m水)× b%(稀)
【例题2】化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
50g × 98% = x × 20% x = 245g
需要水的质量=245g-50g=195g
答:需要水的质量为195 g。
方法一
解:设稀释后溶液的质量为x
方法二
解:设需要加水的质量为y
答:需要水的质量为195g
50 g × 98% = ( 50g+ y )× 20%
y=195g
【练习2】将200克20%的KNO3溶液稀释到10%,求:①需加水多少克?
②需加5%的KNO3溶液多少克?
200g × 20% = x × 10% x=400g
需要水的质量=400g-200g=200g
答:需要水的质量为200g。
①解:设稀释后溶液的质量为x
200g×20%+yⅹ5% =(200g+y)ⅹ10% y=400g
答:需要5%KNO3溶液质量为400g。
②解:设需要5%KNO3溶液质量为y
【题型三】溶质的质量分数在化学方程式应用的计算
【例题3】将6.5克锌放入100克稀H2SO4溶液中恰好完全反应,求:
①稀H2SO4溶液中溶质的质量分数为多少?
②所得溶液的溶质的质量分数为多少?
65
6.5g
=
98
x
65
6.5g
=
161
y
65
6.5g
=
2
z
解:设稀H2SO4中溶质的质量为x,ZnSO4质量为y,H2质量为z
Zn + H2SO4 = ZnSO4 + H2↑
65 98 161 2
6.5g x y z
x=9.8g
y=16.1g
9.8g
100g
=9.8%
ⅹ100%
16.1g
6.5g+100g-0.2g
=15.1%
ⅹ100%
z=0.2g
答:稀H2SO4中溶质的质量分数为9.8%,所得溶液的溶质的质量分数为15.1%。
典型例题
【典例1】甲、乙、丙三种固体物质的溶解度
曲线如图所示。下列说法正确的是( )
A.图中P点表示10℃时丙的饱和溶液
B.10℃时,甲、乙、丙三种物质的溶解度,甲的溶解度最大
C.20℃时,甲、乙、丙饱和溶液降温至10℃,甲溶液中析出固体最
D.20℃时,向130g乙的饱和溶液中加入20g水,所得溶液的溶质质量分数变为20%
D
【典例2】农业上需要配制100g质量分数为16%的氯化钠溶液,用来选种,请列式计算:
(1)需要氯化钠和水的质量分别为多少?
(2)若将配制好的溶液加水稀释到8%,需加水的质量为多少?
(1)解:需要氯化钠质量为100g×16%=16g
需要水的质量为100g-16g=84g
答:需要氯化钠和水的质量分别为16g、84g。
(2)解:设需加水的质量为x;
根据溶液稀释前后溶质质量不变,
100g×16%=(x+100g)×8% x=100g
答:需加水的质量为100g。
1. 对“10%的蔗糖溶液”含义的理解错误的是( )
100克水中溶解了10克蔗糖
B. 将5克蔗糖溶解于45克水中所得到的溶液
C. 200克蔗糖溶液中溶解20克蔗糖
D. 将蔗糖与水按1:9的质量比配成的溶液
A
课堂达标
2.从植物“地不容”中提取抑制新冠病毒的新药一千金藤素,需用到5%的Na2CO3溶液。若配制100g该溶液,需要称取Na2CO3的质量为( )
A.95g B.90g
C.20g D.5g
D
3. 20℃时,将45g氯化钠均分成五份,依次加入到盛有100g水的烧杯中,充分溶解。实验数据如下表:
下列分析正确的是( )
A.实验③所得溶液的溶质质量分数最大
B.实验④所得溶液是氯化钠的不饱和溶液
C.20℃时,氯化钠的溶解度为36g/100g 水
D.将实验①所得溶液蒸发50g水,冷却到20℃,溶液达到饱和
C
实验序号 ① ② ③ ④ ⑤
氯化钠质量/g 9 18 27 36 45
溶液质量/g 109 118 127 136 136
4.将100g硝酸钾的不饱和溶液恒温蒸发水分,直至有晶体析出。在此变化过程中,溶液中溶质质量分数(a%)与蒸发时间(t)的变化关系可用下图表示的是( )
A. B.
C. D.
D
5. 氨气的水溶液即为氨水,下列条件下的氨水,其溶质的质量分数最大的是( )
20℃的饱和溶液 B. 20℃的不饱和溶液
C. 80℃的饱和溶液 D. 80℃的不饱和溶液
A
6.为探究硝酸钾的溶解性,进行了如图实验(实验过程如图)
结合硝酸钾在不同温度下的溶解度,判断下列说法不正确的是( )
A.①③中的溶液均为不饱和溶液
B.②③中溶液的质量:③>②
C.②③④中溶液的溶质质量分数:③>②>④
D.④中析出晶体的质量是0.9g
D
温度/℃ 10 20 30 40 50 60
KNO3溶解度/g 20.9 31.6 45.8 63.9 85.5 110.0
7.用MgCl2溶液喷洒路面可融雪、防尘。20℃时,按下表数据配制溶液,回答问题。(已知:20℃时,MgCl2的溶解度为54.6g)
(1)所得溶液中,溶质与溶剂的质量比为1:2的是 。
A.① B.② C.③ D.④
(2)①中溶质的质量分数约为 。
A.23% B.30% C.35% D.43%
(3)所得溶液中,属于饱和溶液的是 。
A.① B.② C.③ D.④
C
A
D
8.甲、乙、丙三种固体物质的溶解度曲线如图所示。
①t1℃时,甲、乙、丙三种物质的溶解度由大到小
的顺序是 ;
②t2℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数最大的是 ;
③将t2℃时的甲、乙、丙三种物质饱和溶液降温至t1℃,所得三种溶液溶质质量分数由大到小的顺序是 。
丙>乙>甲
甲
乙>丙>甲
9.几种固体物质的溶解度曲线
如图所示,请回答下列问题。
(1)在50℃时,硝酸钾的溶解
度 氯化钾的溶解度。(填
“大于”“小于”或“等于”)
(2)使接近饱和的硝酸钾溶液变为饱和溶液的方法是 。(任写一种)
(3)硝酸钾、氯化钾和氢氧化钙中,溶解度随温度升高而减小的是 。
(4)在40℃时,向50g水中加入25g氯化钾,充分溶解后,所得溶液的溶质质量分数是 。(精确到0.1%)
大于
增加溶质
氢氧化钙
28.6%
10.某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,在20℃时,称取5g样品,加入27g水完全溶解后,缓慢加入稀盐酸,至恰好完全反应时,用去10%的稀盐酸36.5g。(该反应的化学方程式为:NaOH+HCl=NaCl+H2O)试计算:
(1)样品中氢氧化钠的质量分数。
(2)反应后所得溶液中溶质的质量分数。
解:10%的稀盐酸36.5g所含HCl的质量10%×36.5g=3.65g
设5g样品中氢氧化钠的质量为x,生成的氯化钠的质量为y
NaOH + HCl = NaCl + H2O
40 36.5 58.5
x 3.65g y
40/x=36.5/3.65g=58.5/y
x=4g y=5.85g
则样品中氢氧化钠的质量分数为4g/5g×100%=80%
氯化钠的质量分数为(5g-4g+5.85g)/(5g+27g+36g)×100%≈10%
答:(1)样品中氢氧化钠的质量分数为80%;
(2)反应后所得溶液中溶质的质量分数约为10%。
课堂小结
溶液浓度的表示方法:溶质的质量分数
1.定义:
2.公式:
溶质的质量与溶液的质量之比。
3.计算:(1)有关溶质、溶剂和溶液之间的换算
(2)有关溶液稀释的计算
(3)溶质的质量分数在化学方程式应用的计算
溶质质量
溶液质量
溶质的质量分数
ⅹ100%
溶质质量
溶质的质量分数
溶液的质量
溶质质量
溶液质量ⅹ溶质的质量分数
课题3
溶液的浓度
第九单元 溶液
PART
01
PART
02
认识溶质质量分数的含义
能根据溶质和溶剂质量,计算溶质质量分数
学习目标
PART
03
能配制一定溶质质量分数的溶液
在两杯等量的水中分别加入1勺糖和2勺糖时,完全溶解后两杯糖水的甜度是不同的,通俗地说就是这两杯糖水的浓度不同。那么,在化学中如何定量地表示溶液的浓稀呢?
温故知新
溶液的组成
(3)溶剂:溶解溶质的物质
(2)溶质:被溶解的物质叫溶质
(溶质可以是固体、气体、液体)
在溶液中: M液=M剂+M质
溶液
(1)溶液的特征:均一、稳定、混合物
一、溶质的质量分数
【实验9-7】在室温下,向三个小
烧杯中各加入20 mL水,然后分
别加入0.1 g、0.5 g、2 g无水硫
酸铜,振荡,使硫酸铜全部溶解,
比较三种硫酸铜溶液的颜色。在这
三种溶液中,哪种最浓?哪种溶液最稀?你判断的依据是什么?
烧杯编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g
1
2
3
20g
浅蓝色
蓝色
深蓝色
0.1g
20.1g
20g
0.5g
20.5g
20g
2g
22g
1
2
3
根据颜色的深浅可以判断溶液是浓还是稀
将溶液分为浓溶液和稀溶液,这种分发比较粗略,不能准确地表明一定量的溶液里究竟含有多少溶质。在实际生活中,常常要准确知道一定量的溶液里所含溶质的量,即溶液的浓度。
生理盐水的浓度为0.9%,是一种无菌的溶液。0.9%的生理盐水是与人体血浆具有相近渗透压的溶液,可以作为静脉注射的基液。高于或低于0.9%的生理盐水作为基液输入人体,会严重危及到患者的生命。
1.溶液浓度的表示方法——溶质的质量分数
(1)概念:溶质质量与溶液质量之比
(2)计算公式:
溶质质量
溶液质量
溶质的质量分数
ⅹ100%
溶质质量
溶质的质量分数
溶液的质量
溶质质量
溶液质量ⅹ溶质的质量分数
练一练
在【实验9-7】三种硫酸铜
溶液中溶质的质量分数各是
多少?把计算结果填在表中。
烧杯编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g 溶质的质量分数
1
2
3
20g
浅蓝色
蓝色
深蓝色
0.1g
20.1g
20g
0.5g
20.5g
20g
2g
22g
0.5%
2.4%
9.1%
1
2
3
【实验9-8】在室温下,根据下表规定的质量配制氯化钠溶液,观察现象(能否全部溶解),并计算溶液中溶质的质量分数(水的密度可看做1g/cm3)。
溶质质量/g 溶剂(水) 质量/g 现象 溶液中溶质的
质量分数
90g
10
20
氯化钠溶解
10%
80g
氯化钠溶解
20%
讨论
已知20℃时,氯化钠的溶解度是36g。有人说:“20℃时氯化钠饱和溶液中溶质的质量分数为36%。”这种说法对吗?为什么?
分析:
饱和溶液的溶质质量分数=
溶解度
100g+溶解度
结论:
溶解度 溶质(氯化钠) 溶剂(水) 饱和溶液质量 溶质的质量分数
36g
36g
100g
136g
26.5%
ⅹ100%
溶质质量 溶剂质量 溶液质量 溶质的质量分数
取出部分溶液
增加溶质
增加溶剂
减少溶质 (降温结晶)
蒸发溶剂
2.影响溶液溶质质量分数的因素
减小
减小
减小
不变
增加或不变
不变
增加或不变
增加
不变
增加
增加
减小
减小
不变
减小
减小
不变或减小
减小
减小
增加或不变
3.饱和溶液、不饱和溶液与浓溶液、稀溶液之间的关系
饱和溶液
不饱和溶液
稀溶液
(1)不饱和溶液不一定是稀溶液,饱和溶液不一定是浓溶液;
(2)同一种溶质,在一定温度下,饱和溶液比不饱和溶液浓。
浓溶液
二、有关溶质的质量分数的计算
【例题1】在农业生产上,常需要用质量分数为16%的氯化钠溶液选种。现要配制150 kg这种溶液,需要氯化钠和水的质量各是多少?
【题型一】有关溶质、溶剂和溶液之间的换算
提示:溶质质量=溶液质量×溶质质量分数
溶剂质量=溶液质量-溶质质量
溶质质量=溶液质量×溶质的质量分数
=150 kg×16%
=24 kg
溶剂质量=溶液质量—溶质质量
=150 kg-24 kg
=126 kg
答:配制150 kg质量分数为16%的氯化钠溶液需24 kg氯化钠和126 kg水。
溶质质量
溶液质量
解:溶质的质量分数= ×100%
【练习1】若实验需要20g氢氧化钠来吸收有毒的二氧化硫气体,则至少需要10%的氢氧化钠溶液的质量是多少?
解:溶液的质量=溶质的质量÷溶质的质量分数
=20g÷10%=200g
答:至少需要10%的氢氧化钠溶液200g。
【题型二】有关溶液稀释的计算
提示:溶液稀释前后溶质的质量不变
m浓 × a%(浓) =m稀× b%(稀)
m浓 × a%(浓) =(m浓+m水)× b%(稀)
【例题2】化学实验室现在有98%的浓硫酸,但在实验中常需要用较稀的硫酸溶液。要把50g质量分数为98%的浓硫酸稀释为质量分数为20%的硫酸溶液,需要多少克水?
50g × 98% = x × 20% x = 245g
需要水的质量=245g-50g=195g
答:需要水的质量为195 g。
方法一
解:设稀释后溶液的质量为x
方法二
解:设需要加水的质量为y
答:需要水的质量为195g
50 g × 98% = ( 50g+ y )× 20%
y=195g
【练习2】将200克20%的KNO3溶液稀释到10%,求:①需加水多少克?
②需加5%的KNO3溶液多少克?
200g × 20% = x × 10% x=400g
需要水的质量=400g-200g=200g
答:需要水的质量为200g。
①解:设稀释后溶液的质量为x
200g×20%+yⅹ5% =(200g+y)ⅹ10% y=400g
答:需要5%KNO3溶液质量为400g。
②解:设需要5%KNO3溶液质量为y
【题型三】溶质的质量分数在化学方程式应用的计算
【例题3】将6.5克锌放入100克稀H2SO4溶液中恰好完全反应,求:
①稀H2SO4溶液中溶质的质量分数为多少?
②所得溶液的溶质的质量分数为多少?
65
6.5g
=
98
x
65
6.5g
=
161
y
65
6.5g
=
2
z
解:设稀H2SO4中溶质的质量为x,ZnSO4质量为y,H2质量为z
Zn + H2SO4 = ZnSO4 + H2↑
65 98 161 2
6.5g x y z
x=9.8g
y=16.1g
9.8g
100g
=9.8%
ⅹ100%
16.1g
6.5g+100g-0.2g
=15.1%
ⅹ100%
z=0.2g
答:稀H2SO4中溶质的质量分数为9.8%,所得溶液的溶质的质量分数为15.1%。
典型例题
【典例1】甲、乙、丙三种固体物质的溶解度
曲线如图所示。下列说法正确的是( )
A.图中P点表示10℃时丙的饱和溶液
B.10℃时,甲、乙、丙三种物质的溶解度,甲的溶解度最大
C.20℃时,甲、乙、丙饱和溶液降温至10℃,甲溶液中析出固体最
D.20℃时,向130g乙的饱和溶液中加入20g水,所得溶液的溶质质量分数变为20%
D
【典例2】农业上需要配制100g质量分数为16%的氯化钠溶液,用来选种,请列式计算:
(1)需要氯化钠和水的质量分别为多少?
(2)若将配制好的溶液加水稀释到8%,需加水的质量为多少?
(1)解:需要氯化钠质量为100g×16%=16g
需要水的质量为100g-16g=84g
答:需要氯化钠和水的质量分别为16g、84g。
(2)解:设需加水的质量为x;
根据溶液稀释前后溶质质量不变,
100g×16%=(x+100g)×8% x=100g
答:需加水的质量为100g。
1. 对“10%的蔗糖溶液”含义的理解错误的是( )
100克水中溶解了10克蔗糖
B. 将5克蔗糖溶解于45克水中所得到的溶液
C. 200克蔗糖溶液中溶解20克蔗糖
D. 将蔗糖与水按1:9的质量比配成的溶液
A
课堂达标
2.从植物“地不容”中提取抑制新冠病毒的新药一千金藤素,需用到5%的Na2CO3溶液。若配制100g该溶液,需要称取Na2CO3的质量为( )
A.95g B.90g
C.20g D.5g
D
3. 20℃时,将45g氯化钠均分成五份,依次加入到盛有100g水的烧杯中,充分溶解。实验数据如下表:
下列分析正确的是( )
A.实验③所得溶液的溶质质量分数最大
B.实验④所得溶液是氯化钠的不饱和溶液
C.20℃时,氯化钠的溶解度为36g/100g 水
D.将实验①所得溶液蒸发50g水,冷却到20℃,溶液达到饱和
C
实验序号 ① ② ③ ④ ⑤
氯化钠质量/g 9 18 27 36 45
溶液质量/g 109 118 127 136 136
4.将100g硝酸钾的不饱和溶液恒温蒸发水分,直至有晶体析出。在此变化过程中,溶液中溶质质量分数(a%)与蒸发时间(t)的变化关系可用下图表示的是( )
A. B.
C. D.
D
5. 氨气的水溶液即为氨水,下列条件下的氨水,其溶质的质量分数最大的是( )
20℃的饱和溶液 B. 20℃的不饱和溶液
C. 80℃的饱和溶液 D. 80℃的不饱和溶液
A
6.为探究硝酸钾的溶解性,进行了如图实验(实验过程如图)
结合硝酸钾在不同温度下的溶解度,判断下列说法不正确的是( )
A.①③中的溶液均为不饱和溶液
B.②③中溶液的质量:③>②
C.②③④中溶液的溶质质量分数:③>②>④
D.④中析出晶体的质量是0.9g
D
温度/℃ 10 20 30 40 50 60
KNO3溶解度/g 20.9 31.6 45.8 63.9 85.5 110.0
7.用MgCl2溶液喷洒路面可融雪、防尘。20℃时,按下表数据配制溶液,回答问题。(已知:20℃时,MgCl2的溶解度为54.6g)
(1)所得溶液中,溶质与溶剂的质量比为1:2的是 。
A.① B.② C.③ D.④
(2)①中溶质的质量分数约为 。
A.23% B.30% C.35% D.43%
(3)所得溶液中,属于饱和溶液的是 。
A.① B.② C.③ D.④
C
A
D
8.甲、乙、丙三种固体物质的溶解度曲线如图所示。
①t1℃时,甲、乙、丙三种物质的溶解度由大到小
的顺序是 ;
②t2℃时,甲、乙、丙三种物质的饱和溶液中,溶质质量分数最大的是 ;
③将t2℃时的甲、乙、丙三种物质饱和溶液降温至t1℃,所得三种溶液溶质质量分数由大到小的顺序是 。
丙>乙>甲
甲
乙>丙>甲
9.几种固体物质的溶解度曲线
如图所示,请回答下列问题。
(1)在50℃时,硝酸钾的溶解
度 氯化钾的溶解度。(填
“大于”“小于”或“等于”)
(2)使接近饱和的硝酸钾溶液变为饱和溶液的方法是 。(任写一种)
(3)硝酸钾、氯化钾和氢氧化钙中,溶解度随温度升高而减小的是 。
(4)在40℃时,向50g水中加入25g氯化钾,充分溶解后,所得溶液的溶质质量分数是 。(精确到0.1%)
大于
增加溶质
氢氧化钙
28.6%
10.某氢氧化钠样品中混有氯化钠,为测定样品中氢氧化钠的质量分数,在20℃时,称取5g样品,加入27g水完全溶解后,缓慢加入稀盐酸,至恰好完全反应时,用去10%的稀盐酸36.5g。(该反应的化学方程式为:NaOH+HCl=NaCl+H2O)试计算:
(1)样品中氢氧化钠的质量分数。
(2)反应后所得溶液中溶质的质量分数。
解:10%的稀盐酸36.5g所含HCl的质量10%×36.5g=3.65g
设5g样品中氢氧化钠的质量为x,生成的氯化钠的质量为y
NaOH + HCl = NaCl + H2O
40 36.5 58.5
x 3.65g y
40/x=36.5/3.65g=58.5/y
x=4g y=5.85g
则样品中氢氧化钠的质量分数为4g/5g×100%=80%
氯化钠的质量分数为(5g-4g+5.85g)/(5g+27g+36g)×100%≈10%
答:(1)样品中氢氧化钠的质量分数为80%;
(2)反应后所得溶液中溶质的质量分数约为10%。
课堂小结
溶液浓度的表示方法:溶质的质量分数
1.定义:
2.公式:
溶质的质量与溶液的质量之比。
3.计算:(1)有关溶质、溶剂和溶液之间的换算
(2)有关溶液稀释的计算
(3)溶质的质量分数在化学方程式应用的计算
溶质质量
溶液质量
溶质的质量分数
ⅹ100%
溶质质量
溶质的质量分数
溶液的质量
溶质质量
溶液质量ⅹ溶质的质量分数
同课章节目录
