第十一单元盐化肥复习题2022----2023学年人教版九年级化学下册(含解析)
文档属性
| 名称 | 第十一单元盐化肥复习题2022----2023学年人教版九年级化学下册(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 387.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-07 00:00:00 | ||
图片预览




文档简介
第十一单元 盐 化肥复习题
一、选择题
1.下列实验方案中,实验设计能达到实验目的是( )
方案 实验目的 实验设计
A 除去氧化钙中少量碳酸钙 加入足量的水,溶 解,过滤
B 检验集气瓶中的气体是否为二氧化碳 将燃着的木条伸入集气瓶中
C 探究稀盐酸与氢氧化钠溶液是否恰好完全反应 向反应后所得的溶液中滴加酚酞溶液
D 鉴别氯化钡、碳酸钾、稀盐酸三种溶液 将组内物质相互混合,观察现象
A.A B.B C.C D.D
2.下列实验方案中,合理的是
A.比较锌和银的活动性:将锌片和银片分别放入硫酸铜溶液中
B.鉴别氢氧化钠和硝酸铵两瓶固体:向瓶内加入足量水,测温度变化
C.除去稀盐酸中的少量硫酸:加入适量的硝酸钡溶液,充分反应后过滤
D.分离Cu(OH)2和NaNO3的固体混合物:取样,加入足量的水溶解,过滤
3.如图表示甲、乙、丙三类物质的相互关系,甲包含全部乙、部分丙及其他物质。下表中符合图示关系的是
选项 甲 乙 丙
A 含金属元素的盐 钠盐 硝酸盐
B 纯净物 单质 化合物
C 氧化物 非金属氧化物 金属氧化物
D 含氢元素的化合物 酸 盐
A.A B.B C.C D.D
4.下列实验方案能达到实验目的的是
选项 实验目的 操作
A 配制100g 6%的稀盐酸 量取5mL浓盐酸(密度1.2g/mL)溶于94g水中
B Na2SO4溶液中混有少量MgSO4 加入Ba(OH)2溶液至不再产生沉淀,过滤
C 分离KCl和BaCl2的混合溶液 加入过量的K2CO3溶液,过滤、洗涤,再分别向滤渣和滤液中加入适量稀盐酸
D 鉴别CH4和H2 分别点燃后在火焰上方罩一只干燥的烧杯
A.A B.B C.C D.D
5.化学肥料对粮食增产起着重要作用,下列属于氮肥的是
A.KCl B.Na2SO4 C.CO(NH2)2 D.Ca(H2PO4)2
6.下列物质的化学式 俗名及所属类别的对应关系正确的一组是
A.Na2CO3、烧碱、盐 B.CO2(固态)、干冰、氧化物
C.Ca(OH)2、生石灰、碱 D.Hg、水银、非金属单质
7.下列化肥属于氮肥的是
A.K2SO4 B.KNO3 C.CO(NH2)2 D.Ca(H2PO4)2
8.如图为a、b、c、d、e五种物质之间的反应关系如图的五环所示,两圆相交表示物质之间能发生反应,下列各组物质中,不能完全符合图示反应的是
a b c d e
A C O2 CO Fe2O3 H2SO4
B KOH CO2 C CuO H2
C Fe HCl AgNO3 Cu CO
D Ca(OH)2 Na2CO3 BaCl2 CuSO4 NaOH
A.A B.B C.C D.D
9.下列图像与对应的叙述不相符的是
A.足量的红磷在密闭容器中燃烧
B.向含等质量HCl的稀盐酸中分别加入Zn和Fe至过量
C.木炭在充满的集气瓶中燃烧
D.向一定量的硫酸和硫酸铜的混合溶液中逐滴加入氢氧化钠溶液
10.下列图像能正确表示对应叙述的是
① 加热一定质量的氯酸钾与二氧化锰固体混合物
② 向CuSO4和H2SO4的混合溶液中逐滴滴加Ba(OH)2溶液
③ 向一定浓度的NaOH溶液中加水稀释
④ 在恒温条件下,将饱和的NaCl溶液蒸发适量水,溶液中溶质质量分数的变化
A.1个 B.2个 C.3个 D.4个
二、科学探究题
11.学习酸碱盐知识后,兴趣小组同学开展了系列探究活动,请你一同参与。
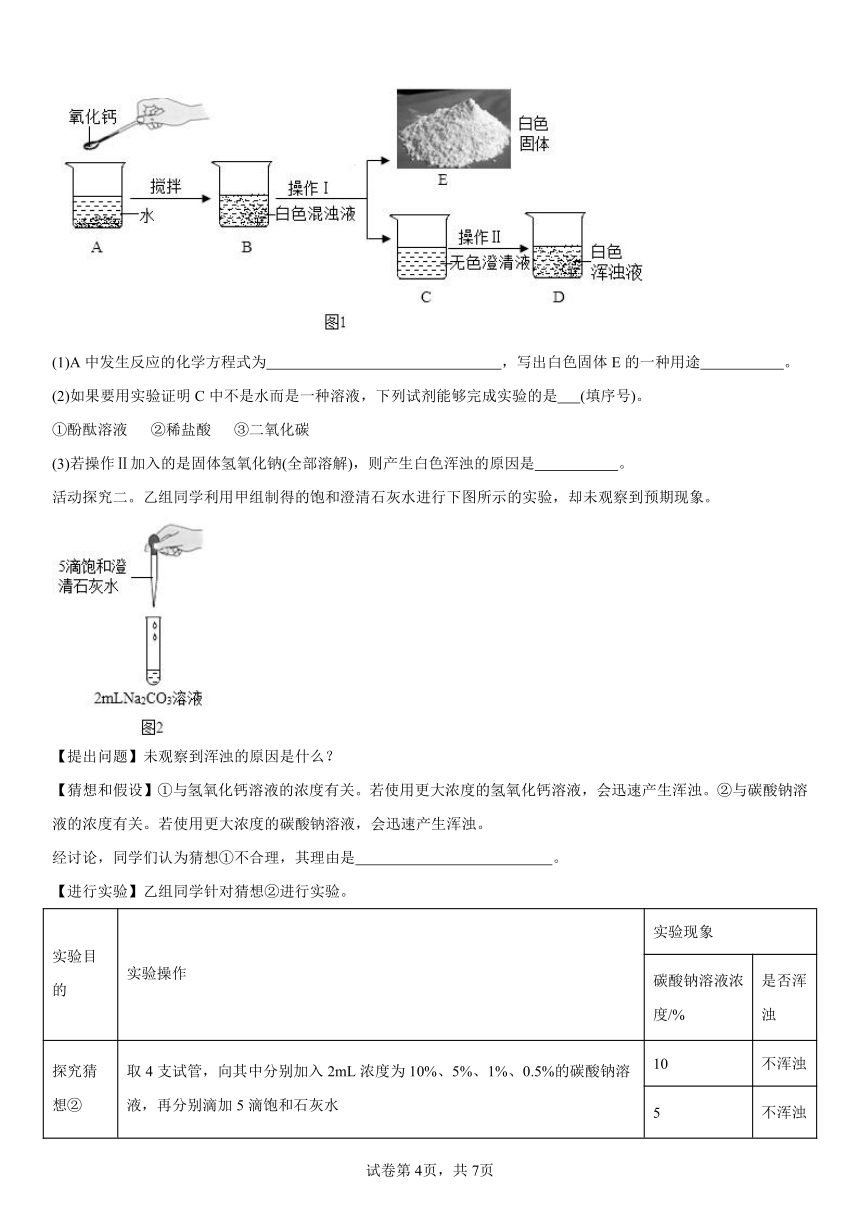
活动探究一。甲组同学为了制取饱和石灰水,利用氧化钙设计了如下实验方案。
(1)A中发生反应的化学方程式为 ,写出白色固体E的一种用途 。
(2)如果要用实验证明C中不是水而是一种溶液,下列试剂能够完成实验的是 (填序号)。
①酚酞溶液 ②稀盐酸 ③二氧化碳
(3)若操作Ⅱ加入的是固体氢氧化钠(全部溶解),则产生白色浑浊的原因是 。
活动探究二。乙组同学利用甲组制得的饱和澄清石灰水进行下图所示的实验,却未观察到预期现象。
【提出问题】未观察到浑浊的原因是什么?
【猜想和假设】①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。
经讨论,同学们认为猜想①不合理,其理由是 。
【进行实验】乙组同学针对猜想②进行实验。
实验目的 实验操作 实验现象
碳酸钠溶液浓度/% 是否浑浊
探究猜想② 取4支试管,向其中分别加入2mL浓度为10%、5%、1%、0.5%的碳酸钠溶液,再分别滴加5滴饱和石灰水 10 不浑浊
5 不浑浊
1 浑浊
0.5 浑浊
【解释与结论】
(1)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是 .
(2)乙组实验证明:猜想② (填“成立”或“不成立”)。
【实验反思】丙组同学对乙组所做实验中未出现浑浊的原因进行探究。设计了多组实验,其中部分同学的实验过程及结果如下:
丙组同学运用的实验方法是 ,得到的结论是 。
三、计算题
12.“庄稼一枝花,全靠肥当家”。有一种新型化肥——硝酸铵钙,其有效成分为NH4NO3和Ca(NO3)2,进入土壤后,都成为可吸收的离子,不会引起土壤板结,且钙离子可提高农作物对病害的抵抗力。
小宁利用某品牌的硝酸铵钙化肥,进行以下实验:取化肥样品8.0g,与足量的NaOH固体充分混合,加热到固体质量不再减少,生成0.17g氨气(NH3)。把反应所得固体溶于适量水中,再加入足量的Na2CO3溶液充分反应,过滤得到沉淀和滤液,测得沉淀质量为4.0g。(已知:NH4NO3+NaOHNaNO3+NH3↑+H2O;化肥中的其它成分不含Ca、N元素,且不参加反应)
(1)计算样品中NH4NO3的质量分数。
(2)计算滤液中NaNO3的质量。
四、填空与简答
13.完成下列反应的化学方程式
(1)小苏打治疗胃酸过多
(2)绿色植物光合作用
(3)稀硫酸除铁锈
(4)铝与氢氧化钠溶液反应产生偏铝酸钠(NaAlO2)和氢气 .
14.为了减轻酸雨的危害,我国研发了“海水法烟气脱硫工艺”.其工艺流程大致是:
I、从高处喷淋下的海水(pH=8.1﹣8.3)洗脱从下而上燃煤烟气中的SO2,(SO2+H2O=H2SO3H2SO3是弱酸),海水变为弱酸性;
Ⅱ、.将洗过烟气后的海水与氧气充分接触,发生下列反应:
4NaCl+O2十2H2SO3═2Na2SO4+4HCl
III.再将与氧气充分接触的海水跟大量天然海水混合等措施,使各项指标接近天然海水后再排放.
(1)、在坐标图中画出“海水法烟气脱硫工艺”全过程中海水的pH依次变化大致趋势 .
(2)、工艺流程中天然海水接触烟气后变为弱酸性,这说明在此过程中海水中的 离子和H2SO3电离出的氢离子发生了反应.
(3)、若要测定海水中Na2SO4含量,实验操作步骤是:
取少量被测海水,测定 、加入足量的 溶液(写化学式)、再加入稀硝酸、过滤、洗涤、烘干、称量沉淀质量.
15.从微观角度研究物质的变化才能揭示变化的本质。
(1)如图甲所示,上面集气瓶中装有空气,下面瓶中装有红棕色气体二氧化氮,当抽去中间玻璃片,一段时间后变成图乙,图甲到图乙属于 (填“物理”或“化学”)变化。根据图2解释由金刚石变为石墨的过程属于 (填“物理”或“化学”)变化。
(2)图3是用扫描隧道显微镜获得的苯分子图像,从微观的角度可以获得的信息是 。
(3)请在图4的方框内画出相应的微粒模型图 。由此可以得出化学变化的实质是 。
(4)根据图5另写一个与该反应的微观实质相同的化学方程式 。
16.现代生活中能源、材料、环保、食品等问题越来越引起人们的重视。请从化学的视角分析回答下列有关问题。
(1)化石燃料包括煤、石油和 ,它们都是属于 (“可再生”或“不可再生”)能源。
(2)野炊食谱如下:主食:馒头;配菜:红烧肉、豆腐汤、牛肉干。从营养学角度来看,你认为食谱中还应添加下列食品中的______(填字母序号)。
A.炒鸡蛋 B.牛奶 C.黄瓜 D.糖醋肉
(3)化肥对提高农作物产量具有重要作用,化肥材料中硝酸钾属于 (填“氮肥”“钾肥”或“磷肥”或“复合肥”)。
(4)测定某工业水样的酸碱度,应用 ;某印染厂排放的废水因含有氢氧化钙而呈碱性,可加硫酸进行处理,请写出发生反应的化学方程式 。
17.按要求用正确的化学用语填空。
(1)改良酸性土壤的物质 ;
(2)生理盐水中的盐 ;
(3)治疗胃酸过多的盐 ;
(4)保持过氧化氢化学性质的微粒 。
18.如图所示是六种物质(两种已经标出)间的反应及转化关系,用“一”表示两种物质能发生化学反应,用“→”表示一种物质可以通过一步反应转化为另一种物质。A、B、C、D四种物质中,A、B、C都含有相同的金属元素,且分别属于不同类别的化合物,其中A为一种黑色固体,B为一种蓝色固体,D物质为一种无色盐溶液。
(1)请在①②③④处写出字母序号和相应物质的化学式:① ;② ;③ ;④ 。
(2)写出③→②反应的化学方程式: 。
19.无水溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:完成下列填空:
(1)上述使用的氢溴酸(HBr)的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸,所需的玻璃仪器有玻璃棒、烧杯、 。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0,将Al3+、Fe3+分别转化成沉淀而除去,写出沉淀的化学式 。
(3)试剂b的作用 ,写出发生的化学反应方程式 。
(4)步骤Ⅴ所含的操作依次是 、降温结晶、过滤。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】
方案 实验目的 实验设计
A 除去氧化钙中少量碳酸钙 加入足量的水,氧化钙与水反应生成氢氧化钙,碳酸钙不溶解,无法通过溶解、过滤除去,故A错误;
B 检验集气瓶中的气体是否为二氧化碳 将燃着的木条伸入集气瓶中,木条熄灭,不一定是二氧化碳,氮气也可以使燃着的木条熄灭,故B错误;
C 探究稀盐酸与氢氧化钠溶液是否恰好完全反应 向反应后所得的溶液中滴加酚酞溶液,遇酸不变色,遇碱变红,无法确定酸是否过量,故C错误;
D 鉴别氯化钡、碳酸钾、稀盐酸三种溶液 将组内物质相互混合,观察现象,碳酸钾与稀盐酸反应生成二氧化碳气体,与氯化钡反应生成碳酸钡白色沉淀,稀盐酸有刺激性气味,故D正确。
点睛∶除杂原则⑴杂质尽量除净,⑵在除去一种杂质的同时不应增添新的杂质,⑶在除去杂质的同时,非杂物质不应过多消耗,但质量可以增加。
2.A
【详解】A. 比较锌和银的活动性:将锌片和银片分别放入硫酸铜溶液中。锌可置换铜,银不可。故A正确。B. 鉴别氢氧化钠和硝酸铵两瓶固体:不应向瓶内加足量水,应各取少量,加水,测温度变化。氢氧化钠溶于水放热,硝酸铵溶于水吸热。故B错误。C. 除去稀盐酸中的少量硫酸:加入适量的氯化钡溶液,充分反应后过滤。故C错误。D. 分离Cu(OH)2和NaNO3的固体混合物:取样,加入足量的水溶解,过滤,蒸发结晶。故D错误。
点睛:本题主要考查金属活动性,溶解时能量变化,除杂等知识。
3.D
【详解】A、钠盐属于含金属元素的盐,硝酸盐与含金属元素的盐属于交叉关系,钠盐和硝酸盐是并列关系,如硝酸钠既是钠盐,又是硝酸盐,错误;
B、纯净物包括单质和化合物,错误;
C、氧化物包括酸性氧化物和碱性氧化物,错误;
D、酸属于含氢的化合物,有些盐含有氢元素,正确;
故选: D。
4.C
【详解】A、浓盐酸的质量为5mL×1.2g/mL=6g,所含溶质的质量小于6g,则量取5mL浓盐酸(密度1.2g/mL)溶于94g水中,所得溶液中溶质质量分数小于6%,故选项实验方案不能达到实验目的;
B、Na2SO4溶液、MgSO4均能与Ba(OH)2溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项实验方案不能达到实验目的;
C、加入过量的K2CO3溶液,碳酸钾能与BaCl2反应生成碳酸钡沉淀和氯化钾,过滤、洗涤,再分别向滤渣和滤液中加入适量稀盐酸,碳酸钡能与稀盐酸反应生成氯化钡、水和二氧化碳,过量的碳酸钾能与稀盐酸反应生成氯化钾、水和二氧化碳,能进行分离,故选项实验方案能达到实验目的;
D、甲烷燃烧生成二氧化碳和水,氢气燃烧生成水,故分别点燃后在火焰上方罩一只干燥的烧杯,均有水雾出现,现象相同,无法区分,故选项实验方案不能达到实验目的。
故选A。
5.C
【详解】含有氮元素的肥料称为氮肥,含有磷元素的肥料称为磷肥,含有钾元素的肥料称为钾肥,同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥。
A、KCl中含有钾元素,属于钾肥,故选项错误;
B、Na2SO4中不含氮、磷、钾三种元素,不能作化学肥料,故选项错误;
C、CO(NH2)2中含有氮元素,属于氮肥,故选项正确;
D、Ca(H2PO4)2中含有磷元素,属于磷肥,故选项正确。
点睛:确定化肥中营养元素的种类、化肥的分类方法是正确解答此类题的关键。
6.B
【详解】A、碳酸钠俗称纯碱、苏打,其化学式为Na2CO3,是由钠离子和碳酸根离子构成的化合物,属于盐,对应关系错误;
B、固态的二氧化碳俗称干冰,是由两种元素组成的化合物,且其中一种元素为氧元素,属于氧化物,对应关系正确;
C、氢氧化钙俗称消石灰,化学式为:Ca(OH)2,是由金属离子与氢氧根离子构成的化合物,属于碱,对应关系错误;
D、汞俗称水银,是一种金属单质,对应关系错误。
故选:B。
7.C
【详解】A、硫酸钾含钾一种营养元素,属于钾肥,不符合题意;
B、硝酸钾含K、N两种营养元素,属于复合肥,不符合题意;
C、尿素含氮一种营养元素,属于氮肥,符合题意;
D、磷酸二氢钙含磷一种营养元素,属于磷肥,不符合题意。
故选C。
8.C
【详解】A、碳和氧气在点燃的条件下生成二氧化碳,氧气和一氧化碳在点燃的条件下生成二氧化碳,一氧化碳和氧化铁在高温的条件下生铁和二氧化碳,氧化铁和硫酸反应生成硫酸铁和水来,完全符合图示反应,故选项正确,不符合题意;
B、氢氧化钾和二氧化碳反应生成碳酸钾和水,二氧化碳和碳在高温的条件下生成一氧化碳,碳和氧化铜在高温的条件下生成铜和二氧化碳,氧化铜和氢气在加热的条件下生成铜和水,完全符合图示反应,故选项正确,不符合题意;
C、铁和盐酸反应生成氯化亚铁和氢气,盐酸和硝酸银反应生成氯化银沉淀和硝酸,硝酸银和铜反应生成硝酸铜和银,铜和一氧化碳不反应,不完全符合图示反应,故选项错误,符合题意;
D、氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,氯化钡和硫酸铜反应生成硫酸钡沉淀和氯化铜,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,完全符合图示反应,故选项正确,不符合题意。
故选:C。
9.A
【详解】A、红磷燃烧放热,温度升高,装置中的压强增大,后随着红磷燃烧消耗氧气,则冷却后装置中的气体减少,压强应小于原来的气压,该选项不正确;
B、最终消耗盐酸的质量相同,则产生氢气的质量相同,又由于、,则刚开始时,消耗的等质量的锌和铁时,铁产生氢气较多,该选项正确;
C、碳燃烧放热,装置中温度升高,反应结束后装置中的温度慢慢降低,该选项正确;
D、向硫酸和硫酸铜的混合溶液中加入氢氧化钠,氢氧化钠先与硫酸反应生成硫酸钠和水,由于,溶质质量增大,后硫酸铜和氢氧化钠反应生成硫酸钠和氢氧化铜沉淀,由于反应过程中硫酸铜质量不断减小,则溶质质量减小,反应结束后,由于氢氧化钠溶液的不断增加,溶质质量不断增大,该选项正确。
故选A。
10.A
【详解】①加热一定质量的氯酸钾与二氧化锰固体混合物,氯酸钾在二氧化锰的催化下受热分解生成氯化钾和氧气,固体质量减小,二氧化锰是催化剂,质量不变,故固体中二氧化锰的质量分数逐渐增大,待完全反应后,不再变化,正确;
②向CuSO4和H2SO4的混合溶液中逐滴滴加Ba(OH)2溶液,氢氧化钡与稀硫酸反应生成的硫酸钡难溶于酸,一开始就有沉淀生成,错误;
③向一定浓度的NaOH溶液中加水稀释,氢氧化钠溶液被稀释,pH逐渐减小至无限接近于7,但是不会等于7,甚至小于7,错误;
④在恒温条件下,将饱和的NaCl溶液蒸发适量水,还是饱和溶液,温度不变,饱和溶液的溶质质量分数不变,错误。
正确的个数是1个。
故选A。
11. CaO+H2O=Ca(OH)2 改良酸性土壤 ①③ 固体氢氧化钠溶解放出热量,氢氧化钙的溶解度随温度的升高而减小 饱和石灰水已是该温度下质量分数最大的溶液 Ca(OH)2+Na2CO3====CaCO3↓+2NaOH 不成立 对比试验,排除水的干扰 未观察到浑浊的原因与碳酸钠溶液的浓度有关
【详解】(1)氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2,氢氧化钙属于常见的碱,可以用来改良酸性土壤;(2)酚酞遇碱变红色,二氧化碳和氢氧化钙会生成碳酸钙沉淀,盐酸和氢氧化钙反应没有明显现象,氯化钠不会与氢氧化钙反应,故选①③;(3)氢氧化钙的溶解度随温度的升高而减小,由于固体氢氧化钠溶解放出热量,白色固体的化学式是Ca(OH)2;【猜想和假设】与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊,猜想错误,因为饱和石灰水已是该温度下质量分数最大的溶液;【解释与结论】(1) 氢氧化钙溶液与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式是:Ca(OH)2+Na2CO3====CaCO3↓+2NaOH;(2) 乙组实验证明:猜想②不成立;碳酸钠溶液浓度在0.5 10%的范围内,能否出现浑浊与碳酸钠溶液的浓度有关,其关系是碳酸钠溶液浓度大,不易产生浑浊;(3) 丙组同学运用的实验方法是对比试验,排除水的干扰,得到的结论是:未观察到浑浊的原因与碳酸钠溶液的浓度有关。
12.(1)解:样品中含有硝酸铵的质量为x,生成硝酸钠的质量为y
x=0.8g
y=0.85g
则样品中NH4NO3的质量分数为=10%
答:样品中NH4NO3的质量分数为10%。
(2)解:设硝酸钙和碳酸钠反应生成硝酸钠的质量为z
z=6.8g
则滤液中NaNO3的质量为0.85g+6.8g=7.65g
答:滤液中NaNO3的质量为7.65g。
【详解】(1)根据氨气的质量结合反应的方程式计算硝酸铵的质量,还有生成的硝酸钠的质量,进而计算硝酸铵的质量分数;详解见答案。
(2)根据碳酸钙的质量结合反应的方程式计算硝酸钠的质量。再算出两个反应生成的硝酸钠的总质量;详解见答案。
【点睛】本题主要考查化学方程式的书写及利用化学方程式计算,有一定难度。
13.(1)
(2)
(3)
(4)
【详解】(1)小苏打是碳酸氢钠的俗称,胃酸主要是盐酸,二者反应生成氯化钠、水和二氧化碳,化学方程式为:
(2)绿色植物的光合作用是二氧化碳和水在光照下合成氧气与葡萄糖,反应的化学方程式为:
(3)铁锈的主要成分是氧化铁,氧化铁和稀硫酸反应生成硫酸铁和水,化学方程式为:
(4)铝与氢氧化钠溶液反应产生偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为:
14. 氢氧根 被测海水质量 BaCl2
【详解】(1)由海水变为弱酸性即PH值越来越小;再结合全过程中海水的pH依次变化大即PH值又开始变大,就可以做出答案;
(2)海水(pH=8.1﹣8.3)说明显碱性,即含有氢氧根离子;
(3)测定海水中Na2SO4含量,首先需要知道海水总质量,再根据与氯化钡反应生成沉淀的质量算出硫酸钠的质量.
15.(1) 物理 化学
(2)分子间有间隙
(3) 分子分成原子,原子重新结合成新的分子
(4)
【详解】(1)图甲到图乙是空气和二氧化氮混合的过程,微观上分子互相运动到对方的间隔中,而分子本身没变,没有新物质生成属于物理变化,故填:物理;
金刚石和石墨的碳原子排列方式不同,虽都由碳原子构成但属于不同物质,故由金刚石变为石墨的过程有新物质生成,属于化学变化,故填:化学;
(2)如图所示,从微观的角度可以获得的信息是:分子间有间隙;
(3)由质量守恒定律反应前后原子的种类及数目不变可知,反应时水分子分解出4个氢原子,根据水通电分解出氢气和氧气,故在图4的方框内应画出两个氢分子,故填:;
由微粒的变化可知,化学变化的实质是:分子分成原子,原子重新结合成新的分子。
(4)由图5微粒的变化可知,该反应的实质是铜离子和氢氧根离子结合生成了氢氧化铜沉淀,则氯化铜与氢氧化钾的反应与该反应的微观实质相同,氯化铜和氢氧化钾反应生成氢氧化铜沉淀和氯化钾,化学方程式是:。
16.(1) 天然气 不可再生
(2)C
(3)复合肥
(4) pH试纸或pH计
【详解】(1)三大化石燃料包括煤、石油和天然气,它们都是属于不可再生能源。
(2)馒头主要富含糖类,红烧肉、豆腐汤、牛肉干富含蛋白质和油脂,还差维生素。而给的选项中,炒鸡蛋,牛奶,富含蛋白质,糖醋肉富含脂肪,黄瓜含有维生素。所以选C
(3)硝酸钾含有营养元素N、P、K中的N和K,所以属于复合肥。
(4)测定酸碱度常用pH试纸,精确测量也可用pH计。氢氧化钙与硫酸反应生成硫酸钙和水,反应的化学方程式为。
17. Ca(OH)2 NaCl NaHCO3 H2O2
【详解】(1)改良酸性土壤的物质为熟石灰氢氧化钙Ca(OH)2;
(2)生理盐水中的盐是指氯化钠NaCl
(3)小苏打碳酸氢钠NaHCO3可以和胃酸盐酸反应,可用于治疗胃酸过多;
(4)分子是保持物质化学性质的基本粒子,保持过氧化氢化学性质的微粒是过氧化氢分子H2O2。
18.(1) D、AgNO3 B、Cu(OH)2 C、CuCl2 A、CuO
(2)
【分析】根据B为一种蓝色固体,结合初中阶段所学知识,推断B为难溶于水的氢氧化铜;由于A、B、C都含有相同的金属元素,故都含铜元素,因为氧化铜为黑色固体,所以A为氧化铜;因为A、B、C分别属于不同类别的化合物,而A为氧化铜、B为氢氧化铜,所以C为铜盐。根据题中六种物质间的反应及转化关系,因为铜和氧气反应生成氧化铜,氧化铜和一氧化碳等还原剂反应生成铜,氧化铜和盐酸等酸反应能生成可溶性铜盐,可溶性铜盐和铁等排在铜前面的金属反应生成铜,所以④为氧化铜,③为可溶性铜盐;因为③是盐酸转化而来,所以③为氯化铜;又因为氢氧化铜可以和盐酸反应,和氯化铜可以相互转化,所以②为氢氧化铜;因为无色的硝酸银溶液和盐酸、铜、氯化铜都能反应,所以①为硝酸银溶液(即D物质)。
【详解】(1)根据分析,①处为无色的硝酸银溶液,字母序号为:D,化学式为:AgNO3;②处物质为氢氧化铜,字母序号为:B,化学式为:Cu(OH)2;③处物质为氯化铜,字母序号为:C,化学式为:CuCl2;④处物质为氧化铜,字母序号为:A,化学式为:CuO。
(2)氯化铜和氢氧化钠反应生成氢氧化铜和氯化钠,反应的化学方程式为:。(合理即可)
19. 量筒和胶头滴管 Ca(OH)2 Al(OH)3、Fe(OH)3 除去过量的Ca(OH)2 Ca(OH)2 + 2HBr = CaBr2 + 2H2O 蒸发浓缩
【详解】(1)若用47%的氢溴酸配置26%的氢溴酸,属于浓溶液的稀释问题,稀释溶液所需的玻璃仪器有玻璃棒、烧杯、量筒和胶头滴管。需要计算好加水的体积和浓溶液的体积,量取一定量的液体体积需要用到玻璃仪器有:量筒和胶头滴管。故填:量筒和胶头滴管。
(2)步骤Ⅰ中加入的氢溴酸是过量的,所以步骤Ⅱ中的溶液是酸性的,加入的试剂a后,控制溶液的pH约为8.0,能将Al3+、Fe3+分别转化成沉淀而除去,所以a是碱,同时不能引入新杂质,所以a是氢氧化钙(石灰水);将Al3+、Fe3+分别转化成氢氧化铝和氢氧化铁沉淀,所以沉淀的化学式为Al(OH)3、Fe(OH)3。故填:Ca(OH)2;Al(OH)3、Fe(OH)3。
(3)步骤Ⅱ中的溶液是酸性的,加入的试剂a(氢氧化钙)过量,所以步骤Ⅲ的滤液中含有氢氧化钙,加入试剂b目的除去氢氧化钙还不能引入新杂质,故b是适量的氢溴酸。氢溴酸与氢氧化钙反应生成溴化钙和水,反应方程式为:Ca(OH)2 + 2HBr = CaBr2 + 2H2O。故填:除去过量的Ca(OH)2;Ca(OH)2 + 2HBr = CaBr2 + 2H2O。
(4)步骤Ⅳ加入适量氢溴酸后得到的是不含其它溶质的溴化钙溶液,步骤Ⅴ经过蒸发浓缩、降温结晶、过滤,可以得到溴化钙晶体。故填:蒸发浓缩。
答案第1页,共2页
答案第1页,共2页
一、选择题
1.下列实验方案中,实验设计能达到实验目的是( )
方案 实验目的 实验设计
A 除去氧化钙中少量碳酸钙 加入足量的水,溶 解,过滤
B 检验集气瓶中的气体是否为二氧化碳 将燃着的木条伸入集气瓶中
C 探究稀盐酸与氢氧化钠溶液是否恰好完全反应 向反应后所得的溶液中滴加酚酞溶液
D 鉴别氯化钡、碳酸钾、稀盐酸三种溶液 将组内物质相互混合,观察现象
A.A B.B C.C D.D
2.下列实验方案中,合理的是
A.比较锌和银的活动性:将锌片和银片分别放入硫酸铜溶液中
B.鉴别氢氧化钠和硝酸铵两瓶固体:向瓶内加入足量水,测温度变化
C.除去稀盐酸中的少量硫酸:加入适量的硝酸钡溶液,充分反应后过滤
D.分离Cu(OH)2和NaNO3的固体混合物:取样,加入足量的水溶解,过滤
3.如图表示甲、乙、丙三类物质的相互关系,甲包含全部乙、部分丙及其他物质。下表中符合图示关系的是
选项 甲 乙 丙
A 含金属元素的盐 钠盐 硝酸盐
B 纯净物 单质 化合物
C 氧化物 非金属氧化物 金属氧化物
D 含氢元素的化合物 酸 盐
A.A B.B C.C D.D
4.下列实验方案能达到实验目的的是
选项 实验目的 操作
A 配制100g 6%的稀盐酸 量取5mL浓盐酸(密度1.2g/mL)溶于94g水中
B Na2SO4溶液中混有少量MgSO4 加入Ba(OH)2溶液至不再产生沉淀,过滤
C 分离KCl和BaCl2的混合溶液 加入过量的K2CO3溶液,过滤、洗涤,再分别向滤渣和滤液中加入适量稀盐酸
D 鉴别CH4和H2 分别点燃后在火焰上方罩一只干燥的烧杯
A.A B.B C.C D.D
5.化学肥料对粮食增产起着重要作用,下列属于氮肥的是
A.KCl B.Na2SO4 C.CO(NH2)2 D.Ca(H2PO4)2
6.下列物质的化学式 俗名及所属类别的对应关系正确的一组是
A.Na2CO3、烧碱、盐 B.CO2(固态)、干冰、氧化物
C.Ca(OH)2、生石灰、碱 D.Hg、水银、非金属单质
7.下列化肥属于氮肥的是
A.K2SO4 B.KNO3 C.CO(NH2)2 D.Ca(H2PO4)2
8.如图为a、b、c、d、e五种物质之间的反应关系如图的五环所示,两圆相交表示物质之间能发生反应,下列各组物质中,不能完全符合图示反应的是
a b c d e
A C O2 CO Fe2O3 H2SO4
B KOH CO2 C CuO H2
C Fe HCl AgNO3 Cu CO
D Ca(OH)2 Na2CO3 BaCl2 CuSO4 NaOH
A.A B.B C.C D.D
9.下列图像与对应的叙述不相符的是
A.足量的红磷在密闭容器中燃烧
B.向含等质量HCl的稀盐酸中分别加入Zn和Fe至过量
C.木炭在充满的集气瓶中燃烧
D.向一定量的硫酸和硫酸铜的混合溶液中逐滴加入氢氧化钠溶液
10.下列图像能正确表示对应叙述的是
① 加热一定质量的氯酸钾与二氧化锰固体混合物
② 向CuSO4和H2SO4的混合溶液中逐滴滴加Ba(OH)2溶液
③ 向一定浓度的NaOH溶液中加水稀释
④ 在恒温条件下,将饱和的NaCl溶液蒸发适量水,溶液中溶质质量分数的变化
A.1个 B.2个 C.3个 D.4个
二、科学探究题
11.学习酸碱盐知识后,兴趣小组同学开展了系列探究活动,请你一同参与。
活动探究一。甲组同学为了制取饱和石灰水,利用氧化钙设计了如下实验方案。
(1)A中发生反应的化学方程式为 ,写出白色固体E的一种用途 。
(2)如果要用实验证明C中不是水而是一种溶液,下列试剂能够完成实验的是 (填序号)。
①酚酞溶液 ②稀盐酸 ③二氧化碳
(3)若操作Ⅱ加入的是固体氢氧化钠(全部溶解),则产生白色浑浊的原因是 。
活动探究二。乙组同学利用甲组制得的饱和澄清石灰水进行下图所示的实验,却未观察到预期现象。
【提出问题】未观察到浑浊的原因是什么?
【猜想和假设】①与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊。②与碳酸钠溶液的浓度有关。若使用更大浓度的碳酸钠溶液,会迅速产生浑浊。
经讨论,同学们认为猜想①不合理,其理由是 。
【进行实验】乙组同学针对猜想②进行实验。
实验目的 实验操作 实验现象
碳酸钠溶液浓度/% 是否浑浊
探究猜想② 取4支试管,向其中分别加入2mL浓度为10%、5%、1%、0.5%的碳酸钠溶液,再分别滴加5滴饱和石灰水 10 不浑浊
5 不浑浊
1 浑浊
0.5 浑浊
【解释与结论】
(1)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是 .
(2)乙组实验证明:猜想② (填“成立”或“不成立”)。
【实验反思】丙组同学对乙组所做实验中未出现浑浊的原因进行探究。设计了多组实验,其中部分同学的实验过程及结果如下:
丙组同学运用的实验方法是 ,得到的结论是 。
三、计算题
12.“庄稼一枝花,全靠肥当家”。有一种新型化肥——硝酸铵钙,其有效成分为NH4NO3和Ca(NO3)2,进入土壤后,都成为可吸收的离子,不会引起土壤板结,且钙离子可提高农作物对病害的抵抗力。
小宁利用某品牌的硝酸铵钙化肥,进行以下实验:取化肥样品8.0g,与足量的NaOH固体充分混合,加热到固体质量不再减少,生成0.17g氨气(NH3)。把反应所得固体溶于适量水中,再加入足量的Na2CO3溶液充分反应,过滤得到沉淀和滤液,测得沉淀质量为4.0g。(已知:NH4NO3+NaOHNaNO3+NH3↑+H2O;化肥中的其它成分不含Ca、N元素,且不参加反应)
(1)计算样品中NH4NO3的质量分数。
(2)计算滤液中NaNO3的质量。
四、填空与简答
13.完成下列反应的化学方程式
(1)小苏打治疗胃酸过多
(2)绿色植物光合作用
(3)稀硫酸除铁锈
(4)铝与氢氧化钠溶液反应产生偏铝酸钠(NaAlO2)和氢气 .
14.为了减轻酸雨的危害,我国研发了“海水法烟气脱硫工艺”.其工艺流程大致是:
I、从高处喷淋下的海水(pH=8.1﹣8.3)洗脱从下而上燃煤烟气中的SO2,(SO2+H2O=H2SO3H2SO3是弱酸),海水变为弱酸性;
Ⅱ、.将洗过烟气后的海水与氧气充分接触,发生下列反应:
4NaCl+O2十2H2SO3═2Na2SO4+4HCl
III.再将与氧气充分接触的海水跟大量天然海水混合等措施,使各项指标接近天然海水后再排放.
(1)、在坐标图中画出“海水法烟气脱硫工艺”全过程中海水的pH依次变化大致趋势 .
(2)、工艺流程中天然海水接触烟气后变为弱酸性,这说明在此过程中海水中的 离子和H2SO3电离出的氢离子发生了反应.
(3)、若要测定海水中Na2SO4含量,实验操作步骤是:
取少量被测海水,测定 、加入足量的 溶液(写化学式)、再加入稀硝酸、过滤、洗涤、烘干、称量沉淀质量.
15.从微观角度研究物质的变化才能揭示变化的本质。
(1)如图甲所示,上面集气瓶中装有空气,下面瓶中装有红棕色气体二氧化氮,当抽去中间玻璃片,一段时间后变成图乙,图甲到图乙属于 (填“物理”或“化学”)变化。根据图2解释由金刚石变为石墨的过程属于 (填“物理”或“化学”)变化。
(2)图3是用扫描隧道显微镜获得的苯分子图像,从微观的角度可以获得的信息是 。
(3)请在图4的方框内画出相应的微粒模型图 。由此可以得出化学变化的实质是 。
(4)根据图5另写一个与该反应的微观实质相同的化学方程式 。
16.现代生活中能源、材料、环保、食品等问题越来越引起人们的重视。请从化学的视角分析回答下列有关问题。
(1)化石燃料包括煤、石油和 ,它们都是属于 (“可再生”或“不可再生”)能源。
(2)野炊食谱如下:主食:馒头;配菜:红烧肉、豆腐汤、牛肉干。从营养学角度来看,你认为食谱中还应添加下列食品中的______(填字母序号)。
A.炒鸡蛋 B.牛奶 C.黄瓜 D.糖醋肉
(3)化肥对提高农作物产量具有重要作用,化肥材料中硝酸钾属于 (填“氮肥”“钾肥”或“磷肥”或“复合肥”)。
(4)测定某工业水样的酸碱度,应用 ;某印染厂排放的废水因含有氢氧化钙而呈碱性,可加硫酸进行处理,请写出发生反应的化学方程式 。
17.按要求用正确的化学用语填空。
(1)改良酸性土壤的物质 ;
(2)生理盐水中的盐 ;
(3)治疗胃酸过多的盐 ;
(4)保持过氧化氢化学性质的微粒 。
18.如图所示是六种物质(两种已经标出)间的反应及转化关系,用“一”表示两种物质能发生化学反应,用“→”表示一种物质可以通过一步反应转化为另一种物质。A、B、C、D四种物质中,A、B、C都含有相同的金属元素,且分别属于不同类别的化合物,其中A为一种黑色固体,B为一种蓝色固体,D物质为一种无色盐溶液。
(1)请在①②③④处写出字母序号和相应物质的化学式:① ;② ;③ ;④ 。
(2)写出③→②反应的化学方程式: 。
19.无水溴化钙可用作阻燃剂、制冷剂,具有易溶于水,易吸潮等性质。实验室用工业大理石(含有少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下:完成下列填空:
(1)上述使用的氢溴酸(HBr)的质量分数为26%,若用47%的氢溴酸配置26%的氢溴酸,所需的玻璃仪器有玻璃棒、烧杯、 。
(2)已知步骤Ⅲ的滤液中不含NH4+。步骤Ⅱ加入的试剂a是 ,控制溶液的pH约为8.0,将Al3+、Fe3+分别转化成沉淀而除去,写出沉淀的化学式 。
(3)试剂b的作用 ,写出发生的化学反应方程式 。
(4)步骤Ⅴ所含的操作依次是 、降温结晶、过滤。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】
方案 实验目的 实验设计
A 除去氧化钙中少量碳酸钙 加入足量的水,氧化钙与水反应生成氢氧化钙,碳酸钙不溶解,无法通过溶解、过滤除去,故A错误;
B 检验集气瓶中的气体是否为二氧化碳 将燃着的木条伸入集气瓶中,木条熄灭,不一定是二氧化碳,氮气也可以使燃着的木条熄灭,故B错误;
C 探究稀盐酸与氢氧化钠溶液是否恰好完全反应 向反应后所得的溶液中滴加酚酞溶液,遇酸不变色,遇碱变红,无法确定酸是否过量,故C错误;
D 鉴别氯化钡、碳酸钾、稀盐酸三种溶液 将组内物质相互混合,观察现象,碳酸钾与稀盐酸反应生成二氧化碳气体,与氯化钡反应生成碳酸钡白色沉淀,稀盐酸有刺激性气味,故D正确。
点睛∶除杂原则⑴杂质尽量除净,⑵在除去一种杂质的同时不应增添新的杂质,⑶在除去杂质的同时,非杂物质不应过多消耗,但质量可以增加。
2.A
【详解】A. 比较锌和银的活动性:将锌片和银片分别放入硫酸铜溶液中。锌可置换铜,银不可。故A正确。B. 鉴别氢氧化钠和硝酸铵两瓶固体:不应向瓶内加足量水,应各取少量,加水,测温度变化。氢氧化钠溶于水放热,硝酸铵溶于水吸热。故B错误。C. 除去稀盐酸中的少量硫酸:加入适量的氯化钡溶液,充分反应后过滤。故C错误。D. 分离Cu(OH)2和NaNO3的固体混合物:取样,加入足量的水溶解,过滤,蒸发结晶。故D错误。
点睛:本题主要考查金属活动性,溶解时能量变化,除杂等知识。
3.D
【详解】A、钠盐属于含金属元素的盐,硝酸盐与含金属元素的盐属于交叉关系,钠盐和硝酸盐是并列关系,如硝酸钠既是钠盐,又是硝酸盐,错误;
B、纯净物包括单质和化合物,错误;
C、氧化物包括酸性氧化物和碱性氧化物,错误;
D、酸属于含氢的化合物,有些盐含有氢元素,正确;
故选: D。
4.C
【详解】A、浓盐酸的质量为5mL×1.2g/mL=6g,所含溶质的质量小于6g,则量取5mL浓盐酸(密度1.2g/mL)溶于94g水中,所得溶液中溶质质量分数小于6%,故选项实验方案不能达到实验目的;
B、Na2SO4溶液、MgSO4均能与Ba(OH)2溶液反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故选项实验方案不能达到实验目的;
C、加入过量的K2CO3溶液,碳酸钾能与BaCl2反应生成碳酸钡沉淀和氯化钾,过滤、洗涤,再分别向滤渣和滤液中加入适量稀盐酸,碳酸钡能与稀盐酸反应生成氯化钡、水和二氧化碳,过量的碳酸钾能与稀盐酸反应生成氯化钾、水和二氧化碳,能进行分离,故选项实验方案能达到实验目的;
D、甲烷燃烧生成二氧化碳和水,氢气燃烧生成水,故分别点燃后在火焰上方罩一只干燥的烧杯,均有水雾出现,现象相同,无法区分,故选项实验方案不能达到实验目的。
故选A。
5.C
【详解】含有氮元素的肥料称为氮肥,含有磷元素的肥料称为磷肥,含有钾元素的肥料称为钾肥,同时含有氮、磷、钾三种元素中的两种或两种以上的肥料称为复合肥。
A、KCl中含有钾元素,属于钾肥,故选项错误;
B、Na2SO4中不含氮、磷、钾三种元素,不能作化学肥料,故选项错误;
C、CO(NH2)2中含有氮元素,属于氮肥,故选项正确;
D、Ca(H2PO4)2中含有磷元素,属于磷肥,故选项正确。
点睛:确定化肥中营养元素的种类、化肥的分类方法是正确解答此类题的关键。
6.B
【详解】A、碳酸钠俗称纯碱、苏打,其化学式为Na2CO3,是由钠离子和碳酸根离子构成的化合物,属于盐,对应关系错误;
B、固态的二氧化碳俗称干冰,是由两种元素组成的化合物,且其中一种元素为氧元素,属于氧化物,对应关系正确;
C、氢氧化钙俗称消石灰,化学式为:Ca(OH)2,是由金属离子与氢氧根离子构成的化合物,属于碱,对应关系错误;
D、汞俗称水银,是一种金属单质,对应关系错误。
故选:B。
7.C
【详解】A、硫酸钾含钾一种营养元素,属于钾肥,不符合题意;
B、硝酸钾含K、N两种营养元素,属于复合肥,不符合题意;
C、尿素含氮一种营养元素,属于氮肥,符合题意;
D、磷酸二氢钙含磷一种营养元素,属于磷肥,不符合题意。
故选C。
8.C
【详解】A、碳和氧气在点燃的条件下生成二氧化碳,氧气和一氧化碳在点燃的条件下生成二氧化碳,一氧化碳和氧化铁在高温的条件下生铁和二氧化碳,氧化铁和硫酸反应生成硫酸铁和水来,完全符合图示反应,故选项正确,不符合题意;
B、氢氧化钾和二氧化碳反应生成碳酸钾和水,二氧化碳和碳在高温的条件下生成一氧化碳,碳和氧化铜在高温的条件下生成铜和二氧化碳,氧化铜和氢气在加热的条件下生成铜和水,完全符合图示反应,故选项正确,不符合题意;
C、铁和盐酸反应生成氯化亚铁和氢气,盐酸和硝酸银反应生成氯化银沉淀和硝酸,硝酸银和铜反应生成硝酸铜和银,铜和一氧化碳不反应,不完全符合图示反应,故选项错误,符合题意;
D、氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,氯化钡和硫酸铜反应生成硫酸钡沉淀和氯化铜,硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,完全符合图示反应,故选项正确,不符合题意。
故选:C。
9.A
【详解】A、红磷燃烧放热,温度升高,装置中的压强增大,后随着红磷燃烧消耗氧气,则冷却后装置中的气体减少,压强应小于原来的气压,该选项不正确;
B、最终消耗盐酸的质量相同,则产生氢气的质量相同,又由于、,则刚开始时,消耗的等质量的锌和铁时,铁产生氢气较多,该选项正确;
C、碳燃烧放热,装置中温度升高,反应结束后装置中的温度慢慢降低,该选项正确;
D、向硫酸和硫酸铜的混合溶液中加入氢氧化钠,氢氧化钠先与硫酸反应生成硫酸钠和水,由于,溶质质量增大,后硫酸铜和氢氧化钠反应生成硫酸钠和氢氧化铜沉淀,由于反应过程中硫酸铜质量不断减小,则溶质质量减小,反应结束后,由于氢氧化钠溶液的不断增加,溶质质量不断增大,该选项正确。
故选A。
10.A
【详解】①加热一定质量的氯酸钾与二氧化锰固体混合物,氯酸钾在二氧化锰的催化下受热分解生成氯化钾和氧气,固体质量减小,二氧化锰是催化剂,质量不变,故固体中二氧化锰的质量分数逐渐增大,待完全反应后,不再变化,正确;
②向CuSO4和H2SO4的混合溶液中逐滴滴加Ba(OH)2溶液,氢氧化钡与稀硫酸反应生成的硫酸钡难溶于酸,一开始就有沉淀生成,错误;
③向一定浓度的NaOH溶液中加水稀释,氢氧化钠溶液被稀释,pH逐渐减小至无限接近于7,但是不会等于7,甚至小于7,错误;
④在恒温条件下,将饱和的NaCl溶液蒸发适量水,还是饱和溶液,温度不变,饱和溶液的溶质质量分数不变,错误。
正确的个数是1个。
故选A。
11. CaO+H2O=Ca(OH)2 改良酸性土壤 ①③ 固体氢氧化钠溶解放出热量,氢氧化钙的溶解度随温度的升高而减小 饱和石灰水已是该温度下质量分数最大的溶液 Ca(OH)2+Na2CO3====CaCO3↓+2NaOH 不成立 对比试验,排除水的干扰 未观察到浑浊的原因与碳酸钠溶液的浓度有关
【详解】(1)氧化钙和水反应生成氢氧化钙,化学方程式为:CaO+H2O=Ca(OH)2,氢氧化钙属于常见的碱,可以用来改良酸性土壤;(2)酚酞遇碱变红色,二氧化碳和氢氧化钙会生成碳酸钙沉淀,盐酸和氢氧化钙反应没有明显现象,氯化钠不会与氢氧化钙反应,故选①③;(3)氢氧化钙的溶解度随温度的升高而减小,由于固体氢氧化钠溶解放出热量,白色固体的化学式是Ca(OH)2;【猜想和假设】与氢氧化钙溶液的浓度有关。若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊,猜想错误,因为饱和石灰水已是该温度下质量分数最大的溶液;【解释与结论】(1) 氢氧化钙溶液与碳酸钠溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式是:Ca(OH)2+Na2CO3====CaCO3↓+2NaOH;(2) 乙组实验证明:猜想②不成立;碳酸钠溶液浓度在0.5 10%的范围内,能否出现浑浊与碳酸钠溶液的浓度有关,其关系是碳酸钠溶液浓度大,不易产生浑浊;(3) 丙组同学运用的实验方法是对比试验,排除水的干扰,得到的结论是:未观察到浑浊的原因与碳酸钠溶液的浓度有关。
12.(1)解:样品中含有硝酸铵的质量为x,生成硝酸钠的质量为y
x=0.8g
y=0.85g
则样品中NH4NO3的质量分数为=10%
答:样品中NH4NO3的质量分数为10%。
(2)解:设硝酸钙和碳酸钠反应生成硝酸钠的质量为z
z=6.8g
则滤液中NaNO3的质量为0.85g+6.8g=7.65g
答:滤液中NaNO3的质量为7.65g。
【详解】(1)根据氨气的质量结合反应的方程式计算硝酸铵的质量,还有生成的硝酸钠的质量,进而计算硝酸铵的质量分数;详解见答案。
(2)根据碳酸钙的质量结合反应的方程式计算硝酸钠的质量。再算出两个反应生成的硝酸钠的总质量;详解见答案。
【点睛】本题主要考查化学方程式的书写及利用化学方程式计算,有一定难度。
13.(1)
(2)
(3)
(4)
【详解】(1)小苏打是碳酸氢钠的俗称,胃酸主要是盐酸,二者反应生成氯化钠、水和二氧化碳,化学方程式为:
(2)绿色植物的光合作用是二氧化碳和水在光照下合成氧气与葡萄糖,反应的化学方程式为:
(3)铁锈的主要成分是氧化铁,氧化铁和稀硫酸反应生成硫酸铁和水,化学方程式为:
(4)铝与氢氧化钠溶液反应产生偏铝酸钠(NaAlO2)和氢气,反应的化学方程式为:
14. 氢氧根 被测海水质量 BaCl2
【详解】(1)由海水变为弱酸性即PH值越来越小;再结合全过程中海水的pH依次变化大即PH值又开始变大,就可以做出答案;
(2)海水(pH=8.1﹣8.3)说明显碱性,即含有氢氧根离子;
(3)测定海水中Na2SO4含量,首先需要知道海水总质量,再根据与氯化钡反应生成沉淀的质量算出硫酸钠的质量.
15.(1) 物理 化学
(2)分子间有间隙
(3) 分子分成原子,原子重新结合成新的分子
(4)
【详解】(1)图甲到图乙是空气和二氧化氮混合的过程,微观上分子互相运动到对方的间隔中,而分子本身没变,没有新物质生成属于物理变化,故填:物理;
金刚石和石墨的碳原子排列方式不同,虽都由碳原子构成但属于不同物质,故由金刚石变为石墨的过程有新物质生成,属于化学变化,故填:化学;
(2)如图所示,从微观的角度可以获得的信息是:分子间有间隙;
(3)由质量守恒定律反应前后原子的种类及数目不变可知,反应时水分子分解出4个氢原子,根据水通电分解出氢气和氧气,故在图4的方框内应画出两个氢分子,故填:;
由微粒的变化可知,化学变化的实质是:分子分成原子,原子重新结合成新的分子。
(4)由图5微粒的变化可知,该反应的实质是铜离子和氢氧根离子结合生成了氢氧化铜沉淀,则氯化铜与氢氧化钾的反应与该反应的微观实质相同,氯化铜和氢氧化钾反应生成氢氧化铜沉淀和氯化钾,化学方程式是:。
16.(1) 天然气 不可再生
(2)C
(3)复合肥
(4) pH试纸或pH计
【详解】(1)三大化石燃料包括煤、石油和天然气,它们都是属于不可再生能源。
(2)馒头主要富含糖类,红烧肉、豆腐汤、牛肉干富含蛋白质和油脂,还差维生素。而给的选项中,炒鸡蛋,牛奶,富含蛋白质,糖醋肉富含脂肪,黄瓜含有维生素。所以选C
(3)硝酸钾含有营养元素N、P、K中的N和K,所以属于复合肥。
(4)测定酸碱度常用pH试纸,精确测量也可用pH计。氢氧化钙与硫酸反应生成硫酸钙和水,反应的化学方程式为。
17. Ca(OH)2 NaCl NaHCO3 H2O2
【详解】(1)改良酸性土壤的物质为熟石灰氢氧化钙Ca(OH)2;
(2)生理盐水中的盐是指氯化钠NaCl
(3)小苏打碳酸氢钠NaHCO3可以和胃酸盐酸反应,可用于治疗胃酸过多;
(4)分子是保持物质化学性质的基本粒子,保持过氧化氢化学性质的微粒是过氧化氢分子H2O2。
18.(1) D、AgNO3 B、Cu(OH)2 C、CuCl2 A、CuO
(2)
【分析】根据B为一种蓝色固体,结合初中阶段所学知识,推断B为难溶于水的氢氧化铜;由于A、B、C都含有相同的金属元素,故都含铜元素,因为氧化铜为黑色固体,所以A为氧化铜;因为A、B、C分别属于不同类别的化合物,而A为氧化铜、B为氢氧化铜,所以C为铜盐。根据题中六种物质间的反应及转化关系,因为铜和氧气反应生成氧化铜,氧化铜和一氧化碳等还原剂反应生成铜,氧化铜和盐酸等酸反应能生成可溶性铜盐,可溶性铜盐和铁等排在铜前面的金属反应生成铜,所以④为氧化铜,③为可溶性铜盐;因为③是盐酸转化而来,所以③为氯化铜;又因为氢氧化铜可以和盐酸反应,和氯化铜可以相互转化,所以②为氢氧化铜;因为无色的硝酸银溶液和盐酸、铜、氯化铜都能反应,所以①为硝酸银溶液(即D物质)。
【详解】(1)根据分析,①处为无色的硝酸银溶液,字母序号为:D,化学式为:AgNO3;②处物质为氢氧化铜,字母序号为:B,化学式为:Cu(OH)2;③处物质为氯化铜,字母序号为:C,化学式为:CuCl2;④处物质为氧化铜,字母序号为:A,化学式为:CuO。
(2)氯化铜和氢氧化钠反应生成氢氧化铜和氯化钠,反应的化学方程式为:。(合理即可)
19. 量筒和胶头滴管 Ca(OH)2 Al(OH)3、Fe(OH)3 除去过量的Ca(OH)2 Ca(OH)2 + 2HBr = CaBr2 + 2H2O 蒸发浓缩
【详解】(1)若用47%的氢溴酸配置26%的氢溴酸,属于浓溶液的稀释问题,稀释溶液所需的玻璃仪器有玻璃棒、烧杯、量筒和胶头滴管。需要计算好加水的体积和浓溶液的体积,量取一定量的液体体积需要用到玻璃仪器有:量筒和胶头滴管。故填:量筒和胶头滴管。
(2)步骤Ⅰ中加入的氢溴酸是过量的,所以步骤Ⅱ中的溶液是酸性的,加入的试剂a后,控制溶液的pH约为8.0,能将Al3+、Fe3+分别转化成沉淀而除去,所以a是碱,同时不能引入新杂质,所以a是氢氧化钙(石灰水);将Al3+、Fe3+分别转化成氢氧化铝和氢氧化铁沉淀,所以沉淀的化学式为Al(OH)3、Fe(OH)3。故填:Ca(OH)2;Al(OH)3、Fe(OH)3。
(3)步骤Ⅱ中的溶液是酸性的,加入的试剂a(氢氧化钙)过量,所以步骤Ⅲ的滤液中含有氢氧化钙,加入试剂b目的除去氢氧化钙还不能引入新杂质,故b是适量的氢溴酸。氢溴酸与氢氧化钙反应生成溴化钙和水,反应方程式为:Ca(OH)2 + 2HBr = CaBr2 + 2H2O。故填:除去过量的Ca(OH)2;Ca(OH)2 + 2HBr = CaBr2 + 2H2O。
(4)步骤Ⅳ加入适量氢溴酸后得到的是不含其它溶质的溴化钙溶液,步骤Ⅴ经过蒸发浓缩、降温结晶、过滤,可以得到溴化钙晶体。故填:蒸发浓缩。
答案第1页,共2页
答案第1页,共2页
同课章节目录
