河南省2024年化学中考热点备考重难专题:流程图题 课件 (共26张PPT)
文档属性
| 名称 | 河南省2024年化学中考热点备考重难专题:流程图题 课件 (共26张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 18.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-07 09:45:44 | ||
图片预览





文档简介
(共26张PPT)
河南 化学
流程图题
2024中考备考重难专题课件
课件说明
一、课件设计初衷
基于老师在总复习过程中对重难题型有较大的需求,难易结合化学学科的重难点,为此设计重难专题复习课件,助力高效课堂
二、课件亮点
1.对专题知识体系的构建
侧重专题知识体系分解再构建,根据本区域近五年的中考真题提炼知识点,通过知识点讲授方法和技巧,并进一步形成对应体系,再让学生尝试应用已有体系中的方法与技巧去解决问题,在复习过程中构建自己的重难专题知识体系。会对难题进行分解,降低梯度,准确、高效攻克重难专题。
2.过程性分析设置分步动画
对方法讲解、解题步骤设置分步动画,按步骤播放,更清晰有条理。
三、课件使用场景
适用于中考二轮专题复习
1
知识回顾
典例精析
2
巩固练习
3
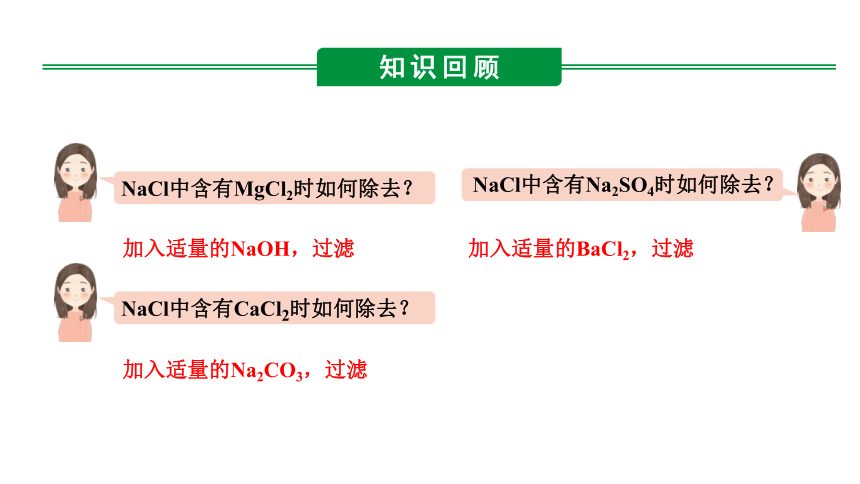
NaCl中含有MgCl2时如何除去?
加入适量的NaOH,过滤
NaCl中含有CaCl2时如何除去?
加入适量的Na2CO3,过滤
NaCl中含有Na2SO4时如何除去?
加入适量的BaCl2,过滤
知识回顾
1.视频制取细盐的时候涉及到哪些化学实验操作?
请你观看以下视频,提取有效信息,回答问题
剁碎:增大接触面积,加快溶解速率
过滤:除去不溶性固体杂质
搅拌:使液体受热均匀,防止局部温度过高液滴飞溅
研磨:在烹饪食物的时候盐能更快的溶剂
2.过滤和蒸发结晶的区别是什么呢?
过滤:操作是将固体和液体分离开
蒸发结晶:操作前为某溶液,操作后得到晶体或者固体
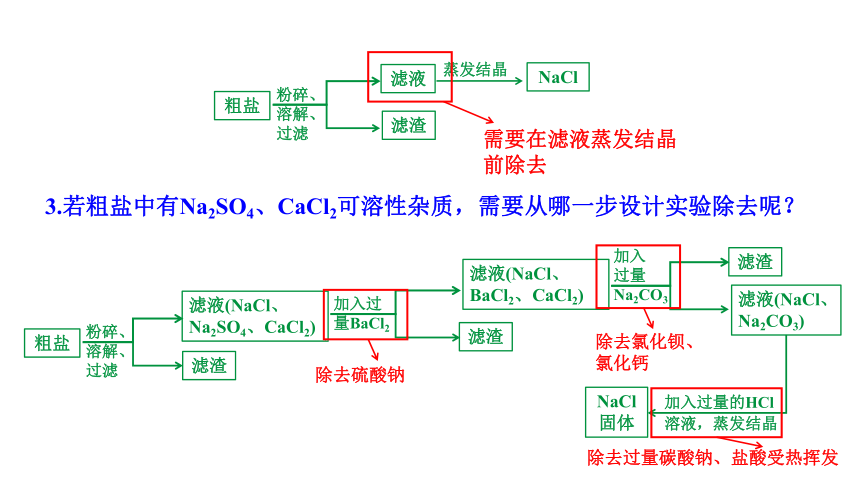
3.若粗盐中有Na2SO4、CaCl2可溶性杂质,需要从哪一步设计实验除去呢?
粗盐
粉碎、
溶解、
过滤
滤渣
滤液
蒸发结晶
NaCl
需要在滤液蒸发结晶前除去
粗盐
粉碎、
溶解、
过滤
滤渣
滤液(NaCl、
Na2SO4、CaCl2)
加入过量的HCl溶液,蒸发结晶
NaCl固体
加入过
量BaCl2
滤液(NaCl、
BaCl2、CaCl2)
滤渣
加入
过量
Na2CO3
滤渣
滤液(NaCl、Na2CO3)
除去硫酸钠
除去氯化钡、氯化钙
除去过量碳酸钠、盐酸受热挥发
粗盐
粉碎、
溶解、
过滤
滤渣
滤液(NaCl、
Na2SO4、CaCl2)
加入过量的HCl溶液,蒸发结晶
NaCl固体
加入过
量BaCl2
滤液(NaCl、
BaCl2、CaCl2)
滤渣
加入
过量
Na2CO3
滤渣
滤液(NaCl、Na2CO3)
核心反应
原料预处理
产品分离与提纯
4.在设计除杂路径时需要考虑哪些问题?
①遵守除杂原则
选择除杂试剂时注意主不增、杂不减、易分离
②注意除杂试剂的添加顺序
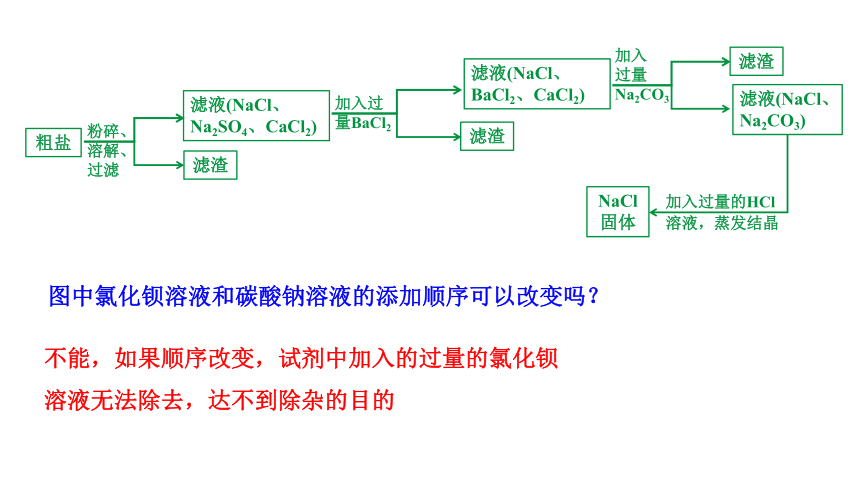
粗盐
粉碎、
溶解、
过滤
滤渣
滤液(NaCl、
Na2SO4、CaCl2)
加入过量的HCl溶液,蒸发结晶
NaCl固体
加入过
量BaCl2
滤液(NaCl、
BaCl2、CaCl2)
滤渣
加入
过量
Na2CO3
滤渣
滤液(NaCl、Na2CO3)
图中氯化钡溶液和碳酸钠溶液的添加顺序可以改变吗?
不能,如果顺序改变,试剂中加入的过量的氯化钡溶液无法除去,达不到除杂的目的
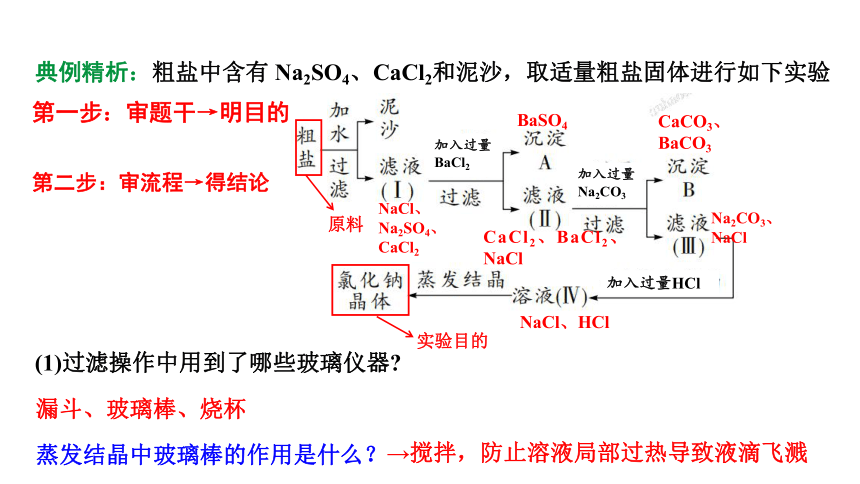
典例精析:粗盐中含有 Na2SO4、CaCl2和泥沙,取适量粗盐固体进行如下实验
第二步:审流程→得结论
加入过量
BaCl2
加入过量Na2CO3
加入过量HCl
实验目的
第一步:审题干→明目的
原料
BaSO4
CaCl2、BaCl2、NaCl
Na2CO3、
NaCl
CaCO3、
BaCO3
NaCl、HCl
NaCl、
Na2SO4、
CaCl2
(1)过滤操作中用到了哪些玻璃仪器
漏斗、玻璃棒、烧杯
蒸发结晶中玻璃棒的作用是什么?
→搅拌,防止溶液局部过热导致液滴飞溅
加入过量
BaCl2
加入过量Na2CO3
加入过量HCl
BaSO4
CaCl2、BaCl2、NaCl
NaCl、HCl
NaCl、
Na2SO4、
CaCl2
(2)写出加入试剂HCl时有明显现象的反应的化学方程式__________________________________。
(3)改变BaCl2、Na2CO3中两种试剂的加入顺序对实验结果有影响吗?
2HCl+Na2CO3===2NaCl+H2O+CO2↑
有影响,顺序改变后试剂中加入的过量的氯化钡无法除去,达不到除杂的目的
Na2CO3、
NaCl
CaCO3、
BaCO3
方法总结:
1、流程图替路线示意图
原料
预处理
核心
反应
目标产物
(产品)
除去哪些物质?
剩余哪些物质?
加辅料
目的是什么?是否过量?
反应现象?反应产物
分离、提纯
除杂、净化等
过滤、结晶等分离操作
用化学方程式体现,
同时考虑是否恰好反应?
2、一般解题思路和方法
①明确原料的成分
②明确流程的目的
第三步:审设问→得答案
第二步:审流程→得结论
第一步:审题干→明目的
①明确两线:主线产物,分支到产物。
②结合提供的信息和设置的问题细审流程中的转化原理,找出进料物质(反应物)和出去的物质(生成物)的主要产物和副产物。
明确答什么,答的问题与哪步流程有关,考查了什么知识等等。
“统览整体,截段分析”
例二:如图是甲同学设计的除去粗盐中 MgCl2、Na2SO4和CaCl2杂质的实验
方案。
(1)取适量Ⅰ中溶液于试管中,滴加肥皂水并振荡,可观察到什么现象
实验目的
原料
I:MgCl2、Na2SO4、CaCl2、NaCl
II:NaOH、Na2SO4、CaCl2、NaCl
III:NaOH、BaCl2、NaCl、BaCl2
NaOH、Na2CO3、NaCl
产生少量泡沫和大量浮渣
(2)写出Ⅱ中加入BaCl2溶液后发生反应的化学方程式。
实验目的
原料
I:MgCl2、Na2SO4、CaCl2、NaCl
II:NaOH、Na2SO4、CaCl2、NaCl
III:NaOH、BaCl2、CaCl2、NaCl
NaOH、Na2CO3、NaCl
BaCl2+Na2SO4 ===BaSO4↓+2NaCl
(3)设计实验方案检验操作a所得溶液中除NaCl外溶质的成分。
实验目的
原料
I:MgCl2、Na2SO4、CaCl2、NaCl
II:NaOH、Na2SO4、CaCl2、NaCl
III:NaOH、BaCl2、CaCl2、NaCl
NaOH、Na2CO3、NaCl
图中添加的四种除杂试剂中,哪两种试剂互相调换不会的最终产物产生影响?
取样,加入足量 CaCl2 (或BaCl2等) 溶液,产生白色沉淀;静置,向上层清液中滴加酚酞溶液,溶液变为红色,证明操作a所得溶液中含有Na2CO3和NaOH。
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
考点归纳
原料
预处理
1.粉碎或研磨
目的:增大接触面积,加快溶解速率或加快反应速率
2.灼烧或煅烧
使固体或杂质在高温条件下分解,使反应充分进行或增大转化率。
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
原料
预处理
3.浸润
水浸:使可溶物溶解,与不溶物分离。例:
水浸
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
核心
反应
1.物质成分的分析(物质化学式的推断或书写)
(1)根据复分解反应:根据复分解反应中已知的反应物及生成物,推出未知的反应物或生成物,剩余物质的成分中一定存在反应的生成物和加入某种过量反应物。
(2)根据质量守恒定律:可从上一步操作中反应物可能发生的反应或题干所给信息入手,同时需注意所加试剂是否有剩余。
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
核心
反应
2.化学方程式的书写
(1)寻找反应物和生成物:根据箭头方向,箭头进入是投料(即反应物),出去的是生成物。
(2)从已知信息中找出反应物和生成物不满足质量守恒定律:
①若反应在溶液中进行,考虑是否有水参与反应或有水生成;
②若反应在空气中进行或通入空气,考虑空气中的各成分是否参与反应
3.除杂顺序分判断
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
核心
反应
要确保前一个除杂试剂可以被后一个除杂试剂反应除去或在最后一步被除去
除去过量的NaOH、Na2CO3,HCl受热挥发
除去过量的BaCl2溶液
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
分离、提纯
请你判断以上两个操作各自的名称是什么?你的判断依据是什么?
A过滤:将固体和液体分离开
B蒸发结晶:操作前为某溶液,操作后得到晶体或者固体
A B
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
分离、提纯
过滤后液体仍浑浊的原因是什么?蒸发结晶时玻璃棒和过滤时的作用一样吗?
过滤操作中滤液浑浊原因可能是滤纸破损、滤液高于滤纸边缘等
不一样,蒸发结晶是玻璃棒的作用是搅拌,防止因局部温度过高,造成液滴飞溅
A B
1.将某盐湖水样品过滤后得到澄清溶液,已知其中可能含有 Na2SO4或CaCl2中的一种或两种,为检验其中含有的杂质并得到纯净的NaCl固体,某化学兴趣小组同学进行了如下实验:
(1)盐湖水样品中一定含有的杂质是_________。
(2)写出向溶液C中加入Na2CO3溶液后
一定发生的化学反应方程式。
Na2SO4
Na2CO3+BaCl2====BaCO3↓+2NaCl
巩固练习
(3)请设计实验方案检验盐湖水样品中可能存在的杂质。
向溶液A中加入Na2CO3溶液,若产生白色沉淀,证明盐湖水样品中含有CaCl2,反之则不含CaCl2。
拓展设问
(4)写出实验室检验固体D与稀盐酸反应产生的气体时有关反应的化学方程式。
(5)若缺少步骤③,写出固体G中成分的化学式_________________。
CO2+ Ca(OH)2===CaCO3↓+ H2O
NaCl、Na2CO3
2.将某盐湖水样品过滤后得到澄清溶液,已知其中可能含有 Na2SO4或CaCl2中的一种或两种,为检验其中含有的杂质并得到纯净的NaCl固体,某化学兴趣小组同学进行了如下实验:
(1)盐湖水样品中一定含有的杂质是_________。
(2)写出向溶液C中加入Na2CO3溶液后
一定发生的化学反应方程式。
(3)请设计实验方案检验盐湖水样品中可能存在的杂质。
Na2SO4
Na2CO3+BaCl2====BaCO3↓+2NaCl
向溶液A中加入Na2CO3溶液,若产生白色沉淀,证明盐湖水样品中含有CaCl2,反之则不含CaCl2。
河南 化学
流程图题
2024中考备考重难专题课件
课件说明
一、课件设计初衷
基于老师在总复习过程中对重难题型有较大的需求,难易结合化学学科的重难点,为此设计重难专题复习课件,助力高效课堂
二、课件亮点
1.对专题知识体系的构建
侧重专题知识体系分解再构建,根据本区域近五年的中考真题提炼知识点,通过知识点讲授方法和技巧,并进一步形成对应体系,再让学生尝试应用已有体系中的方法与技巧去解决问题,在复习过程中构建自己的重难专题知识体系。会对难题进行分解,降低梯度,准确、高效攻克重难专题。
2.过程性分析设置分步动画
对方法讲解、解题步骤设置分步动画,按步骤播放,更清晰有条理。
三、课件使用场景
适用于中考二轮专题复习
1
知识回顾
典例精析
2
巩固练习
3
NaCl中含有MgCl2时如何除去?
加入适量的NaOH,过滤
NaCl中含有CaCl2时如何除去?
加入适量的Na2CO3,过滤
NaCl中含有Na2SO4时如何除去?
加入适量的BaCl2,过滤
知识回顾
1.视频制取细盐的时候涉及到哪些化学实验操作?
请你观看以下视频,提取有效信息,回答问题
剁碎:增大接触面积,加快溶解速率
过滤:除去不溶性固体杂质
搅拌:使液体受热均匀,防止局部温度过高液滴飞溅
研磨:在烹饪食物的时候盐能更快的溶剂
2.过滤和蒸发结晶的区别是什么呢?
过滤:操作是将固体和液体分离开
蒸发结晶:操作前为某溶液,操作后得到晶体或者固体
3.若粗盐中有Na2SO4、CaCl2可溶性杂质,需要从哪一步设计实验除去呢?
粗盐
粉碎、
溶解、
过滤
滤渣
滤液
蒸发结晶
NaCl
需要在滤液蒸发结晶前除去
粗盐
粉碎、
溶解、
过滤
滤渣
滤液(NaCl、
Na2SO4、CaCl2)
加入过量的HCl溶液,蒸发结晶
NaCl固体
加入过
量BaCl2
滤液(NaCl、
BaCl2、CaCl2)
滤渣
加入
过量
Na2CO3
滤渣
滤液(NaCl、Na2CO3)
除去硫酸钠
除去氯化钡、氯化钙
除去过量碳酸钠、盐酸受热挥发
粗盐
粉碎、
溶解、
过滤
滤渣
滤液(NaCl、
Na2SO4、CaCl2)
加入过量的HCl溶液,蒸发结晶
NaCl固体
加入过
量BaCl2
滤液(NaCl、
BaCl2、CaCl2)
滤渣
加入
过量
Na2CO3
滤渣
滤液(NaCl、Na2CO3)
核心反应
原料预处理
产品分离与提纯
4.在设计除杂路径时需要考虑哪些问题?
①遵守除杂原则
选择除杂试剂时注意主不增、杂不减、易分离
②注意除杂试剂的添加顺序
粗盐
粉碎、
溶解、
过滤
滤渣
滤液(NaCl、
Na2SO4、CaCl2)
加入过量的HCl溶液,蒸发结晶
NaCl固体
加入过
量BaCl2
滤液(NaCl、
BaCl2、CaCl2)
滤渣
加入
过量
Na2CO3
滤渣
滤液(NaCl、Na2CO3)
图中氯化钡溶液和碳酸钠溶液的添加顺序可以改变吗?
不能,如果顺序改变,试剂中加入的过量的氯化钡溶液无法除去,达不到除杂的目的
典例精析:粗盐中含有 Na2SO4、CaCl2和泥沙,取适量粗盐固体进行如下实验
第二步:审流程→得结论
加入过量
BaCl2
加入过量Na2CO3
加入过量HCl
实验目的
第一步:审题干→明目的
原料
BaSO4
CaCl2、BaCl2、NaCl
Na2CO3、
NaCl
CaCO3、
BaCO3
NaCl、HCl
NaCl、
Na2SO4、
CaCl2
(1)过滤操作中用到了哪些玻璃仪器
漏斗、玻璃棒、烧杯
蒸发结晶中玻璃棒的作用是什么?
→搅拌,防止溶液局部过热导致液滴飞溅
加入过量
BaCl2
加入过量Na2CO3
加入过量HCl
BaSO4
CaCl2、BaCl2、NaCl
NaCl、HCl
NaCl、
Na2SO4、
CaCl2
(2)写出加入试剂HCl时有明显现象的反应的化学方程式__________________________________。
(3)改变BaCl2、Na2CO3中两种试剂的加入顺序对实验结果有影响吗?
2HCl+Na2CO3===2NaCl+H2O+CO2↑
有影响,顺序改变后试剂中加入的过量的氯化钡无法除去,达不到除杂的目的
Na2CO3、
NaCl
CaCO3、
BaCO3
方法总结:
1、流程图替路线示意图
原料
预处理
核心
反应
目标产物
(产品)
除去哪些物质?
剩余哪些物质?
加辅料
目的是什么?是否过量?
反应现象?反应产物
分离、提纯
除杂、净化等
过滤、结晶等分离操作
用化学方程式体现,
同时考虑是否恰好反应?
2、一般解题思路和方法
①明确原料的成分
②明确流程的目的
第三步:审设问→得答案
第二步:审流程→得结论
第一步:审题干→明目的
①明确两线:主线产物,分支到产物。
②结合提供的信息和设置的问题细审流程中的转化原理,找出进料物质(反应物)和出去的物质(生成物)的主要产物和副产物。
明确答什么,答的问题与哪步流程有关,考查了什么知识等等。
“统览整体,截段分析”
例二:如图是甲同学设计的除去粗盐中 MgCl2、Na2SO4和CaCl2杂质的实验
方案。
(1)取适量Ⅰ中溶液于试管中,滴加肥皂水并振荡,可观察到什么现象
实验目的
原料
I:MgCl2、Na2SO4、CaCl2、NaCl
II:NaOH、Na2SO4、CaCl2、NaCl
III:NaOH、BaCl2、NaCl、BaCl2
NaOH、Na2CO3、NaCl
产生少量泡沫和大量浮渣
(2)写出Ⅱ中加入BaCl2溶液后发生反应的化学方程式。
实验目的
原料
I:MgCl2、Na2SO4、CaCl2、NaCl
II:NaOH、Na2SO4、CaCl2、NaCl
III:NaOH、BaCl2、CaCl2、NaCl
NaOH、Na2CO3、NaCl
BaCl2+Na2SO4 ===BaSO4↓+2NaCl
(3)设计实验方案检验操作a所得溶液中除NaCl外溶质的成分。
实验目的
原料
I:MgCl2、Na2SO4、CaCl2、NaCl
II:NaOH、Na2SO4、CaCl2、NaCl
III:NaOH、BaCl2、CaCl2、NaCl
NaOH、Na2CO3、NaCl
图中添加的四种除杂试剂中,哪两种试剂互相调换不会的最终产物产生影响?
取样,加入足量 CaCl2 (或BaCl2等) 溶液,产生白色沉淀;静置,向上层清液中滴加酚酞溶液,溶液变为红色,证明操作a所得溶液中含有Na2CO3和NaOH。
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
考点归纳
原料
预处理
1.粉碎或研磨
目的:增大接触面积,加快溶解速率或加快反应速率
2.灼烧或煅烧
使固体或杂质在高温条件下分解,使反应充分进行或增大转化率。
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
原料
预处理
3.浸润
水浸:使可溶物溶解,与不溶物分离。例:
水浸
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
核心
反应
1.物质成分的分析(物质化学式的推断或书写)
(1)根据复分解反应:根据复分解反应中已知的反应物及生成物,推出未知的反应物或生成物,剩余物质的成分中一定存在反应的生成物和加入某种过量反应物。
(2)根据质量守恒定律:可从上一步操作中反应物可能发生的反应或题干所给信息入手,同时需注意所加试剂是否有剩余。
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
核心
反应
2.化学方程式的书写
(1)寻找反应物和生成物:根据箭头方向,箭头进入是投料(即反应物),出去的是生成物。
(2)从已知信息中找出反应物和生成物不满足质量守恒定律:
①若反应在溶液中进行,考虑是否有水参与反应或有水生成;
②若反应在空气中进行或通入空气,考虑空气中的各成分是否参与反应
3.除杂顺序分判断
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
核心
反应
要确保前一个除杂试剂可以被后一个除杂试剂反应除去或在最后一步被除去
除去过量的NaOH、Na2CO3,HCl受热挥发
除去过量的BaCl2溶液
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
分离、提纯
请你判断以上两个操作各自的名称是什么?你的判断依据是什么?
A过滤:将固体和液体分离开
B蒸发结晶:操作前为某溶液,操作后得到晶体或者固体
A B
原料
预处理
核心
反应
目标产物
(产品)
分离、提纯
分离、提纯
过滤后液体仍浑浊的原因是什么?蒸发结晶时玻璃棒和过滤时的作用一样吗?
过滤操作中滤液浑浊原因可能是滤纸破损、滤液高于滤纸边缘等
不一样,蒸发结晶是玻璃棒的作用是搅拌,防止因局部温度过高,造成液滴飞溅
A B
1.将某盐湖水样品过滤后得到澄清溶液,已知其中可能含有 Na2SO4或CaCl2中的一种或两种,为检验其中含有的杂质并得到纯净的NaCl固体,某化学兴趣小组同学进行了如下实验:
(1)盐湖水样品中一定含有的杂质是_________。
(2)写出向溶液C中加入Na2CO3溶液后
一定发生的化学反应方程式。
Na2SO4
Na2CO3+BaCl2====BaCO3↓+2NaCl
巩固练习
(3)请设计实验方案检验盐湖水样品中可能存在的杂质。
向溶液A中加入Na2CO3溶液,若产生白色沉淀,证明盐湖水样品中含有CaCl2,反之则不含CaCl2。
拓展设问
(4)写出实验室检验固体D与稀盐酸反应产生的气体时有关反应的化学方程式。
(5)若缺少步骤③,写出固体G中成分的化学式_________________。
CO2+ Ca(OH)2===CaCO3↓+ H2O
NaCl、Na2CO3
2.将某盐湖水样品过滤后得到澄清溶液,已知其中可能含有 Na2SO4或CaCl2中的一种或两种,为检验其中含有的杂质并得到纯净的NaCl固体,某化学兴趣小组同学进行了如下实验:
(1)盐湖水样品中一定含有的杂质是_________。
(2)写出向溶液C中加入Na2CO3溶液后
一定发生的化学反应方程式。
(3)请设计实验方案检验盐湖水样品中可能存在的杂质。
Na2SO4
Na2CO3+BaCl2====BaCO3↓+2NaCl
向溶液A中加入Na2CO3溶液,若产生白色沉淀,证明盐湖水样品中含有CaCl2,反之则不含CaCl2。
同课章节目录
