化学人教版(2019)选择性必修2 2.3.1共价键的极性及对物质性质的影响(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3.1共价键的极性及对物质性质的影响(共31张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 39.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-07 11:11:15 | ||
图片预览










文档简介
(共31张PPT)
第二章
第三节 分子结构与物质性质
0
第1课时:共价键的极性
及对物质性质的影响
新课引入
微波炉经常用来加热饭菜,你知道这是为什么吗?
01
非极性共价键
02
极性共价键
写出Cl2、N2、HCl、H2O、CH4的电子式。讨论其共用电子对是否偏移?
Cl Cl
:
:
:
:
:
:
:
﹕
H O H
﹕
﹕
﹕
1.0
3.0
3.0
3.0
共用电子对不偏移
共用电子对偏移
N
N
电荷分布均匀
﹕
H Cl
﹕
﹕
﹕
电荷分布不均匀
共用电子对
偏移程度越大
键的极性
越强
电负性
差值越大
δ-
δ+
δ+
1.0
3.5 1.0
一、共价键的极性
1.键的极性
一、共价键的极性
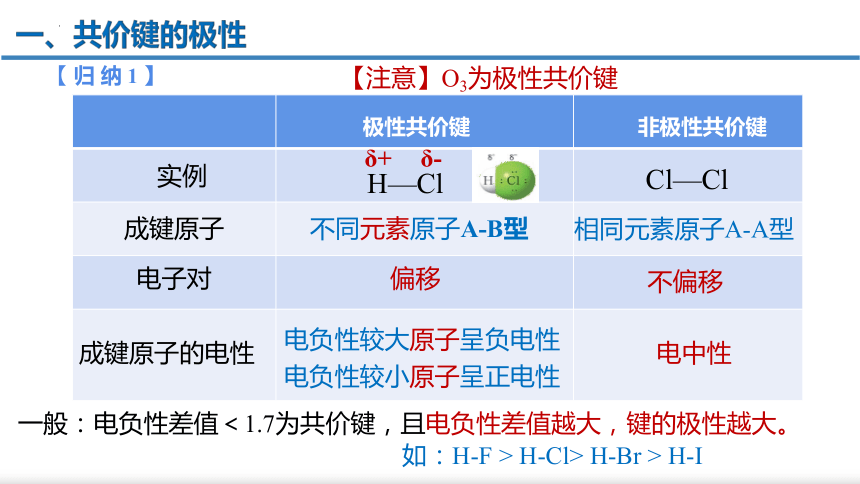
【归纳1】
不同元素原子A-B型
相同元素原子A-A型
偏移
不偏移
电负性较小原子呈正电性
电负性较大原子呈负电性
电中性
非极性共价键
极性共价键
实例
成键原子
电子对
成键原子的电性
Cl—Cl
δ+
H—Cl
δ-
一般:电负性差值<1.7为共价键,且电负性差值越大,键的极性越大。
如:H-F > H-Cl> H-Br > H-I
【注意】O3为极性共价键
一、共价键的极性
按照不同的分类方法,可将共价键分为不同的类型:
(1)按共用电子对数目
单键:如H-H键
双键:如C=C键
三键:如N≡N键
(2)按共用电子对是否偏移
非极性键:如Cl-Cl键
极性键:如H-Cl键
(3)按原子轨道的重叠方式
σ键
π键
σ键可以独立存在,
π键不能单独存在
【归纳2】
练一练
练习1:指出下列物质中的共价键类型
N2
CH4
CO2
CS2
H2O2
Na2O2
SiH4
NaOH
非极性键
极性键
极性键
极性键和非极性键
非极性键
极性键
非极性键
非极性键
练习2:含有非极性键的离子化合物( )
A.NaOH B.Na2O2 C.NaCl D.NH4Cl
B
一、共价键的极性
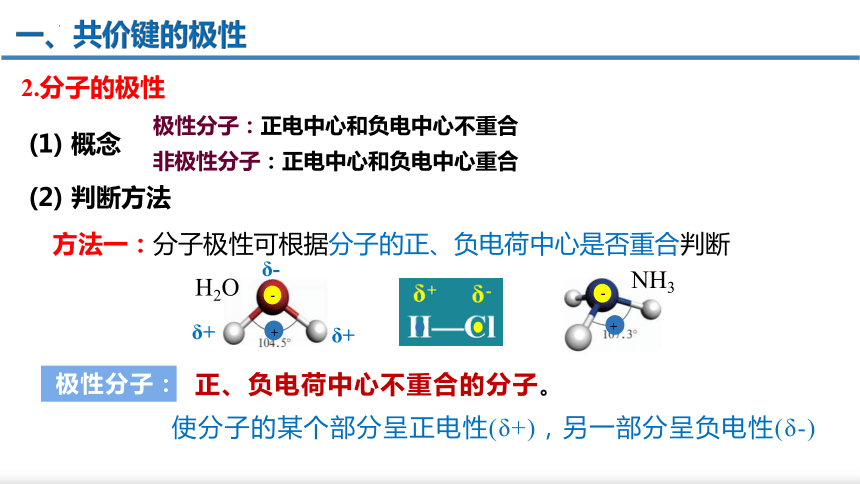
2.分子的极性
极性分子:正电中心和负电中心不重合
非极性分子:正电中心和负电中心重合
(1) 概念
(2) 判断方法
δ-
δ+
δ+
极性分子:
正、负电荷中心不重合的分子。
NH3
H2O
-
+
-
+
使分子的某个部分呈正电性(δ+),另一部分呈负电性(δ-)
方法一:分子极性可根据分子的正、负电荷中心是否重合判断
一、共价键的极性
正、负电荷中心重合的分子。
非极性分子:
BF3
CH4
CH2=CH2
2.分子的极性
方法一:分子极性可根据分子的正、负电荷中心是否重合判断
一、共价键的极性
方向:
大小:
由正电中心指向负电中心
电负性差值越大,键的极性越大,极性向量越大
方法二:分子极性也可根据化学键的极性的向量和判断
大小相等,方向相反,
向量和为0,
非极性分子:
B
F
F
F
平面三角形
直线形
正四面体形
2.分子的极性
F合=0
一、共价键的极性
δ-
δ+
δ+
键的极性向量和不为0
极性分子:
NH3 三角锥形
δ-
δ+
δ+
δ+
H2O
HCN
V形
H2O、
HCN、
NH3 等
方法二:分子极性也可根据化学键的极性的向量和判断
2.分子的极性
F合≠0
一、共价键的极性
常见的非极性分子和极性分子
δ+
δ-
C60
δ+
δ-
δ+
δ-
δ+
δ-
极性
分子:
非极性
分子:
一、共价键的极性
2.分子的极性
请分析O3分子的结构及空间构型
一、共价键的极性
臭氧是一种重要物质。大气高空的臭氧层保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂……
臭氧分子的空间结构与水分子的相似,
臭氧分子有极性,但很微弱。
仅是水分子的极性的28%。
臭氧分子中的共价键是极性键,
其中心氧原子是呈正电性的,
而端位的两个氧原子是呈电负性的。
臭氧的极性微弱,它在四氯化碳中的溶解度高于在水中的溶解度
资料卡片(P53)
一、共价键的极性
【思考与讨论】
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子
H2 O2 Cl2 HCl
(2)P4和C60是极性分子还是非极性分子?
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子?
结论1:只由非极性键形成的双原子分子、多原子分子是非极性分子。
结论2:由极性键形成的双原子分子,是极性分子。
结论3:由极性键形成的多原子分子,可能为极性分子 如 H2O2
也可能是非极性分子。如:SO2、CO2
CO2、 HCN、H2O、 NH3 、 BF3 、 CH4 、 CH3Cl、 SO2、SO3、BeCl2
(1)只由非极性键形成的双原子分子、多原子分子是非极性分子
如:O2、H2、P4、C60。
(2)由极性键形成的双原子分子,是极性分子。
如:HCl、HF、HBr
(3)由极性键形成的多原子分子,可能为极性分子 如 H2O2
也可能是非极性分子。如:SO2、CO2
经验规则:a.对ABn分子,当主族元素A的化合价的绝对值等于其价电子数时,该 分子为非极性分子。
AB2:直线形,如CO2
AB3:平面三角形,如BF3
AB4:正四面体形,如CCl4
AB5 :三角双锥形,如PCl5
AB6:正八面体形,如SF6
【总结归纳】
一、共价键的极性
一般非极性分子,中心原子无孤电子对
经验规则:b.可根据中心原子有无孤电子对判断。
BF3
CO2
PCl5
SO3
H2O
NH3
SO2
中心原子
化合价绝对值
孤电子对数
分子极性
3
0
4
0
5
0
6
0
2
2
3
1
4
1
非极
非极
非极
非极
极性
极性
极性
2.分子的极性
(3)由极性键形成的多原子分子,可能为极性分子 如 H2O2
也可能是非极性分子。如:SO2、CO2
空间结构
非中心对称
中心对称
非极性分子
极性分子
一、共价键的极性
共价键的极性和分子的极性的关系
小结
正负电荷中心
是否重合
分子的空间
结构
共价键的
极性
决定
分子的
极性
决定
正电中心和负电中心不重合
正电中心和负电中心重合
极性
分子
非极性
分子
稀有气体分子是非极性分子,不含共价键;
臭氧是极性分子,共价键为极性键
练习3:判断下列分子的极性
①H2 ②O2 ③HCl ④P4 ⑤C60 ⑥CO2 ⑦CH2==CH2 ⑧HCN
⑨H2O ⑩NH3 BF3 CH4 SO3 CH3Cl H2O2
属于非极性分子的是_______________________,
属于极性分子的是_____________。
①②④⑤⑥⑦
③⑧⑨⑩
练一练
表面活性剂(P53)
去污原理:
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
为什么钠和水的反应比钠和乙醇的反应剧烈?
钠和水的反应
钠和乙醇的反应
H
O
H
δ+
δ-
C2H5
O
H
δ+
δ-
乙醇分子中的C2H5—是推电子基团,
使得乙醇分子中的电子云向着远离乙基的方向偏移
羟基的极性:
水分子 > 乙醇分子
一、共价键的极性
3.键的极性对化学性质的影响
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越强
化学键的极性
物质的化学性质
分子结构
氢氧键的极性越大,O—H越容易断开,酸性越强。
(即共用电子对的偏移程度越大)
3.键的极性对化学性质的影响
一、共价键的极性
分析表格中pKa数据的变化规律及原因
酸
性
增
强
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
烃基(R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
3.键的极性对化学性质的影响
一、共价键的极性
一、共价键的极性
酸
性
增
强
CH2
O
H
δ+
δ-
O
C
Cl
CH3
O
H
δ+
δ-
O
C
CH
O
H
δ+
δ-
O
C
Cl
Cl
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
氯的电负性较大,吸引键合电子对
3.键的极性对化学性质的影响
一、共价键的极性
Cl3C— > Cl2CH— > ClCH2—
三氯乙酸中的羧基的极性最大,更易电离出氢离子
氯的电负性较大,氯原子越多,酸性越强
羧基的极性:
羧酸 氯乙酸 (CH2ClCOOH) 二氯乙酸 (CHCl2COOH) 三氯乙酸
(CCl3COOH)
pKa 2.86 1.29 0.65
3.键的极性对化学性质的影响
一、共价键的极性
预测三氟乙酸和三氯乙酸的酸性相对强弱:
酸性增强
三氟乙酸中的羧基的极性更大,更易电离出氢离子
电负性:
F > Cl
羧基的极性:
F3C— > Cl3C—
羧酸 三氯乙酸(CCl3COOH) 三氟乙酸(CF3COOH)
pKa 0.65 0.23
3.键的极性对化学性质的影响
[小结]
羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大
-NO2 >-CN >-F >-Cl >-Br >-I > C C >-OCH3 >-OH >-C6H5 >-C=C
常见的吸电子基团:
常见的推电子基团:
(CH3)3C-> (CH3)2CH-> CH3CH2-> CH3-
推电子基,即将电子推向羟基,从而减小羟基的极性,导致羧酸的酸性减小。一般地,烃基越长,推电子效应越大,羧酸的酸性越小。
吸电子基,吸电子能力越强,电子向氯原子方向偏移程度越大,使羧基中羟基的极性增大,更容易电离出H+ 。
练习4:试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH
④CH2ClCOOH ⑤CH3COOH ⑥CH3CH2COOH
①>②>③>④>⑤>⑥
练一练
分子结构修饰与分子的性质(P55)
三氯蔗糖
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化。
三氯蔗糖又名蔗糖素,其甜度高、热量值极低,安全性好,可供糖尿病患者食用,被认为是近乎完美的甜味剂。
课堂小结
分子的极性
键的极性对化学性质的影响
极性分子:分子内正电中心和负电中心不重合
非极性分子:分子内正电中心和负电中心重合
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱
键的极性
非极性键:同种元素构成,电子对不偏移
极性键:不同种元素,电子对偏移
课堂练习
1.下列叙述正确的是( )
A.构成单质分子的微粒一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定都是极性键
B
2.下列叙述中正确的是( )
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越大,热稳定性
也越强
B.以极性键结合的分子,一定是极性分子
C.判断A2B或AB2型分子是否是极性分子的依据是看分子中是否含有极性键
D.非极性分子中,各原子间都应以非极性键结合
A
课堂练习
3.有一种AB2C2型分子,在该分子中A为中心原子。下列关于该分子的空间结构和极性的说法中,正确的是( )
A.假设为平面四边形,则该分子一定为非极性分子
B.假设为四面体形,则该分子一定为非极性分子
C.假设为平面四边形,则该分子可能为非极性分子
D.假设为四面体形,则该分子可能为非极性分子
C
第二章
第三节 分子结构与物质性质
0
第1课时:共价键的极性
及对物质性质的影响
新课引入
微波炉经常用来加热饭菜,你知道这是为什么吗?
01
非极性共价键
02
极性共价键
写出Cl2、N2、HCl、H2O、CH4的电子式。讨论其共用电子对是否偏移?
Cl Cl
:
:
:
:
:
:
:
﹕
H O H
﹕
﹕
﹕
1.0
3.0
3.0
3.0
共用电子对不偏移
共用电子对偏移
N
N
电荷分布均匀
﹕
H Cl
﹕
﹕
﹕
电荷分布不均匀
共用电子对
偏移程度越大
键的极性
越强
电负性
差值越大
δ-
δ+
δ+
1.0
3.5 1.0
一、共价键的极性
1.键的极性
一、共价键的极性
【归纳1】
不同元素原子A-B型
相同元素原子A-A型
偏移
不偏移
电负性较小原子呈正电性
电负性较大原子呈负电性
电中性
非极性共价键
极性共价键
实例
成键原子
电子对
成键原子的电性
Cl—Cl
δ+
H—Cl
δ-
一般:电负性差值<1.7为共价键,且电负性差值越大,键的极性越大。
如:H-F > H-Cl> H-Br > H-I
【注意】O3为极性共价键
一、共价键的极性
按照不同的分类方法,可将共价键分为不同的类型:
(1)按共用电子对数目
单键:如H-H键
双键:如C=C键
三键:如N≡N键
(2)按共用电子对是否偏移
非极性键:如Cl-Cl键
极性键:如H-Cl键
(3)按原子轨道的重叠方式
σ键
π键
σ键可以独立存在,
π键不能单独存在
【归纳2】
练一练
练习1:指出下列物质中的共价键类型
N2
CH4
CO2
CS2
H2O2
Na2O2
SiH4
NaOH
非极性键
极性键
极性键
极性键和非极性键
非极性键
极性键
非极性键
非极性键
练习2:含有非极性键的离子化合物( )
A.NaOH B.Na2O2 C.NaCl D.NH4Cl
B
一、共价键的极性
2.分子的极性
极性分子:正电中心和负电中心不重合
非极性分子:正电中心和负电中心重合
(1) 概念
(2) 判断方法
δ-
δ+
δ+
极性分子:
正、负电荷中心不重合的分子。
NH3
H2O
-
+
-
+
使分子的某个部分呈正电性(δ+),另一部分呈负电性(δ-)
方法一:分子极性可根据分子的正、负电荷中心是否重合判断
一、共价键的极性
正、负电荷中心重合的分子。
非极性分子:
BF3
CH4
CH2=CH2
2.分子的极性
方法一:分子极性可根据分子的正、负电荷中心是否重合判断
一、共价键的极性
方向:
大小:
由正电中心指向负电中心
电负性差值越大,键的极性越大,极性向量越大
方法二:分子极性也可根据化学键的极性的向量和判断
大小相等,方向相反,
向量和为0,
非极性分子:
B
F
F
F
平面三角形
直线形
正四面体形
2.分子的极性
F合=0
一、共价键的极性
δ-
δ+
δ+
键的极性向量和不为0
极性分子:
NH3 三角锥形
δ-
δ+
δ+
δ+
H2O
HCN
V形
H2O、
HCN、
NH3 等
方法二:分子极性也可根据化学键的极性的向量和判断
2.分子的极性
F合≠0
一、共价键的极性
常见的非极性分子和极性分子
δ+
δ-
C60
δ+
δ-
δ+
δ-
δ+
δ-
极性
分子:
非极性
分子:
一、共价键的极性
2.分子的极性
请分析O3分子的结构及空间构型
一、共价键的极性
臭氧是一种重要物质。大气高空的臭氧层保护了地球生物的生存;空气质量预报中臭氧含量是空气质量的重要指标;它还是有机合成的氧化剂、替代氯气的净水剂……
臭氧分子的空间结构与水分子的相似,
臭氧分子有极性,但很微弱。
仅是水分子的极性的28%。
臭氧分子中的共价键是极性键,
其中心氧原子是呈正电性的,
而端位的两个氧原子是呈电负性的。
臭氧的极性微弱,它在四氯化碳中的溶解度高于在水中的溶解度
资料卡片(P53)
一、共价键的极性
【思考与讨论】
(1)以下双原子分子中,哪些是极性分子,哪些是非极性分子
H2 O2 Cl2 HCl
(2)P4和C60是极性分子还是非极性分子?
(3)以下化合物分子中,哪些是极性分子,哪些是非极性分子?
结论1:只由非极性键形成的双原子分子、多原子分子是非极性分子。
结论2:由极性键形成的双原子分子,是极性分子。
结论3:由极性键形成的多原子分子,可能为极性分子 如 H2O2
也可能是非极性分子。如:SO2、CO2
CO2、 HCN、H2O、 NH3 、 BF3 、 CH4 、 CH3Cl、 SO2、SO3、BeCl2
(1)只由非极性键形成的双原子分子、多原子分子是非极性分子
如:O2、H2、P4、C60。
(2)由极性键形成的双原子分子,是极性分子。
如:HCl、HF、HBr
(3)由极性键形成的多原子分子,可能为极性分子 如 H2O2
也可能是非极性分子。如:SO2、CO2
经验规则:a.对ABn分子,当主族元素A的化合价的绝对值等于其价电子数时,该 分子为非极性分子。
AB2:直线形,如CO2
AB3:平面三角形,如BF3
AB4:正四面体形,如CCl4
AB5 :三角双锥形,如PCl5
AB6:正八面体形,如SF6
【总结归纳】
一、共价键的极性
一般非极性分子,中心原子无孤电子对
经验规则:b.可根据中心原子有无孤电子对判断。
BF3
CO2
PCl5
SO3
H2O
NH3
SO2
中心原子
化合价绝对值
孤电子对数
分子极性
3
0
4
0
5
0
6
0
2
2
3
1
4
1
非极
非极
非极
非极
极性
极性
极性
2.分子的极性
(3)由极性键形成的多原子分子,可能为极性分子 如 H2O2
也可能是非极性分子。如:SO2、CO2
空间结构
非中心对称
中心对称
非极性分子
极性分子
一、共价键的极性
共价键的极性和分子的极性的关系
小结
正负电荷中心
是否重合
分子的空间
结构
共价键的
极性
决定
分子的
极性
决定
正电中心和负电中心不重合
正电中心和负电中心重合
极性
分子
非极性
分子
稀有气体分子是非极性分子,不含共价键;
臭氧是极性分子,共价键为极性键
练习3:判断下列分子的极性
①H2 ②O2 ③HCl ④P4 ⑤C60 ⑥CO2 ⑦CH2==CH2 ⑧HCN
⑨H2O ⑩NH3 BF3 CH4 SO3 CH3Cl H2O2
属于非极性分子的是_______________________,
属于极性分子的是_____________。
①②④⑤⑥⑦
③⑧⑨⑩
练一练
表面活性剂(P53)
去污原理:
表面活性剂在水中会形成亲水基团向外,疏水基团向内的胶束,由于油渍等污垢是疏水的,会被包裹在胶束内腔,在摩擦力的作用下油渍脱离,达到去污目的。
为什么钠和水的反应比钠和乙醇的反应剧烈?
钠和水的反应
钠和乙醇的反应
H
O
H
δ+
δ-
C2H5
O
H
δ+
δ-
乙醇分子中的C2H5—是推电子基团,
使得乙醇分子中的电子云向着远离乙基的方向偏移
羟基的极性:
水分子 > 乙醇分子
一、共价键的极性
3.键的极性对化学性质的影响
CH3COOH
CH3COO- + H+
Ka =
c(CH3COO-) c(H+ )
c(CH3COOH)
pKa = -lgKa
pKa 越小,酸性越强
化学键的极性
物质的化学性质
分子结构
氢氧键的极性越大,O—H越容易断开,酸性越强。
(即共用电子对的偏移程度越大)
3.键的极性对化学性质的影响
一、共价键的极性
分析表格中pKa数据的变化规律及原因
酸
性
增
强
CH3
O
H
δ+
δ-
O
C
C2H5
O
H
δ+
δ-
O
C
H
O
H
δ+
δ-
O
C
烃基(R—)是推电子基团,烃基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
3.键的极性对化学性质的影响
一、共价键的极性
一、共价键的极性
酸
性
增
强
CH2
O
H
δ+
δ-
O
C
Cl
CH3
O
H
δ+
δ-
O
C
CH
O
H
δ+
δ-
O
C
Cl
Cl
C
O
H
δ+
δ-
O
C
Cl
Cl
Cl
氯的电负性较大,吸引键合电子对
3.键的极性对化学性质的影响
一、共价键的极性
Cl3C— > Cl2CH— > ClCH2—
三氯乙酸中的羧基的极性最大,更易电离出氢离子
氯的电负性较大,氯原子越多,酸性越强
羧基的极性:
羧酸 氯乙酸 (CH2ClCOOH) 二氯乙酸 (CHCl2COOH) 三氯乙酸
(CCl3COOH)
pKa 2.86 1.29 0.65
3.键的极性对化学性质的影响
一、共价键的极性
预测三氟乙酸和三氯乙酸的酸性相对强弱:
酸性增强
三氟乙酸中的羧基的极性更大,更易电离出氢离子
电负性:
F > Cl
羧基的极性:
F3C— > Cl3C—
羧酸 三氯乙酸(CCl3COOH) 三氟乙酸(CF3COOH)
pKa 0.65 0.23
3.键的极性对化学性质的影响
[小结]
羧基中羟基的极性越大,越容易电离出H+,则羧酸的酸性越大
-NO2 >-CN >-F >-Cl >-Br >-I > C C >-OCH3 >-OH >-C6H5 >-C=C
常见的吸电子基团:
常见的推电子基团:
(CH3)3C-> (CH3)2CH-> CH3CH2-> CH3-
推电子基,即将电子推向羟基,从而减小羟基的极性,导致羧酸的酸性减小。一般地,烃基越长,推电子效应越大,羧酸的酸性越小。
吸电子基,吸电子能力越强,电子向氯原子方向偏移程度越大,使羧基中羟基的极性增大,更容易电离出H+ 。
练习4:试比较下列有机酸的酸性强弱。
①CF3COOH ②CCl3COOH ③CHCl2COOH
④CH2ClCOOH ⑤CH3COOH ⑥CH3CH2COOH
①>②>③>④>⑤>⑥
练一练
分子结构修饰与分子的性质(P55)
三氯蔗糖
不改变分子的主体骨架,保持分子的基本结构不变,仅改变分子结构中的某些基团而得到新的分子,分子被修饰后,其性质也可以发生显著的变化。
三氯蔗糖又名蔗糖素,其甜度高、热量值极低,安全性好,可供糖尿病患者食用,被认为是近乎完美的甜味剂。
课堂小结
分子的极性
键的极性对化学性质的影响
极性分子:分子内正电中心和负电中心不重合
非极性分子:分子内正电中心和负电中心重合
烃基是推电子基团,烃基越长,推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱
键的极性
非极性键:同种元素构成,电子对不偏移
极性键:不同种元素,电子对偏移
课堂练习
1.下列叙述正确的是( )
A.构成单质分子的微粒一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定都是极性键
B
2.下列叙述中正确的是( )
A.卤化氢分子中,卤素的非金属性越强,共价键的极性越大,热稳定性
也越强
B.以极性键结合的分子,一定是极性分子
C.判断A2B或AB2型分子是否是极性分子的依据是看分子中是否含有极性键
D.非极性分子中,各原子间都应以非极性键结合
A
课堂练习
3.有一种AB2C2型分子,在该分子中A为中心原子。下列关于该分子的空间结构和极性的说法中,正确的是( )
A.假设为平面四边形,则该分子一定为非极性分子
B.假设为四面体形,则该分子一定为非极性分子
C.假设为平面四边形,则该分子可能为非极性分子
D.假设为四面体形,则该分子可能为非极性分子
C
