6.1 化学反应与能量变化 课时练习(含解析) 2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 6.1 化学反应与能量变化 课时练习(含解析) 2023-2024学年高一下学期化学人教版(2019)必修第二册 |

|
|
| 格式 | docx | ||
| 文件大小 | 362.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-08 00:00:00 | ||
图片预览




文档简介
6.1 化学反应与能量变化 课时练习
一、单选题
1.下列反应属于吸热反应的是( )
A.氢气燃烧 B.煅烧石灰石
C.酸碱中和反应 D.黑火药爆炸
2.在第七十五届联合国大会上,我国向国际社会作出“碳达峰、碳中和”的郑重承诺,树立了大国形象,彰显了大国担当。下列说法错误的是( )
A.研发新型催化剂将分解成碳和,同时吸收热量
B.2022年北京冬奥会使用氢燃料,有利于实现“碳达峰、碳中和”
C.煤燃烧时,化学能全部转化为热能
D.我国科学家构筑催化剂利用光合作用制备生物燃油(戊酸酯类),生物燃油是可再生能源
3.下列反应是吸热反应的是( )
A.Zn+H2SO4=ZnSO4+H2↑ B.CaCO3CaO+CO2↑
C.2Al+Fe2O32Fe+Al2O3 D.HCl+NH3·H2O=NH4Cl+H2O
4.下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,水的能量更低
B.化学反应发生物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.吸热反应一定需要加热条件才能发生
D.化学反应遵循质量守恒也遵循能量守恒
5.下列反应中,生成物所储存的化学能比反应物所储存的化学能多的是( )
A.2Na2O2 + 2H2O = 4NaOH + O2↑
B.NaOH + HCl = NaCl + H2O
C.CH4 + 2O2 CO2 + 2H2O
D.Ba(OH)2·8H2O + 2NH4Cl = BaCl2 + 2NH3↑ + 10H2O
6.甲酸(HCOOH)燃料电池对新能源的发展具有划时代的意义。研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。下列说法错误的是( )
A.电池负极电极反应式为:HCOO-+2OH--2e-=HCO +H2O
B.电池工作时,乙池中只发生还原反应
C.电池工作时,K+、H+从甲池通过半透膜向乙池迁移
D.电池工作时每消耗标准状况下22.4LO2,电路中转移的电子数目是4NA
7.已知298K时,一些物质的相对能量(见图)。可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。例如:H2O(g) H2O(l)ΔH=-286kJ·mol-1-(-242kJ·mol-1)=-44kJ·mol-1。则反应C2H6(g)+CO2(g)+H2O(g) 4H2(g)+3CO(g)的ΔH为( )
A.+430kJ·mol-1 B.-609kJ·mol-1
C.+609kJ·mol-1 D.+389kJ·mol-1
8.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg Mg2++2Ag+2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应式为AgCl+e-=Ag+Cl-
C.可用于海上应急照明供电
D.电池工作时,电解质溶液质量不断减轻
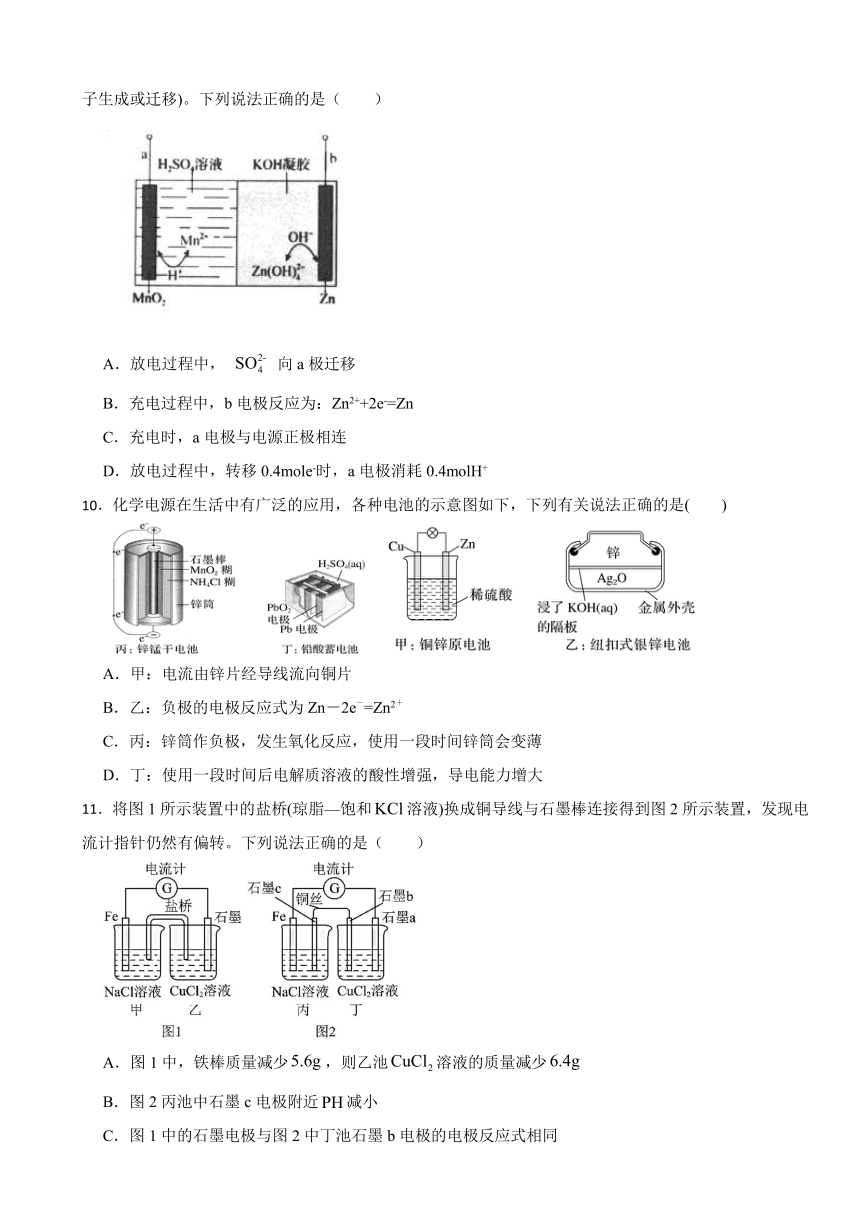
9.锌电池具有价格便宜、比能量大、可充电等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是( )
A.放电过程中, 向a极迁移
B.充电过程中,b电极反应为:Zn2++2e-=Zn
C.充电时,a电极与电源正极相连
D.放电过程中,转移0.4mole-时,a电极消耗0.4molH+
10.化学电源在生活中有广泛的应用,各种电池的示意图如下,下列有关说法正确的是( )
A.甲:电流由锌片经导线流向铜片
B.乙:负极的电极反应式为Zn-2e-=Zn2+
C.丙:锌筒作负极,发生氧化反应,使用一段时间锌筒会变薄
D.丁:使用一段时间后电解质溶液的酸性增强,导电能力增大
11.将图1所示装置中的盐桥(琼脂—饱和溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是( )
A.图1中,铁棒质量减少,则乙池溶液的质量减少
B.图2丙池中石墨c电极附近减小
C.图1中的石墨电极与图2中丁池石墨b电极的电极反应式相同
D.图2中电流方向为石墨c→铜丝→石墨b→石墨a→电流计
12.科学家最近发明了一种Al-PbO2电池,电解质为K2SO4、H2SO4、KOH,通过x(阳离子交换膜)和y(阴离子交换膜)将电解质溶液隔开,形成M、R、N三个电解质溶液区域,结构示意图如图所示。下列说法正确的是( )
A.放电时,K+通过x膜移向M区
B.放电时,正极反应式为PbO2+2e-+4H+=Pb2++2H2O
C.与Zn-PbO2电池相比较,Al-PbO2电池的比能量更高
D.消耗1.8gAl时N区域电解质溶液减少19.2g
13.人们在生产和生活中认识到,几乎在所有的化学变化过程中都伴随着能量变化,例如放热、吸热、发光、放电等等。如果从能量变化的角度来认识,下面说法中,正确的是( )
A.化学变化都是放热的
B.化学变化都是吸热的
C.反应物所含能量等于生成物所含能量
D.化学反应前后反应物和生成物所含能量会发生变化
14.下列反应中,反应物总能量比生成物总能量低的是( )
A.铁片和稀硫酸的反应 B.Ba(OH)2 8H2O与HCl溶液的反应
C.碳与水蒸气在高温下反应 D.甲烷在氧气中燃烧
15.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ。且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为( )
A.920kJ B.557kJ C.436kJ D.188kJ
16.日常所用的干电池的电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2氧化吸收H2),电极反应可简化为:Zn-2e-=Zn2+;2 +2e-=NH3+H2,根据上述叙述判断下列说法正确的是 ( )
A.干电池中锌为正极,碳为负极
B.干电池工作时,电流由锌极经外电路流向碳极
C.干电池长时间连续工作时,内装糊状物可能流出腐蚀用电器
D.干电池可实现化学能向电能的转化和电能向化学能的转化
17.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4溶液,工作时的电池反应为:
Pb+ PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是( )
A.Pb为正极,被氧化
B.电池工作时,电解质溶液的pH不断减小
C.向PbO2极移动
D.电池工作时,电解质溶液的pH不断增大
18.锰-锂锂离子电池结构如图所示。放电时总反应为:C(Li)+LiMn2O4=C+Li2Mn2O4[C(Li)表示锂原子嵌入石墨形成的复合材料]。下列说法错误的是( )
A.放电时,C(Li)为电池的负极
B.电解质溶液用稀H2SO4效果更好
C.放电时,电极LiMn2O4发生还原反应
D.负极反应为C(Li)-e-=C+Li+
19.南极臭氧洞是指臭氧的浓度较臭氧洞发生前减少超过30%的区域,臭氧洞的形成与2O3 3O2有关。下列叙述错误的是( )
A.该变化一定是化学变化
B.该变化一定伴随着能量的变化
C.该变化一定有共价键的断裂与生成
D.该变化一定有电子的转移
20.银锌电池用作各种电子仪器的电源,电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法不正确的是( )
A.原电池放电时,负极上发生反应的物质是Zn
B.正极发生的反应是Ag2O+2e +H2O=2Ag+2OH-
C.工作时,负极区溶液c(OH-)减小
D.溶液中OH-向正极移动,K+、H+向负极移动
二、综合题
21.回收利用炼铜工业产生的排放物,既能节约资源,又能保护环境.
(1)用足量氨水吸收尾气中的SO2后,再加入硫酸,可获得SO2和(NH4)2SO4两种产品.相关反应的化学方程式为 、 .
(2)烟灰中金属元素以硫酸盐和氧化物形态存在,其中锌、铅的含量最大,其次为铜、铁等.烟灰的回收利用工艺如下:
①“沉铜”可得到单质铜,该步骤应加入的试剂是 .
② “一次浸取”铜浸出率较低,原因是烟灰中部分铜元素以 (填化学式)残留在浸出渣中,“二次浸取”应选择 (填化学式)作浸取剂.
(3)从贵金属阳极泥中可提取粗银.电解法精炼粗银时采用AgNO3和HNO3的混合液作电解液,阴极的主要电极反应式为 .阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为 .
22.A,B,C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示:
(1)A中反应的离子方程式是 。
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是 ,总反应离子方程式是 ,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是 。
23.现代生活中,化学电源发挥越来越重要的作用。按要求回答下列问题:
(1)以和为电极,稀为电解质溶液形成的原电池中:
①向 极移动(填“正”或“负”)。
②若有流过导线,则理论上可以生成标准状况下 L。
③负极的电极反应方程式为: 。
(2)氢气、甲醇都是理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水的反应属于 (填“放热”或“吸热”)反应。液态甲醇完全燃烧生成液态水和二氧化碳气体时放出热量,则甲醇燃烧的热化学方程式为 。
(3)有人以化学反应:为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的进行工作。则原电池的负极材料是 ,正极发生的电极反应为 。
24.图1是铜锌原电池示意图。
(1)该装置中的能量转化方式是 能转化为电能。
(2)铜棒为 极(填“正”或“负”),该极上发生 反应;负极反应式为: 。
(3)图2中,x轴表示实验时流入正极的电子的物质的量,y轴可以表示___________。
A.锌棒的质量 B.c(Zn2+) C.c(H+) D.c(SO )
25.选择适宜的材料和试剂设计一个原电池,完成下列反应: Cu+ 2Ag+
= Cu2++2Ag。
(1)负极材料: 、正极材料: ; 电解质溶液:
(2)写出电极反应式:
正极: ;
负极: 。
(3)原电池中电子从 极流出, 电解质溶液中阴离子流向 极(填写电极名称“正”或“负”)。
答案解析部分
1.【答案】B
【解析】【解答】A、氢气燃烧为放热反应,A错误;
B、石灰石分解生成氧化钙和二氧化碳,为吸热反应,B正确;
C、酸碱中和为放热反应,C错误;
D、黑火药爆炸为放热反应,D错误;
故答案为:B
【分析】常见放热反应:燃烧、爆炸、金属腐蚀、食物腐烂、金属的置换反应、大部分化合反应、中和反应;
常见吸热反应:一氧化碳、碳、氢气为还原剂的氧化还原反应,大部分分解反应,八水合氢氧化钡和氯化铵的反应。
2.【答案】C
【解析】【解答】A.二氧化碳分解生成碳和氧气需要断裂化学键,需要吸收热量,A不符合题意;
B.使用氢燃料,减少了CO2的排放,有利于实现“碳达峰、碳中和”,B不符合题意;
C.煤燃烧时,化学能部分转化为热能,还有部分转变为光能,C符合题意;
D.利用光合作用可制备生物燃油,故生物燃油是可再生能源,D不符合题意;
故答案为:C。
【分析】A.断键吸收热量;
B.氢气燃烧的产物只有水,不会排放二氧化碳;
C.煤燃烧时,化学能转化为热能、光能等;
D.生物燃油可利用光合作用制备,属于可再生能源。
3.【答案】B
【解析】【解答】A.活泼金属与酸的置换反应为放热反应,A不符合题意;
B.大部分分解反应,如碳酸钙高温分解为吸热反应,B符合题意;
C.铝热反应为放热反应,C不符合题意;
D.酸和碱的中和反应为放热反应,D不符合题意;
故答案为B。
【分析】常见的吸热反应有:
1.一些分解反应,如碳酸钙高温分解。
2.一些复分解反应,如氯化铵(固体)与八水氢氧化钡(固体)的反应。
3.一些置换反应,如单质碳与水蒸气在高温下的反应。
4.一些化合反应,如碳与二氧化碳在高温下的反应。
常见的放热反应有:
1.活泼金属与水或酸的反应。
2.酸碱中和反应。
3.铝热反应。
4.所有的燃烧反应。
5.一些化合反应,如三氧化硫、氧化钙等与水的反应。
4.【答案】D
【解析】【解答】A、“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰熔化需吸收能量,水的能量高,故A错误;
B、化学反应的能量表现形式有热能、光能、电能等,不一定只有吸热和放热,故B错误;
C、吸热反应不一定需要加热才能发生,故C错误;
D、化学反应遵循质量守恒的同时也遵循能量守恒,故D正确;
故答案为:D。
【分析】 A、冰熔化需吸收能量;
B、化学反应的能量表现形式有热能、光能、电能等;
C、反应吸热还是放热与反应条件无关;
D、化学反应遵循质量守恒和能量守恒。
5.【答案】D
【解析】【解答】A.过氧化钠与水的反应是放热反应,反应物能量高于生成物能量,A不符合题意;
B.氢氧化钠与盐酸反应属于中和反应,是放热反应,反应物能量高于生成物能量,B不符合题意;
C.甲烷的燃烧属于放热反应,反应物能量高于生成物能量,C不符合题意;
D.氯化铵和氢氧化钡晶体的反应属于吸热反应,反应物能量低于生成物能量,D符合题意
故答案为:D
【分析】综合分析,如果是放热反应,则反应物能量高于生成物能量;如果是吸热反应,则反应物能量低于生成物能量。
6.【答案】B
【解析】【解答】A.HCOOH失电子生成KHCO3,做负极,电极反应式为:HCOO-+2OH--2e-=HCO +H2O,A不符合题意;
B.电池工作时,乙池中Fe3+得电子生成Fe2+,发生还原反应,Fe2+被氧气氧化,发生氧化反应,所以乙池既发生了还原反应又发生了氧化反应,B符合题意;
C.原电池工作时,阳离子移向正极,所以K+、H+从甲池通过半透膜向乙池迁移,C不符合题意;
D.根据反应方程式: 和 可知,电池工作时每消耗标准状况下22.4LO2,电路中转移的电子数目是4NA,D不符合题意;
故答案为:B
【分析】HCOOH失电子生成KHCO3,做负极;Fe3+得电子生成Fe2+,做正极。
7.【答案】D
【解析】【解答】ΔH=生成物的总能量-反应物的总能量,则反应C2H6(g)+CO2(g)+H2O(g) 4H2(g)+3CO(g)的ΔH=4×0+3×(-110kJ·mol-1)-( -84kJ·mol-1)- ( -393kJ·mol-1)- ( -242kJ·mol-1)=+389kJ·mol-1,故D符合题意;
故答案为:D。
【分析】根据ΔH=生成物的总能量-反应物的总能量计算。
8.【答案】C
【解析】【解答】A.由分析可知,Mg为负极,A不符合题意;
B.由分析可知,负极的电极反应式为Mg-2e-=Mg2+,B不符合题意;
C.该电池反应将化学能转化为电能,可用于海上应急照明供电,C符合题意;
D.由电池反应方程式可知,反应后,电解质溶液的质量增加,D不符合题意;
故答案为:C
【分析】由电池反应方程式可知,AgCl转化为Ag,发生得电子的还原反应,因此AgCl为正极,其电极反应式为:2AgCl+2e-=2Ag+2Cl-;Mg转化为Mg2+,发生失电子的氧化反应,为负极,其电极反应式为:Mg-2e-=Mg2+;据此结合选项进行分析。
9.【答案】C
【解析】【解答】A.放电过程中,a为正极, b极为负极,溶液中阳离子移向正极,阴离子移向负极,所以放电过程中, 向b极迁移,A项不符合题意;
B.充电过程中b电极得到电子发生还原反应,由于在碱性环境中Zn以 形式存在,则充电过程中, b电极应为: +2e-=Zn+4OH-,B项不符合题意;
C.由图示可知,充电时,a电极失电子发生氧化反应,即a电极与电源正极相连,C项符合题意;
D.放电过程中b电极为负极,其电极反应式为Zn+4OH--2e-= , a极为正极,则其电极反应式为, MnO2+4H++2e-=Mn2+ +2H2O,所以放电过程中,转移0.4mole-时,a电极消耗0.8molH+,D项不符合题意;
故答案为:C。
【分析】根据放电过程中,b为负极,锌失去电子变为结合氢氧根离子变为,电极式为:Zn+4OH--2e-= , a为正极,是二氧化锰得到电子变为锰离子的过程,电极式为:MnO2+4H++2e-=Mn2+ +2H2O,放电时,阴离子向负极,充电时a连接的是电池的正极,发生的反应是Mn2+ +2H2O-2e=MnO2+4H+,b连接的是电池的阴极,发生的反应是: +2e-=Zn+4OH-,结合选项进行判断即可
10.【答案】C
【解析】【解答】A.甲是铜锌原电池,其中锌是负极,铜是正极,电子由锌片经导线流向铜片,A正确;
B.乙是纽扣式银锌电池,锌是负极,氧化银是正极,负极的电极反应式为Zn-2e-=Zn2+,B正确;
C.丙是锌锰干电池,锌筒作负极,发生氧化反应,使用一段时间锌筒会变薄,C错误;
D.丁是铅蓄电池,放电时消耗硫酸,所以使用一段时间后电解质溶液的酸性减弱,导电能力下降,D正确;
故答案为:C。
【分析】放电时,负极失电子,元素化合价升高,发生氧化反应;正极得电子,元素化合价降低,发生还原反应;原电池“同性相吸”,阳离子移向正极,阴离子移向负极。
11.【答案】D
【解析】【解答】A、图1中,铁棒作负极,铁棒质量减少,即0.1mol,失去0.2mol电子,乙池溶液中消耗0.1mol()得0.2mol电子,但盐桥中有向乙烧杯中移动,乙池溶液的减少质量小于,A错误;
B、图2丙池发生吸氧腐蚀,正极电极反应式:,石墨c电极附近pH增大,B错误;
C、图1中的石墨电极作原电池正极,发生还原反应;图2中丁池石墨b电极为电解池阳极,发生氧化反应生成氯气,电极反应式不同,C错误;
D、图2中电流方向为石墨c→铜丝→石墨b→石墨a→电流计,D正确;
故答案为:D。
【分析】图1甲、乙构成原电池,甲为负极,乙为正极, 将图1所示装置中的盐桥(琼脂—饱和溶液)换成铜导线与石墨棒连接得到图2所示装置 ,图2为电解池装置,丙烧杯中铁作负极,石墨c作正极,发生吸氧腐蚀,则石墨a为阴极,石墨b为阳极。
12.【答案】C
【解析】【解答】A.由分析可知,Al为负极, M区为负极区,阳离子流向正极区,故K+通过x膜移向R区,A项不符合题意;
B.放电时,正极反应为PbO2++2e-+4H+=PbSO4+2H2O,B项不符合题意;
C.比能量是指参加电极反应的单位质量的电极材料放出电能的大小,Zn与Al相比质量更重,且每一个Zn转移2个电子,1个Al转移3个电子,故Al-PbO2电池的比能量更高,C项符合题意;
D.消耗1.8g Al时电路上转移的电子数目为0.20mol,则由N区溶液减少0.4mol氢离子和0.1mol硫酸根离子,同时有0.1mol硫酸根离子移向R区,相当于减小0.2mol硫酸,同时生成0.2mol水,N极区实际减少质量为0.2mol×98g/mol-0.2mol×19g/mol=16g,D项不符合题意;
故答案为:C。
【分析】该原电池工作时,Al为负极,被氧化生成[Al(OH)4]-,负极反应式为Al-3e-+4OH-=[Al(OH)4]-,PbO2为正极,发生还原反应,电极反应式为PbO2++2e-+4H+=PbSO4+2H2O,电解质溶液M为KOH,R为K2SO4,C为H2SO4,正极消耗氢离子,阴离子向负极移动,则y是阳离子交换膜,x是阴离子交换膜。
13.【答案】D
【解析】【解答】A. 化学变化不一定都是放热的,也可能吸热,A不符合题意;
B. 化学变化不一定都是吸热的,也可能放热,B不符合题意;
C. 任何化学反应都伴随能量变化,反应物所含能量一定不等于生成物所含能量,C不符合题意;
D. 任何化学反应都伴随能量变化,因此化学反应前后反应物和生成物所含能量会发生变化,D符合题意。
故答案为:D。
【分析】化学反应一般伴随着能量的变化,可表现出吸热或者是放热,反应物和生成物具有的总能量是变化的。能量低的物质较稳定
14.【答案】C
【解析】【解答】A.铁片和稀硫酸的反应为放热反应,反应物的总能量高于生成物的总能量,A不符合题意;
B.Ba(OH)2 8H2O与HCl溶液的反应为放热反应,反应物的总能量高于生成物的总能量,B不符合题意;
C.碳与水蒸气在高温下反应为吸热反应,反应物的总能量低于生成物的总能量,C符合题意;
D.甲烷在氧气中燃烧为放热反应,反应物的总能量高于生成物的总能量,D不符合题意;
故答案为C。
【分析】熟悉常见的放热反应(燃烧、铝热反应、大部分的化合反应),吸热反应(C、CO、H2还原金属氧化物的反应、煤的汽化、大部分分解反应),这要求平时对一些典型的吸热和放热反应要牢记。
15.【答案】C
【解析】【解答】根据2H2+O2=2H2O反应,1g氢气完全燃烧生成水蒸气时放出热量121kJ,则2mol H2即4g完全燃烧生成水蒸气时放出热量484 kJ,设1mol H—H键断裂时吸收热量为x kJ,根据化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量可得463kJ×4 496kJ 2x=484 kJ,x =436kJ,
故答案为:C。
【分析】化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,依此结合反应方程式进行计算。
16.【答案】C
【解析】【解答】A.由分析可知,Zn作负极,石墨作正极,A不符合题意;
B.电流由正极(石墨)经导线流向负极(锌),B不符合题意;
C.干电池时间连续工作,负极锌片被腐蚀,内装糊状物可能流出腐蚀用电器,C符合题意;
D.干电池是一次性电池,不能反复充电,只能实现化学能向电能转化,D不符合题意。
故答案为:C。
【分析】Zn作负极,电极反应式为Zn-2e-=Zn2+;
石墨作正极,电极反应式为2 +2e-=NH3+H2。
17.【答案】D
【解析】【解答】A.根据化合价的变化,Pb的化合价升高,说明其失去电子,作的是原电池的负极,被氧化,A选项是错误的;
B.电池工作时,电解质溶液的pH值是不断增大的,因为是在消耗H2SO4的,B选项是错误的;
C.PbO2是正极,在原电池的电解质溶液中 ,遵循“正正负负”原理,即SO42-不断移向负极,C选项是错误的;
D.根据B可知,电解质溶液的pH值是不断增大的,D选项是正确的。
故答案为:D。
【分析】A.在原电池中,负极失去电子发生氧化反应,正极得到电子,发生还原反应;
B.反应消耗H2SO4,所以电解质溶液的pH值会增大;
C.SO42-不断移向Pb电极;
D.电解质溶液的pH值是不断增大的。
18.【答案】B
【解析】【解答】A.放电时C(Li)失电子被氧化,所以为负极,故A不符合题意;
B.金属Li会与稀硫酸发生反应,降低电池的效率,故B符合题意;
C.放电时LiMn2O4为正极,得电子发生还原反应,故C不符合题意;
D.放电时C(Li)失电子被氧化为负极,根据总反应可知电极反应为C(Li)-e-=C+Li+,故D不符合题意;
故答案为:B。
【分析】根据电极总反应可知放电时C(Li)失电子被氧化,所以为负极,则LiMn2O4为正极。
19.【答案】D
【解析】【解答】A. 臭氧转化为氧气,有新物质生成,一定是化学变化,A不符合题意;
B. 化学变化中一定伴随若能量的变化,B不符合题意;
C. 氧气和臭氧中均存在共价键,该变化一定有共价键的断裂与生成,C不符合题意;
D. 该变化不是氧化还原反应,没有电子的转移,D符合题意;
故答案为:D。
【分析】O由0价到0价,不是氧化还原反应,无电子的转移
20.【答案】D
【解析】【解答】A.根据电池反应式知,放电时Zn为负极, Zn失电子生成Zn2+,负极上发生反应的物质是Zn,A选项是正确的;
B.正极材料是Ag2O,得到电子,发生还原反应: Ag2O+2e +H2O=2Ag+2OH- ,B选项是正确的;
C.负极上zn失电子生成Zn2+,电极反应式为:Zn+2OH- - 2e-=Zn(OH)2,则负极区溶液c(OH-)减小,C选项是正确的;
D.根据原电池中电解质溶液中阴阳离子流向遵循“正正负负”原则,可知,OH-移向负极,K+和H+移向正极,D选项是错误的。
故答案为:D。
【分析】原电池的工作原理:在外电路中,由负极失去电子,经过导线到达正极;在内电路中,是阴阳离子实现导电的作用,形成闭合回路,阴离子在电解质溶液中靠近负极,阳离子在电解质溶液中靠近正极。
21.【答案】(1)SO2+2NH3·H2O=(NH4)2SO3+H2O;(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O
(2)锌粉(或铁粉);CuO;H2SO4
(3)Ag++e-=Ag;NO3-+4H++3e-=NO↑+2H2O
【解析】【解答】(1)SO2溶于水后形成H2SO3,具有酸性,能与氨水反应,该反应的化学方程式为: SO2+2NH3·H2O=(NH4)2SO3+H2O;形成的(NH4)2SO3溶液中加入硫酸后,由于酸性H2SO4>H2SO3,故能反应生成SO2,该反应的化学方程式为: (NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
(2)①沉铜过程中主要是将盐溶液中的Cu2+转化为Cu,故所加试剂应为比铜活泼的金属,故可加入铁粉或锌粉;
②“一次浸取”所加试剂为水,而烟灰中的CuO不溶于水,故铜元素以CuO的形式沉积在浸出渣中;“二次浸取”时,是为了将CuO溶解成铜离子的溶液,故应加入酸溶液,结合最后说的产物3PbO·PbSO4·H2O可知,所加酸溶液为H2SO4;
(3)电解过程中,阴极发生Ag+得电子的还原反应,其电极反应式为:Ag++e-=Ag;由于HNO3具有氧化性,易被还原为NO,故该副反应的电极反应式为:NO3-+4H++3e-=NO+2H2O;
【分析】(1)SO2的水溶液显酸性,能与氨水溶液反应;根据强酸制弱酸原理书写反应的化学方程式;
(2)①根据金属活动性确定所加试剂;
②CuO不溶于水;结合二次浸取后所得产物的化学式确定二次浸取所加试剂;
(3)电解过程中,阴极发生Ag+得电子的还原反应,同时由于HNO3的氧化性,易得电子变为NO;
22.【答案】(1)Fe+2H+=Fe2++H2↑
(2)2H++2e-=H2↑;增大
(3)Zn;Zn+2H+=Zn2++H2↑;B>A>C
【解析】【解答】(1)A中铁与稀硫酸反应生成硫酸亚铁和氢气,反应离子方程式是Fe+2H+=Fe2++H2↑;
(2)装置B构成Sn、Fe原电池,Fe的活泼性大于Sn, Fe作负极,负极反应式是Fe-2e- =Fe2+, Sn作正极,正极反应式是2H++2e-=H2↑,正极氢离子浓度减小,所以Sn极附近溶液的pH增大。
(3)装置B构成Zn、Fe原电池,Fe的活泼性小于Zn, Fe作正极, Zn作负极。总反应是锌与硫酸反应生成硫酸锌和氢气,反应离子方程式是Zn+2H+=Zn2++H2↑;A中铁发生化学腐蚀,B中铁作原电池负极,腐蚀速率加快,C中Fe作正极,铁被保护,所以A、B、C中铁被腐蚀的速率由快到慢的顺序是B>A>C。
【分析】(1)A中发生铁与稀硫酸的置换反应;
(2)装置B形成原电池,Fe的金属性大于Sn,Fe作负极,Sn做正极;
(3)装置C形成原电池,Fe的金属性小于Zn,Fe作正极,Sn负正极。
23.【答案】(1)正;11.2;Fe-2e-=Fe2+
(2)吸热;2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452.8kJ/mol
(3)锌;O2+4H++4e-=2H2O
【解析】【解答】(1)Fe和Cu为电极,稀H2SO4为电解质溶液形成的原电池,铁的活泼性大于铜,铁做负极,铜做正极;
①原电池中阳离子向正极移动,因此H+向正极移动;
②Cu作正极,H+得到电子生成H2,正极反应为:2H++2e-=H2,所以若有1mol e-流过导线,理论上生成0.5molH2,标准状况下的体积为0.5mol×22.4L/mol=11.2L;
③铁做负极,Fe失去电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+;
(2)科学家使海水分解得到氢气,电解水需要消耗能量,该反应是吸热反应,CH3OH(l)在氧气中充分燃烧生成二氧化碳和液态水的方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),1g CH3OH(l)完全燃烧释放22.7kJ,2mol甲醇的质量为64g,则完全燃烧释放的热量为22.7kJ×64=1452.8kJ,则热化学方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452.8kJ/mol;
(3)由反应2Zn+O2+4H+=2Zn2++2H2O可知,反应中锌失去电子,所以原电池的负极材料是锌,Zn被氧化生成Zn2+,正极上O2发生还原反应,产物为H2O,电极反应式为O2+4H++4e-=2H2O。
【分析】(1)①该原电池中Fe为负极,Cu为正极,原电池工作时,阳离子向正极移动;
②根据2H++2e-=H2,结合V=nVm计算;
③负极为Fe失去电子,电极反应为Fe-2e-=Fe2+;
(2)分解海水吸热;1g CH3OH(l)完全燃烧释放22.7kJ,2mol甲醇的质量为64g,则完全燃烧释放的热量为22.7kJ×64=1452.8kJ,据此书写热化学方程式;
(3)根据反应可知,锌失去电子发生氧化反应,作负极;正极上为氧气得电子结合氢离子生成水。
24.【答案】(1)化学
(2)正极;还原反应;Zn-2e- = Zn2+
(3)A;C
【解析】【解答】(1)该装置是原电池,故能量转化方式是化学能转化为电能;
(2)原电池总反应为锌和稀硫酸的反应,铜不活泼,铜棒为正极,氢离子在铜上得到电子,发生2H++2e-=H2 ,故该极上发生还原反应;锌比铜活泼,锌作负极,负极反应式为:Zn-2e- = Zn2+;
(3)图2中,当x轴表示实验时流入正极的电子的物质的量,随着x的增大,
A. 据电极反应式Zn-2e- = Zn2+知:溶解锌棒的质量随流入正极的电子的物质的量而增大,故锌棒的质量减小,A选;
B. c(Zn2+)随着流入正极的电子的物质的量增大,B不选;
C .正极反应式为:2H++2e-=H2 ,则c(H+)随流入正极的电子的物质的量而减小,C选;
D . SO 不参加反应,故c(SO )不发生变化,D不选;
故答案为:AC。
【分析】原电池中,还原剂在负极失去电子发生氧化反应,电子从负极流出,电子沿着导线流向正极,正极上氧化剂得到电子发生还原反应,内电路中阴离子移向负极、阳离子移向正极,据此分析;
25.【答案】(1)铜片;石墨;AgNO3溶液
(2)2Ag++2e-=2Ag;Cu-2e-=Cu2+
(3)负;负
【解析】【解答】(1)根据电极反应式,负极升失氧,正极降得还,先确定Cu作负极,电解质溶液为硝酸银,则再选石墨(或活泼性比Cu弱的金属)为正极;
故答案为:铜片 石墨 AgNO3溶液
(2)根据正极降得还,可知正极电极反应式为:2Ag++2e-=2Ag;根据负极升失氧,可知电极反应式为:Cu-2e-=Cu2+;
故答案为:2Ag++2e-=2Ag;Cu-2e-=Cu2+
(3)原电池中,电子从负极流出经过外电路流向正极;内部阴离子向负极移动,阳离子向正极移动;
故答案为:负 负
【分析】(1)相对活泼的金属做原电池的负极,电解质溶液一定含有银离子;
(2)原电池的正极发生还原反应,负极发生氧化反应;
(3)原电池中电子从负极流出延导线流向正极。
一、单选题
1.下列反应属于吸热反应的是( )
A.氢气燃烧 B.煅烧石灰石
C.酸碱中和反应 D.黑火药爆炸
2.在第七十五届联合国大会上,我国向国际社会作出“碳达峰、碳中和”的郑重承诺,树立了大国形象,彰显了大国担当。下列说法错误的是( )
A.研发新型催化剂将分解成碳和,同时吸收热量
B.2022年北京冬奥会使用氢燃料,有利于实现“碳达峰、碳中和”
C.煤燃烧时,化学能全部转化为热能
D.我国科学家构筑催化剂利用光合作用制备生物燃油(戊酸酯类),生物燃油是可再生能源
3.下列反应是吸热反应的是( )
A.Zn+H2SO4=ZnSO4+H2↑ B.CaCO3CaO+CO2↑
C.2Al+Fe2O32Fe+Al2O3 D.HCl+NH3·H2O=NH4Cl+H2O
4.下列关于能量变化的说法正确的是( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,水的能量更低
B.化学反应发生物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.吸热反应一定需要加热条件才能发生
D.化学反应遵循质量守恒也遵循能量守恒
5.下列反应中,生成物所储存的化学能比反应物所储存的化学能多的是( )
A.2Na2O2 + 2H2O = 4NaOH + O2↑
B.NaOH + HCl = NaCl + H2O
C.CH4 + 2O2 CO2 + 2H2O
D.Ba(OH)2·8H2O + 2NH4Cl = BaCl2 + 2NH3↑ + 10H2O
6.甲酸(HCOOH)燃料电池对新能源的发展具有划时代的意义。研究HCOOH燃料电池性能的装置如图所示,两电极区间用允许K+、H+通过的半透膜隔开。下列说法错误的是( )
A.电池负极电极反应式为:HCOO-+2OH--2e-=HCO +H2O
B.电池工作时,乙池中只发生还原反应
C.电池工作时,K+、H+从甲池通过半透膜向乙池迁移
D.电池工作时每消耗标准状况下22.4LO2,电路中转移的电子数目是4NA
7.已知298K时,一些物质的相对能量(见图)。可根据相关物质的相对能量计算反应或变化的ΔH(ΔH随温度变化可忽略)。例如:H2O(g) H2O(l)ΔH=-286kJ·mol-1-(-242kJ·mol-1)=-44kJ·mol-1。则反应C2H6(g)+CO2(g)+H2O(g) 4H2(g)+3CO(g)的ΔH为( )
A.+430kJ·mol-1 B.-609kJ·mol-1
C.+609kJ·mol-1 D.+389kJ·mol-1
8.Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg Mg2++2Ag+2Cl-。有关该电池的说法正确的是( )
A.Mg为电池的正极
B.负极反应式为AgCl+e-=Ag+Cl-
C.可用于海上应急照明供电
D.电池工作时,电解质溶液质量不断减轻
9.锌电池具有价格便宜、比能量大、可充电等优点。一种新型锌电池的工作原理如图所示(凝胶中允许离子生成或迁移)。下列说法正确的是( )
A.放电过程中, 向a极迁移
B.充电过程中,b电极反应为:Zn2++2e-=Zn
C.充电时,a电极与电源正极相连
D.放电过程中,转移0.4mole-时,a电极消耗0.4molH+
10.化学电源在生活中有广泛的应用,各种电池的示意图如下,下列有关说法正确的是( )
A.甲:电流由锌片经导线流向铜片
B.乙:负极的电极反应式为Zn-2e-=Zn2+
C.丙:锌筒作负极,发生氧化反应,使用一段时间锌筒会变薄
D.丁:使用一段时间后电解质溶液的酸性增强,导电能力增大
11.将图1所示装置中的盐桥(琼脂—饱和溶液)换成铜导线与石墨棒连接得到图2所示装置,发现电流计指针仍然有偏转。下列说法正确的是( )
A.图1中,铁棒质量减少,则乙池溶液的质量减少
B.图2丙池中石墨c电极附近减小
C.图1中的石墨电极与图2中丁池石墨b电极的电极反应式相同
D.图2中电流方向为石墨c→铜丝→石墨b→石墨a→电流计
12.科学家最近发明了一种Al-PbO2电池,电解质为K2SO4、H2SO4、KOH,通过x(阳离子交换膜)和y(阴离子交换膜)将电解质溶液隔开,形成M、R、N三个电解质溶液区域,结构示意图如图所示。下列说法正确的是( )
A.放电时,K+通过x膜移向M区
B.放电时,正极反应式为PbO2+2e-+4H+=Pb2++2H2O
C.与Zn-PbO2电池相比较,Al-PbO2电池的比能量更高
D.消耗1.8gAl时N区域电解质溶液减少19.2g
13.人们在生产和生活中认识到,几乎在所有的化学变化过程中都伴随着能量变化,例如放热、吸热、发光、放电等等。如果从能量变化的角度来认识,下面说法中,正确的是( )
A.化学变化都是放热的
B.化学变化都是吸热的
C.反应物所含能量等于生成物所含能量
D.化学反应前后反应物和生成物所含能量会发生变化
14.下列反应中,反应物总能量比生成物总能量低的是( )
A.铁片和稀硫酸的反应 B.Ba(OH)2 8H2O与HCl溶液的反应
C.碳与水蒸气在高温下反应 D.甲烷在氧气中燃烧
15.已知1g氢气完全燃烧生成水蒸气时放出热量121kJ。且氧气中1molO=O键完全断裂时吸收热量496kJ,水蒸气中1molH-O键形成时放出热量463kJ,则氢气中1molH-H键断裂时吸收热量为( )
A.920kJ B.557kJ C.436kJ D.188kJ
16.日常所用的干电池的电极分别为碳棒和锌皮,以糊状NH4Cl和ZnCl2作电解质(其中加入MnO2氧化吸收H2),电极反应可简化为:Zn-2e-=Zn2+;2 +2e-=NH3+H2,根据上述叙述判断下列说法正确的是 ( )
A.干电池中锌为正极,碳为负极
B.干电池工作时,电流由锌极经外电路流向碳极
C.干电池长时间连续工作时,内装糊状物可能流出腐蚀用电器
D.干电池可实现化学能向电能的转化和电能向化学能的转化
17.铅蓄电池的两极分别为Pb、PbO2,电解质溶液为H2SO4溶液,工作时的电池反应为:
Pb+ PbO2+2H2SO4=2PbSO4+2H2O,下列结论正确的是( )
A.Pb为正极,被氧化
B.电池工作时,电解质溶液的pH不断减小
C.向PbO2极移动
D.电池工作时,电解质溶液的pH不断增大
18.锰-锂锂离子电池结构如图所示。放电时总反应为:C(Li)+LiMn2O4=C+Li2Mn2O4[C(Li)表示锂原子嵌入石墨形成的复合材料]。下列说法错误的是( )
A.放电时,C(Li)为电池的负极
B.电解质溶液用稀H2SO4效果更好
C.放电时,电极LiMn2O4发生还原反应
D.负极反应为C(Li)-e-=C+Li+
19.南极臭氧洞是指臭氧的浓度较臭氧洞发生前减少超过30%的区域,臭氧洞的形成与2O3 3O2有关。下列叙述错误的是( )
A.该变化一定是化学变化
B.该变化一定伴随着能量的变化
C.该变化一定有共价键的断裂与生成
D.该变化一定有电子的转移
20.银锌电池用作各种电子仪器的电源,电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O=2Ag+Zn(OH)2,下列说法不正确的是( )
A.原电池放电时,负极上发生反应的物质是Zn
B.正极发生的反应是Ag2O+2e +H2O=2Ag+2OH-
C.工作时,负极区溶液c(OH-)减小
D.溶液中OH-向正极移动,K+、H+向负极移动
二、综合题
21.回收利用炼铜工业产生的排放物,既能节约资源,又能保护环境.
(1)用足量氨水吸收尾气中的SO2后,再加入硫酸,可获得SO2和(NH4)2SO4两种产品.相关反应的化学方程式为 、 .
(2)烟灰中金属元素以硫酸盐和氧化物形态存在,其中锌、铅的含量最大,其次为铜、铁等.烟灰的回收利用工艺如下:
①“沉铜”可得到单质铜,该步骤应加入的试剂是 .
② “一次浸取”铜浸出率较低,原因是烟灰中部分铜元素以 (填化学式)残留在浸出渣中,“二次浸取”应选择 (填化学式)作浸取剂.
(3)从贵金属阳极泥中可提取粗银.电解法精炼粗银时采用AgNO3和HNO3的混合液作电解液,阴极的主要电极反应式为 .阴极还有少量副反应发生,产生的气体遇空气迅速变为红棕色,该副反应的电极反应式为 .
22.A,B,C三个烧杯中分别盛有相同物质的量浓度的稀硫酸,如下图所示:
(1)A中反应的离子方程式是 。
(2)B中Sn极的电极反应式为 ,Sn极附近溶液的pH (填“增大”“减小”或“不变”)。
(3)C中被腐蚀的金属是 ,总反应离子方程式是 ,比较A、B、C中铁被腐蚀的速率由快到慢的顺序是 。
23.现代生活中,化学电源发挥越来越重要的作用。按要求回答下列问题:
(1)以和为电极,稀为电解质溶液形成的原电池中:
①向 极移动(填“正”或“负”)。
②若有流过导线,则理论上可以生成标准状况下 L。
③负极的电极反应方程式为: 。
(2)氢气、甲醇都是理想的能源,科学家最近研制使海水分解得到氢气的新技术。分解海水的反应属于 (填“放热”或“吸热”)反应。液态甲醇完全燃烧生成液态水和二氧化碳气体时放出热量,则甲醇燃烧的热化学方程式为 。
(3)有人以化学反应:为基础设计一种原电池,移入人体内作为心脏起搏器的能源,它靠人体内血液中溶有一定浓度的进行工作。则原电池的负极材料是 ,正极发生的电极反应为 。
24.图1是铜锌原电池示意图。
(1)该装置中的能量转化方式是 能转化为电能。
(2)铜棒为 极(填“正”或“负”),该极上发生 反应;负极反应式为: 。
(3)图2中,x轴表示实验时流入正极的电子的物质的量,y轴可以表示___________。
A.锌棒的质量 B.c(Zn2+) C.c(H+) D.c(SO )
25.选择适宜的材料和试剂设计一个原电池,完成下列反应: Cu+ 2Ag+
= Cu2++2Ag。
(1)负极材料: 、正极材料: ; 电解质溶液:
(2)写出电极反应式:
正极: ;
负极: 。
(3)原电池中电子从 极流出, 电解质溶液中阴离子流向 极(填写电极名称“正”或“负”)。
答案解析部分
1.【答案】B
【解析】【解答】A、氢气燃烧为放热反应,A错误;
B、石灰石分解生成氧化钙和二氧化碳,为吸热反应,B正确;
C、酸碱中和为放热反应,C错误;
D、黑火药爆炸为放热反应,D错误;
故答案为:B
【分析】常见放热反应:燃烧、爆炸、金属腐蚀、食物腐烂、金属的置换反应、大部分化合反应、中和反应;
常见吸热反应:一氧化碳、碳、氢气为还原剂的氧化还原反应,大部分分解反应,八水合氢氧化钡和氯化铵的反应。
2.【答案】C
【解析】【解答】A.二氧化碳分解生成碳和氧气需要断裂化学键,需要吸收热量,A不符合题意;
B.使用氢燃料,减少了CO2的排放,有利于实现“碳达峰、碳中和”,B不符合题意;
C.煤燃烧时,化学能部分转化为热能,还有部分转变为光能,C符合题意;
D.利用光合作用可制备生物燃油,故生物燃油是可再生能源,D不符合题意;
故答案为:C。
【分析】A.断键吸收热量;
B.氢气燃烧的产物只有水,不会排放二氧化碳;
C.煤燃烧时,化学能转化为热能、光能等;
D.生物燃油可利用光合作用制备,属于可再生能源。
3.【答案】B
【解析】【解答】A.活泼金属与酸的置换反应为放热反应,A不符合题意;
B.大部分分解反应,如碳酸钙高温分解为吸热反应,B符合题意;
C.铝热反应为放热反应,C不符合题意;
D.酸和碱的中和反应为放热反应,D不符合题意;
故答案为B。
【分析】常见的吸热反应有:
1.一些分解反应,如碳酸钙高温分解。
2.一些复分解反应,如氯化铵(固体)与八水氢氧化钡(固体)的反应。
3.一些置换反应,如单质碳与水蒸气在高温下的反应。
4.一些化合反应,如碳与二氧化碳在高温下的反应。
常见的放热反应有:
1.活泼金属与水或酸的反应。
2.酸碱中和反应。
3.铝热反应。
4.所有的燃烧反应。
5.一些化合反应,如三氧化硫、氧化钙等与水的反应。
4.【答案】D
【解析】【解答】A、“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰熔化需吸收能量,水的能量高,故A错误;
B、化学反应的能量表现形式有热能、光能、电能等,不一定只有吸热和放热,故B错误;
C、吸热反应不一定需要加热才能发生,故C错误;
D、化学反应遵循质量守恒的同时也遵循能量守恒,故D正确;
故答案为:D。
【分析】 A、冰熔化需吸收能量;
B、化学反应的能量表现形式有热能、光能、电能等;
C、反应吸热还是放热与反应条件无关;
D、化学反应遵循质量守恒和能量守恒。
5.【答案】D
【解析】【解答】A.过氧化钠与水的反应是放热反应,反应物能量高于生成物能量,A不符合题意;
B.氢氧化钠与盐酸反应属于中和反应,是放热反应,反应物能量高于生成物能量,B不符合题意;
C.甲烷的燃烧属于放热反应,反应物能量高于生成物能量,C不符合题意;
D.氯化铵和氢氧化钡晶体的反应属于吸热反应,反应物能量低于生成物能量,D符合题意
故答案为:D
【分析】综合分析,如果是放热反应,则反应物能量高于生成物能量;如果是吸热反应,则反应物能量低于生成物能量。
6.【答案】B
【解析】【解答】A.HCOOH失电子生成KHCO3,做负极,电极反应式为:HCOO-+2OH--2e-=HCO +H2O,A不符合题意;
B.电池工作时,乙池中Fe3+得电子生成Fe2+,发生还原反应,Fe2+被氧气氧化,发生氧化反应,所以乙池既发生了还原反应又发生了氧化反应,B符合题意;
C.原电池工作时,阳离子移向正极,所以K+、H+从甲池通过半透膜向乙池迁移,C不符合题意;
D.根据反应方程式: 和 可知,电池工作时每消耗标准状况下22.4LO2,电路中转移的电子数目是4NA,D不符合题意;
故答案为:B
【分析】HCOOH失电子生成KHCO3,做负极;Fe3+得电子生成Fe2+,做正极。
7.【答案】D
【解析】【解答】ΔH=生成物的总能量-反应物的总能量,则反应C2H6(g)+CO2(g)+H2O(g) 4H2(g)+3CO(g)的ΔH=4×0+3×(-110kJ·mol-1)-( -84kJ·mol-1)- ( -393kJ·mol-1)- ( -242kJ·mol-1)=+389kJ·mol-1,故D符合题意;
故答案为:D。
【分析】根据ΔH=生成物的总能量-反应物的总能量计算。
8.【答案】C
【解析】【解答】A.由分析可知,Mg为负极,A不符合题意;
B.由分析可知,负极的电极反应式为Mg-2e-=Mg2+,B不符合题意;
C.该电池反应将化学能转化为电能,可用于海上应急照明供电,C符合题意;
D.由电池反应方程式可知,反应后,电解质溶液的质量增加,D不符合题意;
故答案为:C
【分析】由电池反应方程式可知,AgCl转化为Ag,发生得电子的还原反应,因此AgCl为正极,其电极反应式为:2AgCl+2e-=2Ag+2Cl-;Mg转化为Mg2+,发生失电子的氧化反应,为负极,其电极反应式为:Mg-2e-=Mg2+;据此结合选项进行分析。
9.【答案】C
【解析】【解答】A.放电过程中,a为正极, b极为负极,溶液中阳离子移向正极,阴离子移向负极,所以放电过程中, 向b极迁移,A项不符合题意;
B.充电过程中b电极得到电子发生还原反应,由于在碱性环境中Zn以 形式存在,则充电过程中, b电极应为: +2e-=Zn+4OH-,B项不符合题意;
C.由图示可知,充电时,a电极失电子发生氧化反应,即a电极与电源正极相连,C项符合题意;
D.放电过程中b电极为负极,其电极反应式为Zn+4OH--2e-= , a极为正极,则其电极反应式为, MnO2+4H++2e-=Mn2+ +2H2O,所以放电过程中,转移0.4mole-时,a电极消耗0.8molH+,D项不符合题意;
故答案为:C。
【分析】根据放电过程中,b为负极,锌失去电子变为结合氢氧根离子变为,电极式为:Zn+4OH--2e-= , a为正极,是二氧化锰得到电子变为锰离子的过程,电极式为:MnO2+4H++2e-=Mn2+ +2H2O,放电时,阴离子向负极,充电时a连接的是电池的正极,发生的反应是Mn2+ +2H2O-2e=MnO2+4H+,b连接的是电池的阴极,发生的反应是: +2e-=Zn+4OH-,结合选项进行判断即可
10.【答案】C
【解析】【解答】A.甲是铜锌原电池,其中锌是负极,铜是正极,电子由锌片经导线流向铜片,A正确;
B.乙是纽扣式银锌电池,锌是负极,氧化银是正极,负极的电极反应式为Zn-2e-=Zn2+,B正确;
C.丙是锌锰干电池,锌筒作负极,发生氧化反应,使用一段时间锌筒会变薄,C错误;
D.丁是铅蓄电池,放电时消耗硫酸,所以使用一段时间后电解质溶液的酸性减弱,导电能力下降,D正确;
故答案为:C。
【分析】放电时,负极失电子,元素化合价升高,发生氧化反应;正极得电子,元素化合价降低,发生还原反应;原电池“同性相吸”,阳离子移向正极,阴离子移向负极。
11.【答案】D
【解析】【解答】A、图1中,铁棒作负极,铁棒质量减少,即0.1mol,失去0.2mol电子,乙池溶液中消耗0.1mol()得0.2mol电子,但盐桥中有向乙烧杯中移动,乙池溶液的减少质量小于,A错误;
B、图2丙池发生吸氧腐蚀,正极电极反应式:,石墨c电极附近pH增大,B错误;
C、图1中的石墨电极作原电池正极,发生还原反应;图2中丁池石墨b电极为电解池阳极,发生氧化反应生成氯气,电极反应式不同,C错误;
D、图2中电流方向为石墨c→铜丝→石墨b→石墨a→电流计,D正确;
故答案为:D。
【分析】图1甲、乙构成原电池,甲为负极,乙为正极, 将图1所示装置中的盐桥(琼脂—饱和溶液)换成铜导线与石墨棒连接得到图2所示装置 ,图2为电解池装置,丙烧杯中铁作负极,石墨c作正极,发生吸氧腐蚀,则石墨a为阴极,石墨b为阳极。
12.【答案】C
【解析】【解答】A.由分析可知,Al为负极, M区为负极区,阳离子流向正极区,故K+通过x膜移向R区,A项不符合题意;
B.放电时,正极反应为PbO2++2e-+4H+=PbSO4+2H2O,B项不符合题意;
C.比能量是指参加电极反应的单位质量的电极材料放出电能的大小,Zn与Al相比质量更重,且每一个Zn转移2个电子,1个Al转移3个电子,故Al-PbO2电池的比能量更高,C项符合题意;
D.消耗1.8g Al时电路上转移的电子数目为0.20mol,则由N区溶液减少0.4mol氢离子和0.1mol硫酸根离子,同时有0.1mol硫酸根离子移向R区,相当于减小0.2mol硫酸,同时生成0.2mol水,N极区实际减少质量为0.2mol×98g/mol-0.2mol×19g/mol=16g,D项不符合题意;
故答案为:C。
【分析】该原电池工作时,Al为负极,被氧化生成[Al(OH)4]-,负极反应式为Al-3e-+4OH-=[Al(OH)4]-,PbO2为正极,发生还原反应,电极反应式为PbO2++2e-+4H+=PbSO4+2H2O,电解质溶液M为KOH,R为K2SO4,C为H2SO4,正极消耗氢离子,阴离子向负极移动,则y是阳离子交换膜,x是阴离子交换膜。
13.【答案】D
【解析】【解答】A. 化学变化不一定都是放热的,也可能吸热,A不符合题意;
B. 化学变化不一定都是吸热的,也可能放热,B不符合题意;
C. 任何化学反应都伴随能量变化,反应物所含能量一定不等于生成物所含能量,C不符合题意;
D. 任何化学反应都伴随能量变化,因此化学反应前后反应物和生成物所含能量会发生变化,D符合题意。
故答案为:D。
【分析】化学反应一般伴随着能量的变化,可表现出吸热或者是放热,反应物和生成物具有的总能量是变化的。能量低的物质较稳定
14.【答案】C
【解析】【解答】A.铁片和稀硫酸的反应为放热反应,反应物的总能量高于生成物的总能量,A不符合题意;
B.Ba(OH)2 8H2O与HCl溶液的反应为放热反应,反应物的总能量高于生成物的总能量,B不符合题意;
C.碳与水蒸气在高温下反应为吸热反应,反应物的总能量低于生成物的总能量,C符合题意;
D.甲烷在氧气中燃烧为放热反应,反应物的总能量高于生成物的总能量,D不符合题意;
故答案为C。
【分析】熟悉常见的放热反应(燃烧、铝热反应、大部分的化合反应),吸热反应(C、CO、H2还原金属氧化物的反应、煤的汽化、大部分分解反应),这要求平时对一些典型的吸热和放热反应要牢记。
15.【答案】C
【解析】【解答】根据2H2+O2=2H2O反应,1g氢气完全燃烧生成水蒸气时放出热量121kJ,则2mol H2即4g完全燃烧生成水蒸气时放出热量484 kJ,设1mol H—H键断裂时吸收热量为x kJ,根据化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量可得463kJ×4 496kJ 2x=484 kJ,x =436kJ,
故答案为:C。
【分析】化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,依此结合反应方程式进行计算。
16.【答案】C
【解析】【解答】A.由分析可知,Zn作负极,石墨作正极,A不符合题意;
B.电流由正极(石墨)经导线流向负极(锌),B不符合题意;
C.干电池时间连续工作,负极锌片被腐蚀,内装糊状物可能流出腐蚀用电器,C符合题意;
D.干电池是一次性电池,不能反复充电,只能实现化学能向电能转化,D不符合题意。
故答案为:C。
【分析】Zn作负极,电极反应式为Zn-2e-=Zn2+;
石墨作正极,电极反应式为2 +2e-=NH3+H2。
17.【答案】D
【解析】【解答】A.根据化合价的变化,Pb的化合价升高,说明其失去电子,作的是原电池的负极,被氧化,A选项是错误的;
B.电池工作时,电解质溶液的pH值是不断增大的,因为是在消耗H2SO4的,B选项是错误的;
C.PbO2是正极,在原电池的电解质溶液中 ,遵循“正正负负”原理,即SO42-不断移向负极,C选项是错误的;
D.根据B可知,电解质溶液的pH值是不断增大的,D选项是正确的。
故答案为:D。
【分析】A.在原电池中,负极失去电子发生氧化反应,正极得到电子,发生还原反应;
B.反应消耗H2SO4,所以电解质溶液的pH值会增大;
C.SO42-不断移向Pb电极;
D.电解质溶液的pH值是不断增大的。
18.【答案】B
【解析】【解答】A.放电时C(Li)失电子被氧化,所以为负极,故A不符合题意;
B.金属Li会与稀硫酸发生反应,降低电池的效率,故B符合题意;
C.放电时LiMn2O4为正极,得电子发生还原反应,故C不符合题意;
D.放电时C(Li)失电子被氧化为负极,根据总反应可知电极反应为C(Li)-e-=C+Li+,故D不符合题意;
故答案为:B。
【分析】根据电极总反应可知放电时C(Li)失电子被氧化,所以为负极,则LiMn2O4为正极。
19.【答案】D
【解析】【解答】A. 臭氧转化为氧气,有新物质生成,一定是化学变化,A不符合题意;
B. 化学变化中一定伴随若能量的变化,B不符合题意;
C. 氧气和臭氧中均存在共价键,该变化一定有共价键的断裂与生成,C不符合题意;
D. 该变化不是氧化还原反应,没有电子的转移,D符合题意;
故答案为:D。
【分析】O由0价到0价,不是氧化还原反应,无电子的转移
20.【答案】D
【解析】【解答】A.根据电池反应式知,放电时Zn为负极, Zn失电子生成Zn2+,负极上发生反应的物质是Zn,A选项是正确的;
B.正极材料是Ag2O,得到电子,发生还原反应: Ag2O+2e +H2O=2Ag+2OH- ,B选项是正确的;
C.负极上zn失电子生成Zn2+,电极反应式为:Zn+2OH- - 2e-=Zn(OH)2,则负极区溶液c(OH-)减小,C选项是正确的;
D.根据原电池中电解质溶液中阴阳离子流向遵循“正正负负”原则,可知,OH-移向负极,K+和H+移向正极,D选项是错误的。
故答案为:D。
【分析】原电池的工作原理:在外电路中,由负极失去电子,经过导线到达正极;在内电路中,是阴阳离子实现导电的作用,形成闭合回路,阴离子在电解质溶液中靠近负极,阳离子在电解质溶液中靠近正极。
21.【答案】(1)SO2+2NH3·H2O=(NH4)2SO3+H2O;(NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O
(2)锌粉(或铁粉);CuO;H2SO4
(3)Ag++e-=Ag;NO3-+4H++3e-=NO↑+2H2O
【解析】【解答】(1)SO2溶于水后形成H2SO3,具有酸性,能与氨水反应,该反应的化学方程式为: SO2+2NH3·H2O=(NH4)2SO3+H2O;形成的(NH4)2SO3溶液中加入硫酸后,由于酸性H2SO4>H2SO3,故能反应生成SO2,该反应的化学方程式为: (NH4)2SO3+H2SO4=(NH4)2SO4+SO2↑+H2O;
(2)①沉铜过程中主要是将盐溶液中的Cu2+转化为Cu,故所加试剂应为比铜活泼的金属,故可加入铁粉或锌粉;
②“一次浸取”所加试剂为水,而烟灰中的CuO不溶于水,故铜元素以CuO的形式沉积在浸出渣中;“二次浸取”时,是为了将CuO溶解成铜离子的溶液,故应加入酸溶液,结合最后说的产物3PbO·PbSO4·H2O可知,所加酸溶液为H2SO4;
(3)电解过程中,阴极发生Ag+得电子的还原反应,其电极反应式为:Ag++e-=Ag;由于HNO3具有氧化性,易被还原为NO,故该副反应的电极反应式为:NO3-+4H++3e-=NO+2H2O;
【分析】(1)SO2的水溶液显酸性,能与氨水溶液反应;根据强酸制弱酸原理书写反应的化学方程式;
(2)①根据金属活动性确定所加试剂;
②CuO不溶于水;结合二次浸取后所得产物的化学式确定二次浸取所加试剂;
(3)电解过程中,阴极发生Ag+得电子的还原反应,同时由于HNO3的氧化性,易得电子变为NO;
22.【答案】(1)Fe+2H+=Fe2++H2↑
(2)2H++2e-=H2↑;增大
(3)Zn;Zn+2H+=Zn2++H2↑;B>A>C
【解析】【解答】(1)A中铁与稀硫酸反应生成硫酸亚铁和氢气,反应离子方程式是Fe+2H+=Fe2++H2↑;
(2)装置B构成Sn、Fe原电池,Fe的活泼性大于Sn, Fe作负极,负极反应式是Fe-2e- =Fe2+, Sn作正极,正极反应式是2H++2e-=H2↑,正极氢离子浓度减小,所以Sn极附近溶液的pH增大。
(3)装置B构成Zn、Fe原电池,Fe的活泼性小于Zn, Fe作正极, Zn作负极。总反应是锌与硫酸反应生成硫酸锌和氢气,反应离子方程式是Zn+2H+=Zn2++H2↑;A中铁发生化学腐蚀,B中铁作原电池负极,腐蚀速率加快,C中Fe作正极,铁被保护,所以A、B、C中铁被腐蚀的速率由快到慢的顺序是B>A>C。
【分析】(1)A中发生铁与稀硫酸的置换反应;
(2)装置B形成原电池,Fe的金属性大于Sn,Fe作负极,Sn做正极;
(3)装置C形成原电池,Fe的金属性小于Zn,Fe作正极,Sn负正极。
23.【答案】(1)正;11.2;Fe-2e-=Fe2+
(2)吸热;2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452.8kJ/mol
(3)锌;O2+4H++4e-=2H2O
【解析】【解答】(1)Fe和Cu为电极,稀H2SO4为电解质溶液形成的原电池,铁的活泼性大于铜,铁做负极,铜做正极;
①原电池中阳离子向正极移动,因此H+向正极移动;
②Cu作正极,H+得到电子生成H2,正极反应为:2H++2e-=H2,所以若有1mol e-流过导线,理论上生成0.5molH2,标准状况下的体积为0.5mol×22.4L/mol=11.2L;
③铁做负极,Fe失去电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+;
(2)科学家使海水分解得到氢气,电解水需要消耗能量,该反应是吸热反应,CH3OH(l)在氧气中充分燃烧生成二氧化碳和液态水的方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l),1g CH3OH(l)完全燃烧释放22.7kJ,2mol甲醇的质量为64g,则完全燃烧释放的热量为22.7kJ×64=1452.8kJ,则热化学方程式为2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) △H=-1452.8kJ/mol;
(3)由反应2Zn+O2+4H+=2Zn2++2H2O可知,反应中锌失去电子,所以原电池的负极材料是锌,Zn被氧化生成Zn2+,正极上O2发生还原反应,产物为H2O,电极反应式为O2+4H++4e-=2H2O。
【分析】(1)①该原电池中Fe为负极,Cu为正极,原电池工作时,阳离子向正极移动;
②根据2H++2e-=H2,结合V=nVm计算;
③负极为Fe失去电子,电极反应为Fe-2e-=Fe2+;
(2)分解海水吸热;1g CH3OH(l)完全燃烧释放22.7kJ,2mol甲醇的质量为64g,则完全燃烧释放的热量为22.7kJ×64=1452.8kJ,据此书写热化学方程式;
(3)根据反应可知,锌失去电子发生氧化反应,作负极;正极上为氧气得电子结合氢离子生成水。
24.【答案】(1)化学
(2)正极;还原反应;Zn-2e- = Zn2+
(3)A;C
【解析】【解答】(1)该装置是原电池,故能量转化方式是化学能转化为电能;
(2)原电池总反应为锌和稀硫酸的反应,铜不活泼,铜棒为正极,氢离子在铜上得到电子,发生2H++2e-=H2 ,故该极上发生还原反应;锌比铜活泼,锌作负极,负极反应式为:Zn-2e- = Zn2+;
(3)图2中,当x轴表示实验时流入正极的电子的物质的量,随着x的增大,
A. 据电极反应式Zn-2e- = Zn2+知:溶解锌棒的质量随流入正极的电子的物质的量而增大,故锌棒的质量减小,A选;
B. c(Zn2+)随着流入正极的电子的物质的量增大,B不选;
C .正极反应式为:2H++2e-=H2 ,则c(H+)随流入正极的电子的物质的量而减小,C选;
D . SO 不参加反应,故c(SO )不发生变化,D不选;
故答案为:AC。
【分析】原电池中,还原剂在负极失去电子发生氧化反应,电子从负极流出,电子沿着导线流向正极,正极上氧化剂得到电子发生还原反应,内电路中阴离子移向负极、阳离子移向正极,据此分析;
25.【答案】(1)铜片;石墨;AgNO3溶液
(2)2Ag++2e-=2Ag;Cu-2e-=Cu2+
(3)负;负
【解析】【解答】(1)根据电极反应式,负极升失氧,正极降得还,先确定Cu作负极,电解质溶液为硝酸银,则再选石墨(或活泼性比Cu弱的金属)为正极;
故答案为:铜片 石墨 AgNO3溶液
(2)根据正极降得还,可知正极电极反应式为:2Ag++2e-=2Ag;根据负极升失氧,可知电极反应式为:Cu-2e-=Cu2+;
故答案为:2Ag++2e-=2Ag;Cu-2e-=Cu2+
(3)原电池中,电子从负极流出经过外电路流向正极;内部阴离子向负极移动,阳离子向正极移动;
故答案为:负 负
【分析】(1)相对活泼的金属做原电池的负极,电解质溶液一定含有银离子;
(2)原电池的正极发生还原反应,负极发生氧化反应;
(3)原电池中电子从负极流出延导线流向正极。
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
