第七章 有机化合物 测试题 (含解析)2023-2024学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第七章 有机化合物 测试题 (含解析)2023-2024学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 894.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-08 22:15:47 | ||
图片预览




文档简介
第七章《有机化合物》测试题
一、单选题(共20题)
1.下列物质中含有两种官能团的是
A.乳酸 B.苯乙烯
C.丙三醇 D.甲苯
2.下列化学用语使用正确的是
A.中子数为16的磷原子符号: B.铝离子的结构示意图:
C.葡萄糖分子的实验式: D.甲烷的比例模型:
3.关于图中各装置的叙述不正确的是
A.装置①中X若为四氯化碳,可用于吸收氨气,并防止倒吸
B.装置②可检验溴乙烷发生消去反应得到的气体中含有乙烯
C.装置③的两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相同
D.装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
4.有机物a是石油化学工业重要的基本原料,其产量是衡量一个国家石油化工发展水平的标志,下列说法错误的是
A.a生成b属于加成反应
B.b与甘油()互为同系物
C.c与环氧乙烷()互为同分异构体
D.b、d、e三种物质可以用饱和 Na2CO3溶液鉴别
5.聚甲基丙烯酸甲酯(又称有机玻璃)是一种可降解塑料,其结构简式如下所示。下列叙述错误的是( )
A.合成聚甲基丙烯酸甲酯的化学反应是加聚反应
B.聚甲基丙烯酸是高分子化合物
C.聚甲基丙烯酸甲酯不易被氢氟酸腐蚀
D.聚甲基丙烯酸甲酯的链节是
6.下列有机物中,含有两种官能团的是
A.乙二醇 B.1,2-二溴乙烷
C.二氯甲烷 D.乳酸
7.下列说法中正确的是( )
A.含有结构的官能团一定是酮羰基
B.和所含官能团相同,属于同类物质
C.既属于酚类又属于醛类
D.有机物 、 、中含有的官能团相同
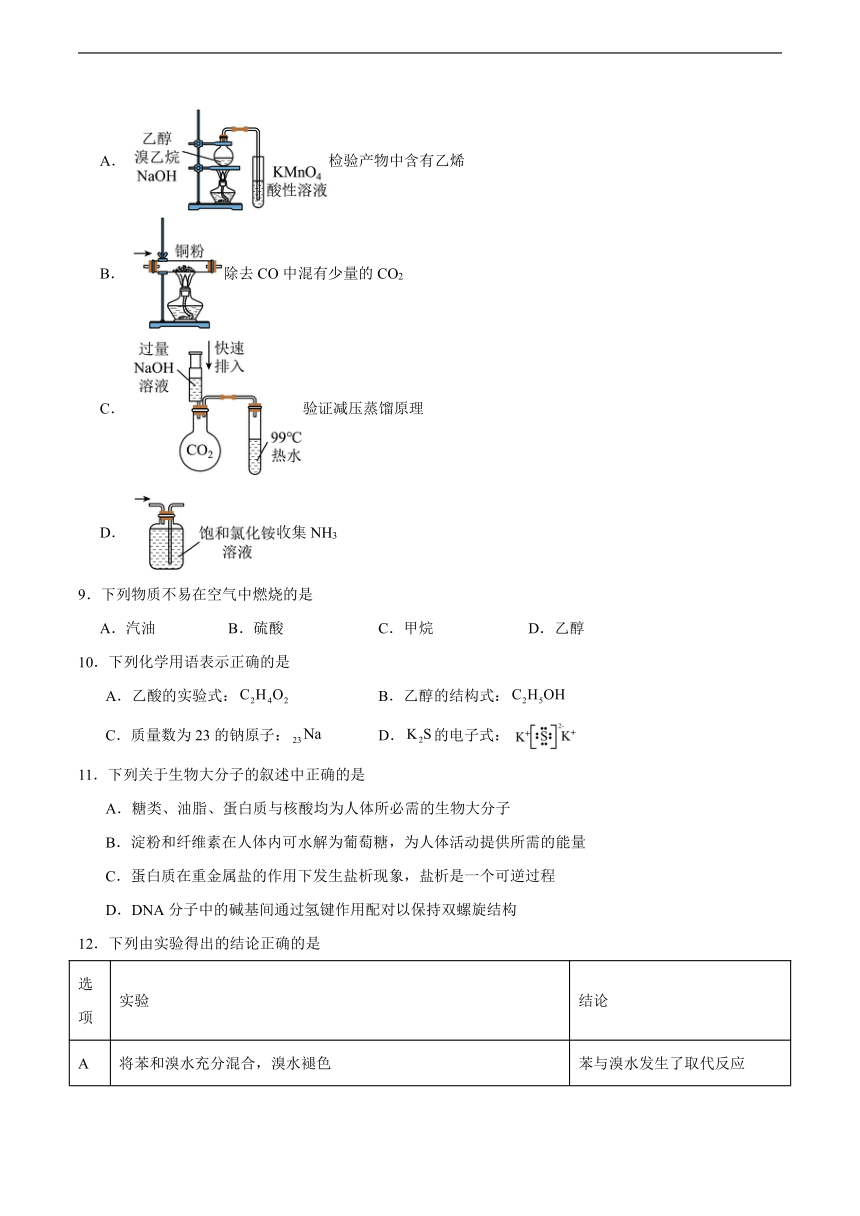
8.下列装置能达到实验目的是( )
A. 检验产物中含有乙烯
B. 除去CO中混有少量的CO2
C. 验证减压蒸馏原理
D. 收集NH3
9.下列物质不易在空气中燃烧的是
A.汽油 B.硫酸 C.甲烷 D.乙醇
10.下列化学用语表示正确的是
A.乙酸的实验式: B.乙醇的结构式:
C.质量数为23的钠原子: D.的电子式:
11.下列关于生物大分子的叙述中正确的是
A.糖类、油脂、蛋白质与核酸均为人体所必需的生物大分子
B.淀粉和纤维素在人体内可水解为葡萄糖,为人体活动提供所需的能量
C.蛋白质在重金属盐的作用下发生盐析现象,盐析是一个可逆过程
D.DNA分子中的碱基间通过氢键作用配对以保持双螺旋结构
12.下列由实验得出的结论正确的是
选项 实验 结论
A 将苯和溴水充分混合,溴水褪色 苯与溴水发生了取代反应
B 乙醇与水都可与金属钠反应产生可燃性气体 乙醇分子中的羟基氢与水分子中的氢具有相同的活性
C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性大于碳酸的酸性
D 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味 乙醇已被铜氧化为乙醛
A.A B.B C.C D.D
13.在北京新机场这座宏伟的“超级工程”建设中化学材料发挥了巨大作用。下列属于无机材料的是
A.高韧薄层沥青罩面 B.高强度耐腐蚀钢筋
C.隔震橡胶垫 D.超高分子量聚乙烯纤维
14.下列实验不能达到预期目的是
A.除去苯中的少量苯酚:加入NaOH溶液振荡,静置分层后,用分液漏斗分离去水层
B.向混有醋酸的乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量醋酸
C.除去CH4中少量的乙烯:通过酸性KMnO4溶液
D.重结晶法提纯苯甲酸时,为除去杂质和防止杂质析出,应该趁热过滤
15.某防腐剂结构为 ,广泛用于食品、化妆品等行业。下列说法正确的是
A.该有机物能使溴水和酸性高锰酸钾溶液褪色且原理相同
B.该有机物的分子式是C6H10O2
C.该有机物能发生取代反应、氧化反应和水解反应
D.该有机物能与碳酸氢钠溶液发生反应
16.下列表示不正确的是
A.硅原子的结构示意图: B.丙烷的球棍模型:
C.乙醇的的分子式:C2H6O D.CO2分子的电子式:
17.下列电子式书写正确的是( )
A. B.
C. D.
18.在一密闭容器中,120℃时通入amolCxH4(烃)和bmolO2点燃后,生成二氧化碳和水蒸气。待反应完成后,恢复至原来温度和压强,则反应前后气体体积之比为( )
A.1:1 B.(a+b):(a+2b) C.(a+b):(2a+b) D.不能确定
19.从化学角度看,橡胶的主要成分属于
A.无机盐 B.有机物 C.金属 D.氧化物
20.某高聚物的结构如图所示,下列说法正确的是( )
A.该高聚物为加聚反应产物
B.该高分子的单体中有三种二元羧酸,它们互为同系物
C.该高分子的单体有6种
D.该高分子中含有酯基、羟基、羧基
二、非选择题(共5题)
21.(1)有下列各组物质:
A.O2和O3B.C和C C.冰醋酸和乙酸D.甲烷和庚烷E.CH3—CH2—CH2—CH3和CH3CH(CH3)CH3F.H2和D2(重氢)
①互为同位素的是 ,②互为同素异形体的是 ,③互为同分异构体的是 ,④同一物质是 ,⑤互为同系物的是 。
(2)①相同条件下完全燃烧甲烷、乙烯、乙烷各1mol,需要氧气最多的是 ,生成水的质量最多的是 。
②相同条件下完全燃烧相同质量的乙烷、乙烯、乙炔,需要氧气最多的是 ,生成水的质量最多的是 。
(3)1mol某不饱和烃可以和1molCl2发生加成反应,生成2,3—二氯—2—甲基戊烷,该不饱和烃结构简式为 ,其系统命名为 。
22.石油是工业的血液,与我们的生产、生活息息相关。
(1)乙烯是石油化工重要的基础原料。 写出乙烯的电子式
(2)分子式为C5H12的某烃,分子中含有4个甲基,该烃的结构简式为 。
(3)与乙烯互为同系物的是 。(选填编号)
a. CH3CH=CH2 b. CH2=CHCH=CH2
c. CH≡CH d. CH3CH3
(4)聚乙烯安全无毒,可用于制食品包装袋。聚乙烯的结构简式为 。
(5)乙炔三聚可得到苯或二乙烯基乙炔 (CH2=CH-C-C-CH=CH2) 。鉴别苯和二乙烯基乙炔可用的试剂是 。
23.下列物质中,属于有机化合物的是 ,属于烃的是 ,属于烃的衍生物的是 。(填序号)
①;②;③;④;⑤;⑥;⑦金刚石;⑧;⑨;⑩
其中,的官能团是 ,的官能团是 。
24.按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是 。
(2)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S。只由离子键构成的物质是 ;只由极性共价键构成的物质是 ;由极性键和非极性键构成的物质是 ;由离子键和极性键构成的物质是 。(填序号)。
(3)写出下列物质的电子式:CaF2: CO2: NH4Cl: 。
(4) 用电子式表示下列化合物的形成过程:H2S: ;MgCl2: 。
25.某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子图中球与球之间的连线代表单键、双键等化学键。
(1)该物质的结构简式为 。该化合物的核磁共振氢谱中有 个吸收峰。
(2)该物质中所含含氧官能团的名称为 。
(3)下列物质中,与该产品互为同分异构体的是填序号 。互为同系物的是填序号 。
① ②
③ ④
参考答案:
1.A
A.乳酸含有羧基和羟基两种官能团,A正确;
B.苯乙烯中含有碳碳双键一种官能团,B错误;
C.丙三醇中含有羟基一种官能团,C错误;
D.甲苯中不含有官能团,D错误;
答案选A。
2.C
A.质量数=质子数+中子数=16+15=31,中子数为16的磷原子:,选项A错误;
B.Al离子核内有13个质子、核外有10个电子,其离子结构示意图为,选项B错误;
C.葡萄糖的分子式为C6H12O6,其实验式为CH2O,选项C正确;
D.甲烷的比例模型为:,表示甲烷的球棍模型,选项D错误;
答案选C。
3.D
A.氨气为极性分子,易溶于水,难溶于四氯化碳,并且四氯化碳不溶于水,密度比水大,可用来防止倒吸,故A正确;
B.溴乙烷发生消去反应后生成乙烯,经过水洗后可除去乙醇,乙烯可与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,故B正确;
C.1molAl和1molZn失去电子数目不同,通过导线的电子数相同时,消耗负极材料的物质的量不相同,故C正确;
D.硝酸银过量,可与硫化钠反应生成硫化银沉淀,不能证明AgCl沉淀可转化为溶解度更小的Ag2S沉淀,如要证明,应在AgCl饱和溶液中加入硫化钠,故D错误;
故答案为D。
4.B
有机物a的产量是衡量一个国家石油工业发展水平的标志,则a为CH2═CH2,a与水发生加成反应生成b为CH3CH2OH,b发生催化氧化生成c为CH3CHO,c进一步氧化生成d为CH3COOH,乙酸与乙醇发生酯化反应生成e为CH3COOCH2CH3。
A.a与水发生加成反应生成b为CH3CH2OH,A正确;
B.b为CH3CH2OH,分子式为C2H6O,甘油的分子式为C3H8O3,两者分子式相差CH2O2,两者不是同系物,B错误;
C.c为CH3CHO,与环氧乙烷,分子式相同,结构式不同,互为同分异构体,C正确;
D.乙醇能够溶于水,不分层,乙酸与饱和Na2CO3溶液发生放出气体,有气泡产生,而乙酸乙酯与饱和Na2CO3溶液是互不相溶的两层液体,故可以用饱和Na2CO3溶液鉴别,D正确;
故选B。
5.D
由高分子结构可知,聚合物单体为CH3CH=CHCOOCH3,合成聚甲基丙烯酸甲酯的反应类型为加聚反应。
A. 合成聚甲基丙烯酸甲酯的化学反应是加聚反应,A正确;
B. 聚甲基丙烯酸是高分子化合物,B正确;
C. 氢氟酸腐蚀二氧化硅,聚甲基丙烯酸甲酯不易被氢氟酸腐蚀,C正确;
D. 聚甲基丙烯酸甲酯的单体是,D错误;
答案为D。
6.D
A.含有羟基一种官能团,故A不符合题意;
B.含有碳溴键一种官能团,故B不符合题意;
C.含有碳氯键一种官能团,故C不符合题意;
D.含有羟基、羧基2种官能团,故D符合题意;
故选D。
7.C
A.含有结构的官能团不一定是酮羰基,可能是醛基,也可能是羧基,故A错误;
B.和所含官能团相同,但结构不相似,羟基与苯环直接相连的有机物属于酚类,间接相连的属于醇类,不属于同类物质,故B错误;
C.中羟基与苯环直接相连,属于酚类,又含有醛基,又属于醛类,故C正确;
D.甲酸和苯甲酸中含有的官能团是羧基,甲酸甲酯中含有的官能团是酯基,官能团不同,故D错误;
故选C。
8.C
乙醇能使酸性高锰酸钾褪色,应除掉乙醇后再通入,故A错误;
B.CO能与灼热的氧化铜反应生成铜和二氧化碳,反而会把原物质除去,不符合除杂原则,故B错误;
C.二氧化碳能与氢氧化钠反应,压强减小,水沸腾,故C正确;
D.氨气是极易溶于水的气体不能用排溶液法收集,故D错误;
答案选C。
9.B
汽油、甲烷、乙醇都是可燃性物质,只有硫酸不易在空气中燃烧,故选B。
10.D
A.乙酸的分子式为,其实验式:,故A错误;
B.是乙醇的结构简式,乙醇结构式为,故B错误;
C.质量数为23的钠原子:,故C错误;
D.是离子化合物,其电子式:,故D正确。
综上所述,答案为D。
11.D
A.糖类中的单糖、二糖等低聚糖不属于生物大分了,油脂不属于生物大分子,选项A错误;
B.纤维素在人体内不水解,选项B错误;
C.蛋白质在重金属盐的作用下会发生变性,变性属于不可逆的变化,选项C错误;
D.DNA分子中的碱基间通过氢键作用配对以保持双螺旋结构,选项D正确;
答案选D。
12.C
A.将苯和溴水充分混合,苯将溴水中的溴萃取出来使溴水褪色,A错误;
B.乙醇和水都可与金属钠反应产生可燃性气体,但乙醇与钠产生气体的速率慢得多,乙醇分子中的羟基氢不如水分子中的氢原子活泼,B错误;
C.用乙酸浸泡水壶中的水垢,可将其清除,其中乙酸与碳酸钙反应生成醋酸钙、二氧化碳和水,说明乙酸的酸性强于碳酸的酸性, C正确;
D.将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色,依次发生反应2Cu+O22CuO、CH3CH2OH+CuOCH3CHO+Cu+H2O,反复数次,试管中的液体出现刺激性气味,生成了乙醛,由反应方程式可知,Cu为反应的催化剂,总反应为:2CH3CH2OH+O22CH3CHO+2H2O,由此可知乙醇是被氧气氧化为乙醛,D错误;
答案选C。
13.B
A项、沥青是一种防水防潮和防腐的有机胶凝材料,故A错误;
B项、钢筋是铁合金,属于无机材料,故B正确;
C项、天然橡胶和合成橡胶是有机高分子材料,故C错误;
D项、聚乙烯纤维是合成有机高分子材料,故D错误;
故选B。
14.C
A.苯酚与NaOH反应生成可溶于水的苯酚钠,而苯不与NaOH反应,且不溶于水,故除去苯中的少量苯酚:加入NaOH溶液振荡,静置分层后,用分液漏斗分离去水层,A能达到预期;
B.醋酸与碳酸钠反应生成易溶于水的醋酸钠溶液,而乙酸乙酯与碳酸钠不反应,且不溶于水,故利用向混有醋酸的乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量醋酸,B能达到预期;
C.乙烯与高锰酸钾反应生成二氧化碳气体,除去CH4中少量的乙烯应用溴水,不能用酸性KMnO4溶液,C不能达到预期;
D.苯甲酸在热水中的溶解性较大,故重结晶法提纯苯甲酸时,为除去杂质和防止杂质析出,应该趁热过滤,D能达到预期;
答案为C。
15.D
A.该物质分子中含有不饱和的碳碳双键,能够与溴水发生加成反应,而使溴水褪色;能够被酸性KMnO4溶液氧化而使溴水褪色,故二者褪色的反应原理不相同,A错误;
B.在有机物键线式表示中,顶点和拐点表示C原子,根据C原子价电子数目是4,可知该键线式表示的防腐剂的分子式是C6H8O2,B错误;
C.该有机物分子中无酯基和卤素原子,因此不能发生水解反应,C错误;
D.该有机物分子中含有羧基,具有酸性,能够碳酸氢钠溶液发生反应产生二氧化碳气体,D正确;
故合理选项是D。
16.D
A. 硅是14号元素,硅原子的结构示意图: ,故A正确 ;
B. 丙烷的3个碳原子连成链状,每个碳原子均饱和,丙烷的球棍模型: ,故B正确;
C. 乙醇由C、H、O三种元素组成,乙醇的的分子式:C2H6O,故C正确;
D. CO2分子中碳与氧原子间形成碳氧双键,电子式: ,故D错误;
故选D。
17.D
A.HF为共价化合物,电子式中不能用方括号,A项错误;
B.CaCl2的电子式为,B项错误;
C.水也是共价化合物,电子式中不能用方括号,C项错误;
D.KCl是离子化合物,电子式书写正确,D项正确;
答案选D。
18.A
120℃时,产物水以气态形式存在,烃CxH4燃烧的化学方程式为:CxH4+(x+1)O2xCO2+2H2O(g)。在恒温、恒容条件下,体积之比等于物质的量之比,该反应前后气体的物质的量不变,则反应前后气体体积之比为1:1,A项正确;
答案选A。
19.B
天然橡胶的主要成分为聚异戊二烯,合成橡胶有丁苯橡胶、丁腈橡胶、氯丁橡胶等,它们的主要成分都是有机物,所以橡胶的主要成分属于有机物,故选B。
20.D
A. 该高聚物中含有酯键,为缩聚产物,A项错误;
B. 根据缩聚产物单体的推断方法:羰基和氧原子断开;羰基连羟基,氧原子连氢,,从左到右得到的单体依次为①HO—CH2—CH2—OH,②,③,④,⑤,⑥,其中②④⑥是二元羧酸,②⑥互为同系物,④与②⑥不是同系物关系,B项错误;
C. ③和⑤结构相同,故合成这种高分子化合物的单体至少有5种,C项错误;
D. 该高分子化合物是一种聚酯类,链端有羟基和羧基,D项正确;
答案选D。
21. B A E C D 乙烷 乙烷 乙烷 乙烷 (CH3)2C=CH—CH2—CH3 2—甲基—2—戊烯
(1)①具有相同质子数,不同中子数的同一元素的不同核素互为同位素,故答案为B;
②同素异形体是指由同样的单一化学元素组成,因排列方式不同,而具有不同性质的单质,故答案为A;
③在有机化学中,将分子式相同,结构不同的化合物互称为同分异构体,故答案为E;
④冰醋酸和乙酸为同一物质,故答案为C;
⑤同系物是指结构相似,分子组成相差若干个CH2原子团的有机化合物,故答案为D;
(2)①相同条件下完全燃烧1mol甲烷消耗2mol氧气生成2mol水;1mol乙烯消耗3mol氧气生成2mol水;1mol乙烷消耗3.5mol氧气生成3mol水;故需要氧气最多的是乙烷,生成水的质量最多的是乙烷;
②乙烷的相对分子质量为30、乙烯相对分子质量为28、乙炔相对分子质量为26,设完全燃烧xg的乙烷、乙烯、乙炔,乙烷的物质的量为,消耗氧气的物质的量为,生成水的物质的量为;乙烯的物质的量为,消耗氧气的物质的量为,生成水的物质的量为;乙炔的物质的量为,消耗氧气的物质的量为,生成水的物质的量为;故需要氧气最多的是乙烷,生成水的质量最多的是乙烷;
(3) 1mol某不饱和烃可以和1molCl2发生加成反应,生成2,3—二氯—2—甲基戊烷,该不饱和烃结构简式为(CH3)2C=CH—CH2—CH3;其系统命名为2—甲基—2—戊烯。
22. 略 a 溴水或酸性高锰酸钾溶液
根据乙烯为共价化合物,及C原子和H原子最外层可达到的电子数写出乙烯的电子式;
根据烃的分子式和含甲基的个数写出结构简式;
根据同系物性质类似,分子式相差n个CH2,结合选项中物质的官能团判断;
根据聚乙烯是由乙烯通过加聚得到的写出结构简式;
找出与苯不反应,与二乙烯基乙炔反应且有颜色的物质即可鉴别此两种物质。
(1)乙烯为共价化合物,C原子最外层可达到8个电子,H原子最外层可达到2个电子,乙烯正确的电子式为:;
(2)根据烃的分子式和含甲基的个数可知,该烃只能为新戊烷,结构简式为;
(3)根据同系物的定义可知与乙烯互为同系物的只能是a;
(4)聚乙烯为乙烯通过加聚反应生成的,其正确的结构简式为:;
(5)根据苯不与溴水(或高锰酸钾溶液)反应而二乙烯基乙炔可与溴水(或高锰酸钾溶液)反应,使溴水(或高锰酸钾溶液)褪色可知可用溴水(或高锰酸钾溶液)鉴别苯和二乙烯基乙炔;其中将溴水(或高锰酸钾溶液)加入到苯中时,能观察到的现象是溶液分层,苯层在上,水在下,振荡,静置后,苯层呈红棕色,水层颜色变浅(或溶液分层,苯层在上,水在下,振荡,静置后,苯层无色,水层仍呈紫色)。
【点睛】苯分子结构是单键和双键之间的特殊的键,与溴水,酸性高锰酸钾溶液均不反应。
23. ②③④⑤⑧⑩ ②⑤⑩ ③④⑧
有机物是指除了、、碳酸以及碳酸盐、氰化物、 的含碳化合物,故:②;③;④;⑤;⑧;⑩;其中烃指只含有碳元素和氢元素的化合物,所以属于烃的是:②;⑤;⑩;烃的衍生物是指烃中的氢原子被其他原子或原子团替代后的物质,所以属于烃的衍生物的:③;④;⑧;的官能团是,的官能团是。
24. ⑤ ⑦ ④ ③⑥
(1)根据质子数与电子数的关系确定是否带电荷及电荷的多少、电性,根据质子数、中子数确定质量数;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答;
(3)CaF2中存在Ca2+和F-离子,通过离子键结合在一起;二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
(4)根据硫化氢中硫原子与氢原子之间通过共价键形成的共价化合物;氯化镁是氯离子和镁离子之间通过离子键形成的离子化合物。
(1)核中有17个质子,为Cl元素,有20个中子,质量数为17+20=37,核外有18个电子,核内质子数比核外电子数少1,所以该微粒是带一个单位负电荷,为阴离子,该粒子的化学符号是;
(2)①H2中只含非极性键;
②Na2O2中钠离子与过氧根离子之间存在离子键,存在O-O非极性键,属于离子化合物;
③NaOH中含有离子键和O-H极性键,属于离子化合物;
④H2O2中存在H-O极性键和O-O非极性键,属于共价化合物;
⑤CaCl2只存在离子键,属于离子化合物;
⑥NH4NO3中存在离子键和极性键,属于离子化合物;
⑦H2S中只存在极性共价键,为共价化合物;
则:只由离子键构成的物质是⑤;只由极性共价键构成的物质是⑦;由极性键和非极性键构成的物质是④;由离子键和极性键构成的物质是③⑥;
(3)CaF2中存在Ca2+和F-离子,电子式为;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:;
(4)H2S的形成过程为,MgCl2的形成过程为。
【点睛】本题难点是用电子式表示化学键形成过程,通常用“→”表示形成过程,在“→”左边是形成该物质的所有原子的电子式,相同的原子可以合并,在“→”右边是该物质的电子式;形成离子化合物时,要标箭头,表示电子转移方向。
25. 3 羧基 ①② ③
根据C、H、O的价键结构可知,左上方应该是碳碳双键,后上方是碳氧双键,因此该物质的结构简式为 ,再根据同系物和同分异构体的定义分析解答。
⑴该物质的结构简式为 ;该化合物含有3种等效氢原子,故该化合物的核磁共振氢谱中共有3个吸收峰;
⑵该物质中所含含氧官能团的名称为羧基;
⑶①,②与原物质分子式相同,结构不同,互为同分异构体;③与原物质都含有一个碳碳双键、一个羧基,官能团相同,结构相似,组成相差一个CH2,则互为同系物;④只含有一个羧基,与原物质结构不相似,不是同系物,分子式不同,不是同分异构体,因此与该物质互为同分异构体的是①②,与该物质互为同系物的是③。
【点睛】同系物指结构相似,分子组成上相差1个或若干个CH2原子团的物质,结构相似即同系物具有相同种类和数目的官能团,通式相同;具有相同分子式而结构不同的化合物互为同分异构体,这是常考点,也是学生们的易错点
一、单选题(共20题)
1.下列物质中含有两种官能团的是
A.乳酸 B.苯乙烯
C.丙三醇 D.甲苯
2.下列化学用语使用正确的是
A.中子数为16的磷原子符号: B.铝离子的结构示意图:
C.葡萄糖分子的实验式: D.甲烷的比例模型:
3.关于图中各装置的叙述不正确的是
A.装置①中X若为四氯化碳,可用于吸收氨气,并防止倒吸
B.装置②可检验溴乙烷发生消去反应得到的气体中含有乙烯
C.装置③的两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不相同
D.装置④能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀
4.有机物a是石油化学工业重要的基本原料,其产量是衡量一个国家石油化工发展水平的标志,下列说法错误的是
A.a生成b属于加成反应
B.b与甘油()互为同系物
C.c与环氧乙烷()互为同分异构体
D.b、d、e三种物质可以用饱和 Na2CO3溶液鉴别
5.聚甲基丙烯酸甲酯(又称有机玻璃)是一种可降解塑料,其结构简式如下所示。下列叙述错误的是( )
A.合成聚甲基丙烯酸甲酯的化学反应是加聚反应
B.聚甲基丙烯酸是高分子化合物
C.聚甲基丙烯酸甲酯不易被氢氟酸腐蚀
D.聚甲基丙烯酸甲酯的链节是
6.下列有机物中,含有两种官能团的是
A.乙二醇 B.1,2-二溴乙烷
C.二氯甲烷 D.乳酸
7.下列说法中正确的是( )
A.含有结构的官能团一定是酮羰基
B.和所含官能团相同,属于同类物质
C.既属于酚类又属于醛类
D.有机物 、 、中含有的官能团相同
8.下列装置能达到实验目的是( )
A. 检验产物中含有乙烯
B. 除去CO中混有少量的CO2
C. 验证减压蒸馏原理
D. 收集NH3
9.下列物质不易在空气中燃烧的是
A.汽油 B.硫酸 C.甲烷 D.乙醇
10.下列化学用语表示正确的是
A.乙酸的实验式: B.乙醇的结构式:
C.质量数为23的钠原子: D.的电子式:
11.下列关于生物大分子的叙述中正确的是
A.糖类、油脂、蛋白质与核酸均为人体所必需的生物大分子
B.淀粉和纤维素在人体内可水解为葡萄糖,为人体活动提供所需的能量
C.蛋白质在重金属盐的作用下发生盐析现象,盐析是一个可逆过程
D.DNA分子中的碱基间通过氢键作用配对以保持双螺旋结构
12.下列由实验得出的结论正确的是
选项 实验 结论
A 将苯和溴水充分混合,溴水褪色 苯与溴水发生了取代反应
B 乙醇与水都可与金属钠反应产生可燃性气体 乙醇分子中的羟基氢与水分子中的氢具有相同的活性
C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性大于碳酸的酸性
D 将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色;反复数次,试管中的液体出现刺激性气味 乙醇已被铜氧化为乙醛
A.A B.B C.C D.D
13.在北京新机场这座宏伟的“超级工程”建设中化学材料发挥了巨大作用。下列属于无机材料的是
A.高韧薄层沥青罩面 B.高强度耐腐蚀钢筋
C.隔震橡胶垫 D.超高分子量聚乙烯纤维
14.下列实验不能达到预期目的是
A.除去苯中的少量苯酚:加入NaOH溶液振荡,静置分层后,用分液漏斗分离去水层
B.向混有醋酸的乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量醋酸
C.除去CH4中少量的乙烯:通过酸性KMnO4溶液
D.重结晶法提纯苯甲酸时,为除去杂质和防止杂质析出,应该趁热过滤
15.某防腐剂结构为 ,广泛用于食品、化妆品等行业。下列说法正确的是
A.该有机物能使溴水和酸性高锰酸钾溶液褪色且原理相同
B.该有机物的分子式是C6H10O2
C.该有机物能发生取代反应、氧化反应和水解反应
D.该有机物能与碳酸氢钠溶液发生反应
16.下列表示不正确的是
A.硅原子的结构示意图: B.丙烷的球棍模型:
C.乙醇的的分子式:C2H6O D.CO2分子的电子式:
17.下列电子式书写正确的是( )
A. B.
C. D.
18.在一密闭容器中,120℃时通入amolCxH4(烃)和bmolO2点燃后,生成二氧化碳和水蒸气。待反应完成后,恢复至原来温度和压强,则反应前后气体体积之比为( )
A.1:1 B.(a+b):(a+2b) C.(a+b):(2a+b) D.不能确定
19.从化学角度看,橡胶的主要成分属于
A.无机盐 B.有机物 C.金属 D.氧化物
20.某高聚物的结构如图所示,下列说法正确的是( )
A.该高聚物为加聚反应产物
B.该高分子的单体中有三种二元羧酸,它们互为同系物
C.该高分子的单体有6种
D.该高分子中含有酯基、羟基、羧基
二、非选择题(共5题)
21.(1)有下列各组物质:
A.O2和O3B.C和C C.冰醋酸和乙酸D.甲烷和庚烷E.CH3—CH2—CH2—CH3和CH3CH(CH3)CH3F.H2和D2(重氢)
①互为同位素的是 ,②互为同素异形体的是 ,③互为同分异构体的是 ,④同一物质是 ,⑤互为同系物的是 。
(2)①相同条件下完全燃烧甲烷、乙烯、乙烷各1mol,需要氧气最多的是 ,生成水的质量最多的是 。
②相同条件下完全燃烧相同质量的乙烷、乙烯、乙炔,需要氧气最多的是 ,生成水的质量最多的是 。
(3)1mol某不饱和烃可以和1molCl2发生加成反应,生成2,3—二氯—2—甲基戊烷,该不饱和烃结构简式为 ,其系统命名为 。
22.石油是工业的血液,与我们的生产、生活息息相关。
(1)乙烯是石油化工重要的基础原料。 写出乙烯的电子式
(2)分子式为C5H12的某烃,分子中含有4个甲基,该烃的结构简式为 。
(3)与乙烯互为同系物的是 。(选填编号)
a. CH3CH=CH2 b. CH2=CHCH=CH2
c. CH≡CH d. CH3CH3
(4)聚乙烯安全无毒,可用于制食品包装袋。聚乙烯的结构简式为 。
(5)乙炔三聚可得到苯或二乙烯基乙炔 (CH2=CH-C-C-CH=CH2) 。鉴别苯和二乙烯基乙炔可用的试剂是 。
23.下列物质中,属于有机化合物的是 ,属于烃的是 ,属于烃的衍生物的是 。(填序号)
①;②;③;④;⑤;⑥;⑦金刚石;⑧;⑨;⑩
其中,的官能团是 ,的官能团是 。
24.按要求回答下列问题:
(1)某种粒子有1个原子核,核中有17个质子,20个中子,核外有18个电子,该粒子的化学符号是 。
(2)现有下列物质:①H2 ②Na2O2 ③NaOH ④H2O2 ⑤CaCl2 ⑥NH4NO3 ⑦H2S。只由离子键构成的物质是 ;只由极性共价键构成的物质是 ;由极性键和非极性键构成的物质是 ;由离子键和极性键构成的物质是 。(填序号)。
(3)写出下列物质的电子式:CaF2: CO2: NH4Cl: 。
(4) 用电子式表示下列化合物的形成过程:H2S: ;MgCl2: 。
25.某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子图中球与球之间的连线代表单键、双键等化学键。
(1)该物质的结构简式为 。该化合物的核磁共振氢谱中有 个吸收峰。
(2)该物质中所含含氧官能团的名称为 。
(3)下列物质中,与该产品互为同分异构体的是填序号 。互为同系物的是填序号 。
① ②
③ ④
参考答案:
1.A
A.乳酸含有羧基和羟基两种官能团,A正确;
B.苯乙烯中含有碳碳双键一种官能团,B错误;
C.丙三醇中含有羟基一种官能团,C错误;
D.甲苯中不含有官能团,D错误;
答案选A。
2.C
A.质量数=质子数+中子数=16+15=31,中子数为16的磷原子:,选项A错误;
B.Al离子核内有13个质子、核外有10个电子,其离子结构示意图为,选项B错误;
C.葡萄糖的分子式为C6H12O6,其实验式为CH2O,选项C正确;
D.甲烷的比例模型为:,表示甲烷的球棍模型,选项D错误;
答案选C。
3.D
A.氨气为极性分子,易溶于水,难溶于四氯化碳,并且四氯化碳不溶于水,密度比水大,可用来防止倒吸,故A正确;
B.溴乙烷发生消去反应后生成乙烯,经过水洗后可除去乙醇,乙烯可与高锰酸钾发生氧化还原反应而使高锰酸钾溶液褪色,故B正确;
C.1molAl和1molZn失去电子数目不同,通过导线的电子数相同时,消耗负极材料的物质的量不相同,故C正确;
D.硝酸银过量,可与硫化钠反应生成硫化银沉淀,不能证明AgCl沉淀可转化为溶解度更小的Ag2S沉淀,如要证明,应在AgCl饱和溶液中加入硫化钠,故D错误;
故答案为D。
4.B
有机物a的产量是衡量一个国家石油工业发展水平的标志,则a为CH2═CH2,a与水发生加成反应生成b为CH3CH2OH,b发生催化氧化生成c为CH3CHO,c进一步氧化生成d为CH3COOH,乙酸与乙醇发生酯化反应生成e为CH3COOCH2CH3。
A.a与水发生加成反应生成b为CH3CH2OH,A正确;
B.b为CH3CH2OH,分子式为C2H6O,甘油的分子式为C3H8O3,两者分子式相差CH2O2,两者不是同系物,B错误;
C.c为CH3CHO,与环氧乙烷,分子式相同,结构式不同,互为同分异构体,C正确;
D.乙醇能够溶于水,不分层,乙酸与饱和Na2CO3溶液发生放出气体,有气泡产生,而乙酸乙酯与饱和Na2CO3溶液是互不相溶的两层液体,故可以用饱和Na2CO3溶液鉴别,D正确;
故选B。
5.D
由高分子结构可知,聚合物单体为CH3CH=CHCOOCH3,合成聚甲基丙烯酸甲酯的反应类型为加聚反应。
A. 合成聚甲基丙烯酸甲酯的化学反应是加聚反应,A正确;
B. 聚甲基丙烯酸是高分子化合物,B正确;
C. 氢氟酸腐蚀二氧化硅,聚甲基丙烯酸甲酯不易被氢氟酸腐蚀,C正确;
D. 聚甲基丙烯酸甲酯的单体是,D错误;
答案为D。
6.D
A.含有羟基一种官能团,故A不符合题意;
B.含有碳溴键一种官能团,故B不符合题意;
C.含有碳氯键一种官能团,故C不符合题意;
D.含有羟基、羧基2种官能团,故D符合题意;
故选D。
7.C
A.含有结构的官能团不一定是酮羰基,可能是醛基,也可能是羧基,故A错误;
B.和所含官能团相同,但结构不相似,羟基与苯环直接相连的有机物属于酚类,间接相连的属于醇类,不属于同类物质,故B错误;
C.中羟基与苯环直接相连,属于酚类,又含有醛基,又属于醛类,故C正确;
D.甲酸和苯甲酸中含有的官能团是羧基,甲酸甲酯中含有的官能团是酯基,官能团不同,故D错误;
故选C。
8.C
乙醇能使酸性高锰酸钾褪色,应除掉乙醇后再通入,故A错误;
B.CO能与灼热的氧化铜反应生成铜和二氧化碳,反而会把原物质除去,不符合除杂原则,故B错误;
C.二氧化碳能与氢氧化钠反应,压强减小,水沸腾,故C正确;
D.氨气是极易溶于水的气体不能用排溶液法收集,故D错误;
答案选C。
9.B
汽油、甲烷、乙醇都是可燃性物质,只有硫酸不易在空气中燃烧,故选B。
10.D
A.乙酸的分子式为,其实验式:,故A错误;
B.是乙醇的结构简式,乙醇结构式为,故B错误;
C.质量数为23的钠原子:,故C错误;
D.是离子化合物,其电子式:,故D正确。
综上所述,答案为D。
11.D
A.糖类中的单糖、二糖等低聚糖不属于生物大分了,油脂不属于生物大分子,选项A错误;
B.纤维素在人体内不水解,选项B错误;
C.蛋白质在重金属盐的作用下会发生变性,变性属于不可逆的变化,选项C错误;
D.DNA分子中的碱基间通过氢键作用配对以保持双螺旋结构,选项D正确;
答案选D。
12.C
A.将苯和溴水充分混合,苯将溴水中的溴萃取出来使溴水褪色,A错误;
B.乙醇和水都可与金属钠反应产生可燃性气体,但乙醇与钠产生气体的速率慢得多,乙醇分子中的羟基氢不如水分子中的氢原子活泼,B错误;
C.用乙酸浸泡水壶中的水垢,可将其清除,其中乙酸与碳酸钙反应生成醋酸钙、二氧化碳和水,说明乙酸的酸性强于碳酸的酸性, C正确;
D.将在空气中灼烧呈黑色的铜丝趁热插入盛有乙醇的试管中,铜丝变红色,依次发生反应2Cu+O22CuO、CH3CH2OH+CuOCH3CHO+Cu+H2O,反复数次,试管中的液体出现刺激性气味,生成了乙醛,由反应方程式可知,Cu为反应的催化剂,总反应为:2CH3CH2OH+O22CH3CHO+2H2O,由此可知乙醇是被氧气氧化为乙醛,D错误;
答案选C。
13.B
A项、沥青是一种防水防潮和防腐的有机胶凝材料,故A错误;
B项、钢筋是铁合金,属于无机材料,故B正确;
C项、天然橡胶和合成橡胶是有机高分子材料,故C错误;
D项、聚乙烯纤维是合成有机高分子材料,故D错误;
故选B。
14.C
A.苯酚与NaOH反应生成可溶于水的苯酚钠,而苯不与NaOH反应,且不溶于水,故除去苯中的少量苯酚:加入NaOH溶液振荡,静置分层后,用分液漏斗分离去水层,A能达到预期;
B.醋酸与碳酸钠反应生成易溶于水的醋酸钠溶液,而乙酸乙酯与碳酸钠不反应,且不溶于水,故利用向混有醋酸的乙酸乙酯中加入饱和Na2CO3溶液,振荡,分液分离除去乙酸乙酯中的少量醋酸,B能达到预期;
C.乙烯与高锰酸钾反应生成二氧化碳气体,除去CH4中少量的乙烯应用溴水,不能用酸性KMnO4溶液,C不能达到预期;
D.苯甲酸在热水中的溶解性较大,故重结晶法提纯苯甲酸时,为除去杂质和防止杂质析出,应该趁热过滤,D能达到预期;
答案为C。
15.D
A.该物质分子中含有不饱和的碳碳双键,能够与溴水发生加成反应,而使溴水褪色;能够被酸性KMnO4溶液氧化而使溴水褪色,故二者褪色的反应原理不相同,A错误;
B.在有机物键线式表示中,顶点和拐点表示C原子,根据C原子价电子数目是4,可知该键线式表示的防腐剂的分子式是C6H8O2,B错误;
C.该有机物分子中无酯基和卤素原子,因此不能发生水解反应,C错误;
D.该有机物分子中含有羧基,具有酸性,能够碳酸氢钠溶液发生反应产生二氧化碳气体,D正确;
故合理选项是D。
16.D
A. 硅是14号元素,硅原子的结构示意图: ,故A正确 ;
B. 丙烷的3个碳原子连成链状,每个碳原子均饱和,丙烷的球棍模型: ,故B正确;
C. 乙醇由C、H、O三种元素组成,乙醇的的分子式:C2H6O,故C正确;
D. CO2分子中碳与氧原子间形成碳氧双键,电子式: ,故D错误;
故选D。
17.D
A.HF为共价化合物,电子式中不能用方括号,A项错误;
B.CaCl2的电子式为,B项错误;
C.水也是共价化合物,电子式中不能用方括号,C项错误;
D.KCl是离子化合物,电子式书写正确,D项正确;
答案选D。
18.A
120℃时,产物水以气态形式存在,烃CxH4燃烧的化学方程式为:CxH4+(x+1)O2xCO2+2H2O(g)。在恒温、恒容条件下,体积之比等于物质的量之比,该反应前后气体的物质的量不变,则反应前后气体体积之比为1:1,A项正确;
答案选A。
19.B
天然橡胶的主要成分为聚异戊二烯,合成橡胶有丁苯橡胶、丁腈橡胶、氯丁橡胶等,它们的主要成分都是有机物,所以橡胶的主要成分属于有机物,故选B。
20.D
A. 该高聚物中含有酯键,为缩聚产物,A项错误;
B. 根据缩聚产物单体的推断方法:羰基和氧原子断开;羰基连羟基,氧原子连氢,,从左到右得到的单体依次为①HO—CH2—CH2—OH,②,③,④,⑤,⑥,其中②④⑥是二元羧酸,②⑥互为同系物,④与②⑥不是同系物关系,B项错误;
C. ③和⑤结构相同,故合成这种高分子化合物的单体至少有5种,C项错误;
D. 该高分子化合物是一种聚酯类,链端有羟基和羧基,D项正确;
答案选D。
21. B A E C D 乙烷 乙烷 乙烷 乙烷 (CH3)2C=CH—CH2—CH3 2—甲基—2—戊烯
(1)①具有相同质子数,不同中子数的同一元素的不同核素互为同位素,故答案为B;
②同素异形体是指由同样的单一化学元素组成,因排列方式不同,而具有不同性质的单质,故答案为A;
③在有机化学中,将分子式相同,结构不同的化合物互称为同分异构体,故答案为E;
④冰醋酸和乙酸为同一物质,故答案为C;
⑤同系物是指结构相似,分子组成相差若干个CH2原子团的有机化合物,故答案为D;
(2)①相同条件下完全燃烧1mol甲烷消耗2mol氧气生成2mol水;1mol乙烯消耗3mol氧气生成2mol水;1mol乙烷消耗3.5mol氧气生成3mol水;故需要氧气最多的是乙烷,生成水的质量最多的是乙烷;
②乙烷的相对分子质量为30、乙烯相对分子质量为28、乙炔相对分子质量为26,设完全燃烧xg的乙烷、乙烯、乙炔,乙烷的物质的量为,消耗氧气的物质的量为,生成水的物质的量为;乙烯的物质的量为,消耗氧气的物质的量为,生成水的物质的量为;乙炔的物质的量为,消耗氧气的物质的量为,生成水的物质的量为;故需要氧气最多的是乙烷,生成水的质量最多的是乙烷;
(3) 1mol某不饱和烃可以和1molCl2发生加成反应,生成2,3—二氯—2—甲基戊烷,该不饱和烃结构简式为(CH3)2C=CH—CH2—CH3;其系统命名为2—甲基—2—戊烯。
22. 略 a 溴水或酸性高锰酸钾溶液
根据乙烯为共价化合物,及C原子和H原子最外层可达到的电子数写出乙烯的电子式;
根据烃的分子式和含甲基的个数写出结构简式;
根据同系物性质类似,分子式相差n个CH2,结合选项中物质的官能团判断;
根据聚乙烯是由乙烯通过加聚得到的写出结构简式;
找出与苯不反应,与二乙烯基乙炔反应且有颜色的物质即可鉴别此两种物质。
(1)乙烯为共价化合物,C原子最外层可达到8个电子,H原子最外层可达到2个电子,乙烯正确的电子式为:;
(2)根据烃的分子式和含甲基的个数可知,该烃只能为新戊烷,结构简式为;
(3)根据同系物的定义可知与乙烯互为同系物的只能是a;
(4)聚乙烯为乙烯通过加聚反应生成的,其正确的结构简式为:;
(5)根据苯不与溴水(或高锰酸钾溶液)反应而二乙烯基乙炔可与溴水(或高锰酸钾溶液)反应,使溴水(或高锰酸钾溶液)褪色可知可用溴水(或高锰酸钾溶液)鉴别苯和二乙烯基乙炔;其中将溴水(或高锰酸钾溶液)加入到苯中时,能观察到的现象是溶液分层,苯层在上,水在下,振荡,静置后,苯层呈红棕色,水层颜色变浅(或溶液分层,苯层在上,水在下,振荡,静置后,苯层无色,水层仍呈紫色)。
【点睛】苯分子结构是单键和双键之间的特殊的键,与溴水,酸性高锰酸钾溶液均不反应。
23. ②③④⑤⑧⑩ ②⑤⑩ ③④⑧
有机物是指除了、、碳酸以及碳酸盐、氰化物、 的含碳化合物,故:②;③;④;⑤;⑧;⑩;其中烃指只含有碳元素和氢元素的化合物,所以属于烃的是:②;⑤;⑩;烃的衍生物是指烃中的氢原子被其他原子或原子团替代后的物质,所以属于烃的衍生物的:③;④;⑧;的官能团是,的官能团是。
24. ⑤ ⑦ ④ ③⑥
(1)根据质子数与电子数的关系确定是否带电荷及电荷的多少、电性,根据质子数、中子数确定质量数;
(2)一般来说,活泼金属和活泼非金属元素之间易形成离子键,不同非金属元素之间易形成极性键,同种非金属元素之间易形成非极性键,含有离子键的化合物是离子化合物,只含共价键的化合物是共价化合物,据此分析解答;
(3)CaF2中存在Ca2+和F-离子,通过离子键结合在一起;二氧化碳中存在两个碳氧键,C、O原子最外层都达到最外层8个电子;氯化铵为离子晶体,由氨根离子与氯离子通过离子键结合在一起;
(4)根据硫化氢中硫原子与氢原子之间通过共价键形成的共价化合物;氯化镁是氯离子和镁离子之间通过离子键形成的离子化合物。
(1)核中有17个质子,为Cl元素,有20个中子,质量数为17+20=37,核外有18个电子,核内质子数比核外电子数少1,所以该微粒是带一个单位负电荷,为阴离子,该粒子的化学符号是;
(2)①H2中只含非极性键;
②Na2O2中钠离子与过氧根离子之间存在离子键,存在O-O非极性键,属于离子化合物;
③NaOH中含有离子键和O-H极性键,属于离子化合物;
④H2O2中存在H-O极性键和O-O非极性键,属于共价化合物;
⑤CaCl2只存在离子键,属于离子化合物;
⑥NH4NO3中存在离子键和极性键,属于离子化合物;
⑦H2S中只存在极性共价键,为共价化合物;
则:只由离子键构成的物质是⑤;只由极性共价键构成的物质是⑦;由极性键和非极性键构成的物质是④;由离子键和极性键构成的物质是③⑥;
(3)CaF2中存在Ca2+和F-离子,电子式为;二氧化碳中存在两对碳氧共用电子对,二氧化碳的电子式为:;氯化铵是离子化合物,由氨根离子与氯离子构成,电子式为:;
(4)H2S的形成过程为,MgCl2的形成过程为。
【点睛】本题难点是用电子式表示化学键形成过程,通常用“→”表示形成过程,在“→”左边是形成该物质的所有原子的电子式,相同的原子可以合并,在“→”右边是该物质的电子式;形成离子化合物时,要标箭头,表示电子转移方向。
25. 3 羧基 ①② ③
根据C、H、O的价键结构可知,左上方应该是碳碳双键,后上方是碳氧双键,因此该物质的结构简式为 ,再根据同系物和同分异构体的定义分析解答。
⑴该物质的结构简式为 ;该化合物含有3种等效氢原子,故该化合物的核磁共振氢谱中共有3个吸收峰;
⑵该物质中所含含氧官能团的名称为羧基;
⑶①,②与原物质分子式相同,结构不同,互为同分异构体;③与原物质都含有一个碳碳双键、一个羧基,官能团相同,结构相似,组成相差一个CH2,则互为同系物;④只含有一个羧基,与原物质结构不相似,不是同系物,分子式不同,不是同分异构体,因此与该物质互为同分异构体的是①②,与该物质互为同系物的是③。
【点睛】同系物指结构相似,分子组成上相差1个或若干个CH2原子团的物质,结构相似即同系物具有相同种类和数目的官能团,通式相同;具有相同分子式而结构不同的化合物互为同分异构体,这是常考点,也是学生们的易错点
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
