2.1.2 钠的氧化物(共19张PPT)-人教版(2019)高中化学必修1
文档属性
| 名称 | 2.1.2 钠的氧化物(共19张PPT)-人教版(2019)高中化学必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 18.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-08 23:21:48 | ||
图片预览




文档简介
(共19张PPT)
钠的氧化物
【任务一】分类对比,证据推理
【思考与讨论】
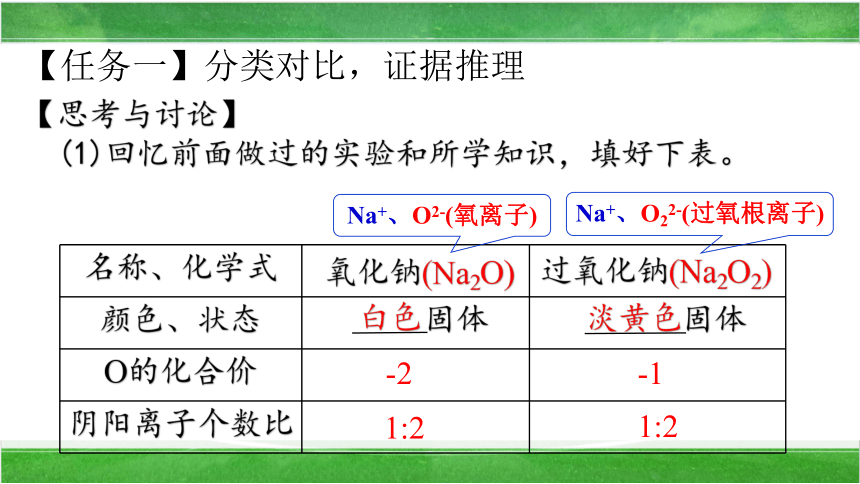
(1)回忆前面做过的实验和所学知识,填好下表。
名称、化学式
颜色、状态 固体 固体
O的化合价
阴阳离子个数比
-2
淡黄色
白色
-1
氧化钠(Na2O)
过氧化钠(Na2O2)
Na+、O2-(氧离子)
Na+、O22-(过氧根离子)
1:2
1:2
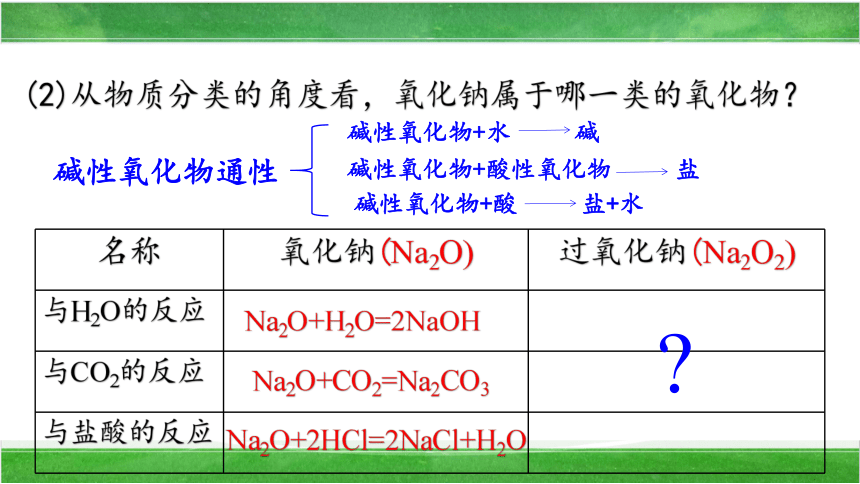
(2)从物质分类的角度看,氧化钠属于哪一类的氧化物?
名称 氧化钠(Na2O) 过氧化钠(Na2O2)
与H2O的反应
与CO2的反应
与盐酸的反应
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
碱性氧化物通性
碱性氧化物+水 碱
碱性氧化物+酸性氧化物 盐
碱性氧化物+酸 盐+水
Na2O2中氧元素的化合价是多少?
-1
1、过氧化钠与水反应
(1) 预测产物
是常见的化合价吗?
不是
会变成多少价呢?
0价
-2价
那么反应的可能产物是什么呢?
O2 和 NaOH
【任务二】探究过氧化钠的性质
(2)探究实验2-3:探究Na2O2与水的反应
将1~2mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞,有什么现象?
实验操作 实验现象 实验结论
Na2O2具有漂白性
溶液褪色
试管外壁发烫
产生气泡、带火星的木条复燃
溶液先变红色
反应放热
反应生成O2
反应生成NaOH
2Na2O2+2H2O=4NaOH+O2↑
失去2xe-
得到2xe-
既是氧化剂又是还原剂
-1 -2 0
结论:
过氧化钠和水反应放热,生成氧气和氢氧化钠,过氧化钠有强氧化性和漂白性。
1、过氧化钠与水反应
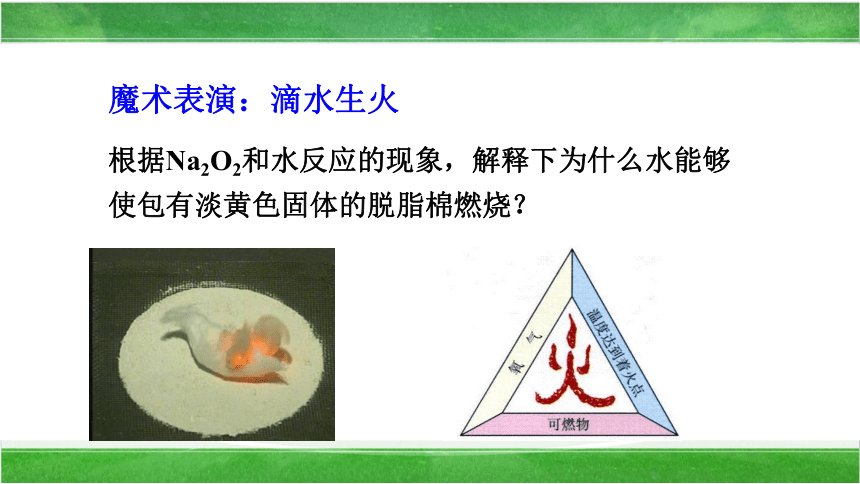
根据Na2O2和水反应的现象,解释下为什么水能够
使包有淡黄色固体的脱脂棉燃烧?
魔术表演:滴水生火
趣味实验:吹气生火
实验用品:过氧化钠、
脱脂棉、石棉网、长导管
问题:怎么提供CO2
2、过氧化钠与二氧化碳反应
2Na2O2+2CO2=2Na2CO3+O2
失去2xe-
得到2xe-
既是氧化剂又是还原剂
-1 -2 0
【推理】 对比Na2O与H2O、Na2O2与H2O的反应,写出其与
盐酸的反应方程式。
2Na2O2+4HCl=4NaCl+2H2O+O2↑
【思考】 Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
【任务三】根据过氧化钠的性质,猜测其用途。
1.氧气的来源。
2.做漂白剂
漂白织物、麦杆、羽毛等。
【任务四】学以致用
【解决问题】
1.钠着火用什么能够灭火?
2.实验室中怎么保存过氧化钠?
3.向运输活鱼的容器中添加过氧化钙干吗?
1.下列对于过氧化钠的叙述正确的是( )
A. 过氧化钠能与水反应,所以过氧化钠可以作为很多气体的干
燥剂
B. 过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
C. 过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
D. Na2O2和Na2O均可作供氧剂
【反馈练习】
C
2.向紫色石蕊试液中加入过量的Na2O2粉末振荡,可观察到的
现象是( )
A. 溶液仍为紫色
B. 溶液最终变成蓝色
C. 最终溶液褪色,而无其他的现象
D.溶液中有气泡产生,溶液先变蓝后褪色
D
3.将Na2O2投入到CuSO4溶液中,可观察到的现象是( )
A. 最终生成蓝色沉淀 B. 有气泡但无沉淀产生
C. 最终生成白色沉淀 D. 无明显现象
A
解:2Na2O2+2H2O = 4NaOH+O2↑
2NaOH+CuSO4 = Na2SO4 +Cu(OH)2↓
一定量的过氧化钠与一定量的CO2和H2O(g)的混合物反应,过氧化钠先与谁反应呢?
【课后思考】
谢 谢 聆 听
钠的氧化物
【任务一】分类对比,证据推理
【思考与讨论】
(1)回忆前面做过的实验和所学知识,填好下表。
名称、化学式
颜色、状态 固体 固体
O的化合价
阴阳离子个数比
-2
淡黄色
白色
-1
氧化钠(Na2O)
过氧化钠(Na2O2)
Na+、O2-(氧离子)
Na+、O22-(过氧根离子)
1:2
1:2
(2)从物质分类的角度看,氧化钠属于哪一类的氧化物?
名称 氧化钠(Na2O) 过氧化钠(Na2O2)
与H2O的反应
与CO2的反应
与盐酸的反应
Na2O+H2O=2NaOH
Na2O+CO2=Na2CO3
Na2O+2HCl=2NaCl+H2O
碱性氧化物通性
碱性氧化物+水 碱
碱性氧化物+酸性氧化物 盐
碱性氧化物+酸 盐+水
Na2O2中氧元素的化合价是多少?
-1
1、过氧化钠与水反应
(1) 预测产物
是常见的化合价吗?
不是
会变成多少价呢?
0价
-2价
那么反应的可能产物是什么呢?
O2 和 NaOH
【任务二】探究过氧化钠的性质
(2)探究实验2-3:探究Na2O2与水的反应
将1~2mL水滴入盛有1~2g过氧化钠固体的试管中,立即把带火星的木条伸入试管中,检验生成的气体。用手轻轻触摸试管外壁,有什么感觉?然后向反应后的溶液中滴入酚酞,有什么现象?
实验操作 实验现象 实验结论
Na2O2具有漂白性
溶液褪色
试管外壁发烫
产生气泡、带火星的木条复燃
溶液先变红色
反应放热
反应生成O2
反应生成NaOH
2Na2O2+2H2O=4NaOH+O2↑
失去2xe-
得到2xe-
既是氧化剂又是还原剂
-1 -2 0
结论:
过氧化钠和水反应放热,生成氧气和氢氧化钠,过氧化钠有强氧化性和漂白性。
1、过氧化钠与水反应
根据Na2O2和水反应的现象,解释下为什么水能够
使包有淡黄色固体的脱脂棉燃烧?
魔术表演:滴水生火
趣味实验:吹气生火
实验用品:过氧化钠、
脱脂棉、石棉网、长导管
问题:怎么提供CO2
2、过氧化钠与二氧化碳反应
2Na2O2+2CO2=2Na2CO3+O2
失去2xe-
得到2xe-
既是氧化剂又是还原剂
-1 -2 0
【推理】 对比Na2O与H2O、Na2O2与H2O的反应,写出其与
盐酸的反应方程式。
2Na2O2+4HCl=4NaCl+2H2O+O2↑
【思考】 Na2O2是不是碱性氧化物?
不是,Na2O2是过氧化物。
【任务三】根据过氧化钠的性质,猜测其用途。
1.氧气的来源。
2.做漂白剂
漂白织物、麦杆、羽毛等。
【任务四】学以致用
【解决问题】
1.钠着火用什么能够灭火?
2.实验室中怎么保存过氧化钠?
3.向运输活鱼的容器中添加过氧化钙干吗?
1.下列对于过氧化钠的叙述正确的是( )
A. 过氧化钠能与水反应,所以过氧化钠可以作为很多气体的干
燥剂
B. 过氧化钠与水反应时,过氧化钠是氧化剂,水是还原剂
C. 过氧化钠与二氧化碳反应时,过氧化钠既是氧化剂又是还原剂
D. Na2O2和Na2O均可作供氧剂
【反馈练习】
C
2.向紫色石蕊试液中加入过量的Na2O2粉末振荡,可观察到的
现象是( )
A. 溶液仍为紫色
B. 溶液最终变成蓝色
C. 最终溶液褪色,而无其他的现象
D.溶液中有气泡产生,溶液先变蓝后褪色
D
3.将Na2O2投入到CuSO4溶液中,可观察到的现象是( )
A. 最终生成蓝色沉淀 B. 有气泡但无沉淀产生
C. 最终生成白色沉淀 D. 无明显现象
A
解:2Na2O2+2H2O = 4NaOH+O2↑
2NaOH+CuSO4 = Na2SO4 +Cu(OH)2↓
一定量的过氧化钠与一定量的CO2和H2O(g)的混合物反应,过氧化钠先与谁反应呢?
【课后思考】
谢 谢 聆 听
