7.2物质溶解的量同步练习科粤版化学九年级下册(含答案)
文档属性
| 名称 | 7.2物质溶解的量同步练习科粤版化学九年级下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 531.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-09 08:42:18 | ||
图片预览



文档简介
7.2物质溶解的量
一、多选题
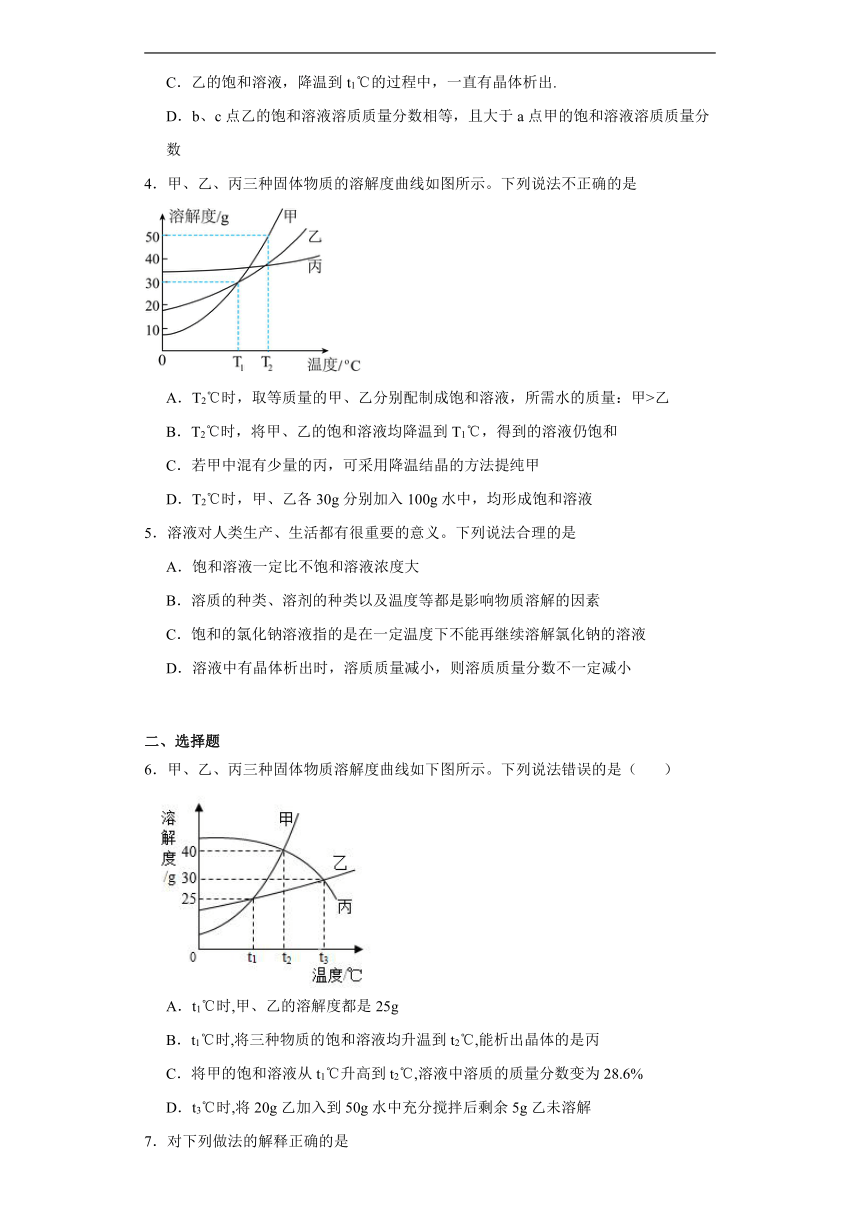
1.甲、乙两种固体物质(不含结晶水)的溶解度曲线如右上图所示。请你分析下列说法中正确的是
A.t2℃时,甲物质的溶解度大于乙物质的溶解度
B.t1℃时,甲、乙两种物质所形成的饱和溶液中,含有溶质的质量相等
C.t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数
D.t1℃时,甲乙两种物质所形成饱和溶液的溶质质量分数均为20%
2.物质世界的变化都遵循一定的规律。下列叙述中,正确的是
A.水的天然循环是通过其三态变化实现的
B.物质溶解时常常伴随能量的变化
C.物质发生化学变化时也伴随着能量变化
D.某温度下的饱和溶液不能再溶解任何物质
3.MgSO4和Na2SO4,的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ 20 30 40 50 60 70
溶解度/g MgSO4 33.7 38.9 44.5 50.6 54.6 55.8
Na2SO4 19.5 40.5 48.8 47.5 45.3 44.8
A.甲为Na2SO4
B.t3C应介于40℃~50℃之间
C.乙的饱和溶液,降温到t1℃的过程中,一直有晶体析出.
D.b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数
4.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是
A.T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙
B.T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T2℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液
5.溶液对人类生产、生活都有很重要的意义。下列说法合理的是
A.饱和溶液一定比不饱和溶液浓度大
B.溶质的种类、溶剂的种类以及温度等都是影响物质溶解的因素
C.饱和的氯化钠溶液指的是在一定温度下不能再继续溶解氯化钠的溶液
D.溶液中有晶体析出时,溶质质量减小,则溶质质量分数不一定减小
二、选择题
6.甲、乙、丙三种固体物质溶解度曲线如下图所示。下列说法错误的是( )
A.t1℃时,甲、乙的溶解度都是25g
B.t1℃时,将三种物质的饱和溶液均升温到t2℃,能析出晶体的是丙
C.将甲的饱和溶液从t1℃升高到t2℃,溶液中溶质的质量分数变为28.6%
D.t3℃时,将20g乙加入到50g水中充分搅拌后剩余5g乙未溶解
7.对下列做法的解释正确的是
A.露置在空气中的铁制品锈迹斑斑:铁与氧气和水接触生锈
B.溶液具有均一性和稳定性:溶液中的各种粒子都静止不动
C.伍德合金可作为保险丝:伍德合金熔点高
D.打开汽水瓶有气泡冒出:温度降低,二氧化碳溶解度减小
8.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法错误的是( )
A.t2℃时,甲物质的溶解度大于乙物质的溶解度
B.t1℃时,甲、乙两种物质各50g分别加入到100g水中,充分溶解,得到的溶液质量都是140g
C.t1℃时,甲、乙两种物质的溶液的溶质质量分数一定相等
D.t2℃时等质量的甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙
9.t℃时,向一支盛有0.l克熟石灰的试管内加入 10 mL水,充分振荡,静置,试管底部仍有未溶解的白色固体,对于试管内上层澄清液体的叙述正确的是
A.溶液中溶质的质量为0.1克 B.溶液是t℃时的饱和溶液
C.升高温度溶液变为不饱和溶液 D.溶液中溶质的质量分数等于1%
10.如图是Ca(OH)2的溶解度曲线,下列说法正确的是
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易溶
A.Ca(OH)2属于易溶物质
B.Ca(OH)2溶解度随温度的升高而降低
C.20℃时,Ca(OH)2饱和溶液中溶质质量分数大于1%
D.将70℃的Ca(OH)2饱和溶液降温到50℃,会析出固体
11.有关固体物质在水中溶解的下列说法:①搅拌可增大物质的溶解度②颗粒越大溶解越慢③温度越高,溶解度一定越大④溶液饱和后就不能再溶解其他物质了⑤物质的溶解受水分子的影响。其中正确的是
A.①②③④⑤ B.①②③⑤ C.②⑤ D.①③④
12.甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是
A.依据溶解度曲线可判断,甲的溶解度比乙的大
B.将t2℃时甲的饱和溶液变为不饱和溶液,可采取升温或加水的方法
C.t1℃时,甲、乙两溶液的溶质质量分数一定相等
D.将甲在t1℃的饱和溶液升温至t2℃,溶液的溶质质量分数增大
13.甲 乙 丙三种固体物质溶解度曲线如下图所示,下列说法错误的是
A.t1℃时,甲 乙的溶解度都是25g
B.t1℃时,将三种物质的饱和溶液均升温到t2℃,能分析出晶体的是丙
C.将甲的饱和溶液从t1℃升高到t2℃,溶液中溶质的质量分数变为28.6%
D.丙的溶解度随温度的升高而减小
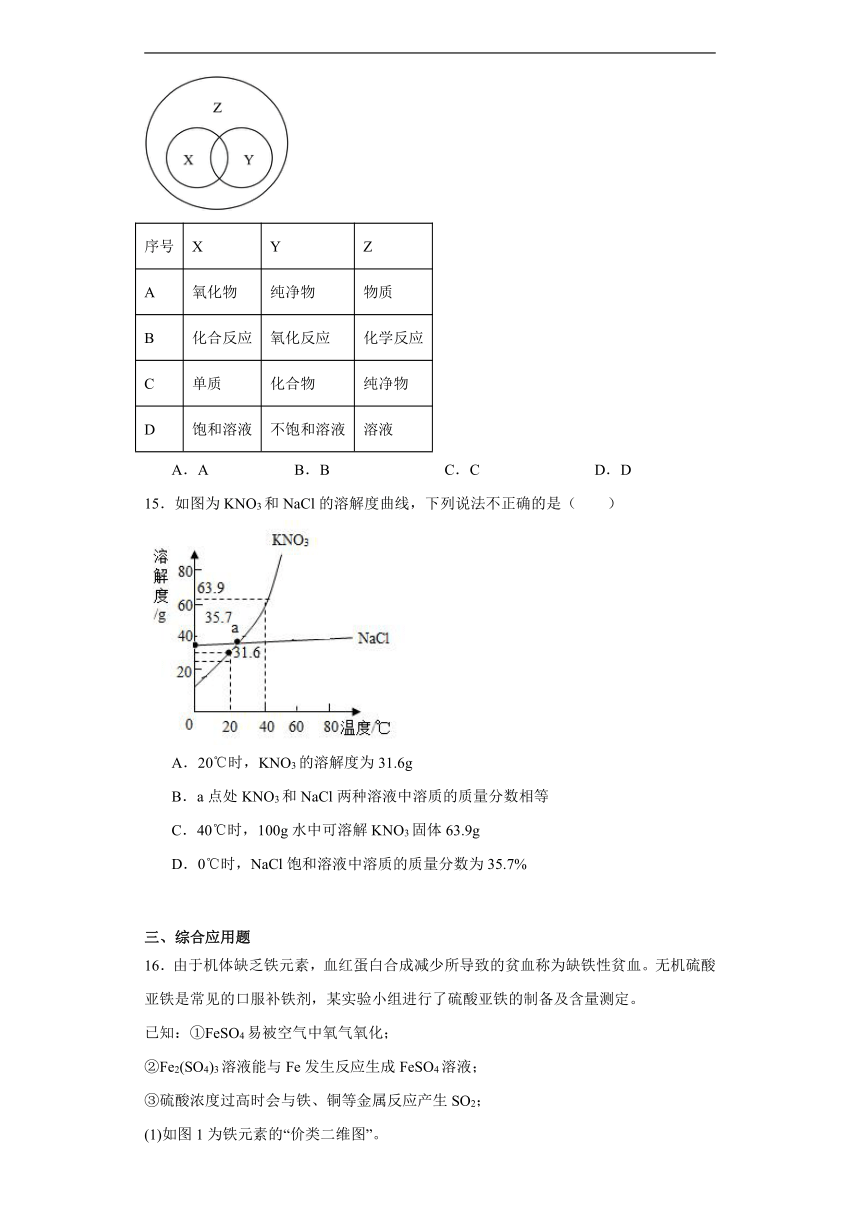
14.概念之间存在并列、交叉和包含等3中关系。符合如图所示关系的一组概念是
序号 X Y Z
A 氧化物 纯净物 物质
B 化合反应 氧化反应 化学反应
C 单质 化合物 纯净物
D 饱和溶液 不饱和溶液 溶液
A.A B.B C.C D.D
15.如图为KNO3和NaCl的溶解度曲线,下列说法不正确的是( )
A.20℃时,KNO3的溶解度为31.6g
B.a点处KNO3和NaCl两种溶液中溶质的质量分数相等
C.40℃时,100g水中可溶解KNO3固体63.9g
D.0℃时,NaCl饱和溶液中溶质的质量分数为35.7%
三、综合应用题
16.由于机体缺乏铁元素,血红蛋白合成减少所导致的贫血称为缺铁性贫血。无机硫酸亚铁是常见的口服补铁剂,某实验小组进行了硫酸亚铁的制备及含量测定。
已知:①FeSO4易被空气中氧气氧化;
②Fe2(SO4)3溶液能与Fe发生反应生成FeSO4溶液;
③硫酸浓度过高时会与铁、铜等金属反应产生SO2;
(1)如图1为铁元素的“价类二维图”。
①图1中E点对应物质易在空气中转化成D点对应物质,原因: 。
②写出铁粉与稀硫酸制备硫酸亚铁的基本反应类型是: 。
③有部分铁屑已生锈,铁锈主要成分用化学式表示: ,
在制备硫酸亚铁过程中不需要对铁锈进行处理,可能的原因(用化学方程式表示)是: 。
(2)探究制备硫酸亚铁时硫酸浓度
某实验小组进行了探究制备硫酸亚铁时硫酸浓度:取10份1g铁粉分别装入10支试管中,向其中滴入含有等量的H2SO4,但质量分数不同的硫酸进行实验,探究合适的硫酸浓度。
①实验小组选择用“含有等量的H2SO4,但质量分数不同的硫酸”,而不是用“等体积质量分数不同的硫酸”的原因是: 。
②实验小组在实验过程中发现不适宜用浓度较高的硫酸,可能的原因是: 。
(3)从溶液中获得FeSO4·7H2O晶体
如图所示为硫酸亚铁在不同温度下的的溶解度曲线,且在不同温度下得到的硫酸亚铁晶体是不同的。从溶液中获得FeSO4·7H2O晶体的方法:
在57℃ (填“加压”“减压”)蒸发,浓缩至 、 、过滤、洗涤、低温干燥。适宜的洗涤液是 。
A.洗洁精 B.热水 C.冰水 D.饱和硫酸亚铁溶液
(4)样品中硫酸亚铁的含量测定
准确称取制得的硫酸亚铁样品1.41g于锥形瓶中,加蒸馏水完全溶解,加入稀硫酸,滴加溶质质量分数为1.58%的高锰酸钾溶液,当恰好完全反应时,消耗高锰酸钾溶液的体积为10.00mL(该高锰酸钾溶液密度近似为1g/mL)。列式计算该样品中硫酸亚铁的含量(结果用百分数表示,保留一位小数)。已知:高锰酸钾与硫酸亚铁反应的化学方程式为10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O(相对分子质量:FeSO4=152,KMnO4=158,FeSO4·7H2O=278)
17.氯化钠是生产、生活中的一种重要化合物,应用很广泛。
(1)图甲和图乙分别是钠原子和氯原子的原子结构示意图。
①图甲中的 x= 。
②金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的 1 个电子,从而形成最外层有 个电子的相对稳定的氯离子,氯离子用化学符号表示为 。
(2)如表是氯化钠在不同温度下的溶解度数据。
温度/℃ 0 10 20 30 40 50 60 70
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8
①30℃时,将 10g 氯化钠加入到 50g 水中,充分搅拌后,所得到的氯化钠溶液属于 (“饱和”或“不饱和”)溶液。
②医用盐水的溶质质量分数为 0.9%,现有 200mL 该盐水(假定该溶液的密度为 1.1g/mL),其中含 NaCl 的质量为 g。
18.我国的海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发前景十分远大。
(1)海水中蕴藏着丰富的资源,海水“晒盐”过程中可得到粗盐和卤水,海水晒盐利用了 (填“蒸发结晶”“降温结晶”之一)的原理。
(2)镁元素广泛应用于火箭、导弹和飞机制造业,被称为“国防元素”。下图为从海水或卤水中制取单质镁的转化过程,试回答下列问题:
①所加石灰乳的主要成分是 (填化学式)。
②海水或卤水中本来就含有MgCl2,为什么还要加入石灰乳、稀盐酸来制取MgCl2,这样做的目的是 。
③小雪同学在实验室进行海水提取氯化镁的模拟实验,在过滤操作中使用了玻璃棒,其作用是 。
④流程图中发生分解反应的化学方程式为 。
(3)同学取100g某氯化镁溶液于一只洁净的烧杯中,然后逐滴加入溶质质量分数为10%的NaOH溶液至过量,烧杯内溶液的质量与加入NaOH溶液的质量关系如图所示。试回答:
①当滴入NaOH溶液46g时(即图中A点),烧杯中溶液里大量存在的金属阳离子是 (填离子符号)。
②当滴入10%的NaOH溶液80g时(即B点)恰好完全反应,试通过计算,求该氯化镁溶液的溶质质量分数(计算结果精确至0.1%)。
参考答案:
1.AD
2.ABC
3.BD
4.AD
5.BD
6.C
7.A
8.C
9.B
10.B
11.C
12.B
13.C
14.B
15.D
16.(1) 氢氧化亚铁化学性质不稳定,在空气中中易被氧气氧化 置换反应 Fe2O3 Fe+Fe2(SO4)3=3FeSO4
(2) 等体积质量分数不同的硫酸溶液中硫酸质量不相等 硫酸浓度过高时会与铁、铜等金属反应产生SO2
(3) 减压 饱和 冷却结晶 CD
(4)53.9%
解:10.00mL高锰酸钾溶液的质量为10g,10.00mL高锰酸钾溶液中高锰酸钾的质量为:10g ×1.58%=0.158g。
设样品中硫酸亚铁的质量为x。
,x=0.76g
该样品中硫酸亚铁的含量为:=53.9%。
17.(1) 1 8 Cl-
(2) 不饱和 1.98
18.(1)蒸发结晶
(2) Ca(OH)2 富集镁元素,除去杂质 引流
(3)①Na+、Mg2+
②解:80g×10%=8g
设:氯化镁溶液中溶质的质量为。
答:氯化镁溶液的溶质质量分数为9.5%。
一、多选题
1.甲、乙两种固体物质(不含结晶水)的溶解度曲线如右上图所示。请你分析下列说法中正确的是
A.t2℃时,甲物质的溶解度大于乙物质的溶解度
B.t1℃时,甲、乙两种物质所形成的饱和溶液中,含有溶质的质量相等
C.t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数
D.t1℃时,甲乙两种物质所形成饱和溶液的溶质质量分数均为20%
2.物质世界的变化都遵循一定的规律。下列叙述中,正确的是
A.水的天然循环是通过其三态变化实现的
B.物质溶解时常常伴随能量的变化
C.物质发生化学变化时也伴随着能量变化
D.某温度下的饱和溶液不能再溶解任何物质
3.MgSO4和Na2SO4,的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ 20 30 40 50 60 70
溶解度/g MgSO4 33.7 38.9 44.5 50.6 54.6 55.8
Na2SO4 19.5 40.5 48.8 47.5 45.3 44.8
A.甲为Na2SO4
B.t3C应介于40℃~50℃之间
C.乙的饱和溶液,降温到t1℃的过程中,一直有晶体析出.
D.b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数
4.甲、乙、丙三种固体物质的溶解度曲线如图所示。下列说法不正确的是
A.T2℃时,取等质量的甲、乙分别配制成饱和溶液,所需水的质量:甲>乙
B.T2℃时,将甲、乙的饱和溶液均降温到T1℃,得到的溶液仍饱和
C.若甲中混有少量的丙,可采用降温结晶的方法提纯甲
D.T2℃时,甲、乙各30g分别加入100g水中,均形成饱和溶液
5.溶液对人类生产、生活都有很重要的意义。下列说法合理的是
A.饱和溶液一定比不饱和溶液浓度大
B.溶质的种类、溶剂的种类以及温度等都是影响物质溶解的因素
C.饱和的氯化钠溶液指的是在一定温度下不能再继续溶解氯化钠的溶液
D.溶液中有晶体析出时,溶质质量减小,则溶质质量分数不一定减小
二、选择题
6.甲、乙、丙三种固体物质溶解度曲线如下图所示。下列说法错误的是( )
A.t1℃时,甲、乙的溶解度都是25g
B.t1℃时,将三种物质的饱和溶液均升温到t2℃,能析出晶体的是丙
C.将甲的饱和溶液从t1℃升高到t2℃,溶液中溶质的质量分数变为28.6%
D.t3℃时,将20g乙加入到50g水中充分搅拌后剩余5g乙未溶解
7.对下列做法的解释正确的是
A.露置在空气中的铁制品锈迹斑斑:铁与氧气和水接触生锈
B.溶液具有均一性和稳定性:溶液中的各种粒子都静止不动
C.伍德合金可作为保险丝:伍德合金熔点高
D.打开汽水瓶有气泡冒出:温度降低,二氧化碳溶解度减小
8.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图所示。下列说法错误的是( )
A.t2℃时,甲物质的溶解度大于乙物质的溶解度
B.t1℃时,甲、乙两种物质各50g分别加入到100g水中,充分溶解,得到的溶液质量都是140g
C.t1℃时,甲、乙两种物质的溶液的溶质质量分数一定相等
D.t2℃时等质量的甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙
9.t℃时,向一支盛有0.l克熟石灰的试管内加入 10 mL水,充分振荡,静置,试管底部仍有未溶解的白色固体,对于试管内上层澄清液体的叙述正确的是
A.溶液中溶质的质量为0.1克 B.溶液是t℃时的饱和溶液
C.升高温度溶液变为不饱和溶液 D.溶液中溶质的质量分数等于1%
10.如图是Ca(OH)2的溶解度曲线,下列说法正确的是
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易溶
A.Ca(OH)2属于易溶物质
B.Ca(OH)2溶解度随温度的升高而降低
C.20℃时,Ca(OH)2饱和溶液中溶质质量分数大于1%
D.将70℃的Ca(OH)2饱和溶液降温到50℃,会析出固体
11.有关固体物质在水中溶解的下列说法:①搅拌可增大物质的溶解度②颗粒越大溶解越慢③温度越高,溶解度一定越大④溶液饱和后就不能再溶解其他物质了⑤物质的溶解受水分子的影响。其中正确的是
A.①②③④⑤ B.①②③⑤ C.②⑤ D.①③④
12.甲、乙两种物质的溶解度曲线如图所示。下列叙述正确的是
A.依据溶解度曲线可判断,甲的溶解度比乙的大
B.将t2℃时甲的饱和溶液变为不饱和溶液,可采取升温或加水的方法
C.t1℃时,甲、乙两溶液的溶质质量分数一定相等
D.将甲在t1℃的饱和溶液升温至t2℃,溶液的溶质质量分数增大
13.甲 乙 丙三种固体物质溶解度曲线如下图所示,下列说法错误的是
A.t1℃时,甲 乙的溶解度都是25g
B.t1℃时,将三种物质的饱和溶液均升温到t2℃,能分析出晶体的是丙
C.将甲的饱和溶液从t1℃升高到t2℃,溶液中溶质的质量分数变为28.6%
D.丙的溶解度随温度的升高而减小
14.概念之间存在并列、交叉和包含等3中关系。符合如图所示关系的一组概念是
序号 X Y Z
A 氧化物 纯净物 物质
B 化合反应 氧化反应 化学反应
C 单质 化合物 纯净物
D 饱和溶液 不饱和溶液 溶液
A.A B.B C.C D.D
15.如图为KNO3和NaCl的溶解度曲线,下列说法不正确的是( )
A.20℃时,KNO3的溶解度为31.6g
B.a点处KNO3和NaCl两种溶液中溶质的质量分数相等
C.40℃时,100g水中可溶解KNO3固体63.9g
D.0℃时,NaCl饱和溶液中溶质的质量分数为35.7%
三、综合应用题
16.由于机体缺乏铁元素,血红蛋白合成减少所导致的贫血称为缺铁性贫血。无机硫酸亚铁是常见的口服补铁剂,某实验小组进行了硫酸亚铁的制备及含量测定。
已知:①FeSO4易被空气中氧气氧化;
②Fe2(SO4)3溶液能与Fe发生反应生成FeSO4溶液;
③硫酸浓度过高时会与铁、铜等金属反应产生SO2;
(1)如图1为铁元素的“价类二维图”。
①图1中E点对应物质易在空气中转化成D点对应物质,原因: 。
②写出铁粉与稀硫酸制备硫酸亚铁的基本反应类型是: 。
③有部分铁屑已生锈,铁锈主要成分用化学式表示: ,
在制备硫酸亚铁过程中不需要对铁锈进行处理,可能的原因(用化学方程式表示)是: 。
(2)探究制备硫酸亚铁时硫酸浓度
某实验小组进行了探究制备硫酸亚铁时硫酸浓度:取10份1g铁粉分别装入10支试管中,向其中滴入含有等量的H2SO4,但质量分数不同的硫酸进行实验,探究合适的硫酸浓度。
①实验小组选择用“含有等量的H2SO4,但质量分数不同的硫酸”,而不是用“等体积质量分数不同的硫酸”的原因是: 。
②实验小组在实验过程中发现不适宜用浓度较高的硫酸,可能的原因是: 。
(3)从溶液中获得FeSO4·7H2O晶体
如图所示为硫酸亚铁在不同温度下的的溶解度曲线,且在不同温度下得到的硫酸亚铁晶体是不同的。从溶液中获得FeSO4·7H2O晶体的方法:
在57℃ (填“加压”“减压”)蒸发,浓缩至 、 、过滤、洗涤、低温干燥。适宜的洗涤液是 。
A.洗洁精 B.热水 C.冰水 D.饱和硫酸亚铁溶液
(4)样品中硫酸亚铁的含量测定
准确称取制得的硫酸亚铁样品1.41g于锥形瓶中,加蒸馏水完全溶解,加入稀硫酸,滴加溶质质量分数为1.58%的高锰酸钾溶液,当恰好完全反应时,消耗高锰酸钾溶液的体积为10.00mL(该高锰酸钾溶液密度近似为1g/mL)。列式计算该样品中硫酸亚铁的含量(结果用百分数表示,保留一位小数)。已知:高锰酸钾与硫酸亚铁反应的化学方程式为10FeSO4+2KMnO4+8H2SO4═5Fe2(SO4)3+2MnSO4+K2SO4+8H2O(相对分子质量:FeSO4=152,KMnO4=158,FeSO4·7H2O=278)
17.氯化钠是生产、生活中的一种重要化合物,应用很广泛。
(1)图甲和图乙分别是钠原子和氯原子的原子结构示意图。
①图甲中的 x= 。
②金属钠与氯气反应时,由图乙的结构可知,氯原子容易得到钠失去的 1 个电子,从而形成最外层有 个电子的相对稳定的氯离子,氯离子用化学符号表示为 。
(2)如表是氯化钠在不同温度下的溶解度数据。
温度/℃ 0 10 20 30 40 50 60 70
NaCl 35.7 35.8 36.0 36.3 36.6 37.0 37.3 37.8
①30℃时,将 10g 氯化钠加入到 50g 水中,充分搅拌后,所得到的氯化钠溶液属于 (“饱和”或“不饱和”)溶液。
②医用盐水的溶质质量分数为 0.9%,现有 200mL 该盐水(假定该溶液的密度为 1.1g/mL),其中含 NaCl 的质量为 g。
18.我国的海岸线长达3.2万千米,海洋专属经济区幅员辽阔,海洋资源丰富,开发前景十分远大。
(1)海水中蕴藏着丰富的资源,海水“晒盐”过程中可得到粗盐和卤水,海水晒盐利用了 (填“蒸发结晶”“降温结晶”之一)的原理。
(2)镁元素广泛应用于火箭、导弹和飞机制造业,被称为“国防元素”。下图为从海水或卤水中制取单质镁的转化过程,试回答下列问题:
①所加石灰乳的主要成分是 (填化学式)。
②海水或卤水中本来就含有MgCl2,为什么还要加入石灰乳、稀盐酸来制取MgCl2,这样做的目的是 。
③小雪同学在实验室进行海水提取氯化镁的模拟实验,在过滤操作中使用了玻璃棒,其作用是 。
④流程图中发生分解反应的化学方程式为 。
(3)同学取100g某氯化镁溶液于一只洁净的烧杯中,然后逐滴加入溶质质量分数为10%的NaOH溶液至过量,烧杯内溶液的质量与加入NaOH溶液的质量关系如图所示。试回答:
①当滴入NaOH溶液46g时(即图中A点),烧杯中溶液里大量存在的金属阳离子是 (填离子符号)。
②当滴入10%的NaOH溶液80g时(即B点)恰好完全反应,试通过计算,求该氯化镁溶液的溶质质量分数(计算结果精确至0.1%)。
参考答案:
1.AD
2.ABC
3.BD
4.AD
5.BD
6.C
7.A
8.C
9.B
10.B
11.C
12.B
13.C
14.B
15.D
16.(1) 氢氧化亚铁化学性质不稳定,在空气中中易被氧气氧化 置换反应 Fe2O3 Fe+Fe2(SO4)3=3FeSO4
(2) 等体积质量分数不同的硫酸溶液中硫酸质量不相等 硫酸浓度过高时会与铁、铜等金属反应产生SO2
(3) 减压 饱和 冷却结晶 CD
(4)53.9%
解:10.00mL高锰酸钾溶液的质量为10g,10.00mL高锰酸钾溶液中高锰酸钾的质量为:10g ×1.58%=0.158g。
设样品中硫酸亚铁的质量为x。
,x=0.76g
该样品中硫酸亚铁的含量为:=53.9%。
17.(1) 1 8 Cl-
(2) 不饱和 1.98
18.(1)蒸发结晶
(2) Ca(OH)2 富集镁元素,除去杂质 引流
(3)①Na+、Mg2+
②解:80g×10%=8g
设:氯化镁溶液中溶质的质量为。
答:氯化镁溶液的溶质质量分数为9.5%。
