7.3溶液浓稀的表示同步练习科粤版化学九年级下册(含答案)
文档属性
| 名称 | 7.3溶液浓稀的表示同步练习科粤版化学九年级下册(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 816.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-09 08:42:37 | ||
图片预览




文档简介
7.3溶液浓稀的表示
一、多选题
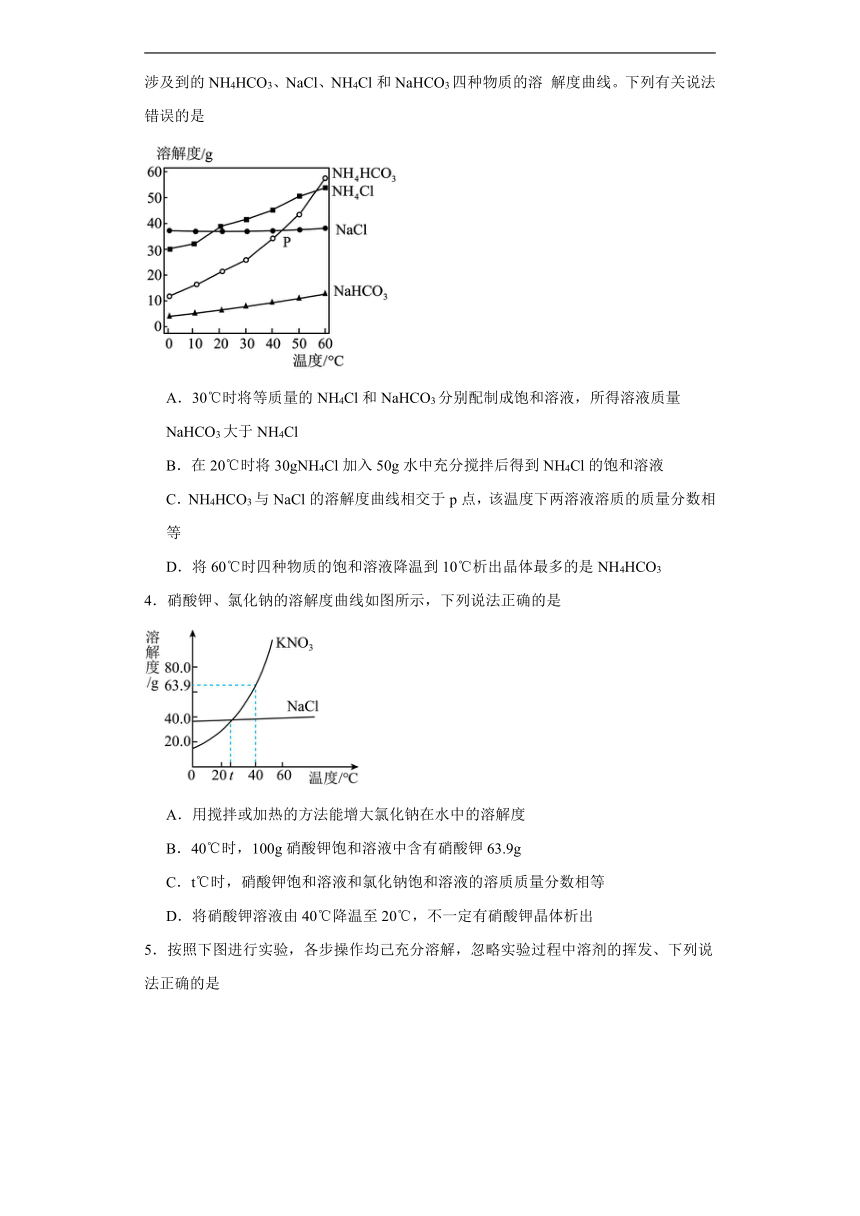
1.现有t2℃时等质量的甲、乙、丙三种物质(不含结晶水)的饱和溶液,将其均降温到t1℃,对所得溶液的描述正确的是
A.溶质质量分数:乙>甲=丙
B.溶液质量:乙>甲>丙
C.溶剂质量:丙>乙>甲
D.溶解度:乙>甲=丙
2.利用甲酸(HCOOH)与浓硫酸制备CO,并用如下实验装置验证CO的有关性质。已知:,下列说法不正确的是
A.操作时,先点燃乙处酒精灯,再滴加甲酸
B.装置丙的作用是防止倒吸
C.装置丁既可检验CO2,又可收集CO
D.该过程中,浓硫酸的质量分数不变
3.我国化学家侯德榜创立的联合制碱法促进了世界制碱技术的发展。如图是反应过程涉及到的NH4HCO3、NaCl、NH4Cl和NaHCO3四种物质的溶 解度曲线。下列有关说法错误的是
A.30℃时将等质量的NH4Cl和NaHCO3分别配制成饱和溶液,所得溶液质量 NaHCO3大于NH4Cl
B.在20℃时将30gNH4Cl加入50g水中充分搅拌后得到NH4Cl的饱和溶液
C.NH4HCO3与NaCl的溶解度曲线相交于p点,该温度下两溶液溶质的质量分数相等
D.将60℃时四种物质的饱和溶液降温到10℃析出晶体最多的是NH4HCO3
4.硝酸钾、氯化钠的溶解度曲线如图所示,下列说法正确的是
A.用搅拌或加热的方法能增大氯化钠在水中的溶解度
B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾63.9g
C.t℃时,硝酸钾饱和溶液和氯化钠饱和溶液的溶质质量分数相等
D.将硝酸钾溶液由40℃降温至20℃,不一定有硝酸钾晶体析出
5.按照下图进行实验,各步操作均己充分溶解,忽略实验过程中溶剂的挥发、下列说法正确的是
A.烧杯a和b内,溶液中溶质的质量分数:aB.烧杯a和d内,溶剂质量:a>d
C.烧杯c和f内,上层清液中溶质的质量分数:c=f
D.烧杯c和f内,剩余固体质量:c>f
E.烧杯b内,溶液中溶质的质量分数约为30.9%
二、选择题
6.MgCl2、KCl和MgSO4的溶解度曲线如图所示。下列说法正确的是
A.T2℃时,溶解度:S(MgCl2)>S(KCl)>S(MgSO4)
B.T2℃时,将三种物质各28.0g分别放入50.0g水中,充分溶解,所得溶液溶质质量分数:ω(MgC12)=ω(MgSO4)>ω(KCl)
C.T1℃时,将KCl、MgSO4的饱和溶液升温至T3℃,为使两溶液均达饱和,加入的对应溶质质量相等
D.T3℃时,等质的MgCl2、MgSO4饱和溶液降温至T2℃,所得溶液质量:m(MgCl2)>m(MgSO4)
7.如图是a、b、c三种物质的溶解度曲线,下列分析正确的是
A.物质a的溶解度大于物质c的溶解度
B.t1℃时,向60g物质a的饱和溶液中加入40g水,得到溶液的溶质质量分数为10%
C.将t3℃时a、b、c三种物质的饱和溶液降温至t2℃时,析出晶体质量最大的是物质a
D.t1℃时,将20g物质a加入100g水中,而后升温到t3℃,此时该溶液的溶质和溶剂的质量比为1:2
8.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图,下列说法中正确的是( )
A.t1℃甲的溶解度大于乙的溶解度
B.溶解度受温度影响乙比甲大
C.t2℃甲乙两种物质饱和溶液中溶质质量分数相等
D.t3℃甲乙两种物质的饱和溶液降温至t1℃,析出溶质多的是甲
9.下列图象中有关量的变化趋势正确的是( )
A. 向一定浓度的NaOH溶液中加水稀释
B.向一定浓度的H2SO4溶液中加水稀释
C. 向一定质量的锌粒中加入稀盐酸
D.向接近饱和的KNO3溶液中加入KNO3晶体
10.如图所示是甲 乙 丙三种固体物质的溶解度曲线,下列分析正确的是
A.t2℃时,升高丙溶液的温度,一定有晶体析出
B.t3℃时,用等质量的甲 乙 丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙
C.t1℃时,甲 丙两溶液的溶质质量分数一定相等
D.t3℃时,甲 乙 丙三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数的大小关系为乙>甲=丙
11.在15℃时,硝酸钾的溶解度为26克,在该温度下,将30克硝酸钾放入100克水中充分搅拌,所得溶液中质量分数为
A.25% B.33.3% C.26% D.20.6%
12.如图表示M、N两种不含结晶水的固体物质的溶解度曲线。根据图示判断,下列说法中,正确的是( )
A.M、N的溶解度都随温度的升高而增大
B.将t1℃时M的饱和溶液升温至t2℃,溶质的质量分数增大
C.在t1℃时,M、N的饱和溶液中溶质的质量分数二者相等
D.将t2℃时M、N的饱和溶液分别降温至t1℃,两溶液中均析出晶体
13.下列有关化学过程的图像正确的是( )
A.水通电产生氢气和氧气
B.一定温度下,向饱和的硝酸钾溶液中加入足量的硝酸钾固体
C.等质量的锌、铁与足量的稀硫酸反应
D.两份完全相同的过氧化氢溶液制取氧气
14.下列四个图像分别对应不同实验过程,其中不正确的是
A. 分别向等质量且足量的Mg片和Zn片中加入等质量、等浓度的稀硫酸
B.室温下,往等体积水中分别加入等质量的NH4NO3、NaOH,搅拌溶解
C. 煅烧石灰石
D. 往20°C饱和NaCl溶液中加入NaCl固体,充分搅拌
15.对于30%的KNO3溶液,下列说法正确的是
A.溶液中溶质和溶剂的质量比为3:10
B.每100g水中溶解30gKNO3
C.某种条件下,可转化为悬浊液
D.若再加30g硝酸钾,则变为60%KNO3溶液
三、综合应用题
16.过氧乙酸溶液是杀死病毒的一种有效药剂,某商店出售一种过氧乙酸消毒液,其标签上的部分文字说明如图所示。试分析并计算:
过氧乙酸消毒液(C2H4O3)
质量 500g
溶质质量分数 40%
使用方法 浸泡、喷雾、熏蒸等方法,用水稀释后使用
密封、避光、避热、不可与可燃物混合存放、防猛烈撞击
(1)由储存方法中要避热储存,推断过氧乙酸可能具有的性质是 (写一条即可)。
(2)一瓶这种溶液中含溶质过氧乙酸的质量是 g。(结果精确到0.1%)
(3)对环境进行消毒时,常用到15%的过氧乙酸溶液,欲配制1000g15%过氧乙酸溶液,需40%的原溶液多少g?需加水质量为多少mL?(写出计算过程)
17.溶液对于自然界中的生命活动和人类生产活动具有重要意义。
Ⅰ、上图是某化学小组配制 50g 溶质质量分数为 16%的氯化钠溶液的实验操作示意图,请回答下列问题:
(1)溶解时玻璃棒的作用为 。
(2)经计算,配制该溶液需要氯化钠的质量为 g;若称量时出现了天平右盘偏低的现象,接下来的操作应该是 (填序号)。
A.调节平衡螺母 B.减少左盘中食盐 C.减少右盘中砝码 D.增加左盘中食盐
(3)配制溶液时应选择 (填写“10”、“50”或“100”)mL 量筒量取所需要的水(水的密度是 1.0g/cm3)。
(4)若在量取水时俯视量筒凹液面最低处,其它操作均正确,则所得溶液的溶质质量分数 16%(选填“大于”、“等于”、“小于”之一)。
Ⅱ、在 20℃时,向质量为 50g 的水中不断加入氯化钠固体并搅拌,加入氯化钠的质量与所得溶液的质量关系如下图所示,请回答下列问题:
(5)A 点时对应的溶液是氯化钠的 溶液(选填“饱和”、“不饱和”、“无法确定”之一)。
(6)A 点时所得溶液中大量存在的金属阳离子是 (写离子符号)。
(7)20℃时,B 点所对应的氯化钠溶液的质量为 g。
(8)20℃时,求 B 点所对应氯化钠溶液中溶质的质量分数。(结果精确到 0.1%)
18.水及溶液与人类的生产生活息息相关。
(1)农业生产中,常用16%的氯化钠溶液选种。在实验室若要配制该溶液100g,需要用到的玻璃仪器有 ,加快氯化钠溶解的操作是 。
(2)如图是氯化钠和氯化钙在水中的溶解度曲线。
①由氯化钠和氯化钙的溶解度曲线你能获得的信息有 (写一条)。
②20℃时,将100g氯化钠溶液蒸发掉10g水,恢复到20℃,析出3g氯化钠。若继续蒸发掉10g水,又恢复到20℃,此时析出氯化钠的质量是 。
(3)生活中常用氯化钠和氯化钙作融雪剂。某小组同学准备探究NaC1、CaCl2溶液浓度对融冰效率的影响。分别取大小、形状相同的冰块进行实验。实验数据记录如下:
实验组别2 1 2 3 4 5 6 7 8
试剂及用量 24%的NaCl溶液质量/g 2 4 6 8 6 4 2 x
24%的CaCl2溶液质量/g 0 0 0 0 2 4 6 8
水的质量/g 6 4 2 0 0 0 0 0
90min时冰融化所得水的质量/g 3.57 6.77 9.44 14.19 12.84 11.54 9.97 9.52
①由实验第1一4组,可以得到的结论是 。
②若通过第4和第8组实验对比,其他条件相同时,24%的NaC1溶液的融冰效率高于24%的CaCl2溶液,则x= 。
参考答案:
1.CD
2.AD
3.CD
4.CD
5.A
6.B
7.B
8.C
9.C
10.B
11.D
12.C
13.C
14.B
15.C
16.(1)受热不稳定
(2)200
(3)375g ;625mL
解:欲配制1000g15%过氧乙酸溶液,需40%的原溶液的质量为x,
则1000g×15%=40%×x,x=375g,
需要加水的质量为:1000g-375g=625g,合625mL。
答:需40%的原溶液375g,需加水625mL。
17.(1)搅拌,加快氯化钠的溶解速率
(2) 8 D
(3)50
(4)大于
(5)不饱和
(6)Na+
(7)68
(8)26.5%
18.(1) 烧杯、玻璃棒、量筒、胶头滴管 搅拌或用热水溶解
(2) 氯化钙的溶解度随温度升高而增大或氯化钠的溶解度随温度升高略有增大,但变化不大 3.6g/3.6克
(3) 其他条件相同时,在实验研究的NaC1溶液浓度范围内,NaCl溶液的浓度越大,融冰效率越高 0
一、多选题
1.现有t2℃时等质量的甲、乙、丙三种物质(不含结晶水)的饱和溶液,将其均降温到t1℃,对所得溶液的描述正确的是
A.溶质质量分数:乙>甲=丙
B.溶液质量:乙>甲>丙
C.溶剂质量:丙>乙>甲
D.溶解度:乙>甲=丙
2.利用甲酸(HCOOH)与浓硫酸制备CO,并用如下实验装置验证CO的有关性质。已知:,下列说法不正确的是
A.操作时,先点燃乙处酒精灯,再滴加甲酸
B.装置丙的作用是防止倒吸
C.装置丁既可检验CO2,又可收集CO
D.该过程中,浓硫酸的质量分数不变
3.我国化学家侯德榜创立的联合制碱法促进了世界制碱技术的发展。如图是反应过程涉及到的NH4HCO3、NaCl、NH4Cl和NaHCO3四种物质的溶 解度曲线。下列有关说法错误的是
A.30℃时将等质量的NH4Cl和NaHCO3分别配制成饱和溶液,所得溶液质量 NaHCO3大于NH4Cl
B.在20℃时将30gNH4Cl加入50g水中充分搅拌后得到NH4Cl的饱和溶液
C.NH4HCO3与NaCl的溶解度曲线相交于p点,该温度下两溶液溶质的质量分数相等
D.将60℃时四种物质的饱和溶液降温到10℃析出晶体最多的是NH4HCO3
4.硝酸钾、氯化钠的溶解度曲线如图所示,下列说法正确的是
A.用搅拌或加热的方法能增大氯化钠在水中的溶解度
B.40℃时,100g硝酸钾饱和溶液中含有硝酸钾63.9g
C.t℃时,硝酸钾饱和溶液和氯化钠饱和溶液的溶质质量分数相等
D.将硝酸钾溶液由40℃降温至20℃,不一定有硝酸钾晶体析出
5.按照下图进行实验,各步操作均己充分溶解,忽略实验过程中溶剂的挥发、下列说法正确的是
A.烧杯a和b内,溶液中溶质的质量分数:a
C.烧杯c和f内,上层清液中溶质的质量分数:c=f
D.烧杯c和f内,剩余固体质量:c>f
E.烧杯b内,溶液中溶质的质量分数约为30.9%
二、选择题
6.MgCl2、KCl和MgSO4的溶解度曲线如图所示。下列说法正确的是
A.T2℃时,溶解度:S(MgCl2)>S(KCl)>S(MgSO4)
B.T2℃时,将三种物质各28.0g分别放入50.0g水中,充分溶解,所得溶液溶质质量分数:ω(MgC12)=ω(MgSO4)>ω(KCl)
C.T1℃时,将KCl、MgSO4的饱和溶液升温至T3℃,为使两溶液均达饱和,加入的对应溶质质量相等
D.T3℃时,等质的MgCl2、MgSO4饱和溶液降温至T2℃,所得溶液质量:m(MgCl2)>m(MgSO4)
7.如图是a、b、c三种物质的溶解度曲线,下列分析正确的是
A.物质a的溶解度大于物质c的溶解度
B.t1℃时,向60g物质a的饱和溶液中加入40g水,得到溶液的溶质质量分数为10%
C.将t3℃时a、b、c三种物质的饱和溶液降温至t2℃时,析出晶体质量最大的是物质a
D.t1℃时,将20g物质a加入100g水中,而后升温到t3℃,此时该溶液的溶质和溶剂的质量比为1:2
8.甲、乙两种固体物质(不含结晶水)的溶解度曲线如图,下列说法中正确的是( )
A.t1℃甲的溶解度大于乙的溶解度
B.溶解度受温度影响乙比甲大
C.t2℃甲乙两种物质饱和溶液中溶质质量分数相等
D.t3℃甲乙两种物质的饱和溶液降温至t1℃,析出溶质多的是甲
9.下列图象中有关量的变化趋势正确的是( )
A. 向一定浓度的NaOH溶液中加水稀释
B.向一定浓度的H2SO4溶液中加水稀释
C. 向一定质量的锌粒中加入稀盐酸
D.向接近饱和的KNO3溶液中加入KNO3晶体
10.如图所示是甲 乙 丙三种固体物质的溶解度曲线,下列分析正确的是
A.t2℃时,升高丙溶液的温度,一定有晶体析出
B.t3℃时,用等质量的甲 乙 丙分别配制成三种物质的饱和溶液,所需溶剂的质量为甲<乙<丙
C.t1℃时,甲 丙两溶液的溶质质量分数一定相等
D.t3℃时,甲 乙 丙三种物质的饱和溶液降温到t1℃,所得溶液中溶质质量分数的大小关系为乙>甲=丙
11.在15℃时,硝酸钾的溶解度为26克,在该温度下,将30克硝酸钾放入100克水中充分搅拌,所得溶液中质量分数为
A.25% B.33.3% C.26% D.20.6%
12.如图表示M、N两种不含结晶水的固体物质的溶解度曲线。根据图示判断,下列说法中,正确的是( )
A.M、N的溶解度都随温度的升高而增大
B.将t1℃时M的饱和溶液升温至t2℃,溶质的质量分数增大
C.在t1℃时,M、N的饱和溶液中溶质的质量分数二者相等
D.将t2℃时M、N的饱和溶液分别降温至t1℃,两溶液中均析出晶体
13.下列有关化学过程的图像正确的是( )
A.水通电产生氢气和氧气
B.一定温度下,向饱和的硝酸钾溶液中加入足量的硝酸钾固体
C.等质量的锌、铁与足量的稀硫酸反应
D.两份完全相同的过氧化氢溶液制取氧气
14.下列四个图像分别对应不同实验过程,其中不正确的是
A. 分别向等质量且足量的Mg片和Zn片中加入等质量、等浓度的稀硫酸
B.室温下,往等体积水中分别加入等质量的NH4NO3、NaOH,搅拌溶解
C. 煅烧石灰石
D. 往20°C饱和NaCl溶液中加入NaCl固体,充分搅拌
15.对于30%的KNO3溶液,下列说法正确的是
A.溶液中溶质和溶剂的质量比为3:10
B.每100g水中溶解30gKNO3
C.某种条件下,可转化为悬浊液
D.若再加30g硝酸钾,则变为60%KNO3溶液
三、综合应用题
16.过氧乙酸溶液是杀死病毒的一种有效药剂,某商店出售一种过氧乙酸消毒液,其标签上的部分文字说明如图所示。试分析并计算:
过氧乙酸消毒液(C2H4O3)
质量 500g
溶质质量分数 40%
使用方法 浸泡、喷雾、熏蒸等方法,用水稀释后使用
密封、避光、避热、不可与可燃物混合存放、防猛烈撞击
(1)由储存方法中要避热储存,推断过氧乙酸可能具有的性质是 (写一条即可)。
(2)一瓶这种溶液中含溶质过氧乙酸的质量是 g。(结果精确到0.1%)
(3)对环境进行消毒时,常用到15%的过氧乙酸溶液,欲配制1000g15%过氧乙酸溶液,需40%的原溶液多少g?需加水质量为多少mL?(写出计算过程)
17.溶液对于自然界中的生命活动和人类生产活动具有重要意义。
Ⅰ、上图是某化学小组配制 50g 溶质质量分数为 16%的氯化钠溶液的实验操作示意图,请回答下列问题:
(1)溶解时玻璃棒的作用为 。
(2)经计算,配制该溶液需要氯化钠的质量为 g;若称量时出现了天平右盘偏低的现象,接下来的操作应该是 (填序号)。
A.调节平衡螺母 B.减少左盘中食盐 C.减少右盘中砝码 D.增加左盘中食盐
(3)配制溶液时应选择 (填写“10”、“50”或“100”)mL 量筒量取所需要的水(水的密度是 1.0g/cm3)。
(4)若在量取水时俯视量筒凹液面最低处,其它操作均正确,则所得溶液的溶质质量分数 16%(选填“大于”、“等于”、“小于”之一)。
Ⅱ、在 20℃时,向质量为 50g 的水中不断加入氯化钠固体并搅拌,加入氯化钠的质量与所得溶液的质量关系如下图所示,请回答下列问题:
(5)A 点时对应的溶液是氯化钠的 溶液(选填“饱和”、“不饱和”、“无法确定”之一)。
(6)A 点时所得溶液中大量存在的金属阳离子是 (写离子符号)。
(7)20℃时,B 点所对应的氯化钠溶液的质量为 g。
(8)20℃时,求 B 点所对应氯化钠溶液中溶质的质量分数。(结果精确到 0.1%)
18.水及溶液与人类的生产生活息息相关。
(1)农业生产中,常用16%的氯化钠溶液选种。在实验室若要配制该溶液100g,需要用到的玻璃仪器有 ,加快氯化钠溶解的操作是 。
(2)如图是氯化钠和氯化钙在水中的溶解度曲线。
①由氯化钠和氯化钙的溶解度曲线你能获得的信息有 (写一条)。
②20℃时,将100g氯化钠溶液蒸发掉10g水,恢复到20℃,析出3g氯化钠。若继续蒸发掉10g水,又恢复到20℃,此时析出氯化钠的质量是 。
(3)生活中常用氯化钠和氯化钙作融雪剂。某小组同学准备探究NaC1、CaCl2溶液浓度对融冰效率的影响。分别取大小、形状相同的冰块进行实验。实验数据记录如下:
实验组别2 1 2 3 4 5 6 7 8
试剂及用量 24%的NaCl溶液质量/g 2 4 6 8 6 4 2 x
24%的CaCl2溶液质量/g 0 0 0 0 2 4 6 8
水的质量/g 6 4 2 0 0 0 0 0
90min时冰融化所得水的质量/g 3.57 6.77 9.44 14.19 12.84 11.54 9.97 9.52
①由实验第1一4组,可以得到的结论是 。
②若通过第4和第8组实验对比,其他条件相同时,24%的NaC1溶液的融冰效率高于24%的CaCl2溶液,则x= 。
参考答案:
1.CD
2.AD
3.CD
4.CD
5.A
6.B
7.B
8.C
9.C
10.B
11.D
12.C
13.C
14.B
15.C
16.(1)受热不稳定
(2)200
(3)375g ;625mL
解:欲配制1000g15%过氧乙酸溶液,需40%的原溶液的质量为x,
则1000g×15%=40%×x,x=375g,
需要加水的质量为:1000g-375g=625g,合625mL。
答:需40%的原溶液375g,需加水625mL。
17.(1)搅拌,加快氯化钠的溶解速率
(2) 8 D
(3)50
(4)大于
(5)不饱和
(6)Na+
(7)68
(8)26.5%
18.(1) 烧杯、玻璃棒、量筒、胶头滴管 搅拌或用热水溶解
(2) 氯化钙的溶解度随温度升高而增大或氯化钠的溶解度随温度升高略有增大,但变化不大 3.6g/3.6克
(3) 其他条件相同时,在实验研究的NaC1溶液浓度范围内,NaCl溶液的浓度越大,融冰效率越高 0
