化学人教版(2019)必修第二册6.2.2化学反应限度(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.2.2化学反应限度(共31张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 872.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-09 10:40:29 | ||
图片预览






文档简介
(共31张PPT)
第六章 化学反应与能量
第二节 化学反应的速率与限度
第二课时
学习目标
1.结合实例体会可逆反应存在限度,理解化学平衡状态的特征,发展“变化观念与平衡思想”的学科核心素养。
2.体会从限度和快慢两个方面去认识和调控化学反应的重要性,认识控制反应条件在生产和科学研究中的作用。
新课导入
炼铁高炉尾气之谜:
一个化学反应在实际进行时,给定量的反应物能否按相应的计量数完全转化为生成物?
为什么增高了炉身,CO的转化率没有提高呢?
C+CO2 2CO
Fe2O3 + 3CO 2Fe + 3CO2
高温
化学反应是有限度的,有些能进行地比较彻底,有些反应是不彻底的,甚至是可逆的。
知识回顾
可逆反应:
1.定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进
行的反应。
注:向生成物方向进行的反应叫做正反应,
向反应物方向进行的反应叫做逆反应。
书写可逆反应的化学方程式时,不用“ === ”,用 “ ”。
2.特征:
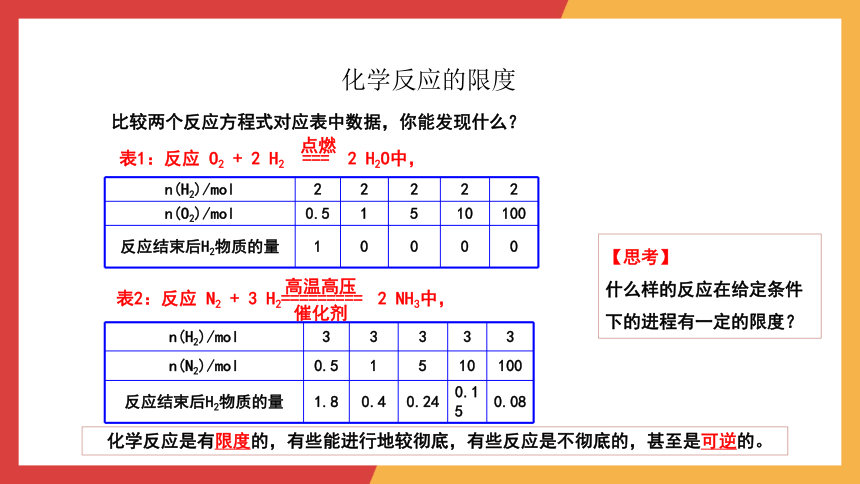
化学反应的限度
比较两个反应方程式对应表中数据,你能发现什么?
n(H2)/mol 2 2 2 2 2
n(O2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1 0 0 0 0
表1:反应 O2 + 2 H2 === 2 H2O中,
点燃
n(H2)/mol 3 3 3 3 3
n(N2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1.8 0.4 0.24 0.15 0.08
表2:反应 N2 + 3 H2========= 2 NH3中,
催化剂
高温高压
化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
【思考】
什么样的反应在给定条件下的进程有一定的限度?
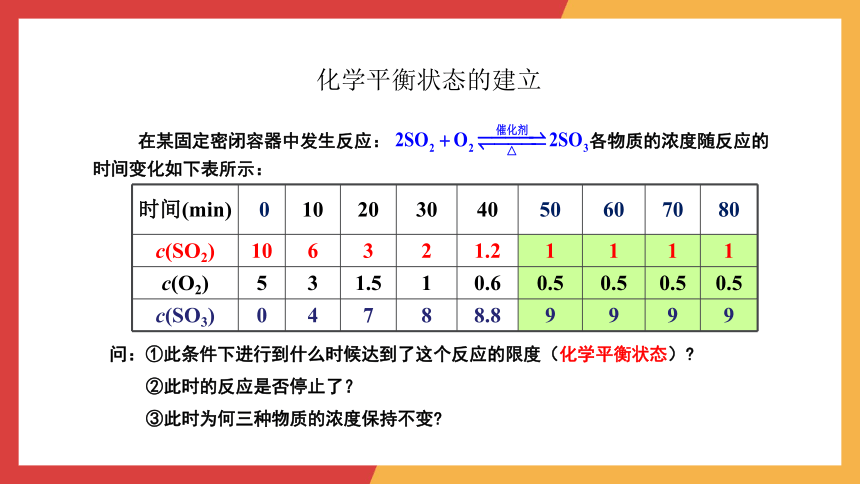
化学平衡状态的建立
在某固定密闭容器中发生反应: 各物质的浓度随反应的时间变化如下表所示:
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
问:①此条件下进行到什么时候达到了这个反应的限度(化学平衡状态)
②此时的反应是否停止了?
③此时为何三种物质的浓度保持不变
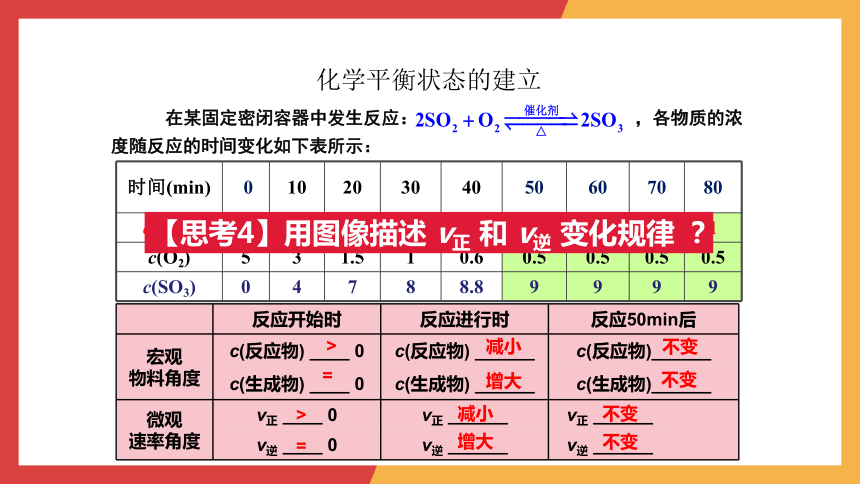
化学平衡状态的建立
在某固定密闭容器中发生反应: ,各物质的浓度随反应的时间变化如下表所示:
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
反应开始时 反应进行时 反应50min后 宏观 物料角度 c(反应物) ____ 0 c(反应物) ______ c(反应物)______ c(生成物) ____ 0 c(生成物) ______ c(生成物)______ 微观 速率角度 v正 ____ 0 v正 ______ v正 ______
v逆 ____ 0 v逆 ______ v逆 ______ >
=
>
=
减小
增大
减小
增大
不变
不变
不变
不变
【思考4】用图像描述 v正 和 v逆 变化规律 ?
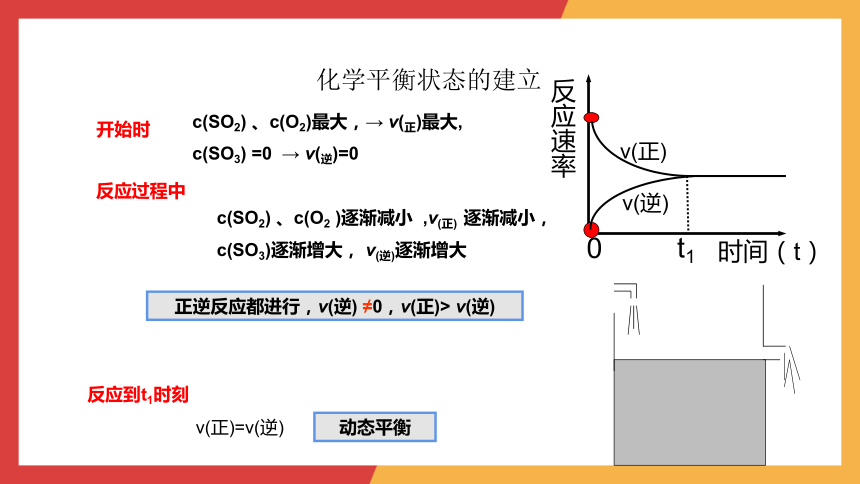
化学平衡状态的建立
正逆反应都进行,v(逆) ≠0,v(正)> v(逆)
c(SO2) 、c(O2 )逐渐减小 ,v(正) 逐渐减小,
c(SO3)逐渐增大, v(逆)逐渐增大
反应过程中
c(SO2) 、c(O2)最大,→ v(正)最大,
c(SO3) =0 → v(逆)=0
开始时
反应速率
时间(t)
0
v(正)
v(逆)
v(正)=v(逆)
t1
反应到t1时刻
动态平衡
化学平衡状态的建立
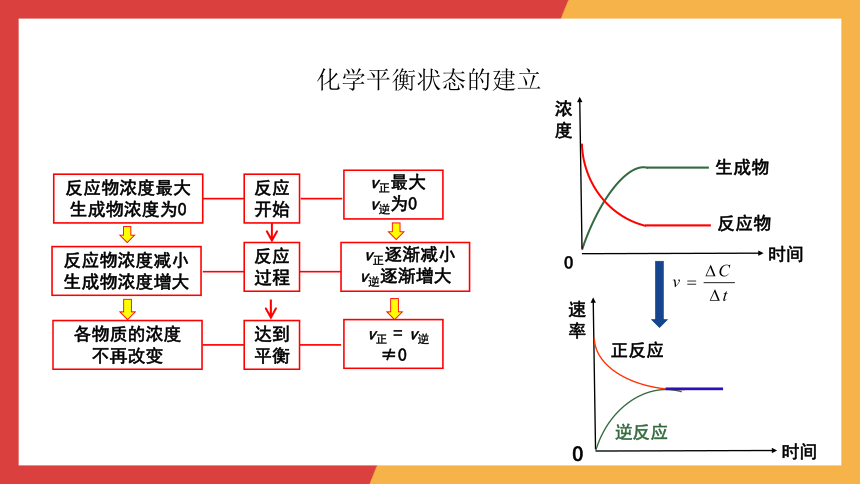
反应物浓度最大
生成物浓度为0
v正最大
v逆为0
反应
开始
反应过程
达到平衡
反应物浓度减小
生成物浓度增大
各物质的浓度
不再改变
v正逐渐减小
v逆逐渐增大
v正 = v逆≠0
生成物
时间
浓度
O
反应物
时间
速率
O
正反应
逆反应
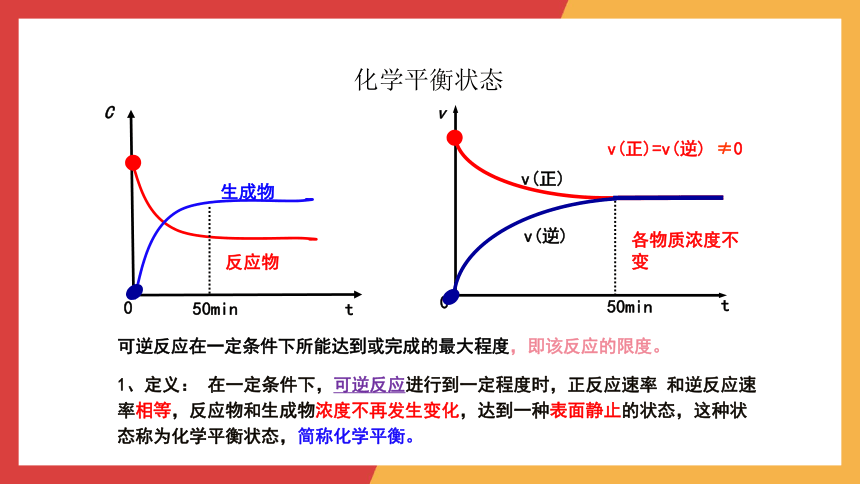
化学平衡状态
t
0
v
v(正)
v(逆)
●
50min
v(正)=v(逆) ≠0
各物质浓度不变
0
t
C
生成物
反应物
●
●
50min
1、定义: 在一定条件下,可逆反应进行到一定程度时,正反应速率 和逆反应速率相等,反应物和生成物浓度不再发生变化,达到一种表面静止的状态,这种状态称为化学平衡状态,简称化学平衡。
可逆反应在一定条件下所能达到或完成的最大程度,即该反应的限度。
●
化学平衡状态
化学平衡状态的特征
逆
定
等
动
变
化学平衡状态研究的对象是可逆反应
达到化学平衡状态后,各组分浓度不再改变,不随时间变化而变化
达到化学平衡状态时,正反应速率和逆反应速率相等
化学平衡是一种表面静止状态,反应并未停止,是一种动态平衡
外界条件改变时,原平衡状态将被打破,再在新条件下建立新的平衡
化学平衡状态
动:化学平衡是一种动态平衡
当可逆反应达到平衡状态时,虽然达到一种表面静止的状态,即总反应速率为0,但正、逆反应速率均不为0。
【思考】在一定条件下的密闭容器中发生反应:2SO2+O2 2SO3,达到化学平衡状态后,再充入少量含18O的氧气,一段时间后,18O可能存在于哪些物质中?
该反应是可逆反应,18O可存在于SO2、O2、SO3中。
化学平衡状态
等:正反应速率等于逆反应速率
可逆反应 N2O4(g) 2NO2(g)
t1时刻时,v逆(NO2)= v正(N2O4),反应未达到平衡状态。
t2时刻后,v逆(NO2)= 2v正(N2O4),反应达到平衡状态。
由此可见,当用不同物质表示化学平衡状态下的正、逆反应速率时,
速率比应该与其化学计量数成正比。
化学平衡状态
定:反应物的浓度和生成物的浓度都不再改变
某条件下的合成氨反应中,N2、H2、NH3的浓度随时间变化如图所示:
从t1时刻开始,它们的浓度均不再改变。这表明该反应中物质的转化达到了“限度” ,即化学平衡状态。此时
反应物的转化率最大:
(转化率= ×100%)
产物的产率最大:
( 产率= ×100%)
化学平衡状态
变:改变反应条件,可以改变化学平衡状态
大量的科学实验证明,化学平衡状态通常会受到浓度、温度、压强等因素的影响。
化学平衡状态
常用于判断反应达到平衡的依据
达到平衡的标志:
(一定条件下)
v正=v逆
浓度不再改变
以xA + yB zC为例:
VA耗 = VA生
VA耗 : VC耗 = x : z
VB生 : VC生 = y : z
VA耗 : VB生 = x : y
能说明V正=V逆的标志:
①如何理解 v(正)=v(逆)?
v(正)=v(逆)
核心:1、有正有逆的描述;2、转化为同一物质速率相等
化学平衡状态
①反应物与生成物浓度不再改变:各物质的物质的量、百分含量、体积分数等保持恒定;
变量不再改变
②方程式左右两边气体系数之和不同的反应,压强、气体密度、气体的总物质的量、气体平均分子质量、容器压强(恒容条件)、容器体积(恒压条件)不变。
③有色物质参加或生成的反应,颜色不再变时,或绝热容器中的温度不再
改变。
②如何理解浓度不再改变
核心:一个量随反应一直变,突然不变
变量不变 即平衡
化学反应条件的控制
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
催化剂
高温、高压
N2 + 3H2 2NH3
工业合成氨
化学反应条件的控制
基本措施
改变反应速率
改变反应限度
改变温度、浓度、气体的压强、
固体的表面积以及催化剂的合理使用等
改变温度、浓度、气体的压强等
思考:为提高燃料的燃烧效率,应如何调控燃烧反应的条件
提高燃料燃烧效率的具体措施:
(1)将煤研细,增大与氧气的接触面积,加快反应速率;使用助燃剂
(2)适当过量的空气有利于煤的充分燃烧;
(3)炉(灶)膛材料采用保温性能好的的耐高温材料;
(4)废气中的热量可用于供暖或发电等。
归纳总结
化学反应限度
1、可逆反应的进程都有一定的限度
2、化学平衡状态的建立
3、化学平衡状态的特征——动、等、定、变。
4、化学平衡状态的判断——判断依据:等、定
化学反应条件的控制
促进有利的化学反应,抑制有害的化学反应。
随堂训练
D
随堂训练
B
随堂训练
C
随堂训练
B
随堂训练
B
随堂训练
C
随堂训练
D
随堂训练
C
随堂训练
D
随堂训练
D
随堂训练
0.2 mol·L-1·min-1
56.25%
4∶5
0.2 mol·L-1·min-1
1.2 mol·L-1
50%
CE
BD
第六章 化学反应与能量
第二节 化学反应的速率与限度
第二课时
学习目标
1.结合实例体会可逆反应存在限度,理解化学平衡状态的特征,发展“变化观念与平衡思想”的学科核心素养。
2.体会从限度和快慢两个方面去认识和调控化学反应的重要性,认识控制反应条件在生产和科学研究中的作用。
新课导入
炼铁高炉尾气之谜:
一个化学反应在实际进行时,给定量的反应物能否按相应的计量数完全转化为生成物?
为什么增高了炉身,CO的转化率没有提高呢?
C+CO2 2CO
Fe2O3 + 3CO 2Fe + 3CO2
高温
化学反应是有限度的,有些能进行地比较彻底,有些反应是不彻底的,甚至是可逆的。
知识回顾
可逆反应:
1.定义:在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进
行的反应。
注:向生成物方向进行的反应叫做正反应,
向反应物方向进行的反应叫做逆反应。
书写可逆反应的化学方程式时,不用“ === ”,用 “ ”。
2.特征:
化学反应的限度
比较两个反应方程式对应表中数据,你能发现什么?
n(H2)/mol 2 2 2 2 2
n(O2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1 0 0 0 0
表1:反应 O2 + 2 H2 === 2 H2O中,
点燃
n(H2)/mol 3 3 3 3 3
n(N2)/mol 0.5 1 5 10 100
反应结束后H2物质的量 1.8 0.4 0.24 0.15 0.08
表2:反应 N2 + 3 H2========= 2 NH3中,
催化剂
高温高压
化学反应是有限度的,有些能进行地较彻底,有些反应是不彻底的,甚至是可逆的。
【思考】
什么样的反应在给定条件下的进程有一定的限度?
化学平衡状态的建立
在某固定密闭容器中发生反应: 各物质的浓度随反应的时间变化如下表所示:
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
问:①此条件下进行到什么时候达到了这个反应的限度(化学平衡状态)
②此时的反应是否停止了?
③此时为何三种物质的浓度保持不变
化学平衡状态的建立
在某固定密闭容器中发生反应: ,各物质的浓度随反应的时间变化如下表所示:
时间(min) 0 10 20 30 40 50 60 70 80
c(SO2) 10 6 3 2 1.2 1 1 1 1
c(O2) 5 3 1.5 1 0.6 0.5 0.5 0.5 0.5
c(SO3) 0 4 7 8 8.8 9 9 9 9
反应开始时 反应进行时 反应50min后 宏观 物料角度 c(反应物) ____ 0 c(反应物) ______ c(反应物)______ c(生成物) ____ 0 c(生成物) ______ c(生成物)______ 微观 速率角度 v正 ____ 0 v正 ______ v正 ______
v逆 ____ 0 v逆 ______ v逆 ______ >
=
>
=
减小
增大
减小
增大
不变
不变
不变
不变
【思考4】用图像描述 v正 和 v逆 变化规律 ?
化学平衡状态的建立
正逆反应都进行,v(逆) ≠0,v(正)> v(逆)
c(SO2) 、c(O2 )逐渐减小 ,v(正) 逐渐减小,
c(SO3)逐渐增大, v(逆)逐渐增大
反应过程中
c(SO2) 、c(O2)最大,→ v(正)最大,
c(SO3) =0 → v(逆)=0
开始时
反应速率
时间(t)
0
v(正)
v(逆)
v(正)=v(逆)
t1
反应到t1时刻
动态平衡
化学平衡状态的建立
反应物浓度最大
生成物浓度为0
v正最大
v逆为0
反应
开始
反应过程
达到平衡
反应物浓度减小
生成物浓度增大
各物质的浓度
不再改变
v正逐渐减小
v逆逐渐增大
v正 = v逆≠0
生成物
时间
浓度
O
反应物
时间
速率
O
正反应
逆反应
化学平衡状态
t
0
v
v(正)
v(逆)
●
50min
v(正)=v(逆) ≠0
各物质浓度不变
0
t
C
生成物
反应物
●
●
50min
1、定义: 在一定条件下,可逆反应进行到一定程度时,正反应速率 和逆反应速率相等,反应物和生成物浓度不再发生变化,达到一种表面静止的状态,这种状态称为化学平衡状态,简称化学平衡。
可逆反应在一定条件下所能达到或完成的最大程度,即该反应的限度。
●
化学平衡状态
化学平衡状态的特征
逆
定
等
动
变
化学平衡状态研究的对象是可逆反应
达到化学平衡状态后,各组分浓度不再改变,不随时间变化而变化
达到化学平衡状态时,正反应速率和逆反应速率相等
化学平衡是一种表面静止状态,反应并未停止,是一种动态平衡
外界条件改变时,原平衡状态将被打破,再在新条件下建立新的平衡
化学平衡状态
动:化学平衡是一种动态平衡
当可逆反应达到平衡状态时,虽然达到一种表面静止的状态,即总反应速率为0,但正、逆反应速率均不为0。
【思考】在一定条件下的密闭容器中发生反应:2SO2+O2 2SO3,达到化学平衡状态后,再充入少量含18O的氧气,一段时间后,18O可能存在于哪些物质中?
该反应是可逆反应,18O可存在于SO2、O2、SO3中。
化学平衡状态
等:正反应速率等于逆反应速率
可逆反应 N2O4(g) 2NO2(g)
t1时刻时,v逆(NO2)= v正(N2O4),反应未达到平衡状态。
t2时刻后,v逆(NO2)= 2v正(N2O4),反应达到平衡状态。
由此可见,当用不同物质表示化学平衡状态下的正、逆反应速率时,
速率比应该与其化学计量数成正比。
化学平衡状态
定:反应物的浓度和生成物的浓度都不再改变
某条件下的合成氨反应中,N2、H2、NH3的浓度随时间变化如图所示:
从t1时刻开始,它们的浓度均不再改变。这表明该反应中物质的转化达到了“限度” ,即化学平衡状态。此时
反应物的转化率最大:
(转化率= ×100%)
产物的产率最大:
( 产率= ×100%)
化学平衡状态
变:改变反应条件,可以改变化学平衡状态
大量的科学实验证明,化学平衡状态通常会受到浓度、温度、压强等因素的影响。
化学平衡状态
常用于判断反应达到平衡的依据
达到平衡的标志:
(一定条件下)
v正=v逆
浓度不再改变
以xA + yB zC为例:
VA耗 = VA生
VA耗 : VC耗 = x : z
VB生 : VC生 = y : z
VA耗 : VB生 = x : y
能说明V正=V逆的标志:
①如何理解 v(正)=v(逆)?
v(正)=v(逆)
核心:1、有正有逆的描述;2、转化为同一物质速率相等
化学平衡状态
①反应物与生成物浓度不再改变:各物质的物质的量、百分含量、体积分数等保持恒定;
变量不再改变
②方程式左右两边气体系数之和不同的反应,压强、气体密度、气体的总物质的量、气体平均分子质量、容器压强(恒容条件)、容器体积(恒压条件)不变。
③有色物质参加或生成的反应,颜色不再变时,或绝热容器中的温度不再
改变。
②如何理解浓度不再改变
核心:一个量随反应一直变,突然不变
变量不变 即平衡
化学反应条件的控制
在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性。
合成氨的生产在温度较低时,氨的产率较高;压强越大,氨的产率越高。但温度低,反应速率小,需要很长时间才能达到化学平衡,生产成本高,工业上通常选择在400~500℃下进行。而压强越大,对动力和生产设备的要求也越高,合成氨厂随着生产规模和设备条件的不同,采用的压强通常为10~30MPa。
催化剂
高温、高压
N2 + 3H2 2NH3
工业合成氨
化学反应条件的控制
基本措施
改变反应速率
改变反应限度
改变温度、浓度、气体的压强、
固体的表面积以及催化剂的合理使用等
改变温度、浓度、气体的压强等
思考:为提高燃料的燃烧效率,应如何调控燃烧反应的条件
提高燃料燃烧效率的具体措施:
(1)将煤研细,增大与氧气的接触面积,加快反应速率;使用助燃剂
(2)适当过量的空气有利于煤的充分燃烧;
(3)炉(灶)膛材料采用保温性能好的的耐高温材料;
(4)废气中的热量可用于供暖或发电等。
归纳总结
化学反应限度
1、可逆反应的进程都有一定的限度
2、化学平衡状态的建立
3、化学平衡状态的特征——动、等、定、变。
4、化学平衡状态的判断——判断依据:等、定
化学反应条件的控制
促进有利的化学反应,抑制有害的化学反应。
随堂训练
D
随堂训练
B
随堂训练
C
随堂训练
B
随堂训练
B
随堂训练
C
随堂训练
D
随堂训练
C
随堂训练
D
随堂训练
D
随堂训练
0.2 mol·L-1·min-1
56.25%
4∶5
0.2 mol·L-1·min-1
1.2 mol·L-1
50%
CE
BD
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
