第三章 不同聚集状态的物质与性质检测题(含解析)2023-2024学年高二下学期鲁科版(2019)化学选择性必修2
文档属性
| 名称 | 第三章 不同聚集状态的物质与性质检测题(含解析)2023-2024学年高二下学期鲁科版(2019)化学选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-09 13:13:50 | ||
图片预览



文档简介
第三章《不同聚集状态的物质与性质》检测题
一、单选题(共20题)
1.下列关于晶体结构和性质的叙述错误的是
A.在晶体中,的配位数为6
B.在晶体中,的填充在形成正八面体空隙中
C.在干冰晶体中,微粒间存在范德华力和共价键
D.在二氧化硅晶体中,平均每个原子形成4个键
2.某高级脂肪酸0.1 mol发生加成反应时需氢气0.2 g,取相同质量的该酸完全燃烧,生成CO2和H2O共3.5 mol,下列组成的脂肪酸有可能是该酸的是( )
A.C15H27COOH B.C16H29COOH C.C17H31COOH D.C17H33COOH
3.不同空腔尺寸的葫芦可以通过形成超分子从气体或溶液中识别不同分子并选择性吸附,对位取代的苯的衍生物恰好可以进入葫芦[6]脲(结构如图所示)的空腔。下列说法正确的是
A.葫芦脲可以吸附进入空腔的所有分子
B.可装入对甲基苯甲酸体现了超分子的“分子识别”功能
C.葫芦[6]脲形成的超分子中存在氢键
D.超分子是分子聚集体,不包括离子
4.下列物质的熔点由高到低排列的顺序为
①NaCl②金刚石③CO2④晶体硅⑤CS2
A.②①⑤④③ B.②④①③⑤
C.②④①⑤③ D.④②①⑤③
5.Fe2(SO4)3溶液可与黄芩素发生显色反应。下列有关说法正确的是
A.电负性由强到弱的顺序为O>H>C
B.Fe3+的基态价电子排布式为3d6
C.黄岑素晶体熔点高、硬度大
D.SO的空间构型为正四面体
6.下列晶体中属于共价型过渡晶体的是
A.Al2O3 B.Na2O C.NaOH D.石墨
7.下列有关说法不正确的是
A.水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B.晶体的晶胞如图2所示,每个晶胞平均占有4个
C.晶体中(晶胞结构如图3所示)每个和12个相紧邻
D.金属Cu中原子堆积模型如图4所示,该金属晶体为最密堆积,每个Cu原子的配位数均为8
8.金晶体的晶胞如图所示,设金原子的直径为d,NA表示阿伏加德罗常数,M表示金原子的摩尔质量,在立方体的各个面的对角线上3个金原子相切。下列说法错误的是
A.金晶体每个晶胞中含有4个金原子 B.金晶体中金原子的配位数为12
C.一个金晶胞的体积是2d3 D.金晶体的密度
9.短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子核外有2个未成对电子,Y是地壳中含量最多的元素,W与X同主族,Z原子的逐级电离能(kJ/mol)依次为578、1817、2745、11575、14830……下列说法正确的是
A.简单离子的半径:r(Z)>r(Y)
B.元素Z在周期表中位于第3周期ⅠA族
C.简单氢化物的沸点:WD.X的一种核素可用于测定一些文物的年代
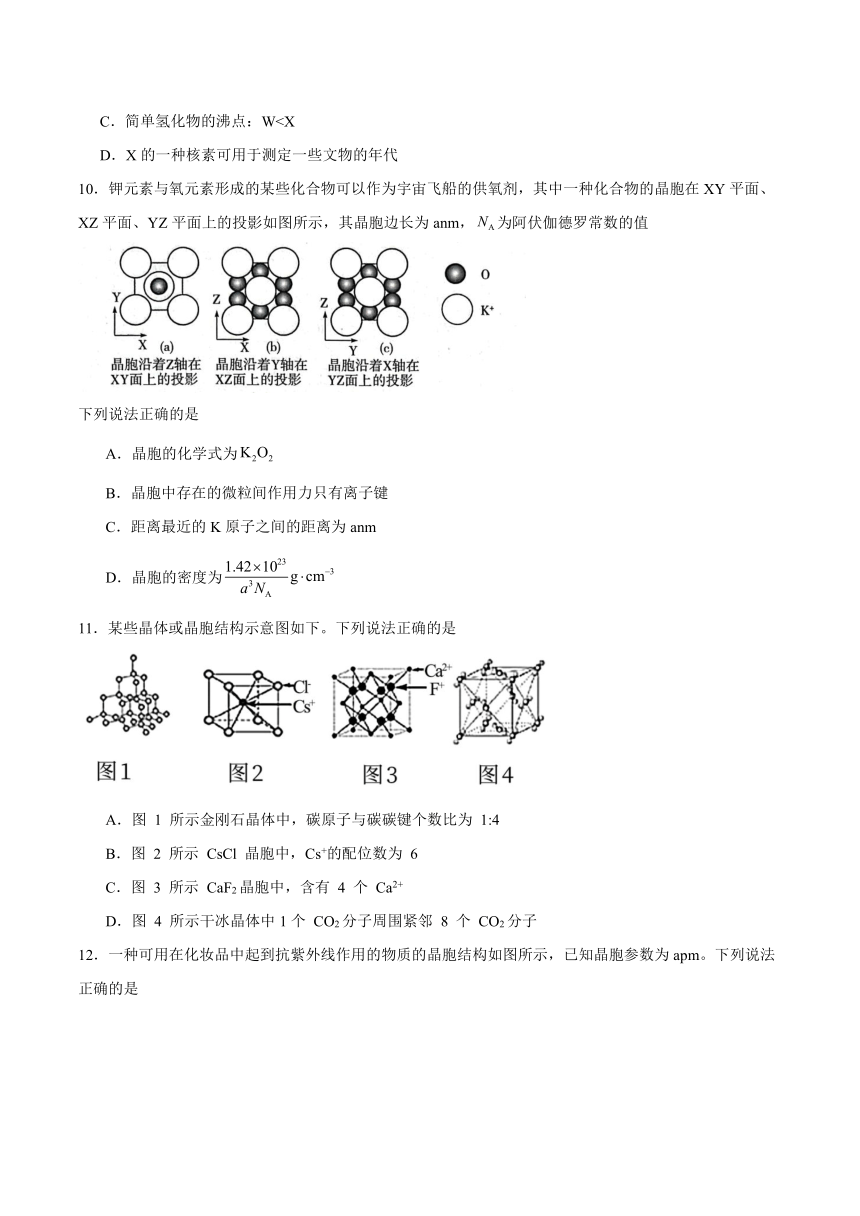
10.钾元素与氧元素形成的某些化合物可以作为宇宙飞船的供氧剂,其中一种化合物的晶胞在XY平面、XZ平面、YZ平面上的投影如图所示,其晶胞边长为anm,为阿伏伽德罗常数的值
下列说法正确的是
A.晶胞的化学式为
B.晶胞中存在的微粒间作用力只有离子键
C.距离最近的K原子之间的距离为anm
D.晶胞的密度为
11.某些晶体或晶胞结构示意图如下。下列说法正确的是
A.图 1 所示金刚石晶体中,碳原子与碳碳键个数比为 1:4
B.图 2 所示 CsCl 晶胞中,Cs+的配位数为 6
C.图 3 所示 CaF2晶胞中,含有 4 个 Ca2+
D.图 4 所示干冰晶体中1个 CO2分子周围紧邻 8 个 CO2分子
12.一种可用在化妆品中起到抗紫外线作用的物质的晶胞结构如图所示,已知晶胞参数为apm。下列说法正确的是
A.Ce与O的个数比为 B.Ce的配位数为4
C.Ce与O的最近距离为 D.该晶体的熔点较低
13.氧化铈(CeO2)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示。下列说法错误的是
A.氧元素位于元素周期表中的p区
B.CeO2晶体中与Ce4+相邻且最近的Ce4+有12个
C.O2-占据所有四面体空隙
D.每个CeO2-x晶胞中Ce4+个数为1-2x
14.已知氯化铝易溶于苯和四氯化碳,其熔点为190℃,则下列结论错误的是
A.氯化铝是电解质 B.固体氯化铝是分子晶体
C.可用电解熔融氯化铝的办法制取金属铝 D.氯化铝可能为非极性分子
15.下列说法不正确的是
A.纯碱和烧碱熔化时克服的化学键类型相同
B.加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏
C.干冰升华和CO2溶于水都只有分子间作用力改变
D.溴和汞的气化所需克服的作用力类型不同
16.下列说法错误的是
A.CH4分子球棍模型:
B.基态Si原子价电子排布图:
C.电负性:O>N>C
D.石墨质软的原因是其层间作用力微弱
17.下列说法错误的是
A.第三周期的某主族元素,其第一至第五电离能数据如图1所示,该元素为Mg
B.周期表ⅣA-~ⅦA中元素氢化物的沸点变化如图2所示,a点代表HCI
C.第三周期8种元素单质熔点高低的顺序如图3所示,序号7对应的元素为A1
D.CO:在高温高压下所形成的晶体其晶胞如图4所示,该晶体属于原子晶体
18.仔细观察下图,它表示的是晶体还是非晶体
A.是晶体 B.可能是晶体,可能是非晶体
C.是非晶体 D.不能确定
19.下列说法不正确的是
A.NCl3中N—Cl键的键长比CCl4中C—C1键的键长短
B.离子的空间结构是V形
C.Fe成为阳离子时首先失去能量最高的3d轨道电子
D.区分晶体、准晶体及非晶体的最可靠方法是对固体进行X射线衍射实验
20.具有较高的光电转接效率,在太阳能电池领域具有重要的应用价值。的立方晶格结构如图所示,下列说法错误的是
A.中N原子的杂化轨道类型为
B.中存在配位键
C.甲基的供电子能力强于氢原子,则接受质子能力:
D.晶胞中B(灰色球)代表,则每个晶胞中含有的数目为3
二、非选择题(共5题)
21.如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)代表金刚石的是 (填编号字母,下同),其中每个碳原子与 个碳原子最接近且距离相等。
(2)代表石墨的是 ,其中每个正六边形占有的碳原子数平均为 个。
(3)代表NaCl的是 ,每个Na+周围与它最接近且距离相等的Na+有 个。
(4)代表干冰的是 ,它属于 晶体,每个CO2分子与 个CO2分子紧邻。
(5)NaCl晶体、HCl晶体、干冰、金刚石;其中在熔融或液态时能导电的电解质是 ,液态不导电但为电解质的是 ,在水溶液中能导电的非电解质是 。
22.金属晶体有金属光泽,有良好的 性、 性、 性。金属在锻压或锤打时,密堆积层的金属原子之间比较容易产生 ,这种滑动不会破坏 ,而且在滑动过程中"自由电子"能够维系整个金属键的存在,即各层之间始终保持着 的作用,因此金属具有良好的 性。
23.利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
(1)该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(,,)。则D原子的坐标参数为 ,它代表 原子。
(2)若Cu2O晶体的密度为d g·cm-3,Cu和O的原子半径分别为rCupm和rO pm,阿伏加德罗常数值为NA,列式表示Cu2O晶胞中原子的空间利用率为 。
24.磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示,由图推知该多磷酸钙盐的通式为 。
25.铍透X射线的能力很强,有“金属玻璃”之称,其合金是航空、航天、军工、电子、核能等领域不可替代的战略金属材料。
回答下列问题:
(1)第一电离能:Be B(填“>”或“<”)。
(2)BeCl2熔沸点低,易升华,能溶于有机溶剂,气态时存在分子BeCl2和二聚分子(BeCl2)2。
①BeCl2属于 晶体,其空间构型是 。
②(BeCl2)2分子中Be原子的杂化方式相同,且所有原子都在同一平面上,则(BeCl2)2分子的结构为 (标出配位键)。
(3)晶格能BeO MgO(填“>”或“<”),推测BeCO3的分解温度 (填“高于”或“低于”)MgCO3。
参考答案:
1.A
A.氯化铯为离子晶体,在晶体中,的配位数为8,故A错误;
B.氯化钠为离子晶体,根据晶胞结构可判断在晶体中,的填充在形成正八面体空隙中,故B正确;
C.二氧化碳分子晶体中,不仅存在范德华力,构成分子的原子之间还形成化学键,故C正确;
D.根据二氧化硅的晶胞结构可判断在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键,故D正确。
故选A。
2.D
0.1mol高级脂肪酸发生加成反应时需氢气0.2g,n(H2)==0.1mol,说明分子中含有1个C=C键,0.1mol该高级脂肪酸完全燃烧,生成CO2和水共3.5mol,设该高级脂肪酸分子中C、H原子数目分别为x、y,由原子守恒可知x+y×2 =35;
A.C15H27COOH中含有2个C=C键,分子中x+y×2 =16+14=30,故A错误;
B.C16H29COOH中含有2个C=C键,分子中x+y×2 =17+15=32,故B错误;
C.C17H31COOH中含有2个C=C键,分子中x+y×2 =18+16=34,故C错误;
D.C17H33COOH中含有1个C=C键,分子中x+y×2 =18+17=35,故D正确;
故选:D。
3.B
A.由题给信息可知,只有对位取代的苯的衍生物恰好可以进入葫芦[6]脲的空腔,故A错误;
B.由题给信息可知,对位取代的苯的衍生物恰好可以进入葫芦[6]脲的空腔,则可装入对甲基苯甲酸,体现了超分子的“分子识别"功能,故B正确;
C.氢键是电负性大的原子N、O、F与氢原子形成共价键,这个氢原子吸引另外电负性大的原子形成,葫芦[6]脲形成的超分子间不存在氢键,故C错误;
D.超分子是两种或两种以上的分子通过分子相互作用形成的分子聚集体,分子时广义的定义,包括离子,故D错误;
故答案为B。
4.C
物质的熔点的变化规律:一般来讲,原子晶体>离子晶体>分子晶体;原子晶体中键长短的键能大,熔点高;分子晶体中,相对分子质量较大的熔点高,据此进行分析。
物质的熔点的变化规律:一般来讲,原子晶体>离子晶体>分子晶体;金刚石、晶体硅均属于原子晶体,但是C-C键的键长比Si-Si键的键长要短,键能大,因此金刚石的熔点大于晶体硅;CO2和CS2均属于分子晶体,一般来讲,分子量较大的,分子间作用力大,熔点高,因此熔点:⑤CS2>③CO2;NaCl属于离子晶体,熔点比原子晶体的低,比分子晶体的高;正确的顺序为:②④①⑤③;
综上所述,本题正确选项C。
5.D
A.同周期从左向右,电负性依次增大;同主族从下到上,电负性依次增大;电负性由强到弱的顺序为 O> C> H,A项错误;
B.Fe3+的基态的电子排布式为1s22s22p63s23p63d5,其价电子排布式为3d5,B项错误;
C.Fe2(SO4)3溶液可与黄芩素发生显色反应,说明黄芩素属于酚类,是分子晶体,熔点低、硬度小,C项错误;
D. 的中心S的价层电子对数为,其空间构型为正四面体形,D项正确;
答案选D。
6.A
A.Al2O3是离子晶体与共价晶体之间的过渡晶体,偏向共价晶体,可当作共价晶体处理,A符合题意;
B.Na2O是离子晶体与共价晶体之间的过渡晶体,偏向离子晶体,B不符合题意;
C.NaOH属于离子键构成的离子晶体,C不符合题意;
D.石墨是混合型晶体,不属于共价型过渡晶体,D不符合题意;
故选A。
7.D
A.由图可以看出,1个铜离子与4个水分子结合成[Cu(H2O)4]2+,Cu2+与H2O分子之间通过配位键相结合,则1个水合铜离子中有4个配位键,A正确;
B.CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+的数目为8×+6×=4,B正确;
C.CaTiO3晶体中钛离子位于顶点,氧离子位于面心,每个钛离子与12个氧离子相紧邻,C正确;
D.金属Cu原子形成的金属晶体为最密堆积,每个Cu原子周围同一层有6个Cu原子,上、下层各有3个Cu原子,所以其配位数均为12,D不正确;
故选D。
8.D
A.金晶体每个晶胞中含有6+8=4个金原子,故A正确;
B.如图:对于面心立方晶体,任取其中一个原子,以之位原点作x、y、z三个平面,构成空间直角坐标系。那么,在每一个平面中,都有四个配位原子在其左上、左下、右上、右下,三个平面共12个,故B正确
C.在立方体的各个面的对角线上3个金原子彼此两两相切,金原子的直径为d,故面对角线长度为2d,棱长为×2d=d,故晶胞的体积为(d)3=2d3,故C正确;
D.晶胞中含有4个原子,故晶胞质量为,晶胞的体积为2d3,故晶胞密度=,故D错误;
故选D。
9.D
短周期主族元素X、Y、Z、W的原子序数依次增大,Y是地壳中含量最多的元素,则Y是O元素;基态X原子核外有2个未成对电子, W与X同主族,则X为C元素、W为Si元素;Z原子的逐级电离能(kJ/mol)依次为578、1817、2745、11575、14830……,则Z为Al元素。
A.电子层结构相同的离子,核电荷数越大,离子半径越小,则铝离子的离子半径小于氧离子,故A错误;
B.铝元素位于元素周期表第三周期ⅢA族,故B错误;
C.结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高,则甲烷的沸点低于硅烷,故C错误;
D.14C是碳元素的一种核素,可用于测定一些文物的年代,故D正确;
故选D。
10.D
A.根据晶胞的投影图可以知道,K原子在晶胞的顶点和体心,一个晶胞含有K原子,O原子有两个在晶胞内,八个在棱上,一个晶胞中含有O原子,则晶胞的化学式为,故A错误;
B.晶胞的化学式为,则晶胞中存在的微粒间作用力有离子键和共价键,故B错误;
C.K原子在晶胞的顶点和体心,则距离最近的K原子之间的距离为体对角线的一半即anm,故C错误;
D.根据前面分析该晶胞中含有2个,则晶胞的密度为,故D正确。
综上所述,答案为D。
11.C
A.金刚石晶体中,每个碳原子形成4个碳碳键,每个碳碳键属于2个碳原子,所以平均每个碳原子形成2个碳碳键,碳原子与碳碳键个数比为 1:2,A不正确;
B.CsCl 晶胞中,每个Cs+周围距离最近且相等的Cl-有8个,则Cs+的配位数为 8,B不正确;
C.CaF2晶胞中,含有Ca2+个数为8×+6×=4,C正确;
D.干冰晶体中,1个 CO2分子周围紧邻的CO2分子数目为×8=12,D不正确;
故选C。
12.C
A.根据“均摊法”可得,晶胞中Ce的个数为,O的个数为8,则晶胞中Ce与O的个数比为,选项A错误;
B.以底面面心的Ce为中心,上、下层各有4个O,与Ce距离最近的O的个数为8,所以Ce的配位数为8,选项B错误;
C.Ce与O的最近距离为体对角线的,对角线长为,Ce与O的最近距离为,选项C正确;
D.是离子晶体,熔点较高,选项D错误;
答案选C。
13.D
A.O是第二周期第ⅥA族元素,其核外电子排布式为1s22s22p4,属于p区元素,A正确;
B.由CeO2晶胞图可知,以任一顶点的Ce4+为例,距离其最近的Ce4+位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则距离最近的Ce4+的个数为,B正确;
C.晶胞中位于顶点和面心Ce4+个数为,由化学式CeO2可知,晶胞中O2-个数为,即晶胞内部8个四面体空隙全部被O2-占据,C正确;
D.假设CeO2-x中的Ce4+和Ce3+的个数分别为m和n,则m+n= 1,由化合价代数和为0可得4m+3n=2(2-x),解得m=1-2x,由晶胞结构可知,位于顶点和面心的Ce4+或Ce3+个数为,所以每个晶胞中Ce4+的个数为4-8x,D错误;
故选D。
14.C
A.氯化铝溶于水可以电离出氯离子、铝离子溶液能导电,氯化铝是电解质,A正确;
B.的熔点较低,且易溶于苯和四氯化,因此为共价化合物固体氯化铝是分子晶体,B正确;
C.氯化铝是共价化合物,熔融状态下不导电,不能用电解熔融氯化铝的办法制取金属铝,C错误;
D.的熔点较低易溶于苯和四氯化碳苯、四氯化碳为非极性分子,根据“相似相溶”原理,氯化铝可能是非极性分子,D正确。
故选:C。
15.C
A.纯碱和烧碱熔化时均只克服离子键的作用,故克服的化学键类型相同,A正确;
B.加热蒸发氯化钾水溶液的过程中,水由液态变为水蒸气,故水分子的分子间作用力被破坏,B正确;
C.干冰升华只克服分子间作用力,但CO2溶于水却发生化学反应H2O+CO2H2CO3,故有化学键的断裂和形成,不仅仅是分子间作用力改变,C错误;
D.固体溴是分子晶体,气化时质克服分子间作用力,而固体汞属于金属晶体,其的气化所需克服金属键,故克服的作用力类型不同,D正确;
故答案为:C。
16.A
A.碳原子半径大于氢原子,CH4分子球棍模型为,故A错误;
B.Si元素位于周期表中第三周期第IVA族,价电子排布式为3s23p2,价电子排布图:,故B正确;
C.同周期电负性从左到右依次增大,故电负性:O>N>C,故C正确;
D.石墨层间是以范德华力结合的,范德华力弱,故石墨质软,故D正确;
故答案为A。
17.B
A.由该元素的第一至第五电离能数据可知,该元素第一二电离能较小,说明容易失去2个电子,即最外层有两个电子,已知该元素为第三周期的某主族元素,则该元素为Mg,A正确;
B.a点所在曲线第二周期的氢化物沸点为100℃,即H2O,则a点代表H2S,B错误;
C.一般情况,熔点:原子晶体>金属晶体>分子晶体,第三周期八种元素中,形成的单质只有硅为原子晶体,Si熔点最高,Na、Mg、Al为金属晶体,熔点:Na<Mg<Al,所以熔点第二高的为Al,即8代表的是Al元素,C正确;
D.C、O原子之间通过共价键形成空间立体网状结构,故该晶体属于原子晶体,D正确。
答案选B。
18.C
从图的结构可以看出此固体构成微粒排列的无序,比如观察右侧一个空隙中就有2个大球,属于非晶体;
故选C。
19.C
A.C原子的原子半径大于N原子的原子半径,则NCl3中N—Cl键的键长比CCl4中C—C1键的键长短,故A正确;
B.I离子与ClO离子具有相同的原子个数和价电子数,互为等电子体,等电子体具有相同的空间结构,ClO离子氯原子的价层电子对数为4,孤对电子对数为2,ClO离子的空间结构是V形,则I离子的空间结构也是V形,故B正确;
C.铁原子形成阳离子时首先失去最外层4s轨道上的电子,故C错误;
D.对固体进行X射线衍射实验可以准确的区分固体是否为晶体、准晶体及非晶体,故D正确;
故选C。
20.C
由立方晶格结构可推知每个晶胞中A的个数=8×=1,C的个数=6×=3,B的个数为1,对比化学式可知C为I-,B为中心原子,则B为,A为。
A.的电子式为,N有4个σ键,杂化方式为sp3杂化,A正确;
B.中N提供孤电子对,H提供空轨道,形成一个配位键,B正确;
C.甲基的供电子能力强于氢原子,则中含有两个甲基,接受质子能力较强,即接受质子能力:,C错误;
D.由分析可知晶胞中B(灰色球)代表,则每个晶胞中含有的数目为3,D正确;
选C。
21.(1) D 4
(2) E 2
(3) A 12
(4) B 分子 12
(5) NaCl HCl 干冰
(1)金刚石中每个碳原子与周围的4个碳原子成键,形成空间网状正八面体,符合金刚石结构的为D,每个C原子周围最近的碳原子有4个,答案为:D;4;
(2)石墨为层状结构,层内每个C原子与三个C形成共价键,符合石墨结构的为E,同时每个C原子为三个六元环共用,则属于一个六元环的碳原子数为,故答案为:E;2;
(3)A为NaCl晶胞的一部分,每个Na原子周围距离最近的钠原子有12,故答案为:A;12;
(4)二氧化碳为面心堆积方式,其晶体为分子晶体,每个二氧化碳周围紧邻的二氧化碳有12个,故答案为:B;分子;12;
(5)NaCl是在熔融或水溶液中能导电的电解质,HCl液态时不能电离,但是其在水溶液中可以电离故属于电解质,二氧化碳水溶液中因产生碳酸电离出离子而导电,但其自身不能电离,故属于非电解质,故答案为: NaCl;HCl;干冰。
22. 导电性 导热性 延展性 滑动 密堆积的排列方式 金属键 延展性
【解析】略
23. (,,) Cu
(1)根据晶胞的结构,D在A和C中间,因此D的坐标是(,,),白色的原子位于顶点和体心,个数为8×+1=2,D原子位于晶胞内,全部属于晶胞,个数为4,根据化学式,推出D为Cu,故答案为:(,,);Cu;
(2)空间利用率是晶胞中球的体积与晶胞体积的比值,晶胞中球的体积为×10-30 cm3,晶胞的体积可以采用晶胞的密度进行计算,即晶胞的体积为cm3,因此空间利用率为,故答案为:。
24.(CaP2O6)n
晶胞中方框中为重复单元: ,Ca原子个数为1,P原子个数为2,O原子个数为6,化合价依次为+2、+5、-2,故该多磷酸钙盐的通式为(CaP2O6)n。
25. > 分子 直线形 > 低于
(1)第一电离能是基态的气态原子失去最外层的一个电子所需能量。原子越容易失去一个电子,第一电离能数值越小。
(2)①结合BeCl2的物理性质可判断BeCl2的晶体类型;根据价层电子对互斥理论计算得到分子构型。
②(BeCl2)2中Be外层电子具有空轨道,Cl外层电子具有孤电子对,因此Be与Cl之间可形成配位键。
(3)晶格能是指在标准状况下,使离子晶体变成气态正离子和气态负离子时所吸收的能量。电荷高、半径小的离子,其晶格能大。碳酸盐分解生成金属氧化物,可利用氧化物的晶格能来分析分解温度。
(1)第一电离能是基态的气态原子失去最外层的一个电子所需能量。Be原子核外电子排布式为1s22s2,2s轨道处于全充满状态,是比较稳定的状态,较难失去最外层的一个电子;B原子核外电子排布式为1s22s22p1,与铍相比易失去最外层的一个电子,所以Be第一电离能大于B;
故答案为:>;
(2)①由题知BeCl2熔点较低,易升华,能溶于有机溶剂可知BeCl2为分子晶体;BeCl2中成键电子对为2,孤电子对数=,根据价层电子对互斥理论可得BeCl2的分子构型为直线形;
故答案为:分子;直线形;
②由①可知BeCl2的分子构型为直线形,其单分子结构为Cl-Be-Cl,(BeCl2)2中Be外层电子具有空轨道,Cl外层电子具有孤电子对,因此Be与Cl之间可形成配位键,其二聚分子(BeCl2)2结构式为;
故答案为:;
(3)晶格能是指在标准状况下,使离子晶体变成气态正离子和气态负离子时所吸收的能量。电荷高、半径小的离子,其晶格能大。BeO和MgO相比,铍离子的半径小于镁离子,因此晶格能BeO>MgO;碳酸盐分解生成金属氧化物,金属氧化物的晶格能越大,越易分解。因氧化铍的晶格能比氧化镁的晶格能大,所以BeCO3更易分解,因此BeCO3的分解温度低于MgCO3。
故答案为:>;低于。
【点睛】本题是对物质结构与性质的考查,涉及核外电子排布、电离能、晶体类型与性质、价层电子对互斥理论、晶格能等知识,明确核外电子排布遵循的规律,熟悉离子晶体晶格能大小影响因素是解题关键
一、单选题(共20题)
1.下列关于晶体结构和性质的叙述错误的是
A.在晶体中,的配位数为6
B.在晶体中,的填充在形成正八面体空隙中
C.在干冰晶体中,微粒间存在范德华力和共价键
D.在二氧化硅晶体中,平均每个原子形成4个键
2.某高级脂肪酸0.1 mol发生加成反应时需氢气0.2 g,取相同质量的该酸完全燃烧,生成CO2和H2O共3.5 mol,下列组成的脂肪酸有可能是该酸的是( )
A.C15H27COOH B.C16H29COOH C.C17H31COOH D.C17H33COOH
3.不同空腔尺寸的葫芦可以通过形成超分子从气体或溶液中识别不同分子并选择性吸附,对位取代的苯的衍生物恰好可以进入葫芦[6]脲(结构如图所示)的空腔。下列说法正确的是
A.葫芦脲可以吸附进入空腔的所有分子
B.可装入对甲基苯甲酸体现了超分子的“分子识别”功能
C.葫芦[6]脲形成的超分子中存在氢键
D.超分子是分子聚集体,不包括离子
4.下列物质的熔点由高到低排列的顺序为
①NaCl②金刚石③CO2④晶体硅⑤CS2
A.②①⑤④③ B.②④①③⑤
C.②④①⑤③ D.④②①⑤③
5.Fe2(SO4)3溶液可与黄芩素发生显色反应。下列有关说法正确的是
A.电负性由强到弱的顺序为O>H>C
B.Fe3+的基态价电子排布式为3d6
C.黄岑素晶体熔点高、硬度大
D.SO的空间构型为正四面体
6.下列晶体中属于共价型过渡晶体的是
A.Al2O3 B.Na2O C.NaOH D.石墨
7.下列有关说法不正确的是
A.水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B.晶体的晶胞如图2所示,每个晶胞平均占有4个
C.晶体中(晶胞结构如图3所示)每个和12个相紧邻
D.金属Cu中原子堆积模型如图4所示,该金属晶体为最密堆积,每个Cu原子的配位数均为8
8.金晶体的晶胞如图所示,设金原子的直径为d,NA表示阿伏加德罗常数,M表示金原子的摩尔质量,在立方体的各个面的对角线上3个金原子相切。下列说法错误的是
A.金晶体每个晶胞中含有4个金原子 B.金晶体中金原子的配位数为12
C.一个金晶胞的体积是2d3 D.金晶体的密度
9.短周期主族元素X、Y、Z、W的原子序数依次增大,基态X原子核外有2个未成对电子,Y是地壳中含量最多的元素,W与X同主族,Z原子的逐级电离能(kJ/mol)依次为578、1817、2745、11575、14830……下列说法正确的是
A.简单离子的半径:r(Z)>r(Y)
B.元素Z在周期表中位于第3周期ⅠA族
C.简单氢化物的沸点:W
10.钾元素与氧元素形成的某些化合物可以作为宇宙飞船的供氧剂,其中一种化合物的晶胞在XY平面、XZ平面、YZ平面上的投影如图所示,其晶胞边长为anm,为阿伏伽德罗常数的值
下列说法正确的是
A.晶胞的化学式为
B.晶胞中存在的微粒间作用力只有离子键
C.距离最近的K原子之间的距离为anm
D.晶胞的密度为
11.某些晶体或晶胞结构示意图如下。下列说法正确的是
A.图 1 所示金刚石晶体中,碳原子与碳碳键个数比为 1:4
B.图 2 所示 CsCl 晶胞中,Cs+的配位数为 6
C.图 3 所示 CaF2晶胞中,含有 4 个 Ca2+
D.图 4 所示干冰晶体中1个 CO2分子周围紧邻 8 个 CO2分子
12.一种可用在化妆品中起到抗紫外线作用的物质的晶胞结构如图所示,已知晶胞参数为apm。下列说法正确的是
A.Ce与O的个数比为 B.Ce的配位数为4
C.Ce与O的最近距离为 D.该晶体的熔点较低
13.氧化铈(CeO2)是一种重要的光催化材料,光催化过程中立方晶胞的组成变化如图所示。下列说法错误的是
A.氧元素位于元素周期表中的p区
B.CeO2晶体中与Ce4+相邻且最近的Ce4+有12个
C.O2-占据所有四面体空隙
D.每个CeO2-x晶胞中Ce4+个数为1-2x
14.已知氯化铝易溶于苯和四氯化碳,其熔点为190℃,则下列结论错误的是
A.氯化铝是电解质 B.固体氯化铝是分子晶体
C.可用电解熔融氯化铝的办法制取金属铝 D.氯化铝可能为非极性分子
15.下列说法不正确的是
A.纯碱和烧碱熔化时克服的化学键类型相同
B.加热蒸发氯化钾水溶液的过程中有分子间作用力的破坏
C.干冰升华和CO2溶于水都只有分子间作用力改变
D.溴和汞的气化所需克服的作用力类型不同
16.下列说法错误的是
A.CH4分子球棍模型:
B.基态Si原子价电子排布图:
C.电负性:O>N>C
D.石墨质软的原因是其层间作用力微弱
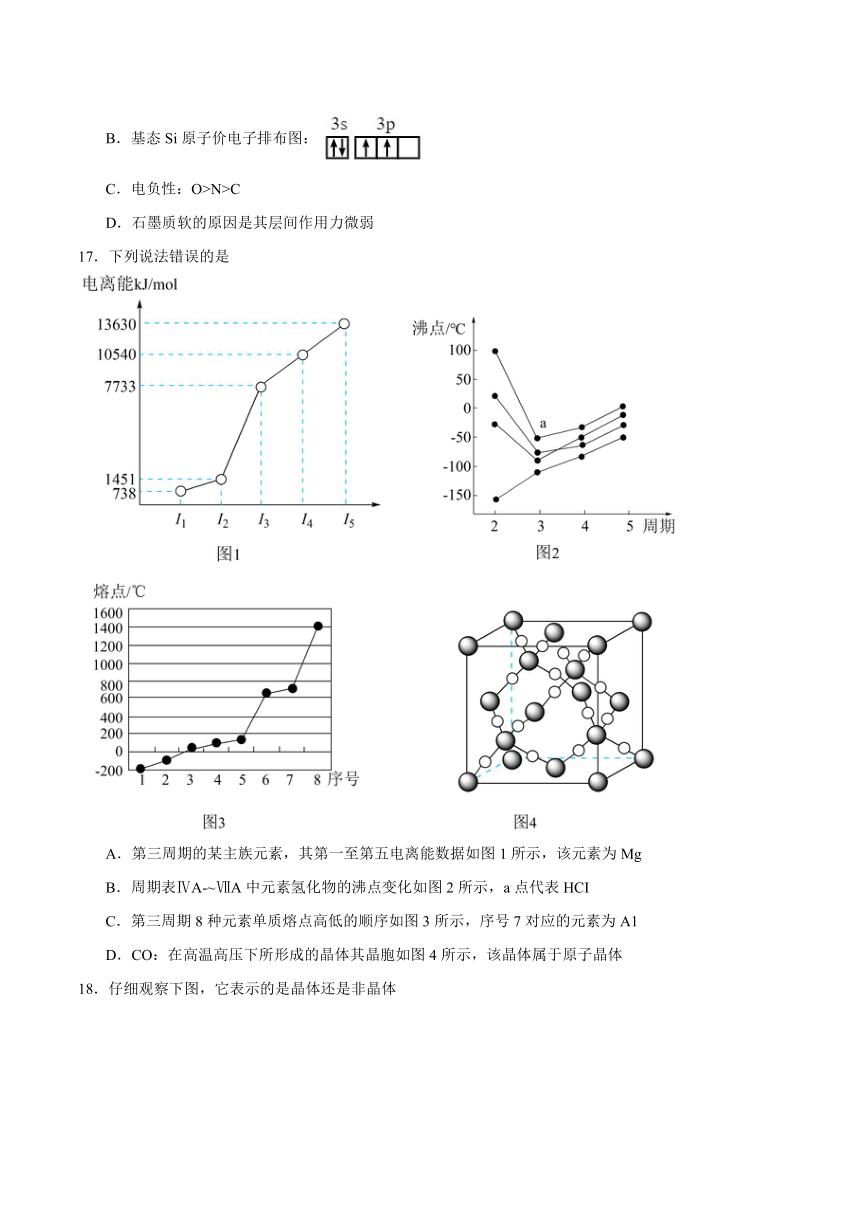
17.下列说法错误的是
A.第三周期的某主族元素,其第一至第五电离能数据如图1所示,该元素为Mg
B.周期表ⅣA-~ⅦA中元素氢化物的沸点变化如图2所示,a点代表HCI
C.第三周期8种元素单质熔点高低的顺序如图3所示,序号7对应的元素为A1
D.CO:在高温高压下所形成的晶体其晶胞如图4所示,该晶体属于原子晶体
18.仔细观察下图,它表示的是晶体还是非晶体
A.是晶体 B.可能是晶体,可能是非晶体
C.是非晶体 D.不能确定
19.下列说法不正确的是
A.NCl3中N—Cl键的键长比CCl4中C—C1键的键长短
B.离子的空间结构是V形
C.Fe成为阳离子时首先失去能量最高的3d轨道电子
D.区分晶体、准晶体及非晶体的最可靠方法是对固体进行X射线衍射实验
20.具有较高的光电转接效率,在太阳能电池领域具有重要的应用价值。的立方晶格结构如图所示,下列说法错误的是
A.中N原子的杂化轨道类型为
B.中存在配位键
C.甲基的供电子能力强于氢原子,则接受质子能力:
D.晶胞中B(灰色球)代表,则每个晶胞中含有的数目为3
二、非选择题(共5题)
21.如图表示一些晶体中的某些结构,它们分别是NaCl、CsCl、干冰、金刚石、石墨结构中的某一种的某一部分。
(1)代表金刚石的是 (填编号字母,下同),其中每个碳原子与 个碳原子最接近且距离相等。
(2)代表石墨的是 ,其中每个正六边形占有的碳原子数平均为 个。
(3)代表NaCl的是 ,每个Na+周围与它最接近且距离相等的Na+有 个。
(4)代表干冰的是 ,它属于 晶体,每个CO2分子与 个CO2分子紧邻。
(5)NaCl晶体、HCl晶体、干冰、金刚石;其中在熔融或液态时能导电的电解质是 ,液态不导电但为电解质的是 ,在水溶液中能导电的非电解质是 。
22.金属晶体有金属光泽,有良好的 性、 性、 性。金属在锻压或锤打时,密堆积层的金属原子之间比较容易产生 ,这种滑动不会破坏 ,而且在滑动过程中"自由电子"能够维系整个金属键的存在,即各层之间始终保持着 的作用,因此金属具有良好的 性。
23.利用新制的Cu(OH)2检验醛基时,生成红色的Cu2O,其晶胞结构如图所示。
(1)该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(,,)。则D原子的坐标参数为 ,它代表 原子。
(2)若Cu2O晶体的密度为d g·cm-3,Cu和O的原子半径分别为rCupm和rO pm,阿伏加德罗常数值为NA,列式表示Cu2O晶胞中原子的空间利用率为 。
24.磷酸分子间脱水可生成多磷酸,其某一钙盐的结构如图所示,由图推知该多磷酸钙盐的通式为 。
25.铍透X射线的能力很强,有“金属玻璃”之称,其合金是航空、航天、军工、电子、核能等领域不可替代的战略金属材料。
回答下列问题:
(1)第一电离能:Be B(填“>”或“<”)。
(2)BeCl2熔沸点低,易升华,能溶于有机溶剂,气态时存在分子BeCl2和二聚分子(BeCl2)2。
①BeCl2属于 晶体,其空间构型是 。
②(BeCl2)2分子中Be原子的杂化方式相同,且所有原子都在同一平面上,则(BeCl2)2分子的结构为 (标出配位键)。
(3)晶格能BeO MgO(填“>”或“<”),推测BeCO3的分解温度 (填“高于”或“低于”)MgCO3。
参考答案:
1.A
A.氯化铯为离子晶体,在晶体中,的配位数为8,故A错误;
B.氯化钠为离子晶体,根据晶胞结构可判断在晶体中,的填充在形成正八面体空隙中,故B正确;
C.二氧化碳分子晶体中,不仅存在范德华力,构成分子的原子之间还形成化学键,故C正确;
D.根据二氧化硅的晶胞结构可判断在二氧化硅晶体中,平均每个Si原子形成4个Si-O共价单键,故D正确。
故选A。
2.D
0.1mol高级脂肪酸发生加成反应时需氢气0.2g,n(H2)==0.1mol,说明分子中含有1个C=C键,0.1mol该高级脂肪酸完全燃烧,生成CO2和水共3.5mol,设该高级脂肪酸分子中C、H原子数目分别为x、y,由原子守恒可知x+y×2 =35;
A.C15H27COOH中含有2个C=C键,分子中x+y×2 =16+14=30,故A错误;
B.C16H29COOH中含有2个C=C键,分子中x+y×2 =17+15=32,故B错误;
C.C17H31COOH中含有2个C=C键,分子中x+y×2 =18+16=34,故C错误;
D.C17H33COOH中含有1个C=C键,分子中x+y×2 =18+17=35,故D正确;
故选:D。
3.B
A.由题给信息可知,只有对位取代的苯的衍生物恰好可以进入葫芦[6]脲的空腔,故A错误;
B.由题给信息可知,对位取代的苯的衍生物恰好可以进入葫芦[6]脲的空腔,则可装入对甲基苯甲酸,体现了超分子的“分子识别"功能,故B正确;
C.氢键是电负性大的原子N、O、F与氢原子形成共价键,这个氢原子吸引另外电负性大的原子形成,葫芦[6]脲形成的超分子间不存在氢键,故C错误;
D.超分子是两种或两种以上的分子通过分子相互作用形成的分子聚集体,分子时广义的定义,包括离子,故D错误;
故答案为B。
4.C
物质的熔点的变化规律:一般来讲,原子晶体>离子晶体>分子晶体;原子晶体中键长短的键能大,熔点高;分子晶体中,相对分子质量较大的熔点高,据此进行分析。
物质的熔点的变化规律:一般来讲,原子晶体>离子晶体>分子晶体;金刚石、晶体硅均属于原子晶体,但是C-C键的键长比Si-Si键的键长要短,键能大,因此金刚石的熔点大于晶体硅;CO2和CS2均属于分子晶体,一般来讲,分子量较大的,分子间作用力大,熔点高,因此熔点:⑤CS2>③CO2;NaCl属于离子晶体,熔点比原子晶体的低,比分子晶体的高;正确的顺序为:②④①⑤③;
综上所述,本题正确选项C。
5.D
A.同周期从左向右,电负性依次增大;同主族从下到上,电负性依次增大;电负性由强到弱的顺序为 O> C> H,A项错误;
B.Fe3+的基态的电子排布式为1s22s22p63s23p63d5,其价电子排布式为3d5,B项错误;
C.Fe2(SO4)3溶液可与黄芩素发生显色反应,说明黄芩素属于酚类,是分子晶体,熔点低、硬度小,C项错误;
D. 的中心S的价层电子对数为,其空间构型为正四面体形,D项正确;
答案选D。
6.A
A.Al2O3是离子晶体与共价晶体之间的过渡晶体,偏向共价晶体,可当作共价晶体处理,A符合题意;
B.Na2O是离子晶体与共价晶体之间的过渡晶体,偏向离子晶体,B不符合题意;
C.NaOH属于离子键构成的离子晶体,C不符合题意;
D.石墨是混合型晶体,不属于共价型过渡晶体,D不符合题意;
故选A。
7.D
A.由图可以看出,1个铜离子与4个水分子结合成[Cu(H2O)4]2+,Cu2+与H2O分子之间通过配位键相结合,则1个水合铜离子中有4个配位键,A正确;
B.CaF2晶体的晶胞中,每个CaF2晶胞平均占有Ca2+的数目为8×+6×=4,B正确;
C.CaTiO3晶体中钛离子位于顶点,氧离子位于面心,每个钛离子与12个氧离子相紧邻,C正确;
D.金属Cu原子形成的金属晶体为最密堆积,每个Cu原子周围同一层有6个Cu原子,上、下层各有3个Cu原子,所以其配位数均为12,D不正确;
故选D。
8.D
A.金晶体每个晶胞中含有6+8=4个金原子,故A正确;
B.如图:对于面心立方晶体,任取其中一个原子,以之位原点作x、y、z三个平面,构成空间直角坐标系。那么,在每一个平面中,都有四个配位原子在其左上、左下、右上、右下,三个平面共12个,故B正确
C.在立方体的各个面的对角线上3个金原子彼此两两相切,金原子的直径为d,故面对角线长度为2d,棱长为×2d=d,故晶胞的体积为(d)3=2d3,故C正确;
D.晶胞中含有4个原子,故晶胞质量为,晶胞的体积为2d3,故晶胞密度=,故D错误;
故选D。
9.D
短周期主族元素X、Y、Z、W的原子序数依次增大,Y是地壳中含量最多的元素,则Y是O元素;基态X原子核外有2个未成对电子, W与X同主族,则X为C元素、W为Si元素;Z原子的逐级电离能(kJ/mol)依次为578、1817、2745、11575、14830……,则Z为Al元素。
A.电子层结构相同的离子,核电荷数越大,离子半径越小,则铝离子的离子半径小于氧离子,故A错误;
B.铝元素位于元素周期表第三周期ⅢA族,故B错误;
C.结构相似的分子晶体,相对分子质量越大,分子间作用力越大,熔沸点越高,则甲烷的沸点低于硅烷,故C错误;
D.14C是碳元素的一种核素,可用于测定一些文物的年代,故D正确;
故选D。
10.D
A.根据晶胞的投影图可以知道,K原子在晶胞的顶点和体心,一个晶胞含有K原子,O原子有两个在晶胞内,八个在棱上,一个晶胞中含有O原子,则晶胞的化学式为,故A错误;
B.晶胞的化学式为,则晶胞中存在的微粒间作用力有离子键和共价键,故B错误;
C.K原子在晶胞的顶点和体心,则距离最近的K原子之间的距离为体对角线的一半即anm,故C错误;
D.根据前面分析该晶胞中含有2个,则晶胞的密度为,故D正确。
综上所述,答案为D。
11.C
A.金刚石晶体中,每个碳原子形成4个碳碳键,每个碳碳键属于2个碳原子,所以平均每个碳原子形成2个碳碳键,碳原子与碳碳键个数比为 1:2,A不正确;
B.CsCl 晶胞中,每个Cs+周围距离最近且相等的Cl-有8个,则Cs+的配位数为 8,B不正确;
C.CaF2晶胞中,含有Ca2+个数为8×+6×=4,C正确;
D.干冰晶体中,1个 CO2分子周围紧邻的CO2分子数目为×8=12,D不正确;
故选C。
12.C
A.根据“均摊法”可得,晶胞中Ce的个数为,O的个数为8,则晶胞中Ce与O的个数比为,选项A错误;
B.以底面面心的Ce为中心,上、下层各有4个O,与Ce距离最近的O的个数为8,所以Ce的配位数为8,选项B错误;
C.Ce与O的最近距离为体对角线的,对角线长为,Ce与O的最近距离为,选项C正确;
D.是离子晶体,熔点较高,选项D错误;
答案选C。
13.D
A.O是第二周期第ⅥA族元素,其核外电子排布式为1s22s22p4,属于p区元素,A正确;
B.由CeO2晶胞图可知,以任一顶点的Ce4+为例,距离其最近的Ce4+位于该顶点所在的三个面的面心,一个顶点被8个晶胞共用,则距离最近的Ce4+的个数为,B正确;
C.晶胞中位于顶点和面心Ce4+个数为,由化学式CeO2可知,晶胞中O2-个数为,即晶胞内部8个四面体空隙全部被O2-占据,C正确;
D.假设CeO2-x中的Ce4+和Ce3+的个数分别为m和n,则m+n= 1,由化合价代数和为0可得4m+3n=2(2-x),解得m=1-2x,由晶胞结构可知,位于顶点和面心的Ce4+或Ce3+个数为,所以每个晶胞中Ce4+的个数为4-8x,D错误;
故选D。
14.C
A.氯化铝溶于水可以电离出氯离子、铝离子溶液能导电,氯化铝是电解质,A正确;
B.的熔点较低,且易溶于苯和四氯化,因此为共价化合物固体氯化铝是分子晶体,B正确;
C.氯化铝是共价化合物,熔融状态下不导电,不能用电解熔融氯化铝的办法制取金属铝,C错误;
D.的熔点较低易溶于苯和四氯化碳苯、四氯化碳为非极性分子,根据“相似相溶”原理,氯化铝可能是非极性分子,D正确。
故选:C。
15.C
A.纯碱和烧碱熔化时均只克服离子键的作用,故克服的化学键类型相同,A正确;
B.加热蒸发氯化钾水溶液的过程中,水由液态变为水蒸气,故水分子的分子间作用力被破坏,B正确;
C.干冰升华只克服分子间作用力,但CO2溶于水却发生化学反应H2O+CO2H2CO3,故有化学键的断裂和形成,不仅仅是分子间作用力改变,C错误;
D.固体溴是分子晶体,气化时质克服分子间作用力,而固体汞属于金属晶体,其的气化所需克服金属键,故克服的作用力类型不同,D正确;
故答案为:C。
16.A
A.碳原子半径大于氢原子,CH4分子球棍模型为,故A错误;
B.Si元素位于周期表中第三周期第IVA族,价电子排布式为3s23p2,价电子排布图:,故B正确;
C.同周期电负性从左到右依次增大,故电负性:O>N>C,故C正确;
D.石墨层间是以范德华力结合的,范德华力弱,故石墨质软,故D正确;
故答案为A。
17.B
A.由该元素的第一至第五电离能数据可知,该元素第一二电离能较小,说明容易失去2个电子,即最外层有两个电子,已知该元素为第三周期的某主族元素,则该元素为Mg,A正确;
B.a点所在曲线第二周期的氢化物沸点为100℃,即H2O,则a点代表H2S,B错误;
C.一般情况,熔点:原子晶体>金属晶体>分子晶体,第三周期八种元素中,形成的单质只有硅为原子晶体,Si熔点最高,Na、Mg、Al为金属晶体,熔点:Na<Mg<Al,所以熔点第二高的为Al,即8代表的是Al元素,C正确;
D.C、O原子之间通过共价键形成空间立体网状结构,故该晶体属于原子晶体,D正确。
答案选B。
18.C
从图的结构可以看出此固体构成微粒排列的无序,比如观察右侧一个空隙中就有2个大球,属于非晶体;
故选C。
19.C
A.C原子的原子半径大于N原子的原子半径,则NCl3中N—Cl键的键长比CCl4中C—C1键的键长短,故A正确;
B.I离子与ClO离子具有相同的原子个数和价电子数,互为等电子体,等电子体具有相同的空间结构,ClO离子氯原子的价层电子对数为4,孤对电子对数为2,ClO离子的空间结构是V形,则I离子的空间结构也是V形,故B正确;
C.铁原子形成阳离子时首先失去最外层4s轨道上的电子,故C错误;
D.对固体进行X射线衍射实验可以准确的区分固体是否为晶体、准晶体及非晶体,故D正确;
故选C。
20.C
由立方晶格结构可推知每个晶胞中A的个数=8×=1,C的个数=6×=3,B的个数为1,对比化学式可知C为I-,B为中心原子,则B为,A为。
A.的电子式为,N有4个σ键,杂化方式为sp3杂化,A正确;
B.中N提供孤电子对,H提供空轨道,形成一个配位键,B正确;
C.甲基的供电子能力强于氢原子,则中含有两个甲基,接受质子能力较强,即接受质子能力:,C错误;
D.由分析可知晶胞中B(灰色球)代表,则每个晶胞中含有的数目为3,D正确;
选C。
21.(1) D 4
(2) E 2
(3) A 12
(4) B 分子 12
(5) NaCl HCl 干冰
(1)金刚石中每个碳原子与周围的4个碳原子成键,形成空间网状正八面体,符合金刚石结构的为D,每个C原子周围最近的碳原子有4个,答案为:D;4;
(2)石墨为层状结构,层内每个C原子与三个C形成共价键,符合石墨结构的为E,同时每个C原子为三个六元环共用,则属于一个六元环的碳原子数为,故答案为:E;2;
(3)A为NaCl晶胞的一部分,每个Na原子周围距离最近的钠原子有12,故答案为:A;12;
(4)二氧化碳为面心堆积方式,其晶体为分子晶体,每个二氧化碳周围紧邻的二氧化碳有12个,故答案为:B;分子;12;
(5)NaCl是在熔融或水溶液中能导电的电解质,HCl液态时不能电离,但是其在水溶液中可以电离故属于电解质,二氧化碳水溶液中因产生碳酸电离出离子而导电,但其自身不能电离,故属于非电解质,故答案为: NaCl;HCl;干冰。
22. 导电性 导热性 延展性 滑动 密堆积的排列方式 金属键 延展性
【解析】略
23. (,,) Cu
(1)根据晶胞的结构,D在A和C中间,因此D的坐标是(,,),白色的原子位于顶点和体心,个数为8×+1=2,D原子位于晶胞内,全部属于晶胞,个数为4,根据化学式,推出D为Cu,故答案为:(,,);Cu;
(2)空间利用率是晶胞中球的体积与晶胞体积的比值,晶胞中球的体积为×10-30 cm3,晶胞的体积可以采用晶胞的密度进行计算,即晶胞的体积为cm3,因此空间利用率为,故答案为:。
24.(CaP2O6)n
晶胞中方框中为重复单元: ,Ca原子个数为1,P原子个数为2,O原子个数为6,化合价依次为+2、+5、-2,故该多磷酸钙盐的通式为(CaP2O6)n。
25. > 分子 直线形 > 低于
(1)第一电离能是基态的气态原子失去最外层的一个电子所需能量。原子越容易失去一个电子,第一电离能数值越小。
(2)①结合BeCl2的物理性质可判断BeCl2的晶体类型;根据价层电子对互斥理论计算得到分子构型。
②(BeCl2)2中Be外层电子具有空轨道,Cl外层电子具有孤电子对,因此Be与Cl之间可形成配位键。
(3)晶格能是指在标准状况下,使离子晶体变成气态正离子和气态负离子时所吸收的能量。电荷高、半径小的离子,其晶格能大。碳酸盐分解生成金属氧化物,可利用氧化物的晶格能来分析分解温度。
(1)第一电离能是基态的气态原子失去最外层的一个电子所需能量。Be原子核外电子排布式为1s22s2,2s轨道处于全充满状态,是比较稳定的状态,较难失去最外层的一个电子;B原子核外电子排布式为1s22s22p1,与铍相比易失去最外层的一个电子,所以Be第一电离能大于B;
故答案为:>;
(2)①由题知BeCl2熔点较低,易升华,能溶于有机溶剂可知BeCl2为分子晶体;BeCl2中成键电子对为2,孤电子对数=,根据价层电子对互斥理论可得BeCl2的分子构型为直线形;
故答案为:分子;直线形;
②由①可知BeCl2的分子构型为直线形,其单分子结构为Cl-Be-Cl,(BeCl2)2中Be外层电子具有空轨道,Cl外层电子具有孤电子对,因此Be与Cl之间可形成配位键,其二聚分子(BeCl2)2结构式为;
故答案为:;
(3)晶格能是指在标准状况下,使离子晶体变成气态正离子和气态负离子时所吸收的能量。电荷高、半径小的离子,其晶格能大。BeO和MgO相比,铍离子的半径小于镁离子,因此晶格能BeO>MgO;碳酸盐分解生成金属氧化物,金属氧化物的晶格能越大,越易分解。因氧化铍的晶格能比氧化镁的晶格能大,所以BeCO3更易分解,因此BeCO3的分解温度低于MgCO3。
故答案为:>;低于。
【点睛】本题是对物质结构与性质的考查,涉及核外电子排布、电离能、晶体类型与性质、价层电子对互斥理论、晶格能等知识,明确核外电子排布遵循的规律,熟悉离子晶体晶格能大小影响因素是解题关键
