第三章 晶体结构与性质 测试题 (含解析)2023-2024学年高二下学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 第三章 晶体结构与性质 测试题 (含解析)2023-2024学年高二下学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 501.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-09 13:18:07 | ||
图片预览




文档简介
第三章 晶体结构与性质 测试题
一、选择题
1.下列说法正确的是
A.乙醇中的上的氢比水分子中的上的氢活泼
B.的配合物内界和外界的数目之比是1∶2
C.乙炔分子中π键重叠程度比σ键大
D.手性分子与足量的反应后分子中没有手性碳原子
2.我国科学家研究出一种磷化硼纳米颗粒作为高选择性 CO2 电化学还原为甲醇的非金属电催化剂,磷化硼晶胞结构如图所示。下列说法正确的是
A.若氮化硼与磷化硼具有相似的结构,则 BN 的熔点比 BP 低
B.磷化硼晶体中“普通共价键”与配位键的数目之比为 3:1
C.磷化硼晶体中,每个磷原子周围紧邻且距离相等的硼原子共有 2 个
D.磷化硼纳米颗粒的大小与磷化硼晶胞大小相似
3.下列有关元素及其化合物性质的说法正确的是
A.、与酸反应只生成盐和水,均属于碱性氧化物
B.只有过渡金属元素的原子或离子才能形成配合物
C.N的电负性比P大,可推断的键角比小
D.比稳定是因为中含有分子间氢键
4.下列实验操作、现象和所得的结论均正确的是
选项 实验操作与现象 结论
A 向无水乙醇中加入绿豆大的金属钠,直接收集反应中产生的气体,用燃着的火柴靠近气体,气体燃烧 乙醇与Na反应生成了氢气
B 向2mL鸡蛋清溶液中逐滴加入饱和硫酸铵溶液并振荡,溶液中不断有白色沉淀析出,该沉淀加水重新溶解 饱和硫酸铵溶液可以降低蛋白质在水中的溶解度
C 向稀的氯化铜溶液中加入适量氯化钠固体,溶液由蓝色变绿色 水合铜离子和氯离子形成了新的配合物
D 把小的明矾晶体悬挂在40~50℃的饱和明矾溶液中,快速冷却,得到较大的明矾晶体 晶体颗粒大小与溶液冷却速度有关
A.A B.B C.C D.D
5.下列有关晶体的比较不正确的是
A.熔点: B.熔点:
C.熔点: D.硬度:金刚石>碳化硅>晶体硅
6.中国空间站建造成功、神舟系列飞船顺利往返,均展示了我国科技发展的巨大成就。下列相关叙述正确的是
A.空间站太阳翼伸展关键部件采用碳化硅材料,属于无机非金属材料
B.核心舱太阳能电池采用砷化镓()材料,属于金属材料
C.飞船火箭使用偏二甲肼作燃料,属于烃类
D.飞船返回舱使用氮化硅耐高温结构材料,属于分子晶体
7.通过如下实验进行浓硫酸性质的探究:
步骤I:取2g蔗糖放入大试管中,加入2~3滴水,向试管中再加入约3mL浓硫酸,迅速搅拌,然后塞紧带玻璃导管的橡皮塞,观察现象。
步骤II:将玻璃导管的另一端插入盛有品红溶液的试管中,观察现象
下列说法错误的是
A.步骤I中加入少量水的目的利用了浓硫酸遇水放热的性质
B.步骤II中品红溶液褪色体现了的漂白性
C.蔗糖变黑说明浓硫酸可使有机化合物碳化
D.上图是一种碳单质的晶胞结构,每个C原子周围最近的C原子为12个
8.我国用BeO、KBF4等原料制备KBe2BO3F2晶体,在世界上首次实现在177.3nm深紫外激光倍频输出,其晶胞如图所示,下列说法不正确的是
A.构成晶体的非金属元素的电负性由大到小的顺序为F>O>B
B.根据元素周期表中元素所处的位置可推测BeO与Al2O3性质相似
C.阴离子BF的中心原子没有满足8电子稳定结构
D.晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则1mol该晶胞含3molKBe2BO3F2
9.下列说法正确的是
A.H2O汽化成水蒸气、分解为H2 和O2,都需要破坏共价键
B.HBr和HI因为分子间作用力大小不同,因而热稳定性不同
C.SiO2 与CO2 都是酸性氧化物,化学性质类似,因此它们的结构类似
D.FeCl3 熔点较低,易升华,易溶于水和乙醇,由此可推测FeCl3 属于分子晶体
10.下列物质的熔沸点比较中,不正确的是
A.沸点:N2<CO B.沸点:CH4<H2S<H2O
C.熔点:Al<Mg<Na D.熔点:晶体硅<碳化硅<金刚石
11.下列叙述正确的有几项
①晶胞是晶体中最小的平行六面体
②外观呈现规则多面体的物质,内部微观粒子在三维空间一定呈周期性有序排列
③晶体具有各向异性,所以用红热的铁针刺涂有石蜡的水晶柱面,熔化的石蜡呈椭圆形
④分子晶体中共价键键能越大,熔点和沸点越高
⑤当单一波长的X射线通过晶体时,可以看到分立的斑点或明锐的衍射峰
⑥将饱和硫酸铜溶液降温,析出的固体不是晶体
⑦分子晶体中肯定没有离子键
⑧分子晶体中都存在共价键
A.3项 B.4项 C.5项 D.6项
12.下列物质中,化学式能真正表示该物质分子组成的是
A.KHCO3 B.S C.H3PO4 D.SiO2
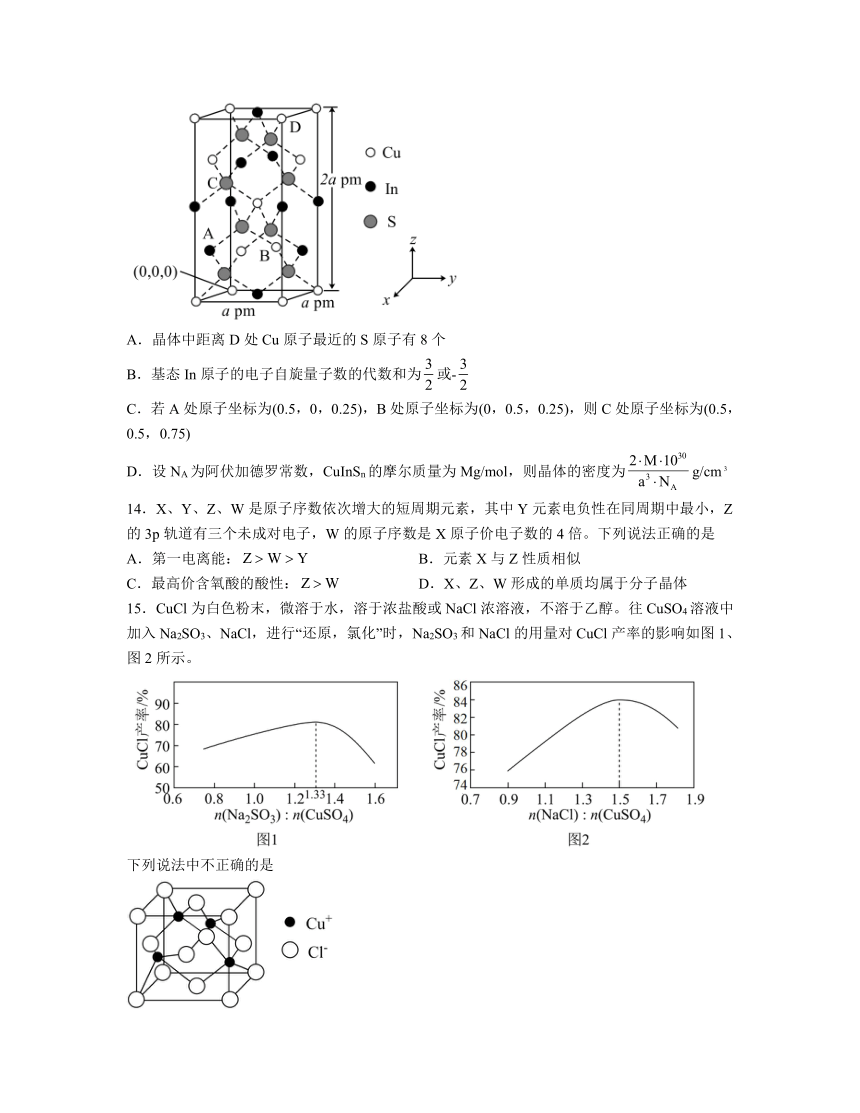
13.一种理想的荧光材料CuInSn的晶胞结构如图所示。已知:原子中电子有两种相反的自旋状态,一种用+表示,另一种用-表示。下列说法正确的是
A.晶体中距离D处Cu原子最近的S原子有8个
B.基态In原子的电子自旋量子数的代数和为或-
C.若A处原子坐标为(0.5,0,0.25),B处原子坐标为(0,0.5,0.25),则C处原子坐标为(0.5,0.5,0.75)
D.设NA为阿伏加德罗常数,CuInSn的摩尔质量为Mg/mol,则晶体的密度为g/cm
14.X、Y、Z、W是原子序数依次增大的短周期元素,其中Y元素电负性在同周期中最小,Z的3p轨道有三个未成对电子,W的原子序数是X原子价电子数的4倍。下列说法正确的是
A.第一电离能: B.元素X与Z性质相似
C.最高价含氧酸的酸性: D.X、Z、W形成的单质均属于分子晶体
15.CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。往CuSO4溶液中加入Na2SO3、NaCl,进行“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。
下列说法中不正确的是
A.反应的离子方程式为2Cu2+++2Cl-+H2O=2CuCl↓++2H+
B.为减少CuCl的溶解损耗,可用乙醇洗涤沉淀
C.NaCl的用量越多,c(Cl-)越大,CuCl的产率越大
D.CuCl的晶胞如上图所示,1个晶胞中含4个Cl-
二、填空题
16.(1)Zn的氯化物与氨水反应可形成配合物,1mol该配合物中含有σ键的数目为______。
(2)若与通过B原子与X原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是______。
(3)金属镍在电池、合金、催化剂等方面应用广泛。过渡金属配合物的中心原子价层电子数与配体提供电子总数之和为18,则n=______。
17.下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a
f y h i
b e j
c d [ d g l
[
(1)请写出h元素的价电子排布图_____________________;
(2)ya3分子的电子式是_______ ,其分子的空间构型是_______ ,分子中y原子的杂化轨道类型是_________, g2+可以与ya3以________键形成 [g (ya3)4]2+离子;
(3)请写出上述元素d3+的核外电子排布式____________________,实验室常用形成一种红色配离子的方法检验该离子,该反应的离子方程式为_______________________________________________。
(4)请比较b、e、j三种元素的第一电离能由大到小的顺序_____________(写元素符号),其原因是_____________________________________________
18.我国科学家合成了白光材料Ba2[Sn(OH)6][B(OH)4]2,[B(OH)4]-中B的价层电子对数为___________,[Sn(OH)6]2-中,Sn与O之间的化学键不可能是___________。
a.π键 b.σ键 c.配位键 d.极性键
19.金属钾、铜的部分结构和性质的数据如下表所示,请比较钾、铜金属键的强弱。_____
金属 K
原子外围电子排布
原子半径/pm 255 128
原子化热/() 90.0 339.3
熔点/℃ 63.4 1083
20.晶体和晶胞的关系:整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
(1)“无隙”是相邻晶胞之间_______。
(2)“并置”是所有晶胞都是_______排列的,取向_______。
(3)所有晶胞的_______及其内部的原子_______、_______及几何排列是完全相同的。
(4)一般来说,晶胞都是_______。
21.数十亿年来,地球上的物质不断地发生变化,大气的成分也发生了很大变化。下表是原始大气和目前空气的成分:
空气的成分 N2、O2、CO2、水蒸气及稀有气体He、Ne等
原始大气 的成分 CH4、NH3、CO、CO2等
用上表所涉及的分子填写下列空白。
(1)含有10个电子的化学式有(填化学式,下同)________。
(2)由极性键构成的非极性分子有________。
(3)与H+可直接形成配位键的分子有________。
(4)分子中不含孤电子对的分子(除稀有气体外)有_______,它的立体构型为______。
(5)CO的结构可表示为OC,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
22.N,P,As等元素的化合物在生产和研究中有许多重要用途。请回答下列问题:
(1)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为_______,N—N键的键角为____。
(2)基态砷原子的价电子排布图为_______,砷与同周期相邻元素的第一电离能由大到小的顺序为______。
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。与的结构相似,和过渡金属更容易形成配合物的是__________填PH4”或“”。
(4)SCl3+和是等电子体,的空间构型是_________。键键长____键键长填“”、“”或“”,原因是____________。
23.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ/mol):
I1 I2 I3 I4 …
496 4562 6912 9540 …
请回答:
(1)的电子式为_______,含有的化学键类型为_______,为_______晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为_______;的结构式为_______,分子空间结构为_______。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是_______(填名称);晶体ZW的熔点比晶体明显高的原因是_______。
24.在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
(1)液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式___________。
(2)实验室用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是___________ (填序号字母)。
A.酒精灯 B.长直玻璃导管 C.锥形瓶 D.直型冷凝管
E.尾接管(接液管) F.蒸馏烧瓶 G.滴定管
②除上述必需的仪器外,还缺少的主要玻璃仪器是___________。
(3)肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为___________g。
(4)磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3.某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1.黑色粉末是CuO;
假设2.黑色粉末是Fe3O4;
假设3.___________。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是___________。
②若所得溶液显血红色,则假设___________成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生___________现象,则假设3成立。有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)+4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生___________现象;若产生___________现象,则假设3成立。
【参考答案】
一、选择题
1.B
解析:A.乙醇与钠反应比水与钠反应缓和得多,则表明乙醇中的上的氢不如水分子中的上的氢活泼,A不正确;
B.的配合物内界为[TiCl(H2O)5]2+,[ ]以外的是外界,则内界和外界的数目之比是1∶2,B正确;
C.σ键是头对头重叠,π键是肩并肩重叠,头对头重叠的程度比肩并肩重叠的程度大,所以乙炔分子中π键重叠程度比σ键小,C不正确;
D.手性分子(带“ ”碳为手性碳)与足量的反应后,带“ ”手性碳结构不变,所以分子中仍有手性碳原子,D不正确;
故选B。
2.B
解析:A.氮化硼与磷化硼都是原子晶体,原子半径:N<P,则键长B-N键<B-P,B-N键的键能较B-P的键能大,所以BN晶体的熔点高于BP晶体,A错误;
B.B原子的价电子数为3,且杂化类型为杂化,其中与3个P原子形成3个共价键,另外一条杂化轨道无电子,为空轨道,与P原子形成配位键,磷化硼晶体中“普通共价键”与配位键的数目之比为3∶1,B正确;
C.由磷化硼晶胞结构可知,磷原子位于晶胞的顶点和面心,磷原子的堆积方式为面心立方最密堆积,则与磷原子距离最近且相等的磷原子有12个,且每个晶胞中磷原子个数为,硼原子位于小立方体内,因此一个晶胞中硼原子和磷原子的个数之比为1:1,因此磷化硼晶体中与硼原子距离最近且相等的硼原子个数为12,C错误;
D.纳米颗粒本身是分子,晶胞是晶体中最小重复单元,二者是完全不同的概念,大小不同,D错误;
故选B。
3.A
解析:A.氧化钠和氧化钙都能与酸反应生成盐和水,都属于碱性氧化物,故A正确;
B.不是只有过渡金属元素的原子或离子才能形成配合物,如六氟合铝酸钠是铝离子形成的配合物,铝元素是主族元素,故B错误;
C.氮元素的电负性大于磷元素,氨分子中成键电子对间的斥力大于磷化氢分子,键角大于磷化氢分子,故C错误;
D.水比硫化氢稳定是因为氧元素的非金属性强于硫元素,与水分子中含有氢键无关,故D错误;
故选A。
4.C
解析:A.可燃气体性质验证实验之前必须验纯,实验操作错误,不符题意;
B.饱和硫酸铵的加入使得蛋白质溶胶发生了聚沉,出现白色沉淀,加水稀释硫酸铵浓度后,胶体会重新分散形成小颗粒,沉淀会消失,结论错误,不符题意;
C.提高氯离子浓度,使溶液中出现反应平衡向正反应方向移动,溶液中呈绿色,描述正确,符合题意;
D.快速冷却,会形成比较多的细小结晶颗粒,不会出现大颗粒结晶,现象描述错误,不符题意;
综上,本题选C。
5.A
【分析】离子半径越小,离子所带电荷越多,离子晶体晶格能越大,熔点越高,硬度越大。
解析:A.离子半径Na+>Mg2+>Al3+,离子半径越小,离子所带电荷越多,离子晶体的晶格能越大导致熔点越高,所以熔点:NaFB.碱金属原子半径越大,价电子数越少,金属键越弱,熔点越低,离子半径,他们价电子数相同,故B正确;
C.四种物质都形成分子晶体,相对分子质量越大,熔点越高,则熔点由低到高为:CF4D.原子晶体中,共价键越短,共价键越强,硬度越大;碳原子半径小于硅原子,共价键长度:C-C碳化硅>晶体硅,故D正确。
故选A。
6.A
解析:A.属于无机非金属材料,A正确;
B.属于半导体材料,B错误;
C.烃只含碳和氢,不属于烃类,C错误;
D.氮化硅耐高温,属于共价晶体,D错误;
故选A。
7.D
解析:A.浓硫酸加水稀释会放出大量热量,步骤I中加入少量水的目的利用了浓硫酸遇水放热的性质,可为浓硫酸与蔗糖反应提供热量,A正确;
B.浓硫酸具有脱水性,碳和浓硫酸发生氧化还原反应生成二氧化碳和SO2气体,步骤II中品红溶液褪色体现了的漂白性,B正确;
C.浓硫酸具有脱水性,蔗糖变黑说明浓硫酸可使有机化合物碳化,C正确;
D.由晶胞可知每个C原子周围最近的C原子为4个,D错误;
故选:D。
8.C
解析:A.根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,则构成晶体的非金属元素的电负性由大到小的顺序为F>O>B,故A正确;
B.根据元素周期表中元素所处的位置,Be和Al处于对角线规则,则可推测BeO与Al2O3性质相似,故B正确;
C.阴离子BF的中心原子价层电子对数为,则中心原子满足8电子稳定结构,故C错误;
D.晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则每个晶胞中K+个数为,根据化学式得到1mol该晶胞含3molKBe2BO3F2,故D正确。
综上所述,答案为C。
9.D
解析:A.H2O汽化成水蒸气发生物理变化,破坏分子间作用力,A错误;
B.分子间作用力影响物理性质,热稳定性为化学性质,B错误;
C.CO2为平面结构,SiO2为空间网状结构,C错误;
D.分子晶体的熔点低,易升华,故FeCl3为分子晶体,D正确;
故答案为:D。
10.C
解析:A.相对分子质量相近的分子,极性越强,范德华力越强,熔沸点越高,CO是极性分子,N2是非极性分子,因此沸点:N2<CO,故A正确;
B.水存在分子间氢键,熔沸点高,H2S相对分子质量比CH4相对分子质量大,范德华力越大,熔沸点越高,因此沸点:CH4<H2S<H2O,故B正确;
C.原子半径Al<Mg<Na,半径越大,金属键越弱,金属熔沸点越低,因此熔点:Na<Mg<Al,故C错误;
D.原子半径C<Si,键长:C C<Si C<Si Si,键长越短,键能越大,熔沸点越高,因此熔点:晶体硅<碳化硅<金刚石,故D正确。
综上所述,答案为C。
11.A
解析:①晶胞一般是具有代表性的体积最小的平行六面体,故①错误;
②外观呈现规则多面体的物质,内部微观粒子在三维空间不一定呈周期性有序排列,比如玻璃外观呈现规则多面体,但内部没有周期性有序排列,故②错误;
③用红热的铁针刺涂有石蜡的水晶柱面,熔化的石蜡呈椭圆形,这是晶体具有各向异性表现出来的,故③正确;
④分子晶体的分子间作用力与熔点和沸点有关,而共价键与熔点和沸点无关,故④错误;
⑤X射线衍射仪可测定晶体结构,当单一波长的X射线通过晶体时,可产生衍射,从而可以看到分立的斑点或明锐的衍射峰,故⑤正确;
⑥将饱和硫酸铜溶液降温,析出的是五水硫酸铜晶体,故错误;
⑦分子晶体中肯定没有离子键,有离子键就是离子化合物,故⑦正确;
⑧分子晶体中不一定存在共价键,比如稀有气体的分子晶体,故⑧错误;
因此有3项正确,故A符合题意。
综上所述,答案为A。
12.C
解析:A. KHCO3离子晶体,只有钾离子和碳酸氢根根离子,没有分子, 故A错误;
B. S单质是由原子构成的,故化学式不能表示其分子组成,故B错误;
C. H3PO4是分子晶体,由H3PO4分子构成,化学式能真正表示该物质分子组成,故C正确;
D. SiO2为原子晶体,是由硅原子和氧原子以共价键构成的空间网状结构,没有SiO2分子,故D正确;
故选:C。
13.D
解析:A.晶体中距离D处Cu原子最近的S原子有4个,故A错误;
B.基态In原子的电子自旋量子数的代数和为或,故B错误;
C.x、y以apm为1个单位,z以2apm为1个单位,则C处原子坐标为,故C错误;
D.晶胞中Cu有8个位于顶点,4个位于面心,1个位于体内,则Cu的个数为4,In有4个位于棱上,6个位于面心,则In的个数为4,8个S位于晶胞内,则晶体的密度为g/cm,故D正确;
故选:D。
14.A
【分析】根据题意可判断X为C元素,Y为Na元素,Z为P元素,W为S元素。
解析:A.主族元素同周期从左向右第一电离能呈增大趋势,P的3p能级处于半满稳定状态,其第一电离能大于同周期相邻元素,则第一电离能:P>S>Na,A正确;
B.碳与磷的性质显然不具有相似性,B错误;
C.元素非金属性越强,其最高价含氧酸的酸性越强,因非金属性:S>P,所以最高价含氧酸的酸性:,C错误;
D.C元素形成的单质可能是共价晶体如金刚石,也可能是混合型晶体如石墨,S元素和P元素形成的单质是分子晶体,D错误;
故答案为:A。
15.C
解析:A.CuSO4溶液中加入Na2SO3、NaCl反应生成CuCl沉淀,铜元素化合价由+2降低为+1、S元素化合价由+4升高为+6,根据电子守恒、质量守恒,反应的离子方程式为2Cu2++SO+2Cl-+H2O=2CuCl↓+SO+2H+,故A正确;
B.CuCl为白色粉末,不溶于乙醇,用乙醇洗涤沉淀可以快速干燥,且减少CuCl的溶解损耗,故B正确;
C.根据图2可知,若n(NaCl):n(CuSO4)>1.5,随着c(Cl-)的增大,CuCl的产率减小,故C错误;
D.根据均摊原则,Cl-在晶胞含有的数目为,故D正确;
选C。
二、填空题
16. X 4
解析:(1)中与形成离子键,而1个中含有4个(配位键)和12个,共16个σ键,故1mol该配合物中含有16molσ键,即含有σ键的数目为,故答案为:;
(2)B原子的最外层有3个电子,中B原子最外层电子全部参与成键,不存在孤电子对,故提供孤电子对的是X,故答案为:X;
(3)Ni的价层电子排布式为,即的中心原子的价层电子数为10,则配体提供的电子总数为8。CO分子中,C的电负性较小,作为配体时一般是由碳原子提供孤电子对,CO中碳原子的孤电子对数为,则每个CO与体配位可提供1对孤电子对,故,故答案为:4。
17. 三角锥形 sp3杂化 配位 ls22s22p63s23p63d5 Fe3+ + 3SCN-Fe(SCN)3(合理均给分) Cl>Mg>Al 同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势。但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素
【分析】由元素在周期表中的位置可知,a为H,b为Mg,c为K,e为Al,h为O,i为F,f为C,d为Fe元素,j为Cl,g为Zn,
(1)H为O,其原子序数为8;
(2)y为N,a为H,则ya3分子为NH3,由最外层电子等来分析结构,氨气中的N原子能单方提供孤对电子形成配位键;
(3)d为Fe,原子序数为26,利用KSCN溶液检验铁离子;
(4)Mg、Al均在第三周期,同周期从左向右金属性减弱,金属性越强,第一电离能越小,但镁原子最外层为全满;
解析:由元素在周期表中的位置可知,a为H,b为Mg,c为K,e为Al,h为O,i为F,f为C,d为Fe元素,j为Cl,g为Zn,
(1)H为O,其原子序数为8,其价电子为2s22p4,则价电子排布图为 ;
综上所述,本题正确答案为: ;
(2)y为N,a为H,则ya3分子为NH3,其电子式为,为三角锥形,σ键数为3,孤对电子数为1,则N原子为杂化sp3,氨气中的N原子能单方提供孤对电子,与锌离子提供的空轨道形成配位键;
综上所述,本题正确答案为: ;三角锥形;sp3杂化;配位;
(3)d为Fe,原子序数为26,则d3+的核外电子排布式为ls22s22p63s23p63d5,利用KSCN溶液检验铁离子,离子反应为Fe3++3SCN-=Fe(SCN)3,
综上所述,本题正确答案为:ls22s22p63s23p63d5;Fe3+ + 3SCN- = Fe(SCN)3;
(4)Cl、Mg、Al位于同一周期,因同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势.但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素,第一电离能由大到小的顺序为Cl>Mg>Al;
综上所述,本题正确答案为:Cl>Mg>Al;同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势.但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素。
18.a
解析:[B(OH)4]-中B的价层电子对数为,[Sn(OH)6]2-中,Sn4+与氢氧根离子之间形成配位键,配位键是一种特殊的共价键,则Sn与O之间的化学键属于键或极性键的,不可能是π键。
19.由图表可知,铜的原子半径更小、价电子数更多,熔点更高,故铜的金属键强于钾
【分析】金属晶体是金属原子通过金属键形成的,金属键的强弱直接影响佥属晶体的熔点。原子半径越小,价电子数越多,则金属键强度越强,导致金属晶体的熔沸点升高;
解析:由图表可知,铜的原子半径更小、价电子数更多,熔点更高,故铜的金属键强于钾。
20.(1)没有任何间隙
(2) 平行 相同
(3) 形状 种类 个数
(4)平行六面体
解析:(1)晶体中晶胞之间是紧密排列的,“无隙”是相邻晶胞之间没有任何间隙;
(2)晶胞在形成晶体时,各个晶胞都是平行排列的,并且去向也是相同的;
(3)同一种晶体的各个晶胞都是一样的,在这些晶胞中所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的;
(4)晶胞是晶体中最小的重复结构单元,并且并且一般来说,晶胞都是平行六面体,并且比较容易确立晶胞当中的原子坐标。
21. H2O、Ne、CH4、NH3 CH4、CO2 NH3、H2O CH4 正四面体形 N2 不相同 配位键
解析:(1)10e-分子可以用氖(Ne)作为标准,依次找出与氖同周期的元素与氢形成的化合物,有HF、H2O、NH3、CH4,题干要求用表中分子填空,不应填写HF。
(2)由极性键构成的非极性分子应是含有极性键且分子有对称结构的,应是CH4和CO2。
(3)H+有空轨道,与它形成配位键的分子应有孤电子对,据知,NH3和H2O可以和H+以配位键结合分别形成NH和H3O+。
(4)甲烷电子式为,不存在孤电子对,且中心碳原子采用sp3杂化,故其立体构型为正四面体形。
(5)根据信息OC知,C和O之间存在三个共价键,氮气中两个原子间也是三个共价键,与CO结构相似。但C和O电负性不同,共价键是极性键,而N2中两个氮原子形成的键是非极性键,OC中“→”表示氧原子单方提供电子对,是配位键。
22. sp3 60° As>Se>Ge PH3 三角锥形 < S 原子半径小于P原子半径,故 S-Cl 键要比 P-Cl 键短
【分析】(1)N4分子的空间构型与P4类似,4个N原子形成正四面体构型,每个N原子形成3个N-N键,还含有1对孤对电子;
(2)As元素处于第四周期VA族,价电子排布式为4s24p3,结合泡利原理、洪特规则画出价电子排布图;As原子4p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
(3)元素的电负性越小,对孤电子对吸引越弱,越容易形成配位键;
(4)PCl3中P原子形成3个P-Cl键,含有1对孤对电子,其空间结构三角锥形,而等电子体的结构相似;原子半径越小,原子之间形成的共价键越短。
解析:(1)N4分子的空间构型与P4类似,4个N原子形成正四面体构型,每个N原子形成3个N-N键,还含有1对孤对电子,杂化轨道数目为4,故N原子采取sp3杂化,每个面均为正三角形,故N-N键的键角为60°;
(2)As元素处于第四周期VA族,价电子排布式为4s24p3,价电子排布图为:,As原子4p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:As>Se>Ge;
(3)P元素的电负性比N元素的小,P原子对孤电子对吸引更弱,容易给出孤对电子形成配位键;
(4)PCl3中P原子形成3个P-Cl键,含有1对孤对电子,其空间结构三角锥形,而等电子体的结构相似,SCl3+的空间构型是三角锥形, S 原子半径小于P原子半径,故 S-Cl 键要比 P-Cl 键短。
23.(1) 离子键、非极性键 离子
(2) 碳酸钠 O=C=O 直线形
(3) 金刚石 为离子晶体而为分子晶体
解析:①X元素原子价电子排布式为,且原子半径是同族元素中最小的,则X为C元素;
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子,则Y为O元素,W为Cl元素;
③根据Z元素的电离能数据可知,Z电离能I2远大于I1;
(1)由题意知X、Y、Z、W分别为C、O、、。
的电子式为,含有离子键、非极性键,为离子晶体,故答案为:;离子键、非极性键;离子;
(2)C、O、三种元素所形成的常见化合物为碳酸钠;的结构式为O=C=O,是直线形分子,故答案为:碳酸钠;O=C=O;直线形;
(3)C、O、、四种元素所形成的单质中,共价晶体金刚石熔点最高,硬度最大;由于为离子晶体,而为分子晶体,故晶体的熔点比晶体的熔点明显高,故答案为:金刚石;为离子晶体而为分子晶体。
24.(1)N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)ΔH1=-64a kJ·mol-1
(2) BG 温度计
(3)8
(4) 黑色粉末是CuO和Fe3O4的混合物 溶液显蓝色 “2或3” 红色固体 红褐色沉淀 红褐色沉淀,同时溶液呈深蓝色
解析:(1)肼和四氧化二氮的反应的化学方程式:2N2H4+N2O4=3N2+4H2O,64g肼参加此反应放出的热量为64akJ,所以热化学反应方程式:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH1=-64a kJ·mol-1 ;
(2)①蒸馏过程中需要的仪器有:带铁圈的铁架台、蒸馏烧瓶、酒精灯、石棉网、温度计、直型冷凝管、牛角管、锥形瓶等仪器 ,所以不需要的仪器是:BG;
②根据①的分析缺少温度计;
(3)发生的化学反应方程式:N2H4+6Fe2O3=N2+4Fe3O4+2H2O,生成1molFe3O4消耗肼8g,还可以采用得失电子数目守恒1×3×(3-)=x×2×2,解得:x=mol,则消耗肼8g;
(4)根据提出的假设,假设3是两者的混合物;
①假设1:黑色物质的氧化铜,跟酸反应生成Cu2+,不与KSCN反应,溶液呈现二价铜离子的颜色蓝色,实验现象是溶液显蓝色;
②溶液显血红色说明含有含有Fe3+,假设2或3中都含有Fe3+,所以假设2或3成立;
③铁单质先和Fe3+反应生成Fe2+,然后再和Cu2+反应,生成铜单质,金属铜是红色物质,因此产生红色物质,则假设3成立;
④假设2是Fe3O4,与酸反应生成Fe2+、Fe3+,加入氨水生成Fe(OH)2、Fe(OH)3,最终生成Fe(OH)3红褐色沉淀;假设3是两者的混合物有红褐色沉淀生成,氧化铜与酸反应生成Cu2+,当加入过量氨水生成深蓝色溶液,证明假设3成立
一、选择题
1.下列说法正确的是
A.乙醇中的上的氢比水分子中的上的氢活泼
B.的配合物内界和外界的数目之比是1∶2
C.乙炔分子中π键重叠程度比σ键大
D.手性分子与足量的反应后分子中没有手性碳原子
2.我国科学家研究出一种磷化硼纳米颗粒作为高选择性 CO2 电化学还原为甲醇的非金属电催化剂,磷化硼晶胞结构如图所示。下列说法正确的是
A.若氮化硼与磷化硼具有相似的结构,则 BN 的熔点比 BP 低
B.磷化硼晶体中“普通共价键”与配位键的数目之比为 3:1
C.磷化硼晶体中,每个磷原子周围紧邻且距离相等的硼原子共有 2 个
D.磷化硼纳米颗粒的大小与磷化硼晶胞大小相似
3.下列有关元素及其化合物性质的说法正确的是
A.、与酸反应只生成盐和水,均属于碱性氧化物
B.只有过渡金属元素的原子或离子才能形成配合物
C.N的电负性比P大,可推断的键角比小
D.比稳定是因为中含有分子间氢键
4.下列实验操作、现象和所得的结论均正确的是
选项 实验操作与现象 结论
A 向无水乙醇中加入绿豆大的金属钠,直接收集反应中产生的气体,用燃着的火柴靠近气体,气体燃烧 乙醇与Na反应生成了氢气
B 向2mL鸡蛋清溶液中逐滴加入饱和硫酸铵溶液并振荡,溶液中不断有白色沉淀析出,该沉淀加水重新溶解 饱和硫酸铵溶液可以降低蛋白质在水中的溶解度
C 向稀的氯化铜溶液中加入适量氯化钠固体,溶液由蓝色变绿色 水合铜离子和氯离子形成了新的配合物
D 把小的明矾晶体悬挂在40~50℃的饱和明矾溶液中,快速冷却,得到较大的明矾晶体 晶体颗粒大小与溶液冷却速度有关
A.A B.B C.C D.D
5.下列有关晶体的比较不正确的是
A.熔点: B.熔点:
C.熔点: D.硬度:金刚石>碳化硅>晶体硅
6.中国空间站建造成功、神舟系列飞船顺利往返,均展示了我国科技发展的巨大成就。下列相关叙述正确的是
A.空间站太阳翼伸展关键部件采用碳化硅材料,属于无机非金属材料
B.核心舱太阳能电池采用砷化镓()材料,属于金属材料
C.飞船火箭使用偏二甲肼作燃料,属于烃类
D.飞船返回舱使用氮化硅耐高温结构材料,属于分子晶体
7.通过如下实验进行浓硫酸性质的探究:
步骤I:取2g蔗糖放入大试管中,加入2~3滴水,向试管中再加入约3mL浓硫酸,迅速搅拌,然后塞紧带玻璃导管的橡皮塞,观察现象。
步骤II:将玻璃导管的另一端插入盛有品红溶液的试管中,观察现象
下列说法错误的是
A.步骤I中加入少量水的目的利用了浓硫酸遇水放热的性质
B.步骤II中品红溶液褪色体现了的漂白性
C.蔗糖变黑说明浓硫酸可使有机化合物碳化
D.上图是一种碳单质的晶胞结构,每个C原子周围最近的C原子为12个
8.我国用BeO、KBF4等原料制备KBe2BO3F2晶体,在世界上首次实现在177.3nm深紫外激光倍频输出,其晶胞如图所示,下列说法不正确的是
A.构成晶体的非金属元素的电负性由大到小的顺序为F>O>B
B.根据元素周期表中元素所处的位置可推测BeO与Al2O3性质相似
C.阴离子BF的中心原子没有满足8电子稳定结构
D.晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则1mol该晶胞含3molKBe2BO3F2
9.下列说法正确的是
A.H2O汽化成水蒸气、分解为H2 和O2,都需要破坏共价键
B.HBr和HI因为分子间作用力大小不同,因而热稳定性不同
C.SiO2 与CO2 都是酸性氧化物,化学性质类似,因此它们的结构类似
D.FeCl3 熔点较低,易升华,易溶于水和乙醇,由此可推测FeCl3 属于分子晶体
10.下列物质的熔沸点比较中,不正确的是
A.沸点:N2<CO B.沸点:CH4<H2S<H2O
C.熔点:Al<Mg<Na D.熔点:晶体硅<碳化硅<金刚石
11.下列叙述正确的有几项
①晶胞是晶体中最小的平行六面体
②外观呈现规则多面体的物质,内部微观粒子在三维空间一定呈周期性有序排列
③晶体具有各向异性,所以用红热的铁针刺涂有石蜡的水晶柱面,熔化的石蜡呈椭圆形
④分子晶体中共价键键能越大,熔点和沸点越高
⑤当单一波长的X射线通过晶体时,可以看到分立的斑点或明锐的衍射峰
⑥将饱和硫酸铜溶液降温,析出的固体不是晶体
⑦分子晶体中肯定没有离子键
⑧分子晶体中都存在共价键
A.3项 B.4项 C.5项 D.6项
12.下列物质中,化学式能真正表示该物质分子组成的是
A.KHCO3 B.S C.H3PO4 D.SiO2
13.一种理想的荧光材料CuInSn的晶胞结构如图所示。已知:原子中电子有两种相反的自旋状态,一种用+表示,另一种用-表示。下列说法正确的是
A.晶体中距离D处Cu原子最近的S原子有8个
B.基态In原子的电子自旋量子数的代数和为或-
C.若A处原子坐标为(0.5,0,0.25),B处原子坐标为(0,0.5,0.25),则C处原子坐标为(0.5,0.5,0.75)
D.设NA为阿伏加德罗常数,CuInSn的摩尔质量为Mg/mol,则晶体的密度为g/cm
14.X、Y、Z、W是原子序数依次增大的短周期元素,其中Y元素电负性在同周期中最小,Z的3p轨道有三个未成对电子,W的原子序数是X原子价电子数的4倍。下列说法正确的是
A.第一电离能: B.元素X与Z性质相似
C.最高价含氧酸的酸性: D.X、Z、W形成的单质均属于分子晶体
15.CuCl为白色粉末,微溶于水,溶于浓盐酸或NaCl浓溶液,不溶于乙醇。往CuSO4溶液中加入Na2SO3、NaCl,进行“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图1、图2所示。
下列说法中不正确的是
A.反应的离子方程式为2Cu2+++2Cl-+H2O=2CuCl↓++2H+
B.为减少CuCl的溶解损耗,可用乙醇洗涤沉淀
C.NaCl的用量越多,c(Cl-)越大,CuCl的产率越大
D.CuCl的晶胞如上图所示,1个晶胞中含4个Cl-
二、填空题
16.(1)Zn的氯化物与氨水反应可形成配合物,1mol该配合物中含有σ键的数目为______。
(2)若与通过B原子与X原子间的配位键结合形成配合物,则该配合物提供孤电子对的原子是______。
(3)金属镍在电池、合金、催化剂等方面应用广泛。过渡金属配合物的中心原子价层电子数与配体提供电子总数之和为18,则n=______。
17.下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
a
f y h i
b e j
c d [ d g l
[
(1)请写出h元素的价电子排布图_____________________;
(2)ya3分子的电子式是_______ ,其分子的空间构型是_______ ,分子中y原子的杂化轨道类型是_________, g2+可以与ya3以________键形成 [g (ya3)4]2+离子;
(3)请写出上述元素d3+的核外电子排布式____________________,实验室常用形成一种红色配离子的方法检验该离子,该反应的离子方程式为_______________________________________________。
(4)请比较b、e、j三种元素的第一电离能由大到小的顺序_____________(写元素符号),其原因是_____________________________________________
18.我国科学家合成了白光材料Ba2[Sn(OH)6][B(OH)4]2,[B(OH)4]-中B的价层电子对数为___________,[Sn(OH)6]2-中,Sn与O之间的化学键不可能是___________。
a.π键 b.σ键 c.配位键 d.极性键
19.金属钾、铜的部分结构和性质的数据如下表所示,请比较钾、铜金属键的强弱。_____
金属 K
原子外围电子排布
原子半径/pm 255 128
原子化热/() 90.0 339.3
熔点/℃ 63.4 1083
20.晶体和晶胞的关系:整块晶体可以看作是数量巨大的晶胞“无隙并置”而成。
(1)“无隙”是相邻晶胞之间_______。
(2)“并置”是所有晶胞都是_______排列的,取向_______。
(3)所有晶胞的_______及其内部的原子_______、_______及几何排列是完全相同的。
(4)一般来说,晶胞都是_______。
21.数十亿年来,地球上的物质不断地发生变化,大气的成分也发生了很大变化。下表是原始大气和目前空气的成分:
空气的成分 N2、O2、CO2、水蒸气及稀有气体He、Ne等
原始大气 的成分 CH4、NH3、CO、CO2等
用上表所涉及的分子填写下列空白。
(1)含有10个电子的化学式有(填化学式,下同)________。
(2)由极性键构成的非极性分子有________。
(3)与H+可直接形成配位键的分子有________。
(4)分子中不含孤电子对的分子(除稀有气体外)有_______,它的立体构型为______。
(5)CO的结构可表示为OC,与CO结构最相似的分子是________,这两种结构相似的分子中,分子的极性________(填“相同”或“不相同”),CO分子中有一个键的形成与另外两个键不同,它叫________。
22.N,P,As等元素的化合物在生产和研究中有许多重要用途。请回答下列问题:
(1)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4分子,该分子的空间构型与P4类似,其中氮原子的轨道杂化方式为_______,N—N键的键角为____。
(2)基态砷原子的价电子排布图为_______,砷与同周期相邻元素的第一电离能由大到小的顺序为______。
(3)配位原子对孤对电子的吸引力越弱,配体越容易与过渡金属形成配合物。与的结构相似,和过渡金属更容易形成配合物的是__________填PH4”或“”。
(4)SCl3+和是等电子体,的空间构型是_________。键键长____键键长填“”、“”或“”,原因是____________。
23.X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子。
③Z元素的电离能数据见下表(kJ/mol):
I1 I2 I3 I4 …
496 4562 6912 9540 …
请回答:
(1)的电子式为_______,含有的化学键类型为_______,为_______晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为_______;的结构式为_______,分子空间结构为_______。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是_______(填名称);晶体ZW的熔点比晶体明显高的原因是_______。
24.在航天发射时,肼(N2H4)及其衍生物常用作火箭推进剂。
(1)液态肼作火箭燃料时,与液态N2O4混合发生氧化还原反应,已知每1g肼充分反应后生成气态水放出热量为a KJ,试写出该反应的热化学方程式___________。
(2)实验室用N2H4·H2O与NaOH颗粒一起蒸馏,收集114~116℃的馏分即为无水肼。
①在蒸馏过程中不需要的仪器是___________ (填序号字母)。
A.酒精灯 B.长直玻璃导管 C.锥形瓶 D.直型冷凝管
E.尾接管(接液管) F.蒸馏烧瓶 G.滴定管
②除上述必需的仪器外,还缺少的主要玻璃仪器是___________。
(3)肼能使锅炉内壁的铁锈变成较为致密的磁性氧化铁(Fe3O4)层,以减缓锅炉锈蚀。若反应过程中肼转化为氮气,则每生成1molFe3O4,需要消耗肼的质量为___________g。
(4)磁性氧化铁(Fe3O4)的组成可写成FeO·Fe2O3.某化学实验小组通过实验来探究一黑色粉末是否由Fe3O4、CuO组成(不含有其它黑色物质)。探究过程如下:
提出假设:假设1.黑色粉末是CuO;
假设2.黑色粉末是Fe3O4;
假设3.___________。
探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是___________。
②若所得溶液显血红色,则假设___________成立。
③为进一步探究,继续向所得溶液加入足量铁粉,若产生___________现象,则假设3成立。有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)+4H2O。
④为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生___________现象;若产生___________现象,则假设3成立。
【参考答案】
一、选择题
1.B
解析:A.乙醇与钠反应比水与钠反应缓和得多,则表明乙醇中的上的氢不如水分子中的上的氢活泼,A不正确;
B.的配合物内界为[TiCl(H2O)5]2+,[ ]以外的是外界,则内界和外界的数目之比是1∶2,B正确;
C.σ键是头对头重叠,π键是肩并肩重叠,头对头重叠的程度比肩并肩重叠的程度大,所以乙炔分子中π键重叠程度比σ键小,C不正确;
D.手性分子(带“ ”碳为手性碳)与足量的反应后,带“ ”手性碳结构不变,所以分子中仍有手性碳原子,D不正确;
故选B。
2.B
解析:A.氮化硼与磷化硼都是原子晶体,原子半径:N<P,则键长B-N键<B-P,B-N键的键能较B-P的键能大,所以BN晶体的熔点高于BP晶体,A错误;
B.B原子的价电子数为3,且杂化类型为杂化,其中与3个P原子形成3个共价键,另外一条杂化轨道无电子,为空轨道,与P原子形成配位键,磷化硼晶体中“普通共价键”与配位键的数目之比为3∶1,B正确;
C.由磷化硼晶胞结构可知,磷原子位于晶胞的顶点和面心,磷原子的堆积方式为面心立方最密堆积,则与磷原子距离最近且相等的磷原子有12个,且每个晶胞中磷原子个数为,硼原子位于小立方体内,因此一个晶胞中硼原子和磷原子的个数之比为1:1,因此磷化硼晶体中与硼原子距离最近且相等的硼原子个数为12,C错误;
D.纳米颗粒本身是分子,晶胞是晶体中最小重复单元,二者是完全不同的概念,大小不同,D错误;
故选B。
3.A
解析:A.氧化钠和氧化钙都能与酸反应生成盐和水,都属于碱性氧化物,故A正确;
B.不是只有过渡金属元素的原子或离子才能形成配合物,如六氟合铝酸钠是铝离子形成的配合物,铝元素是主族元素,故B错误;
C.氮元素的电负性大于磷元素,氨分子中成键电子对间的斥力大于磷化氢分子,键角大于磷化氢分子,故C错误;
D.水比硫化氢稳定是因为氧元素的非金属性强于硫元素,与水分子中含有氢键无关,故D错误;
故选A。
4.C
解析:A.可燃气体性质验证实验之前必须验纯,实验操作错误,不符题意;
B.饱和硫酸铵的加入使得蛋白质溶胶发生了聚沉,出现白色沉淀,加水稀释硫酸铵浓度后,胶体会重新分散形成小颗粒,沉淀会消失,结论错误,不符题意;
C.提高氯离子浓度,使溶液中出现反应平衡向正反应方向移动,溶液中呈绿色,描述正确,符合题意;
D.快速冷却,会形成比较多的细小结晶颗粒,不会出现大颗粒结晶,现象描述错误,不符题意;
综上,本题选C。
5.A
【分析】离子半径越小,离子所带电荷越多,离子晶体晶格能越大,熔点越高,硬度越大。
解析:A.离子半径Na+>Mg2+>Al3+,离子半径越小,离子所带电荷越多,离子晶体的晶格能越大导致熔点越高,所以熔点:NaF
C.四种物质都形成分子晶体,相对分子质量越大,熔点越高,则熔点由低到高为:CF4
故选A。
6.A
解析:A.属于无机非金属材料,A正确;
B.属于半导体材料,B错误;
C.烃只含碳和氢,不属于烃类,C错误;
D.氮化硅耐高温,属于共价晶体,D错误;
故选A。
7.D
解析:A.浓硫酸加水稀释会放出大量热量,步骤I中加入少量水的目的利用了浓硫酸遇水放热的性质,可为浓硫酸与蔗糖反应提供热量,A正确;
B.浓硫酸具有脱水性,碳和浓硫酸发生氧化还原反应生成二氧化碳和SO2气体,步骤II中品红溶液褪色体现了的漂白性,B正确;
C.浓硫酸具有脱水性,蔗糖变黑说明浓硫酸可使有机化合物碳化,C正确;
D.由晶胞可知每个C原子周围最近的C原子为4个,D错误;
故选:D。
8.C
解析:A.根据同周期从左到右电负性逐渐增大,同主族从上到下电负性逐渐减小,则构成晶体的非金属元素的电负性由大到小的顺序为F>O>B,故A正确;
B.根据元素周期表中元素所处的位置,Be和Al处于对角线规则,则可推测BeO与Al2O3性质相似,故B正确;
C.阴离子BF的中心原子价层电子对数为,则中心原子满足8电子稳定结构,故C错误;
D.晶胞中的K+有2个位于晶胞内部,8个位于晶胞顶点,则每个晶胞中K+个数为,根据化学式得到1mol该晶胞含3molKBe2BO3F2,故D正确。
综上所述,答案为C。
9.D
解析:A.H2O汽化成水蒸气发生物理变化,破坏分子间作用力,A错误;
B.分子间作用力影响物理性质,热稳定性为化学性质,B错误;
C.CO2为平面结构,SiO2为空间网状结构,C错误;
D.分子晶体的熔点低,易升华,故FeCl3为分子晶体,D正确;
故答案为:D。
10.C
解析:A.相对分子质量相近的分子,极性越强,范德华力越强,熔沸点越高,CO是极性分子,N2是非极性分子,因此沸点:N2<CO,故A正确;
B.水存在分子间氢键,熔沸点高,H2S相对分子质量比CH4相对分子质量大,范德华力越大,熔沸点越高,因此沸点:CH4<H2S<H2O,故B正确;
C.原子半径Al<Mg<Na,半径越大,金属键越弱,金属熔沸点越低,因此熔点:Na<Mg<Al,故C错误;
D.原子半径C<Si,键长:C C<Si C<Si Si,键长越短,键能越大,熔沸点越高,因此熔点:晶体硅<碳化硅<金刚石,故D正确。
综上所述,答案为C。
11.A
解析:①晶胞一般是具有代表性的体积最小的平行六面体,故①错误;
②外观呈现规则多面体的物质,内部微观粒子在三维空间不一定呈周期性有序排列,比如玻璃外观呈现规则多面体,但内部没有周期性有序排列,故②错误;
③用红热的铁针刺涂有石蜡的水晶柱面,熔化的石蜡呈椭圆形,这是晶体具有各向异性表现出来的,故③正确;
④分子晶体的分子间作用力与熔点和沸点有关,而共价键与熔点和沸点无关,故④错误;
⑤X射线衍射仪可测定晶体结构,当单一波长的X射线通过晶体时,可产生衍射,从而可以看到分立的斑点或明锐的衍射峰,故⑤正确;
⑥将饱和硫酸铜溶液降温,析出的是五水硫酸铜晶体,故错误;
⑦分子晶体中肯定没有离子键,有离子键就是离子化合物,故⑦正确;
⑧分子晶体中不一定存在共价键,比如稀有气体的分子晶体,故⑧错误;
因此有3项正确,故A符合题意。
综上所述,答案为A。
12.C
解析:A. KHCO3离子晶体,只有钾离子和碳酸氢根根离子,没有分子, 故A错误;
B. S单质是由原子构成的,故化学式不能表示其分子组成,故B错误;
C. H3PO4是分子晶体,由H3PO4分子构成,化学式能真正表示该物质分子组成,故C正确;
D. SiO2为原子晶体,是由硅原子和氧原子以共价键构成的空间网状结构,没有SiO2分子,故D正确;
故选:C。
13.D
解析:A.晶体中距离D处Cu原子最近的S原子有4个,故A错误;
B.基态In原子的电子自旋量子数的代数和为或,故B错误;
C.x、y以apm为1个单位,z以2apm为1个单位,则C处原子坐标为,故C错误;
D.晶胞中Cu有8个位于顶点,4个位于面心,1个位于体内,则Cu的个数为4,In有4个位于棱上,6个位于面心,则In的个数为4,8个S位于晶胞内,则晶体的密度为g/cm,故D正确;
故选:D。
14.A
【分析】根据题意可判断X为C元素,Y为Na元素,Z为P元素,W为S元素。
解析:A.主族元素同周期从左向右第一电离能呈增大趋势,P的3p能级处于半满稳定状态,其第一电离能大于同周期相邻元素,则第一电离能:P>S>Na,A正确;
B.碳与磷的性质显然不具有相似性,B错误;
C.元素非金属性越强,其最高价含氧酸的酸性越强,因非金属性:S>P,所以最高价含氧酸的酸性:,C错误;
D.C元素形成的单质可能是共价晶体如金刚石,也可能是混合型晶体如石墨,S元素和P元素形成的单质是分子晶体,D错误;
故答案为:A。
15.C
解析:A.CuSO4溶液中加入Na2SO3、NaCl反应生成CuCl沉淀,铜元素化合价由+2降低为+1、S元素化合价由+4升高为+6,根据电子守恒、质量守恒,反应的离子方程式为2Cu2++SO+2Cl-+H2O=2CuCl↓+SO+2H+,故A正确;
B.CuCl为白色粉末,不溶于乙醇,用乙醇洗涤沉淀可以快速干燥,且减少CuCl的溶解损耗,故B正确;
C.根据图2可知,若n(NaCl):n(CuSO4)>1.5,随着c(Cl-)的增大,CuCl的产率减小,故C错误;
D.根据均摊原则,Cl-在晶胞含有的数目为,故D正确;
选C。
二、填空题
16. X 4
解析:(1)中与形成离子键,而1个中含有4个(配位键)和12个,共16个σ键,故1mol该配合物中含有16molσ键,即含有σ键的数目为,故答案为:;
(2)B原子的最外层有3个电子,中B原子最外层电子全部参与成键,不存在孤电子对,故提供孤电子对的是X,故答案为:X;
(3)Ni的价层电子排布式为,即的中心原子的价层电子数为10,则配体提供的电子总数为8。CO分子中,C的电负性较小,作为配体时一般是由碳原子提供孤电子对,CO中碳原子的孤电子对数为,则每个CO与体配位可提供1对孤电子对,故,故答案为:4。
17. 三角锥形 sp3杂化 配位 ls22s22p63s23p63d5 Fe3+ + 3SCN-Fe(SCN)3(合理均给分) Cl>Mg>Al 同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势。但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素
【分析】由元素在周期表中的位置可知,a为H,b为Mg,c为K,e为Al,h为O,i为F,f为C,d为Fe元素,j为Cl,g为Zn,
(1)H为O,其原子序数为8;
(2)y为N,a为H,则ya3分子为NH3,由最外层电子等来分析结构,氨气中的N原子能单方提供孤对电子形成配位键;
(3)d为Fe,原子序数为26,利用KSCN溶液检验铁离子;
(4)Mg、Al均在第三周期,同周期从左向右金属性减弱,金属性越强,第一电离能越小,但镁原子最外层为全满;
解析:由元素在周期表中的位置可知,a为H,b为Mg,c为K,e为Al,h为O,i为F,f为C,d为Fe元素,j为Cl,g为Zn,
(1)H为O,其原子序数为8,其价电子为2s22p4,则价电子排布图为 ;
综上所述,本题正确答案为: ;
(2)y为N,a为H,则ya3分子为NH3,其电子式为,为三角锥形,σ键数为3,孤对电子数为1,则N原子为杂化sp3,氨气中的N原子能单方提供孤对电子,与锌离子提供的空轨道形成配位键;
综上所述,本题正确答案为: ;三角锥形;sp3杂化;配位;
(3)d为Fe,原子序数为26,则d3+的核外电子排布式为ls22s22p63s23p63d5,利用KSCN溶液检验铁离子,离子反应为Fe3++3SCN-=Fe(SCN)3,
综上所述,本题正确答案为:ls22s22p63s23p63d5;Fe3+ + 3SCN- = Fe(SCN)3;
(4)Cl、Mg、Al位于同一周期,因同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势.但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素,第一电离能由大到小的顺序为Cl>Mg>Al;
综上所述,本题正确答案为:Cl>Mg>Al;同一周期,随着原子序数的增加,元素的第一电离能呈现增大的趋势.但镁元素的最外层电子达到全充满的稳定结构,其第一电离能大于铝元素。
18.a
解析:[B(OH)4]-中B的价层电子对数为,[Sn(OH)6]2-中,Sn4+与氢氧根离子之间形成配位键,配位键是一种特殊的共价键,则Sn与O之间的化学键属于键或极性键的,不可能是π键。
19.由图表可知,铜的原子半径更小、价电子数更多,熔点更高,故铜的金属键强于钾
【分析】金属晶体是金属原子通过金属键形成的,金属键的强弱直接影响佥属晶体的熔点。原子半径越小,价电子数越多,则金属键强度越强,导致金属晶体的熔沸点升高;
解析:由图表可知,铜的原子半径更小、价电子数更多,熔点更高,故铜的金属键强于钾。
20.(1)没有任何间隙
(2) 平行 相同
(3) 形状 种类 个数
(4)平行六面体
解析:(1)晶体中晶胞之间是紧密排列的,“无隙”是相邻晶胞之间没有任何间隙;
(2)晶胞在形成晶体时,各个晶胞都是平行排列的,并且去向也是相同的;
(3)同一种晶体的各个晶胞都是一样的,在这些晶胞中所有晶胞的形状及其内部的原子种类、个数及几何排列是完全相同的;
(4)晶胞是晶体中最小的重复结构单元,并且并且一般来说,晶胞都是平行六面体,并且比较容易确立晶胞当中的原子坐标。
21. H2O、Ne、CH4、NH3 CH4、CO2 NH3、H2O CH4 正四面体形 N2 不相同 配位键
解析:(1)10e-分子可以用氖(Ne)作为标准,依次找出与氖同周期的元素与氢形成的化合物,有HF、H2O、NH3、CH4,题干要求用表中分子填空,不应填写HF。
(2)由极性键构成的非极性分子应是含有极性键且分子有对称结构的,应是CH4和CO2。
(3)H+有空轨道,与它形成配位键的分子应有孤电子对,据知,NH3和H2O可以和H+以配位键结合分别形成NH和H3O+。
(4)甲烷电子式为,不存在孤电子对,且中心碳原子采用sp3杂化,故其立体构型为正四面体形。
(5)根据信息OC知,C和O之间存在三个共价键,氮气中两个原子间也是三个共价键,与CO结构相似。但C和O电负性不同,共价键是极性键,而N2中两个氮原子形成的键是非极性键,OC中“→”表示氧原子单方提供电子对,是配位键。
22. sp3 60° As>Se>Ge PH3 三角锥形 < S 原子半径小于P原子半径,故 S-Cl 键要比 P-Cl 键短
【分析】(1)N4分子的空间构型与P4类似,4个N原子形成正四面体构型,每个N原子形成3个N-N键,还含有1对孤对电子;
(2)As元素处于第四周期VA族,价电子排布式为4s24p3,结合泡利原理、洪特规则画出价电子排布图;As原子4p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的;
(3)元素的电负性越小,对孤电子对吸引越弱,越容易形成配位键;
(4)PCl3中P原子形成3个P-Cl键,含有1对孤对电子,其空间结构三角锥形,而等电子体的结构相似;原子半径越小,原子之间形成的共价键越短。
解析:(1)N4分子的空间构型与P4类似,4个N原子形成正四面体构型,每个N原子形成3个N-N键,还含有1对孤对电子,杂化轨道数目为4,故N原子采取sp3杂化,每个面均为正三角形,故N-N键的键角为60°;
(2)As元素处于第四周期VA族,价电子排布式为4s24p3,价电子排布图为:,As原子4p轨道为半满稳定状态,能量较低,第一电离能高于同周期相邻元素的,故第一电离能:As>Se>Ge;
(3)P元素的电负性比N元素的小,P原子对孤电子对吸引更弱,容易给出孤对电子形成配位键;
(4)PCl3中P原子形成3个P-Cl键,含有1对孤对电子,其空间结构三角锥形,而等电子体的结构相似,SCl3+的空间构型是三角锥形, S 原子半径小于P原子半径,故 S-Cl 键要比 P-Cl 键短。
23.(1) 离子键、非极性键 离子
(2) 碳酸钠 O=C=O 直线形
(3) 金刚石 为离子晶体而为分子晶体
解析:①X元素原子价电子排布式为,且原子半径是同族元素中最小的,则X为C元素;
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电子排布中,p轨道上只有1个未成对电子,则Y为O元素,W为Cl元素;
③根据Z元素的电离能数据可知,Z电离能I2远大于I1;
(1)由题意知X、Y、Z、W分别为C、O、、。
的电子式为,含有离子键、非极性键,为离子晶体,故答案为:;离子键、非极性键;离子;
(2)C、O、三种元素所形成的常见化合物为碳酸钠;的结构式为O=C=O,是直线形分子,故答案为:碳酸钠;O=C=O;直线形;
(3)C、O、、四种元素所形成的单质中,共价晶体金刚石熔点最高,硬度最大;由于为离子晶体,而为分子晶体,故晶体的熔点比晶体的熔点明显高,故答案为:金刚石;为离子晶体而为分子晶体。
24.(1)N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g)ΔH1=-64a kJ·mol-1
(2) BG 温度计
(3)8
(4) 黑色粉末是CuO和Fe3O4的混合物 溶液显蓝色 “2或3” 红色固体 红褐色沉淀 红褐色沉淀,同时溶液呈深蓝色
解析:(1)肼和四氧化二氮的反应的化学方程式:2N2H4+N2O4=3N2+4H2O,64g肼参加此反应放出的热量为64akJ,所以热化学反应方程式:N2O4(l)+2N2H4(l)=3N2(g)+4H2O(g) ΔH1=-64a kJ·mol-1 ;
(2)①蒸馏过程中需要的仪器有:带铁圈的铁架台、蒸馏烧瓶、酒精灯、石棉网、温度计、直型冷凝管、牛角管、锥形瓶等仪器 ,所以不需要的仪器是:BG;
②根据①的分析缺少温度计;
(3)发生的化学反应方程式:N2H4+6Fe2O3=N2+4Fe3O4+2H2O,生成1molFe3O4消耗肼8g,还可以采用得失电子数目守恒1×3×(3-)=x×2×2,解得:x=mol,则消耗肼8g;
(4)根据提出的假设,假设3是两者的混合物;
①假设1:黑色物质的氧化铜,跟酸反应生成Cu2+,不与KSCN反应,溶液呈现二价铜离子的颜色蓝色,实验现象是溶液显蓝色;
②溶液显血红色说明含有含有Fe3+,假设2或3中都含有Fe3+,所以假设2或3成立;
③铁单质先和Fe3+反应生成Fe2+,然后再和Cu2+反应,生成铜单质,金属铜是红色物质,因此产生红色物质,则假设3成立;
④假设2是Fe3O4,与酸反应生成Fe2+、Fe3+,加入氨水生成Fe(OH)2、Fe(OH)3,最终生成Fe(OH)3红褐色沉淀;假设3是两者的混合物有红褐色沉淀生成,氧化铜与酸反应生成Cu2+,当加入过量氨水生成深蓝色溶液,证明假设3成立
