人教版化学九年级下册第八单元课题2金属的化学性质同步检测.doc
文档属性
| 名称 | 人教版化学九年级下册第八单元课题2金属的化学性质同步检测.doc |  | |
| 格式 | doc | ||
| 文件大小 | 90.5KB | ||
| 资源类型 | 素材 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-09-01 09:35:52 | ||
图片预览



文档简介
人教版化学九年级下册第八单元课题2金属的化学性质同步检测
1、 选择题
1.俗话说“真金不怕火炼”,指的是( )
A.金的硬度大
B.金在常温下与氧气反应,高温不反应
C.金的熔点高,可以用火烧
D.金的性质不活泼,在高温时也不与氧气反应
答案:D
知识点:金属的化学性质
解析:解答:金的化学性质在自然条件下非常稳定,在自然界中多以单质的形式存在,即使在高温时也不与氧气反应。
分析:该题考查了金属的化学性质
2. 市面上时有不法商贩使用颜色和外形与黄金十分相似的假黄金(铜锌合金)来蒙骗消费者。请你利用所学的化学知识判断,下列方案不能区分真假黄金的是( )。
A.放在稀硫酸中 B.在空气中灼烧
C.测密度 D.认真观察外观
答案:D
知识点:金属的化学性质
解析:解答:在金属活动顺序表中,金排在氢的后面,不能与稀硫酸反应,而假黄金中的锌排在氢的前面,可以与稀硫酸反应产生气泡,故选项A可以区分真假黄金;真金不拍火来炼,金在空气中灼烧没有变化,而假黄金中的铜在空气中灼烧,颜色会变为黑色,现象明显,故选项B可以区分真假黄金;金的密度比铜锌合金的密度大,相同体积的黄金与铜锌合金,黄金要重一些,故选项C可以区分真假黄金;黄金与铜锌合金的颜色相近,难以区分,故选项D不能区分真假黄金。
分析:该题考查了金属的化学性质。
3. 已知金属M与硫酸铜溶液反应的化学反应方程式:M + CuSO4 = MSO4 + Cu。则下列说法错误的是( )。
A.M的金属活动性比Cu强 B.该反应属于置换反应
C.金属M可能是铝 D.该反应前后M的化合价发生了改变
答案:C
知识点:金属活动性顺序与置换反应
解析:解答:金属M可与硫酸铜溶液反应置换出Cu,所以M的金属活动性比Cu强;由一种单质和一种化合物反应产生另一种单质和另一种化合物的反应是置换反应;反应前M为单质,化合价为0价,生成物MSO4中M的化合价为+2价,化合价发生改变;若M为铝,则生成物的化学式应为M2(SO4)3,故选C。
分析:该题考查了金属活动性顺序与置换反应
4. 铝在一百多年里产量得到大幅度的提高,并被广泛地使用,原因之一就是铝的抗腐蚀性能好。铝具有良好的抗腐蚀性能的原因是 ( )
A.铝的化学性质不活泼 B.铝表面生成一层致密的氧化铝保护膜
C.铝常温下不与氧气反应 D.铝不与酸、碱反应
答案:B
知识点:金属的化学性质
解析:解答:铝的化学性质比较活泼,在空气中和氧气发生缓慢氧化,表面生成一层致密的氧化铝保护膜,从而阻止铝进一步氧化,故选项B正确。
分析:该题考查了金属的化学性质。
5. 下列现象和事实,可用金属活动性作出合理解释的是( )
①金属镁在空气中比铝更易点燃,说明镁比铝活动性强;
②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强;
③硫酸铜、石灰水配制农药波尔多液,不宜用铁制容器;
④金属锌与稀硫酸反应速率适中,更适于实验室制取氢气。
A.①② B.③④ C.①③④ D.①②③④
答案:C
知识点:金属的化学性质
解析:解答:①金属与氧气的难易以及剧烈程度也能反应金属的活动性,②铝的化学性质比较活泼,在空气中和氧气发生缓慢氧化,表面生成一层致密的氧化铝保护膜,从而阻止铝进一步氧化,所以铝的抗腐蚀性能比较好,③铁可以和硫酸铜溶液发生反应,所以不宜用铁制容器配制波尔多液,④金属锌与稀硫酸反应速率适中,更适于实验室制取氢气。正确的是①③④。
分析:该题考查了金属的化学性质
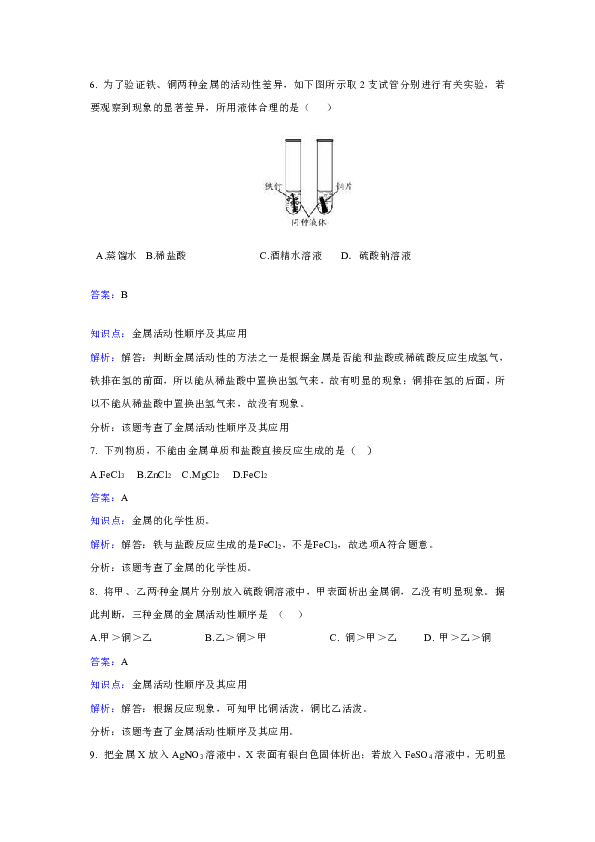
6. 为了验证铁、铜两种金属的活动性差异,如下图所示取2支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
A.蒸馏水 B.稀盐酸 C.酒精水溶液 D.硫酸钠溶液
答案:B
知识点:金属活动性顺序及其应用
解析:解答:判断金属活动性的方法之一是根据金属是否能和盐酸或稀硫酸反应生成氢气,铁排在氢的前面,所以能从稀盐酸中置换出氢气来,故有明显的现象;铜排在氢的后面,所以不能从稀盐酸中置换出氢气来,故没有现象。
分析:该题考查了金属活动性顺序及其应用
7. 下列物质,不能由金属单质和盐酸直接反应生成的是( )
A.FeCl3 B.ZnCl2 C.MgCl2 D.FeCl2
答案:A
知识点:金属的化学性质。
解析:解答:铁与盐酸反应生成的是FeCl2,不是FeCl3,故选项A符合题意。
分析:该题考查了金属的化学性质。
8. 将甲、乙两种金属片分别放入硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象。据此判断,三种金属的金属活动性顺序是 ( )
A.甲>铜>乙 B.乙>铜>甲 C. 铜>甲>乙 D. 甲>乙>铜
答案:A
知识点:金属活动性顺序及其应用
解析:解答:根据反应现象,可知甲比铜活泼,铜比乙活泼。
分析:该题考查了金属活动性顺序及其应用。
9. 把金属X放入AgNO3溶液中,X表面有银白色固体析出;若放入FeSO4溶液中,无明显现象。则X、Ag、Fe三种金属活动性由强到弱的顺序正确的是( )
A. Fe、X、Ag B. X、Fe、Ag C. Fe、Ag、X D. Ag、X、Fe
答案:A
知识点:金属活动性顺序及其应用
解析:解答:在金属活动性顺序中前面的金属可以将后面的金属从它的盐溶液中置换出来。X置换出银,说明X在银的前面;X不能置换出铁,说明X在铁的后面,故选项A符合题意。
分析:该题考查了金属材料及其应用。
10. X、Y、Z三种金属及其化合物间可发生如下化学反应:Y+ZCl2=Z+YCl2 , X+ZCl2=Z+XCl2,Y+2HCl=YCl2+H2↑, X+HCl 不反应,则X、Y、Z三种金属的活动性由强到弱的顺序是 ( )
A.Z>Y>X B.X>Y>Z C.Y>X>Z D.Y>Z>X
答案:C
知识点:置换反应及其应用
解析:解答:在金属活动性顺序中,排在H前的金属可以和盐酸、稀硫酸发生置换反应,前面的金属可以将后面的金属从它的盐溶液中置换出来。Y置换出Z说明Y比Z活泼;X置换出Z说明X比Z活泼;同时Y能与酸反应置换出氢气,而X不能,得出Y比X活泼;所以Y比X活泼,X比Z活泼。
分析:该题考查了置换反应及其应用
11.下列金属中,金属活动性最强的是( )
A.Zn B.Ag C.Mg D.Cu
答案:C
知识点:金属活动性顺序及其应用
解析:解答:记住金属活动性顺序表:K、 Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)、Cu、Hg、Ag、Pt、Au,得出选项C符合题意。
分析:该题考查了金属活动性顺序及其应用,请同学们熟练掌握金属活动性顺序表。
12. 用实验比较铜、铁的金属活动性,直接使用下列试剂不能达到目的的是( )
A.硫酸亚铁溶液 B.硝酸银溶液 C.盐酸溶液 D.硫酸铜溶液
答案:B
知识点:金属活动性顺序及其应用
解析:解答:把铜放入硫酸亚铁溶液中没有任何现象得出铁比铜活泼,故选项A正确;铁、铜放入硝酸银溶液中没有现象,说明铜、铁都比银活泼,但铜与铁的金属活动性无从比较,故选项B不符合题意;铜、铁放入盐酸溶液中,铁周围有气泡生成,铜没有现象,故选项C符合题意;铜、铁放入硫酸铜溶液中,铁的周围生成一层红色的铜,铁置换出铜说明铁比铜活泼,故选项D符合题意。
分析:该题考查了金属活动性顺序及其应用
13. 常温下,下列各组物质中相互间能发生化学反应的是( )
A.碳和氧气 B.铜和硫酸锌溶液 C.铝和氧气 D.氧化铜和水
答案:C
知识点:金属的化学性质
解析:解答:碳和氧气在点燃的条件下反应,常温下不反应,故选项A不正确;锌比铜活泼,铜不能置换出锌,所以铜与硫酸锌不反应,故选项B不正确;铝和氧气常温下就能反应,生成一层致密的氧化物薄膜,故选项C正确;氧化铜与水不反应,故选项D不正确。
分析:该题考查了金属的化学性质
14. 下列有关事实不能用金属活动性顺序解释的是 ( )
A.不能用金属铜与稀硫酸反应制取氢气
B.银的导电性强于铜
C.镁和铝与稀盐酸反应的剧烈程度不同
D.铜能将银从硝酸银溶液中置换出来
答案:B
知识点:金属活动性顺序及其应用
解析:解答:在金属活动性顺序中,排在H前的金属可以和盐酸、稀硫酸发生置换反应,并且在控制酸完全相同时,反应速度也能体现金属活动性强弱,故选项A 、C不符合题意;前面的金属可以将它后面的金属从它的盐溶液中置换出来,故选项D不符合题意。
分析:该题考查了金属活动性顺序及其应用
15. 为验证Mg、Cu、Ag三种金属的活动性强弱,某化学兴趣小组设计了如图所示的四个实验。 其中不必进行的实验是( )
A B C D
答案:C
知识点:金属活动性顺序及其应用
解析:解答:由实验A可知Mg〉H,由B可知H〉Cu,由C可知H〉Ag,由D可知Cu〉Ag。几个实验综合考虑便知C实验不必进行。
分析:该题考查了金属活动性顺序及其应用。
二、填空题
16. 要除去FeSO4中含有的CuSO4杂质。可以在其溶液中加入__________,充分反应后,再用____________方法除去杂质;该反应的化学方程式是:__________________________。
答案:铁,过滤,Fe+CuSO4= FeSO4+Cu
知识点:金属的化学性质
解析:解答:除杂就是加入某种物质跟杂质反应同时不能生成新的杂质,可以选铁,加铁充分反应后,剩余的铁和生成的铜可以通过过滤的方法除去。
分析:该题让学生熟记一些常用金属的化学性质
17. 金属钛(Ti)是航空、宇航、化工等方面的重要金属材料,被称为“21世纪的金属”。在工业上可用镁在高温下与TiCl4反应制取金属钛,反应的化学方程式为TiCl4+2Mg 高温 Ti+2MgCl2。此反应说明金属钛的活动性比镁 (填“强”或“弱”);在TiCl4中钛元素的化合价为 。
答案:弱 +4
知识点:金属活动性顺序与置换反应
解析:解答:活泼的金属可也把比它不活泼的金属从其盐溶液中置换出来,Mg置换出Ti说明Mg比Ti活泼,TiCl4中Cl是-1价的,根据化合物中各元素化合价代数和为零得出钛元素的化合价为+4价。
分析:本题考查了金属活动性顺序与置换反应。
18. 写出铁、铜、氧气、稀硫酸两两间能发生反应的化学方程式,并注明反应类型。
答案:3Fe + 2O2 点燃 Fe3O4,化合反应;Fe + H2SO4 = FeSO4 + H2↑,置换反应;
2Cu + O2 加热 2CuO,化合反应。
知识点:金属的化学性质
解析:解答:铁与铜均可在不同条件下与氧气发生反应,而铜不能与稀硫酸反应。
分析:该题考查了物质的微粒性。
19. 波尔多液是一种农业上常用到的杀菌剂,它是由硫酸铜、生石灰加水配置而成。请用化学方程式解释不能用铁制容器来配置波尔多液的原因: 。
答案:Fe + CuSO4 = FeSO4 + Cu
知识点:金属活动性顺序及其应用。
解析:解答:铁的金属活动性比铜强,所以若用铁制容器来配置波尔多液,则铁会与硫酸铜溶液发生置换反应。
分析:该题考查了金属活动性顺序及其应用。
20. 人们常说的“五金”是指“金、银、铜、铁、锌”,根据所学知识判断,不能与盐酸反应的金属是 (填名称)。世界上常用黄金作金融储备、货币等,其原因是 。黄铜是铜锌合金,其硬度比纯铜 (填“大”、“小”或“相同”)。
答案:金、银、铜 ;储量小、性质稳定、价格高; 大。
知识点:金属的化学性质;金属活动性顺序及其应用;合金与合金的性质。
解析:解答:金属活动性顺序表中排在H后面的金属不能与稀盐酸反应,金、银、铜、铁、锌中排在H后面的金属是金、银、铜;金的化学性质稳定,储量小可以用来作金融储备;合金的硬度一般比组分金属的硬度大。
分析:该题考查了金属的化学性质;金属活动性顺序及其应用;合金与合金的性质。
三、简答题
21. A、B、C、D为金属活动顺序表中常见的四种金属。已知:①A+BSO4=ASO4+B ②C+H2SO4=CSO4+H2↑ ③B+2DNO3=B(NO3)2+2D 请完成以下填空:
(1)金属C在金属活动顺序表中排在氢 (填“前面”或“后面”)。
(2)根据上述反应能判断出其中三种金属的活动性,其金属活动性由强到弱的顺序是____ (用字母填写)。
(3)若A、B、C、D分别为锌、铁、铜、银中的一种,金属C与H2SO4反应后所得溶液呈浅绿色,则金属A为 ,反应③的化学方程式为 。
答案:(1)前面 (2)A>B>D (3)Zn Cu+2AgNO3=Cu(NO3)2+2Ag。
知识点:金属活动性顺序及其应用
解析:解答:(1)金属C可以与稀硫酸反应生成氢气,说明金属C排在氢的前面。(2)排在前面的金属可以把排在它后面的金属从其盐溶液中置换出来,A置换出B说明A比B活泼,B置换出D说明B比D活泼,所以金属活动性由强到弱的顺序是A>B>D。(3)由金属C与H2SO4反应后所得溶液呈浅绿色,我们可知金属C是铁,浅绿色溶液是硫酸亚铁,根据A比B活泼,B比D活泼可知,可知A是锌,B是铜,D是银,所以反应③的化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag。
分析:该题考查了金属活动性顺序及其应用
22. 同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
(1)填表
实验步骤 观察到的现象
① 在试管中取少量盐酸,插入铁丝,充分作用。
② 在①所得的溶液中,插入 ,充分作用。 无明显现象
③ 在②所得的溶液中插入 ,充分作用。
结论:金属活动性Al > Fe > Cu
(2) 将铝丝插入前应进行的操作是 ;
(3)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出Al > Fe > H >Cu的结论。小华要补充的实验是 ;
(4)小强同学认为要得到Al > Fe > H >Cu的结论,不必做补充实验,中需将小明同学方案中插入金属的顺序调整即可,你认为调整后插入金属的顺序是 。
答案:(1)产生气泡,溶液由无色变为浅绿色;铜丝;铝丝 溶液由浅绿色变为无色
(2)用砂纸打磨其表面的氧化铝 (3)把铜丝插入稀盐酸中(4)Cu Fe Al。
知识点:金属活动性顺序及其应用
解析:解答:(1)在试管中取少量盐酸,插入铁丝,因为铁的金属活动性排在氢的前面,可以与盐酸反应生成氢气,所以现象是产生气泡,溶液由无色变为浅绿色;①反应后的溶液为硫酸亚铁,插入一种金属没有现象说明这种金属不能与硫酸亚铁反应,故这种金属的活动性应该排在铁的后面,所以是铜丝;在②所得的溶液中插入剩下的铝丝,铝比铁活泼,能置换出铁,现象为溶液由浅绿色变为无色。(2)铝在空气中易被氧化生成氧化铝,所以实验前要先用砂纸打磨,除掉外层的氧化铝。(3)前面的实验已经能证明铝比铁活泼,铁比铜活泼,铁排在氢前面,但铜排在氢前还是氢后面,实验不能证明,所以我们只要将铜放入稀盐酸中即可验证。(4)先把铜插入盐酸中没有现象证明铜排在氢的后面,然后再把铁插入盐酸中,有气泡生成,溶液变为浅绿色,可以判定铁排在氢的前面,比铜活泼,最后在氯化亚铁溶液中插入铝丝,溶液由浅绿色变为无色,可以判断铝比铁活泼。
分析:该题考查了金属活动性顺序及其应用。
23. 金属及金属材料在生产、生活中应用广泛。
(1)铝具有很好的抗腐蚀性能,原因是____________________(用化学方程式表示)。
(2)小明在学习金属的化学性质时,做了如下探究实验(金属片已打磨):
①将铁片插入硫酸铜溶液中,铁片表面的现象是_____________________;
②将铜片插入硝酸银溶液中,反应的化学方程式是__________________。
此探究实验的目的是________________________________。
答案:(1)4Al+3O2=2Al2O3 (2)①有紫红色的物质生成
②Cu+2AgNO3=Cu(NO3)2+2Ag 探究铁、铜、银三种金属的活动性顺序
知识点:金属的化学性质;金属活动性顺序与置换反应;
解析:解答:(1)铝有很好的抗腐蚀性是因为铝与空气中的氧气结合生成了一种致密的氧化物薄膜,隔绝铝与空气进一步接触,化学方程式为4Al+3O2=2Al2O3,(2)①铁比铜活泼,可以从铜的盐溶液中置换出铜,故现象为有紫红色的物质生成;②铜比银活泼,所以可以从银的盐溶液中置换出银,反应方程式为Cu+2AgNO3=Cu(NO3)2+2Ag,通过这两个实验我们可以得出铁比铜活泼,铜比银活泼。
分析:该题考查了金属的化学性质;金属活动性顺序与置换反应;
24. 小亮在实验室用一块生铁与稀盐酸反应,观察到生铁表面出现,同时发现充分反应后的液体中有少量黑色不溶物。
提出问题:这种黑色不溶物是什么呢?
猜想与假设:这种黑色不溶物中可能含碳。
设计方案:将黑色固体灼烧,若黑色固体中含有碳,就会有________气体生成,要想进一步确定这种气体,可以用_______________检验。
进行实验:小亮按设计方案进行实验,得到了预想的结果。
解释与结论:由此小亮得出结论:
(1)生铁中___碳(含/不含);
(2)碳与稀盐酸_____反应(能/不能),铁与稀盐酸___(能/不能)反应。
答案:二氧化碳、澄清石灰水;(1)含(2)不能,能。
知识点:常见的金属和非金属的区分;金属的化学性质
解析:解答:碳在氧气中充分燃烧生成二氧化碳,二氧化碳可以使澄清的石灰水变浑浊,所以可以用澄清的石灰水来检验二氧化碳;出现预想的现象,说明有二氧化碳产生,也就说明生铁中含有碳,而且碳不和稀盐酸反应,而铁排在氢的前面,可以与稀盐酸反应。
分析:该题考查了常见的金属和非金属的区分;金属的化学性质
25.已知A、B、C、D四种物质都含有同一种元素,其中A是单质,B是黑色固体,C是红色固体。它们之间存在着如下转化关系:
(1)A在不同条件下能够转化成B或C;
(2)A和稀硫酸反应有D生成;
(3)在高温条件下,B、C分别和无色气体E反应,都能生成A和另一种无色气体。根据上述信息,写出下列物质的化学式:
A ;C ;D ;E 。
答案:Fe;Fe2O3;FeSO4;CO2
知识点:金属的化学性质;金属活动性顺序及其应用
解析:解答:根据题目给出的已知信息我们很容易判断出A是铁,C为红色固体应该是氧化铁,铁与稀硫酸反应生成的D中也含铁元素那就是硫酸亚铁,B、C都是氧化物,与E反应完后生成铁,所以这种气体必须具有还原性,又根据反应后的另一种也是无色气体,我们推出E是二氧化碳。
分析:该题考查了金属的化学性质;金属活动性顺序及其应用
1、 选择题
1.俗话说“真金不怕火炼”,指的是( )
A.金的硬度大
B.金在常温下与氧气反应,高温不反应
C.金的熔点高,可以用火烧
D.金的性质不活泼,在高温时也不与氧气反应
答案:D
知识点:金属的化学性质
解析:解答:金的化学性质在自然条件下非常稳定,在自然界中多以单质的形式存在,即使在高温时也不与氧气反应。
分析:该题考查了金属的化学性质
2. 市面上时有不法商贩使用颜色和外形与黄金十分相似的假黄金(铜锌合金)来蒙骗消费者。请你利用所学的化学知识判断,下列方案不能区分真假黄金的是( )。
A.放在稀硫酸中 B.在空气中灼烧
C.测密度 D.认真观察外观
答案:D
知识点:金属的化学性质
解析:解答:在金属活动顺序表中,金排在氢的后面,不能与稀硫酸反应,而假黄金中的锌排在氢的前面,可以与稀硫酸反应产生气泡,故选项A可以区分真假黄金;真金不拍火来炼,金在空气中灼烧没有变化,而假黄金中的铜在空气中灼烧,颜色会变为黑色,现象明显,故选项B可以区分真假黄金;金的密度比铜锌合金的密度大,相同体积的黄金与铜锌合金,黄金要重一些,故选项C可以区分真假黄金;黄金与铜锌合金的颜色相近,难以区分,故选项D不能区分真假黄金。
分析:该题考查了金属的化学性质。
3. 已知金属M与硫酸铜溶液反应的化学反应方程式:M + CuSO4 = MSO4 + Cu。则下列说法错误的是( )。
A.M的金属活动性比Cu强 B.该反应属于置换反应
C.金属M可能是铝 D.该反应前后M的化合价发生了改变
答案:C
知识点:金属活动性顺序与置换反应
解析:解答:金属M可与硫酸铜溶液反应置换出Cu,所以M的金属活动性比Cu强;由一种单质和一种化合物反应产生另一种单质和另一种化合物的反应是置换反应;反应前M为单质,化合价为0价,生成物MSO4中M的化合价为+2价,化合价发生改变;若M为铝,则生成物的化学式应为M2(SO4)3,故选C。
分析:该题考查了金属活动性顺序与置换反应
4. 铝在一百多年里产量得到大幅度的提高,并被广泛地使用,原因之一就是铝的抗腐蚀性能好。铝具有良好的抗腐蚀性能的原因是 ( )
A.铝的化学性质不活泼 B.铝表面生成一层致密的氧化铝保护膜
C.铝常温下不与氧气反应 D.铝不与酸、碱反应
答案:B
知识点:金属的化学性质
解析:解答:铝的化学性质比较活泼,在空气中和氧气发生缓慢氧化,表面生成一层致密的氧化铝保护膜,从而阻止铝进一步氧化,故选项B正确。
分析:该题考查了金属的化学性质。
5. 下列现象和事实,可用金属活动性作出合理解释的是( )
①金属镁在空气中比铝更易点燃,说明镁比铝活动性强;
②金属铝比金属锌更耐腐蚀,说明锌比铝活动性强;
③硫酸铜、石灰水配制农药波尔多液,不宜用铁制容器;
④金属锌与稀硫酸反应速率适中,更适于实验室制取氢气。
A.①② B.③④ C.①③④ D.①②③④
答案:C
知识点:金属的化学性质
解析:解答:①金属与氧气的难易以及剧烈程度也能反应金属的活动性,②铝的化学性质比较活泼,在空气中和氧气发生缓慢氧化,表面生成一层致密的氧化铝保护膜,从而阻止铝进一步氧化,所以铝的抗腐蚀性能比较好,③铁可以和硫酸铜溶液发生反应,所以不宜用铁制容器配制波尔多液,④金属锌与稀硫酸反应速率适中,更适于实验室制取氢气。正确的是①③④。
分析:该题考查了金属的化学性质
6. 为了验证铁、铜两种金属的活动性差异,如下图所示取2支试管分别进行有关实验,若要观察到现象的显著差异,所用液体合理的是( )
A.蒸馏水 B.稀盐酸 C.酒精水溶液 D.硫酸钠溶液
答案:B
知识点:金属活动性顺序及其应用
解析:解答:判断金属活动性的方法之一是根据金属是否能和盐酸或稀硫酸反应生成氢气,铁排在氢的前面,所以能从稀盐酸中置换出氢气来,故有明显的现象;铜排在氢的后面,所以不能从稀盐酸中置换出氢气来,故没有现象。
分析:该题考查了金属活动性顺序及其应用
7. 下列物质,不能由金属单质和盐酸直接反应生成的是( )
A.FeCl3 B.ZnCl2 C.MgCl2 D.FeCl2
答案:A
知识点:金属的化学性质。
解析:解答:铁与盐酸反应生成的是FeCl2,不是FeCl3,故选项A符合题意。
分析:该题考查了金属的化学性质。
8. 将甲、乙两种金属片分别放入硫酸铜溶液中,甲表面析出金属铜,乙没有明显现象。据此判断,三种金属的金属活动性顺序是 ( )
A.甲>铜>乙 B.乙>铜>甲 C. 铜>甲>乙 D. 甲>乙>铜
答案:A
知识点:金属活动性顺序及其应用
解析:解答:根据反应现象,可知甲比铜活泼,铜比乙活泼。
分析:该题考查了金属活动性顺序及其应用。
9. 把金属X放入AgNO3溶液中,X表面有银白色固体析出;若放入FeSO4溶液中,无明显现象。则X、Ag、Fe三种金属活动性由强到弱的顺序正确的是( )
A. Fe、X、Ag B. X、Fe、Ag C. Fe、Ag、X D. Ag、X、Fe
答案:A
知识点:金属活动性顺序及其应用
解析:解答:在金属活动性顺序中前面的金属可以将后面的金属从它的盐溶液中置换出来。X置换出银,说明X在银的前面;X不能置换出铁,说明X在铁的后面,故选项A符合题意。
分析:该题考查了金属材料及其应用。
10. X、Y、Z三种金属及其化合物间可发生如下化学反应:Y+ZCl2=Z+YCl2 , X+ZCl2=Z+XCl2,Y+2HCl=YCl2+H2↑, X+HCl 不反应,则X、Y、Z三种金属的活动性由强到弱的顺序是 ( )
A.Z>Y>X B.X>Y>Z C.Y>X>Z D.Y>Z>X
答案:C
知识点:置换反应及其应用
解析:解答:在金属活动性顺序中,排在H前的金属可以和盐酸、稀硫酸发生置换反应,前面的金属可以将后面的金属从它的盐溶液中置换出来。Y置换出Z说明Y比Z活泼;X置换出Z说明X比Z活泼;同时Y能与酸反应置换出氢气,而X不能,得出Y比X活泼;所以Y比X活泼,X比Z活泼。
分析:该题考查了置换反应及其应用
11.下列金属中,金属活动性最强的是( )
A.Zn B.Ag C.Mg D.Cu
答案:C
知识点:金属活动性顺序及其应用
解析:解答:记住金属活动性顺序表:K、 Ca、Na、Mg、Al、Zn、Fe、Sn、Pb(H)、Cu、Hg、Ag、Pt、Au,得出选项C符合题意。
分析:该题考查了金属活动性顺序及其应用,请同学们熟练掌握金属活动性顺序表。
12. 用实验比较铜、铁的金属活动性,直接使用下列试剂不能达到目的的是( )
A.硫酸亚铁溶液 B.硝酸银溶液 C.盐酸溶液 D.硫酸铜溶液
答案:B
知识点:金属活动性顺序及其应用
解析:解答:把铜放入硫酸亚铁溶液中没有任何现象得出铁比铜活泼,故选项A正确;铁、铜放入硝酸银溶液中没有现象,说明铜、铁都比银活泼,但铜与铁的金属活动性无从比较,故选项B不符合题意;铜、铁放入盐酸溶液中,铁周围有气泡生成,铜没有现象,故选项C符合题意;铜、铁放入硫酸铜溶液中,铁的周围生成一层红色的铜,铁置换出铜说明铁比铜活泼,故选项D符合题意。
分析:该题考查了金属活动性顺序及其应用
13. 常温下,下列各组物质中相互间能发生化学反应的是( )
A.碳和氧气 B.铜和硫酸锌溶液 C.铝和氧气 D.氧化铜和水
答案:C
知识点:金属的化学性质
解析:解答:碳和氧气在点燃的条件下反应,常温下不反应,故选项A不正确;锌比铜活泼,铜不能置换出锌,所以铜与硫酸锌不反应,故选项B不正确;铝和氧气常温下就能反应,生成一层致密的氧化物薄膜,故选项C正确;氧化铜与水不反应,故选项D不正确。
分析:该题考查了金属的化学性质
14. 下列有关事实不能用金属活动性顺序解释的是 ( )
A.不能用金属铜与稀硫酸反应制取氢气
B.银的导电性强于铜
C.镁和铝与稀盐酸反应的剧烈程度不同
D.铜能将银从硝酸银溶液中置换出来
答案:B
知识点:金属活动性顺序及其应用
解析:解答:在金属活动性顺序中,排在H前的金属可以和盐酸、稀硫酸发生置换反应,并且在控制酸完全相同时,反应速度也能体现金属活动性强弱,故选项A 、C不符合题意;前面的金属可以将它后面的金属从它的盐溶液中置换出来,故选项D不符合题意。
分析:该题考查了金属活动性顺序及其应用
15. 为验证Mg、Cu、Ag三种金属的活动性强弱,某化学兴趣小组设计了如图所示的四个实验。 其中不必进行的实验是( )
A B C D
答案:C
知识点:金属活动性顺序及其应用
解析:解答:由实验A可知Mg〉H,由B可知H〉Cu,由C可知H〉Ag,由D可知Cu〉Ag。几个实验综合考虑便知C实验不必进行。
分析:该题考查了金属活动性顺序及其应用。
二、填空题
16. 要除去FeSO4中含有的CuSO4杂质。可以在其溶液中加入__________,充分反应后,再用____________方法除去杂质;该反应的化学方程式是:__________________________。
答案:铁,过滤,Fe+CuSO4= FeSO4+Cu
知识点:金属的化学性质
解析:解答:除杂就是加入某种物质跟杂质反应同时不能生成新的杂质,可以选铁,加铁充分反应后,剩余的铁和生成的铜可以通过过滤的方法除去。
分析:该题让学生熟记一些常用金属的化学性质
17. 金属钛(Ti)是航空、宇航、化工等方面的重要金属材料,被称为“21世纪的金属”。在工业上可用镁在高温下与TiCl4反应制取金属钛,反应的化学方程式为TiCl4+2Mg 高温 Ti+2MgCl2。此反应说明金属钛的活动性比镁 (填“强”或“弱”);在TiCl4中钛元素的化合价为 。
答案:弱 +4
知识点:金属活动性顺序与置换反应
解析:解答:活泼的金属可也把比它不活泼的金属从其盐溶液中置换出来,Mg置换出Ti说明Mg比Ti活泼,TiCl4中Cl是-1价的,根据化合物中各元素化合价代数和为零得出钛元素的化合价为+4价。
分析:本题考查了金属活动性顺序与置换反应。
18. 写出铁、铜、氧气、稀硫酸两两间能发生反应的化学方程式,并注明反应类型。
答案:3Fe + 2O2 点燃 Fe3O4,化合反应;Fe + H2SO4 = FeSO4 + H2↑,置换反应;
2Cu + O2 加热 2CuO,化合反应。
知识点:金属的化学性质
解析:解答:铁与铜均可在不同条件下与氧气发生反应,而铜不能与稀硫酸反应。
分析:该题考查了物质的微粒性。
19. 波尔多液是一种农业上常用到的杀菌剂,它是由硫酸铜、生石灰加水配置而成。请用化学方程式解释不能用铁制容器来配置波尔多液的原因: 。
答案:Fe + CuSO4 = FeSO4 + Cu
知识点:金属活动性顺序及其应用。
解析:解答:铁的金属活动性比铜强,所以若用铁制容器来配置波尔多液,则铁会与硫酸铜溶液发生置换反应。
分析:该题考查了金属活动性顺序及其应用。
20. 人们常说的“五金”是指“金、银、铜、铁、锌”,根据所学知识判断,不能与盐酸反应的金属是 (填名称)。世界上常用黄金作金融储备、货币等,其原因是 。黄铜是铜锌合金,其硬度比纯铜 (填“大”、“小”或“相同”)。
答案:金、银、铜 ;储量小、性质稳定、价格高; 大。
知识点:金属的化学性质;金属活动性顺序及其应用;合金与合金的性质。
解析:解答:金属活动性顺序表中排在H后面的金属不能与稀盐酸反应,金、银、铜、铁、锌中排在H后面的金属是金、银、铜;金的化学性质稳定,储量小可以用来作金融储备;合金的硬度一般比组分金属的硬度大。
分析:该题考查了金属的化学性质;金属活动性顺序及其应用;合金与合金的性质。
三、简答题
21. A、B、C、D为金属活动顺序表中常见的四种金属。已知:①A+BSO4=ASO4+B ②C+H2SO4=CSO4+H2↑ ③B+2DNO3=B(NO3)2+2D 请完成以下填空:
(1)金属C在金属活动顺序表中排在氢 (填“前面”或“后面”)。
(2)根据上述反应能判断出其中三种金属的活动性,其金属活动性由强到弱的顺序是____ (用字母填写)。
(3)若A、B、C、D分别为锌、铁、铜、银中的一种,金属C与H2SO4反应后所得溶液呈浅绿色,则金属A为 ,反应③的化学方程式为 。
答案:(1)前面 (2)A>B>D (3)Zn Cu+2AgNO3=Cu(NO3)2+2Ag。
知识点:金属活动性顺序及其应用
解析:解答:(1)金属C可以与稀硫酸反应生成氢气,说明金属C排在氢的前面。(2)排在前面的金属可以把排在它后面的金属从其盐溶液中置换出来,A置换出B说明A比B活泼,B置换出D说明B比D活泼,所以金属活动性由强到弱的顺序是A>B>D。(3)由金属C与H2SO4反应后所得溶液呈浅绿色,我们可知金属C是铁,浅绿色溶液是硫酸亚铁,根据A比B活泼,B比D活泼可知,可知A是锌,B是铜,D是银,所以反应③的化学方程式为Cu+2AgNO3=Cu(NO3)2+2Ag。
分析:该题考查了金属活动性顺序及其应用
22. 同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铁丝、铝丝和稀盐酸,只用一只试管,取一次盐酸的探究方案。请你和他们一起完善下表的探究方案并回答有关问题。
(1)填表
实验步骤 观察到的现象
① 在试管中取少量盐酸,插入铁丝,充分作用。
② 在①所得的溶液中,插入 ,充分作用。 无明显现象
③ 在②所得的溶液中插入 ,充分作用。
结论:金属活动性Al > Fe > Cu
(2) 将铝丝插入前应进行的操作是 ;
(3)小华同学认为在小刚设计的方案中,只要补充一个实验,就可得出Al > Fe > H >Cu的结论。小华要补充的实验是 ;
(4)小强同学认为要得到Al > Fe > H >Cu的结论,不必做补充实验,中需将小明同学方案中插入金属的顺序调整即可,你认为调整后插入金属的顺序是 。
答案:(1)产生气泡,溶液由无色变为浅绿色;铜丝;铝丝 溶液由浅绿色变为无色
(2)用砂纸打磨其表面的氧化铝 (3)把铜丝插入稀盐酸中(4)Cu Fe Al。
知识点:金属活动性顺序及其应用
解析:解答:(1)在试管中取少量盐酸,插入铁丝,因为铁的金属活动性排在氢的前面,可以与盐酸反应生成氢气,所以现象是产生气泡,溶液由无色变为浅绿色;①反应后的溶液为硫酸亚铁,插入一种金属没有现象说明这种金属不能与硫酸亚铁反应,故这种金属的活动性应该排在铁的后面,所以是铜丝;在②所得的溶液中插入剩下的铝丝,铝比铁活泼,能置换出铁,现象为溶液由浅绿色变为无色。(2)铝在空气中易被氧化生成氧化铝,所以实验前要先用砂纸打磨,除掉外层的氧化铝。(3)前面的实验已经能证明铝比铁活泼,铁比铜活泼,铁排在氢前面,但铜排在氢前还是氢后面,实验不能证明,所以我们只要将铜放入稀盐酸中即可验证。(4)先把铜插入盐酸中没有现象证明铜排在氢的后面,然后再把铁插入盐酸中,有气泡生成,溶液变为浅绿色,可以判定铁排在氢的前面,比铜活泼,最后在氯化亚铁溶液中插入铝丝,溶液由浅绿色变为无色,可以判断铝比铁活泼。
分析:该题考查了金属活动性顺序及其应用。
23. 金属及金属材料在生产、生活中应用广泛。
(1)铝具有很好的抗腐蚀性能,原因是____________________(用化学方程式表示)。
(2)小明在学习金属的化学性质时,做了如下探究实验(金属片已打磨):
①将铁片插入硫酸铜溶液中,铁片表面的现象是_____________________;
②将铜片插入硝酸银溶液中,反应的化学方程式是__________________。
此探究实验的目的是________________________________。
答案:(1)4Al+3O2=2Al2O3 (2)①有紫红色的物质生成
②Cu+2AgNO3=Cu(NO3)2+2Ag 探究铁、铜、银三种金属的活动性顺序
知识点:金属的化学性质;金属活动性顺序与置换反应;
解析:解答:(1)铝有很好的抗腐蚀性是因为铝与空气中的氧气结合生成了一种致密的氧化物薄膜,隔绝铝与空气进一步接触,化学方程式为4Al+3O2=2Al2O3,(2)①铁比铜活泼,可以从铜的盐溶液中置换出铜,故现象为有紫红色的物质生成;②铜比银活泼,所以可以从银的盐溶液中置换出银,反应方程式为Cu+2AgNO3=Cu(NO3)2+2Ag,通过这两个实验我们可以得出铁比铜活泼,铜比银活泼。
分析:该题考查了金属的化学性质;金属活动性顺序与置换反应;
24. 小亮在实验室用一块生铁与稀盐酸反应,观察到生铁表面出现,同时发现充分反应后的液体中有少量黑色不溶物。
提出问题:这种黑色不溶物是什么呢?
猜想与假设:这种黑色不溶物中可能含碳。
设计方案:将黑色固体灼烧,若黑色固体中含有碳,就会有________气体生成,要想进一步确定这种气体,可以用_______________检验。
进行实验:小亮按设计方案进行实验,得到了预想的结果。
解释与结论:由此小亮得出结论:
(1)生铁中___碳(含/不含);
(2)碳与稀盐酸_____反应(能/不能),铁与稀盐酸___(能/不能)反应。
答案:二氧化碳、澄清石灰水;(1)含(2)不能,能。
知识点:常见的金属和非金属的区分;金属的化学性质
解析:解答:碳在氧气中充分燃烧生成二氧化碳,二氧化碳可以使澄清的石灰水变浑浊,所以可以用澄清的石灰水来检验二氧化碳;出现预想的现象,说明有二氧化碳产生,也就说明生铁中含有碳,而且碳不和稀盐酸反应,而铁排在氢的前面,可以与稀盐酸反应。
分析:该题考查了常见的金属和非金属的区分;金属的化学性质
25.已知A、B、C、D四种物质都含有同一种元素,其中A是单质,B是黑色固体,C是红色固体。它们之间存在着如下转化关系:
(1)A在不同条件下能够转化成B或C;
(2)A和稀硫酸反应有D生成;
(3)在高温条件下,B、C分别和无色气体E反应,都能生成A和另一种无色气体。根据上述信息,写出下列物质的化学式:
A ;C ;D ;E 。
答案:Fe;Fe2O3;FeSO4;CO2
知识点:金属的化学性质;金属活动性顺序及其应用
解析:解答:根据题目给出的已知信息我们很容易判断出A是铁,C为红色固体应该是氧化铁,铁与稀硫酸反应生成的D中也含铁元素那就是硫酸亚铁,B、C都是氧化物,与E反应完后生成铁,所以这种气体必须具有还原性,又根据反应后的另一种也是无色气体,我们推出E是二氧化碳。
分析:该题考查了金属的化学性质;金属活动性顺序及其应用
同课章节目录
