化学人教版(2019)必修第二册6.1.1化学反应与热能(共34张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第二册6.1.1化学反应与热能(共34张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-10 10:00:17 | ||
图片预览










文档简介
(共34张PPT)
第一节 化学反应与能量变化
第一课时 化学反应与热能
第六章 化学反应与能量
1. 认识物质具有能量,了解吸热反应与放热反应的概念。
2. 从化学键的角度理解吸热反应与放热反应
3. 学会从能量角度判断吸热反应与放热反应
学习目标
(1)放热反应发生不需要加热。 ( )(2)有热量变化的物质变化一定是化学变化。
( )(3)所有化学反应都伴随着能量的变化。 ( )(4)有能量放出的变化都是放热反应,吸收能量的变化都是吸热反应。 ( )
(正确的打“√”,错误的打“×”)
×
×
√
×
碳的燃烧是放热反应,需要加热
物理变化时也可能伴随能量变化,如气态水液化会放出热量
NaOH 固体溶于水释放能量,NH4NO3固体溶于水吸收能量,但二者均属于物理变化,不是化学反应。
实战演练
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到学科研究等)都离不开能量,而许多能量的利用与化学反应中能量变化密切相关。
从煤、石油、天然气等燃料燃烧提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。
化学反应中的能量变化通常表现为热量的变化,例如化石燃料燃烧会释放大量的热,除了燃烧,其他化学反应也伴随着放热或吸热现象。
新课导入
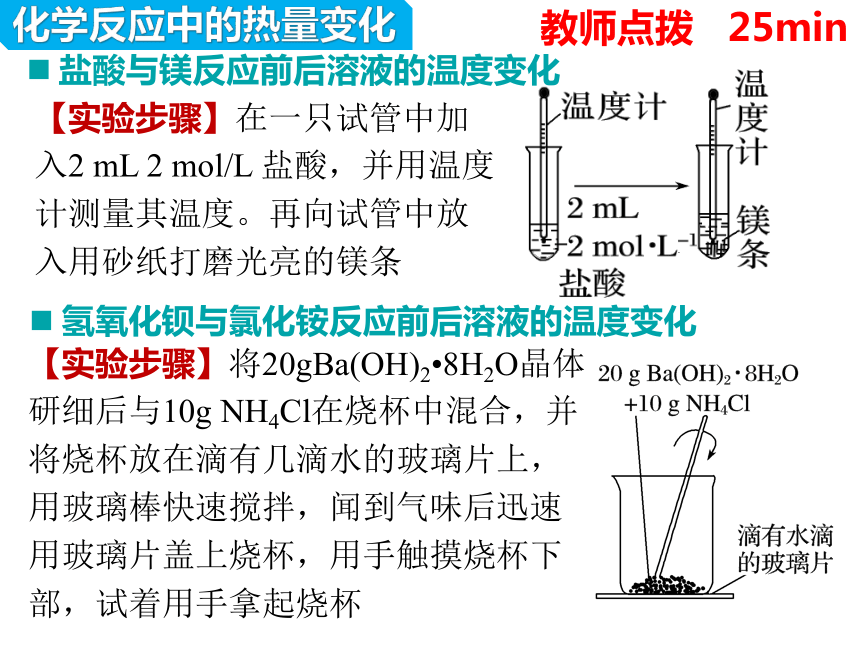
化学反应中的热量变化
教师点拨 25min
盐酸与镁反应前后溶液的温度变化
【实验步骤】在一只试管中加入2 mL 2 mol/L 盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条
氢氧化钡与氯化铵反应前后溶液的温度变化
【实验步骤】将20gBa(OH)2 8H2O晶体研细后与10g NH4Cl在烧杯中混合,并将烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯
【实验现象】
用温度计测得反应后温度升高
看到有气泡产生
化学反应中的热量变化
盐酸与镁反应前后溶液的温度变化
该反应产生________,__________热量
气体
【实验结论】
放出
化学反应中的热量变化
氢氧化钡与氯化铵反应前后溶液的温度变化
【实验现象】
闻到 气味;烧杯壁 ;
烧杯内的反应物呈________
烧杯与玻璃片间的水________
刺激性
发凉
结冰
糊状
【实验结论】
该反应产生 , 热量
NH3和H2O
吸收
化学反应中总会伴随着能量变化,通常主要表现为热能的变化,有的放出热量,有的吸收热量。
化学反应的能量变化。
除转化为热能外,还转化为机械能、光、声、电等多种能量形式。
化学反应中的热量变化
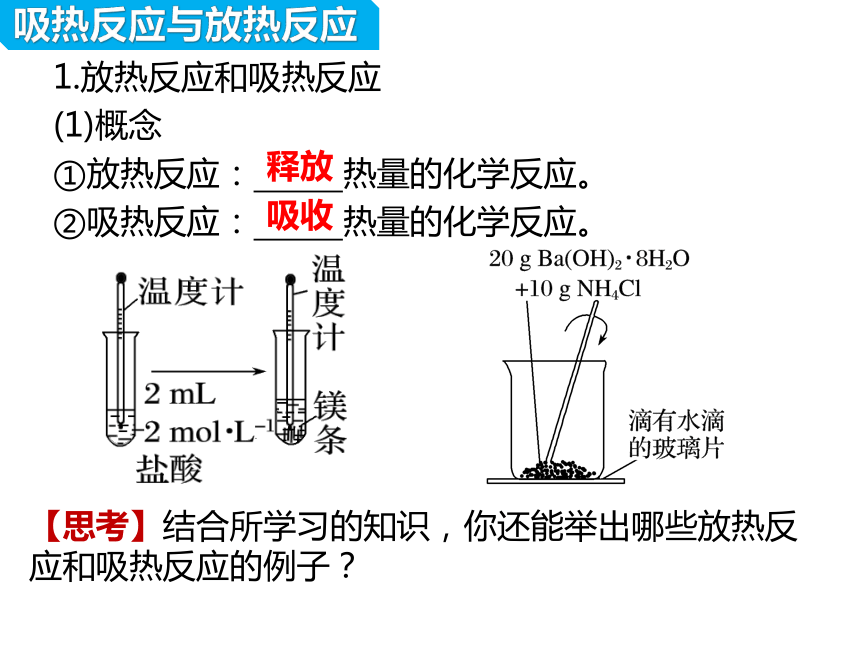
吸热反应与放热反应
1.放热反应和吸热反应
(1)概念
①放热反应: 热量的化学反应。
②吸热反应: 热量的化学反应。
释放
吸收
【思考】结合所学习的知识,你还能举出哪些放热反应和吸热反应的例子?
(2)概念常见的放热反应和吸热反应
放热反应 吸热反应
①大多数化合反应 ②所有的燃烧反应 ③酸碱中和反应 ④活泼金属与水或酸的反应 ⑤物质的缓慢氧化 ①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O与NH4Cl反应
③以C、H2、CO为还原剂的反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸的反应
放热:2H2O2 = 2H2O+O2 (分解反应)
催化剂
吸热反应与放热反应
【思考】NaOH固体或浓硫酸溶于水,溶液温度均会
升高,则NaOH固体、浓硫酸溶于水是放热反应
吸热反应与放热反应
吸热反应和放热反应都是化学变化,NaOH固体或浓硫酸溶于水溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应。
【思考】放热反应不用加热、吸热反应一定需要加热才能发生吗?
不一定,如NH4Cl晶体与Ba(OH)2·8H2O晶体常温下的反应为吸热反应,而H2和O2反应需要点燃的条件反应,为放热反应。
反应吸热还是放热与反应条件无关
放热反应常温下不一定容易发生
①⑧
燃烧 (放)
分解反应 (吸)
C作还原剂(吸)
CO作还原剂(吸)
吸热
C作还原剂(吸)
液化-放热过程(物理变化)
化合反应(放)
实战演练
化学反应中能量变化的原因
【思考】化学反应过程中为什么会有能量变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
化学反应本质:
吸收能量
释放能量
微观角度
旧化学键的断裂、新化学键形成的过程
吸收
吸热
释放
放热
例: H2(g)+Cl2(g)=2HCl(g)的反应过程如图所示:
根据上图计算1 mol H2和1 mol Cl2断键吸收的总能量为 kJ,形成2 mol HCl共释放 kJ能量,断键吸收的总能量 成键释放的总能量,因此该反应为 反应。
679
862
放热
<
化学反应中能量变化的原因
吸收
释放
吸收
形成 2 mol
H-Cl键放出2×431 kJ即862 kJ 能量
化学反应中能量变化的原因
能量
反应进程
H
Cl
Cl -
H -
H-Cl
H-Cl
断1 mol H-H键吸收436kJ
断1 mol Cl-Cl键吸收243kJ
H
Cl
Cl
H
放出能量183kJ
从化学键变化导致能量变化角度放热、吸热反应的能量随反应过程的变化图。(微观探析)
放热反应
吸热反应
化学反应中能量变化的原因
放热反应:化学能转化为热能
吸热反应:热能转化为化学能
各种物质都具有能量,物质的组成、结构、状态不同,所具有的能量也不同。化学反应中能量变化决定于反应物的总能量和生成物的总能量的相对大小
一般能量越低物质越稳定。
化学反应中能量变化的原因
放热、吸热反应反应物与生成物的总能量随反应过程的变化图(宏观辨识)
放热反应
反应物总能量<生成物总能量
反应物总能量 > 生成物总能量
吸热反应
化学反应中能量变化的原因
一个化学反应是放热反应还是吸热反应取决于:
①断键吸收的总能量Q吸 Vs 成键放出的总能量Q放
②反应物的总能量E反 Vs 生成物的总能量E生
反应物
E反
E生
生成物
断键 Q吸
成键 Q放
放热反应
归纳总结
反应物
E反
E生
生成物
断键 Q吸
成键 Q放
吸热反应
Q吸<Q放
Q吸>Q放
1.下列各组变化中,前者属于吸热反应,
后者属于放热反应的是( )
A.生石灰与水反应;醋酸与氢氧化钠反应
B.煅烧石灰石;碳酸氢钠与盐酸反应
C.Ba(OH)2·8H2O与NH4Cl反应;钠与水反应
D.甲烷的燃烧;过氧化氢的分解
放热反应
吸热反应
放热反应
放热反应
吸热反应
吸热反应
放热反应
放热反应
C
实战演练
2.下列有关化学能与热能的说法正确的是( )
A.氢气和氯气的反应属于吸热反应
B.H2―→H+H的变化需要吸收能量
C.凡经加热而发生的化学反应都是吸热反应
D.冰融化成水属于吸热反应
B
放热反应
木柴燃烧等也需要加热,但是属于放热反应
冰融化成水属于物理变化,不是化学变化
实战演练
3.某反应由两步反应A B C构成,
它的反应能量曲线如图,下列叙述正确的是( )
A.三种化合物中C最稳定
B.两步反应均为吸热反应
C.A与C的能量差为E4
D.A B反应,反应条件一定要加热
A
放热反应
吸热反应
[能力达成]
A与C的能量差为ΔH=(E1-E2)+(E3-E4)
=E1+E3-E2-E4
4.根据下列信息判断氢气燃烧生成水时的热量变化,
其中一定正确的是( )
A.H2(g)分解为2H(g)属于化学变化
B.生成1 mol H2O时吸收热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为
乙>甲>丙
D.氢气和氧气的总能量小于水的能量
只涉及旧化学键的断裂
放热反应
断键吸收热量,成键释放能量
反应物总能量高于生成物总能量
C
第一节 化学反应与能量变化
第一课时 化学反应与热能
第六章 化学反应与能量
1. 知道化学反应可以实现化学能与其他能量形式的转化
2.体会提高燃料的燃烧效率、开发新能源的重要性。
学习目标
(1)风能、氢能、石油等能源属于可再生能源。( )
(2)固体煤变为气体燃料后,燃烧效率会更低。( )
(3)现在储氢技术难题已经解决,氢燃料将被广泛应用。 ( )
(4)化石燃料的过度利用可能带来温室效应等问题。
( )
(正确的打“√”,错误的打“×”)
×
√
×
×
石油为化石燃料,属于不可再生能源
接触面积增大,且物质燃烧更加充分,燃烧效率更高
实战演练
化学能与热能相互转化的应用
教师点拨 20min
人类利用能源的三个阶段
柴草时期——树枝杂草
化石能源时期——煤、石油、天然气
多能源结构时期——太阳能、氢能、核能、风能、地热能等
现阶段人类获取热能的主要途径 —— 物质的燃烧
化学能与热能相互转化的应用
煤的燃烧
石油的燃烧
天然气的燃烧
大气污染物:
化石燃料储量有限,短期内不可再生。
弊端
粉尘、SO2、NOx、CO
[思考]为了改善人类的生存环境,促进社会可持续发展,有哪些节能减排的措施?
化学能与热能相互转化的应用
①在燃料燃烧阶段,可以通过改进锅炉的炉型何燃
料的空气比、清洁积灰等方法,提高燃料的燃烧效率。
②在能量利用阶段,可通过使用节能灯、改进电
动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
③开发使用新能源,目前人们比较关注的新能源有太阳能、风能、地热能、海洋能和氢能等。
太阳能
1.甲烷燃烧反应能提供能量是因为( )A.甲烷的能量高B.生成物分子形成化学键释放能量C.破坏反应物分子化学键所吸收的能量小于形成生成物分子化学键所释放的能量D.破坏反应物分子化学键所吸收的能量大于形成生成物分子化学键所释放的能量
应该为甲烷和氧气的总能量高
C
实战演练
2.下列反应或过程中能量的变化符合图像的是( )
A.H+H―→H—HB.2NH4Cl+Ba(OH)2·8H2O=BaCl2+2NH3↑+10H2OC.Mg+2HCl=MgCl2+H2↑D.H2SO4+2KOH=K2SO4+2H2O
吸热反应
形成化学键的过程中会放出能量
吸热反应
放热反应
放热反应
B
实战演练
3.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol H2中的化学键消耗的能量为Q1 kJ,破坏1 mol Cl2中的化学键消耗的能量为Q2 kJ,形成1 mol HCl中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是( )A.Q1+Q2>Q3
B.Q1+Q2>2Q3C.Q1+Q2D.Q1+Q2<2Q3
H2(g)+Cl2(g)=2HCl(g)
放热反应
D
实战演练
4.某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:(1)①甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图所示实验。
X溶液是________,滴入的量一般为______滴。②乙同学认为甲同学的实验不能充分证明氢氧化钠溶液与稀盐酸能够发生反应,乙同学的理由是_________________________________________
酚酞溶液
甲同学的实验不能说明是盐酸与氢氧化钠溶液发生了反应还是盐酸与红色物质发生了反应
1~2
(2)丙同学利用“保温瓶式量热计”(图略),测出10 mL 10%氢氧化钠溶液和不同体积的10%盐酸混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
就此实验回答下列问题:①盐酸和氢氧化钠的反应是________(填“吸热”或“放热”)反应。②请在下图中绘制出溶液的温度变化与加入盐酸体积之间的变化关系图。
放热
第一节 化学反应与能量变化
第一课时 化学反应与热能
第六章 化学反应与能量
1. 认识物质具有能量,了解吸热反应与放热反应的概念。
2. 从化学键的角度理解吸热反应与放热反应
3. 学会从能量角度判断吸热反应与放热反应
学习目标
(1)放热反应发生不需要加热。 ( )(2)有热量变化的物质变化一定是化学变化。
( )(3)所有化学反应都伴随着能量的变化。 ( )(4)有能量放出的变化都是放热反应,吸收能量的变化都是吸热反应。 ( )
(正确的打“√”,错误的打“×”)
×
×
√
×
碳的燃烧是放热反应,需要加热
物理变化时也可能伴随能量变化,如气态水液化会放出热量
NaOH 固体溶于水释放能量,NH4NO3固体溶于水吸收能量,但二者均属于物理变化,不是化学反应。
实战演练
现代社会中,人类的一切活动(从衣食住行到文化娱乐,从社会生产到学科研究等)都离不开能量,而许多能量的利用与化学反应中能量变化密切相关。
从煤、石油、天然气等燃料燃烧提供的热能,到各种化学电池提供的电能,都是通过化学反应获得的。
化学反应中的能量变化通常表现为热量的变化,例如化石燃料燃烧会释放大量的热,除了燃烧,其他化学反应也伴随着放热或吸热现象。
新课导入
化学反应中的热量变化
教师点拨 25min
盐酸与镁反应前后溶液的温度变化
【实验步骤】在一只试管中加入2 mL 2 mol/L 盐酸,并用温度计测量其温度。再向试管中放入用砂纸打磨光亮的镁条
氢氧化钡与氯化铵反应前后溶液的温度变化
【实验步骤】将20gBa(OH)2 8H2O晶体研细后与10g NH4Cl在烧杯中混合,并将烧杯放在滴有几滴水的玻璃片上,用玻璃棒快速搅拌,闻到气味后迅速用玻璃片盖上烧杯,用手触摸烧杯下部,试着用手拿起烧杯
【实验现象】
用温度计测得反应后温度升高
看到有气泡产生
化学反应中的热量变化
盐酸与镁反应前后溶液的温度变化
该反应产生________,__________热量
气体
【实验结论】
放出
化学反应中的热量变化
氢氧化钡与氯化铵反应前后溶液的温度变化
【实验现象】
闻到 气味;烧杯壁 ;
烧杯内的反应物呈________
烧杯与玻璃片间的水________
刺激性
发凉
结冰
糊状
【实验结论】
该反应产生 , 热量
NH3和H2O
吸收
化学反应中总会伴随着能量变化,通常主要表现为热能的变化,有的放出热量,有的吸收热量。
化学反应的能量变化。
除转化为热能外,还转化为机械能、光、声、电等多种能量形式。
化学反应中的热量变化
吸热反应与放热反应
1.放热反应和吸热反应
(1)概念
①放热反应: 热量的化学反应。
②吸热反应: 热量的化学反应。
释放
吸收
【思考】结合所学习的知识,你还能举出哪些放热反应和吸热反应的例子?
(2)概念常见的放热反应和吸热反应
放热反应 吸热反应
①大多数化合反应 ②所有的燃烧反应 ③酸碱中和反应 ④活泼金属与水或酸的反应 ⑤物质的缓慢氧化 ①大多数分解反应
②铵盐与碱的反应,如Ba(OH)2·8H2O与NH4Cl反应
③以C、H2、CO为还原剂的反应,如C与H2O(g)反应,C与CO2反应
④NaHCO3与盐酸的反应
放热:2H2O2 = 2H2O+O2 (分解反应)
催化剂
吸热反应与放热反应
【思考】NaOH固体或浓硫酸溶于水,溶液温度均会
升高,则NaOH固体、浓硫酸溶于水是放热反应
吸热反应与放热反应
吸热反应和放热反应都是化学变化,NaOH固体或浓硫酸溶于水溶于水是放热过程,但不是放热反应;如升华、蒸发等过程是吸热过程,但不是吸热反应。
【思考】放热反应不用加热、吸热反应一定需要加热才能发生吗?
不一定,如NH4Cl晶体与Ba(OH)2·8H2O晶体常温下的反应为吸热反应,而H2和O2反应需要点燃的条件反应,为放热反应。
反应吸热还是放热与反应条件无关
放热反应常温下不一定容易发生
①⑧
燃烧 (放)
分解反应 (吸)
C作还原剂(吸)
CO作还原剂(吸)
吸热
C作还原剂(吸)
液化-放热过程(物理变化)
化合反应(放)
实战演练
化学反应中能量变化的原因
【思考】化学反应过程中为什么会有能量变化?为什么有的化学反应释放热量,有的化学反应吸收热量?
化学反应本质:
吸收能量
释放能量
微观角度
旧化学键的断裂、新化学键形成的过程
吸收
吸热
释放
放热
例: H2(g)+Cl2(g)=2HCl(g)的反应过程如图所示:
根据上图计算1 mol H2和1 mol Cl2断键吸收的总能量为 kJ,形成2 mol HCl共释放 kJ能量,断键吸收的总能量 成键释放的总能量,因此该反应为 反应。
679
862
放热
<
化学反应中能量变化的原因
吸收
释放
吸收
形成 2 mol
H-Cl键放出2×431 kJ即862 kJ 能量
化学反应中能量变化的原因
能量
反应进程
H
Cl
Cl -
H -
H-Cl
H-Cl
断1 mol H-H键吸收436kJ
断1 mol Cl-Cl键吸收243kJ
H
Cl
Cl
H
放出能量183kJ
从化学键变化导致能量变化角度放热、吸热反应的能量随反应过程的变化图。(微观探析)
放热反应
吸热反应
化学反应中能量变化的原因
放热反应:化学能转化为热能
吸热反应:热能转化为化学能
各种物质都具有能量,物质的组成、结构、状态不同,所具有的能量也不同。化学反应中能量变化决定于反应物的总能量和生成物的总能量的相对大小
一般能量越低物质越稳定。
化学反应中能量变化的原因
放热、吸热反应反应物与生成物的总能量随反应过程的变化图(宏观辨识)
放热反应
反应物总能量<生成物总能量
反应物总能量 > 生成物总能量
吸热反应
化学反应中能量变化的原因
一个化学反应是放热反应还是吸热反应取决于:
①断键吸收的总能量Q吸 Vs 成键放出的总能量Q放
②反应物的总能量E反 Vs 生成物的总能量E生
反应物
E反
E生
生成物
断键 Q吸
成键 Q放
放热反应
归纳总结
反应物
E反
E生
生成物
断键 Q吸
成键 Q放
吸热反应
Q吸<Q放
Q吸>Q放
1.下列各组变化中,前者属于吸热反应,
后者属于放热反应的是( )
A.生石灰与水反应;醋酸与氢氧化钠反应
B.煅烧石灰石;碳酸氢钠与盐酸反应
C.Ba(OH)2·8H2O与NH4Cl反应;钠与水反应
D.甲烷的燃烧;过氧化氢的分解
放热反应
吸热反应
放热反应
放热反应
吸热反应
吸热反应
放热反应
放热反应
C
实战演练
2.下列有关化学能与热能的说法正确的是( )
A.氢气和氯气的反应属于吸热反应
B.H2―→H+H的变化需要吸收能量
C.凡经加热而发生的化学反应都是吸热反应
D.冰融化成水属于吸热反应
B
放热反应
木柴燃烧等也需要加热,但是属于放热反应
冰融化成水属于物理变化,不是化学变化
实战演练
3.某反应由两步反应A B C构成,
它的反应能量曲线如图,下列叙述正确的是( )
A.三种化合物中C最稳定
B.两步反应均为吸热反应
C.A与C的能量差为E4
D.A B反应,反应条件一定要加热
A
放热反应
吸热反应
[能力达成]
A与C的能量差为ΔH=(E1-E2)+(E3-E4)
=E1+E3-E2-E4
4.根据下列信息判断氢气燃烧生成水时的热量变化,
其中一定正确的是( )
A.H2(g)分解为2H(g)属于化学变化
B.生成1 mol H2O时吸收热量245 kJ
C.甲、乙、丙中物质所具有的总能量大小关系为
乙>甲>丙
D.氢气和氧气的总能量小于水的能量
只涉及旧化学键的断裂
放热反应
断键吸收热量,成键释放能量
反应物总能量高于生成物总能量
C
第一节 化学反应与能量变化
第一课时 化学反应与热能
第六章 化学反应与能量
1. 知道化学反应可以实现化学能与其他能量形式的转化
2.体会提高燃料的燃烧效率、开发新能源的重要性。
学习目标
(1)风能、氢能、石油等能源属于可再生能源。( )
(2)固体煤变为气体燃料后,燃烧效率会更低。( )
(3)现在储氢技术难题已经解决,氢燃料将被广泛应用。 ( )
(4)化石燃料的过度利用可能带来温室效应等问题。
( )
(正确的打“√”,错误的打“×”)
×
√
×
×
石油为化石燃料,属于不可再生能源
接触面积增大,且物质燃烧更加充分,燃烧效率更高
实战演练
化学能与热能相互转化的应用
教师点拨 20min
人类利用能源的三个阶段
柴草时期——树枝杂草
化石能源时期——煤、石油、天然气
多能源结构时期——太阳能、氢能、核能、风能、地热能等
现阶段人类获取热能的主要途径 —— 物质的燃烧
化学能与热能相互转化的应用
煤的燃烧
石油的燃烧
天然气的燃烧
大气污染物:
化石燃料储量有限,短期内不可再生。
弊端
粉尘、SO2、NOx、CO
[思考]为了改善人类的生存环境,促进社会可持续发展,有哪些节能减排的措施?
化学能与热能相互转化的应用
①在燃料燃烧阶段,可以通过改进锅炉的炉型何燃
料的空气比、清洁积灰等方法,提高燃料的燃烧效率。
②在能量利用阶段,可通过使用节能灯、改进电
动机的材料和结构,以及发电厂、钢铁厂余热与城市供热联产等措施促进能源循环利用,有效提高能源利用率。
③开发使用新能源,目前人们比较关注的新能源有太阳能、风能、地热能、海洋能和氢能等。
太阳能
1.甲烷燃烧反应能提供能量是因为( )A.甲烷的能量高B.生成物分子形成化学键释放能量C.破坏反应物分子化学键所吸收的能量小于形成生成物分子化学键所释放的能量D.破坏反应物分子化学键所吸收的能量大于形成生成物分子化学键所释放的能量
应该为甲烷和氧气的总能量高
C
实战演练
2.下列反应或过程中能量的变化符合图像的是( )
A.H+H―→H—HB.2NH4Cl+Ba(OH)2·8H2O=BaCl2+2NH3↑+10H2OC.Mg+2HCl=MgCl2+H2↑D.H2SO4+2KOH=K2SO4+2H2O
吸热反应
形成化学键的过程中会放出能量
吸热反应
放热反应
放热反应
B
实战演练
3.氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1 mol H2中的化学键消耗的能量为Q1 kJ,破坏1 mol Cl2中的化学键消耗的能量为Q2 kJ,形成1 mol HCl中的化学键释放的能量为Q3 kJ。下列关系式中,正确的是( )A.Q1+Q2>Q3
B.Q1+Q2>2Q3C.Q1+Q2
H2(g)+Cl2(g)=2HCl(g)
放热反应
D
实战演练
4.某校兴趣小组对氢氧化钠溶液和稀盐酸混合后的有关问题,进行了如下探究:(1)①甲同学为了证明氢氧化钠溶液与稀盐酸能够发生反应,设计并完成了如图所示实验。
X溶液是________,滴入的量一般为______滴。②乙同学认为甲同学的实验不能充分证明氢氧化钠溶液与稀盐酸能够发生反应,乙同学的理由是_________________________________________
酚酞溶液
甲同学的实验不能说明是盐酸与氢氧化钠溶液发生了反应还是盐酸与红色物质发生了反应
1~2
(2)丙同学利用“保温瓶式量热计”(图略),测出10 mL 10%氢氧化钠溶液和不同体积的10%盐酸混合过程中,溶液的温度变化见下表(假设两溶液密度相同)。
就此实验回答下列问题:①盐酸和氢氧化钠的反应是________(填“吸热”或“放热”)反应。②请在下图中绘制出溶液的温度变化与加入盐酸体积之间的变化关系图。
放热
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
