9.3溶液的浓度同步练习(含答案)人教版化学九年级下册
文档属性
| 名称 | 9.3溶液的浓度同步练习(含答案)人教版化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 627.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-10 00:00:00 | ||
图片预览


文档简介
9.3溶液的浓度
一、多选题
1.现有10gMg(OH)2和MgCO3的固体混合物,在室温条件下,将该混合物与100 g稀硫酸混合,恰好完全反应,得到107.8 g不饱和溶液。下列有关说法中,正确的是
A.生成二氧化碳气体的质量为4.4 g
B.原混合物中镁元素的的质量为3.6 g
C.混合物中碳元素和氢元素的质量比为3:1
D.所用稀硫酸的溶质质量分数为9.8%
2.根据溶解度表中相关数据,下列说法不正确的是
温度/℃ 0 20 40 60 80
溶解度/g 氯化钠 35.7 36.0 36.3 37.3 38.4
硝酸钾 13.3 31.6 63.9 110 169
A.20℃时,氯化钠饱和溶液的质量分数为 36%
B.可以用降温结晶的方法除去硝酸钾中混有的少量氯化钠
C.20℃~40℃,氯化钠和硝酸钾的溶解度可能相等
D.60℃时,硝酸钾的饱和溶液中不能再溶解氯化钠
3.实验室为了测定过氧化氢溶液的质量分数,称取85.00gH2O2溶液和2.0gMnO2混合放入质量为50.00g的烧杯中,用电子天平称得烧杯及内容物的总质量随时间变化如下
时间/S 15 30 45 60 75 90
烧杯及内容物的总质量/g 136.60 136.20 135.80 135.50 135.40 135.40
根据表格中的数据进行计算,结果正确的是
A.90s时,产生O2的质量为1.60g
B.过氧化氢溶液中溶质的质量分数4.0%
C.90s时,MnO2的质量为2.0g
D.30s时,过氧化氢反应掉60%
4.现有9.4 gCaCO3和K2CO3的固体混合物,将该混合物与100g稀盐酸混合,恰好完全反应,所得不饱和溶液的质量为106.1g,则下列判断中,正确的是
A.原固体混合物中含氧元素的质量为3.6g
B.原固体混合物中金属元素的质量为4.9g
C.稀盐酸中氢元素的质量为0.15
D.所用稀盐酸的溶质质量分数为7.3%
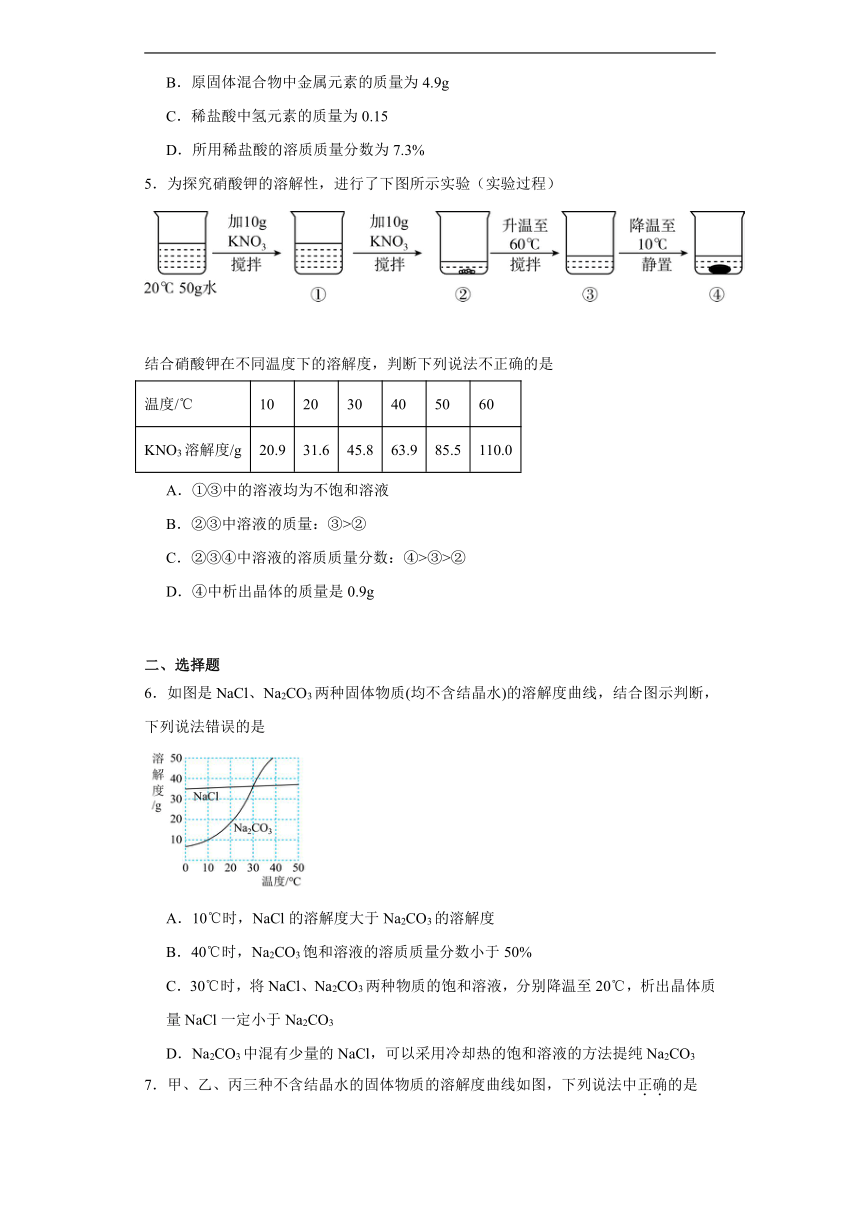
5.为探究硝酸钾的溶解性,进行了下图所示实验(实验过程)
结合硝酸钾在不同温度下的溶解度,判断下列说法不正确的是
温度/℃ 10 20 30 40 50 60
KNO3溶解度/g 20.9 31.6 45.8 63.9 85.5 110.0
A.①③中的溶液均为不饱和溶液
B.②③中溶液的质量:③>②
C.②③④中溶液的溶质质量分数:④>③>②
D.④中析出晶体的质量是0.9g
二、选择题
6.如图是NaCl、Na2CO3两种固体物质(均不含结晶水)的溶解度曲线,结合图示判断,下列说法错误的是
A.10℃时,NaCl的溶解度大于Na2CO3的溶解度
B.40℃时,Na2CO3饱和溶液的溶质质量分数小于50%
C.30℃时,将NaCl、Na2CO3两种物质的饱和溶液,分别降温至20℃,析出晶体质量NaCl一定小于Na2CO3
D.Na2CO3中混有少量的NaCl,可以采用冷却热的饱和溶液的方法提纯Na2CO3
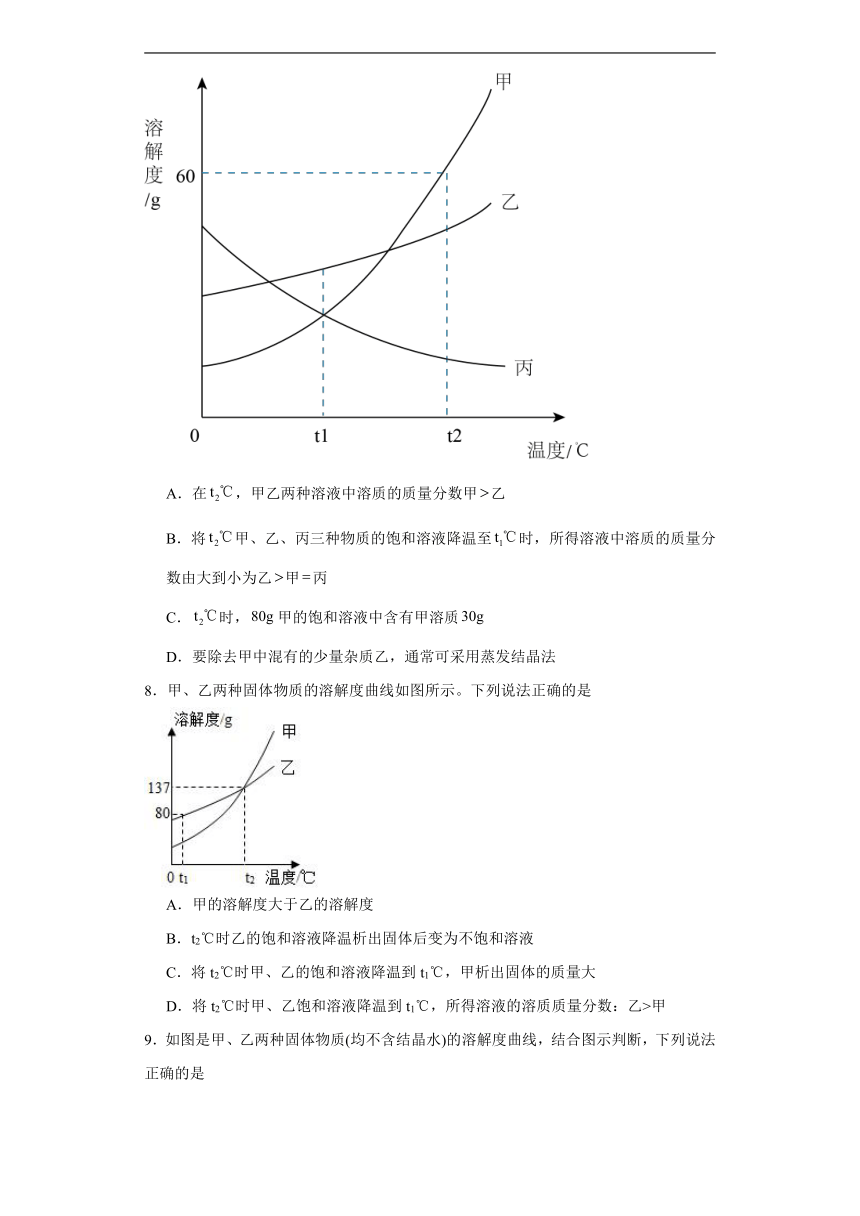
7.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图,下列说法中正确的是
A.在,甲乙两种溶液中溶质的质量分数甲乙
B.将甲、乙、丙三种物质的饱和溶液降温至时,所得溶液中溶质的质量分数由大到小为乙甲丙
C.时,甲的饱和溶液中含有甲溶质
D.要除去甲中混有的少量杂质乙,通常可采用蒸发结晶法
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.t2℃时乙的饱和溶液降温析出固体后变为不饱和溶液
C.将t2℃时甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大
D.将t2℃时甲、乙饱和溶液降温到t1℃,所得溶液的溶质质量分数:乙>甲
9.如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,结合图示判断,下列说法正确的是
A.20℃时甲、乙溶液中溶质质量相等
B.30℃时甲的饱和溶液中溶质的质量分数为 60%
C.20℃时甲、乙的饱和溶液中溶质的质量分数相等
D.甲中混有少量乙时,可采取蒸发结晶的方法提纯甲
10.甲、乙的溶解度曲线如图所示。下列有关说法不正确的是( )
A.t1℃时,甲、乙两种饱和溶液中溶质的质量相等
B.乙的饱和溶液从t2℃降温到t1℃,溶液仍饱和
C.甲、乙的饱和溶液分别从t2℃降温到t1℃,两溶液中溶质质量分数相等
D.t2℃时,用等质量的甲和乙固体配制饱和溶液,得到乙溶液的质量大于甲
11.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,三种物质的溶解度:乙>甲>丙
B.20 ℃时,将30 g甲放入50 g水中,充分搅拌,所得溶液的质量是80 g
C.分别将t2 ℃时三种物质的饱和溶液降温到t1℃,乙溶液中析出的固体质量最大
D.分别将t1 ℃时三种物质的饱和溶液升温到t2℃,溶液中溶质的质量分数:乙>甲>丙
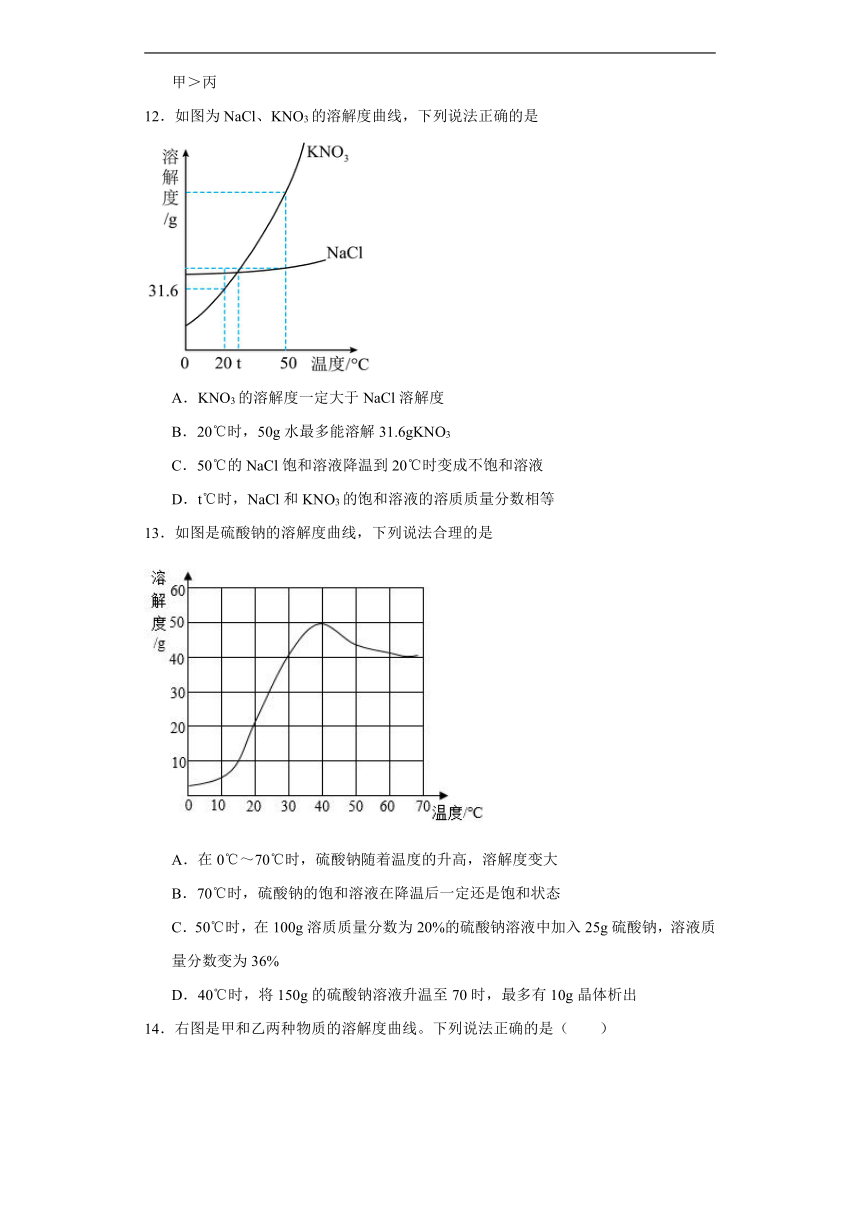
12.如图为NaCl、KNO3的溶解度曲线,下列说法正确的是
A.KNO3的溶解度一定大于NaCl溶解度
B.20℃时,50g水最多能溶解31.6gKNO3
C.50℃的NaCl饱和溶液降温到20℃时变成不饱和溶液
D.t℃时,NaCl和KNO3的饱和溶液的溶质质量分数相等
13.如图是硫酸钠的溶解度曲线,下列说法合理的是
A.在0℃~70℃时,硫酸钠随着温度的升高,溶解度变大
B.70℃时,硫酸钠的饱和溶液在降温后一定还是饱和状态
C.50℃时,在100g溶质质量分数为20%的硫酸钠溶液中加入25g硫酸钠,溶液质量分数变为36%
D.40℃时,将150g的硫酸钠溶液升温至70时,最多有10g晶体析出
14.右图是甲和乙两种物质的溶解度曲线。下列说法正确的是( )
A.10℃时,甲与乙的饱和溶液中溶质质量相同
B.20℃时,100g甲的饱和溶液中含40g甲
C.30℃时,甲饱和溶液的溶质质量分数为60%
D.30℃时,甲、乙饱和溶液降温都将有晶体析出
15.下列实验方案不正确的是
选项 实验目的 实验方案
A 除去银粉中锌粉 加入过量的稀盐酸,充分反应后过滤、洗涤、干燥
B 验证Mg、Cu、Ag的金属活动性 向硫酸镁溶液和硝酸银溶液中各放入一根铜丝,观察现象
C 除去ZnSO4溶液中的CuSO4 加入过量锌粉充分反应后,过滤
D 配制10%的NaOH溶液 将10 gNaOH放入100g水中完全溶解
A.A B.B C.C D.D
三、综合应用题
16.人类文明进步与金属材料发展关系十分密切,种类繁多的金属材料已成为社会发展的重要物质基础。
(1)众多的金属材料中,铝、铁、铜及其合金一直在人类生产、生活中占据着主导地位。试回答下列问题:
①铝制品具有很好的抗腐蚀性,其原因是铝在空气中易与氧气发生反应,生成一层致密而坚固的 薄膜(填化学式)。
②铁的化学性质比较活泼,在潮湿的空气中容易生锈,工人师傅常用稀盐酸去除铁锈,其反应的化学方程式为 。
③铜质的器皿长期暴露在潮湿空气中会长出一层绿色的铜锈,铜锈的主要成分是碱式碳酸铜。小雪同学认为铜的锈蚀是铜与空气中水蒸气、氧气共同作用的结果,对于这个结论你认为还应补充的一个重要影响因素是 (填化学式)。
④世界年产量前三位的金属分别是铁、铝、铜,为验证这三种金属的活动性顺序,选取了下列四组药品,其中不可行的是 (填选项序号之一)。
A.溶液
B.溶液
C.溶液、溶液
D.溶液、溶液
⑤某化学小组的同学利用废铜制取硫酸铜,设计了如下甲、乙两个方案:
甲:
乙:(已知:)
从环保的角度出发,方案一更合理的理由是 。
(2)化学小组的同学取溶液于烧杯中,然后向烧杯中逐滴加入溶质质量分数为8%的溶液,反应过程中产生沉淀的质量与所滴入溶液的质量关系曲线如图所示,试回答:
①当滴入溶液时(即图中B点),烧杯中溶液里大量存在的酸根阴离子是 (填离子符号)。
②恰好反应时,产生沉淀的质量是 g(计算结果精确至)。
③试通过计算,求所取用的溶液的溶质质量分数(计算结果精确至0.1%) 。
17.食盐是生产生活中常见的物质,自然界中氯化钠储量很大,海水中氯化钠的含量在2%~3%。
(1)构成氯化钠的阳离子是 (填微粒符号)。
(2)据记载,炎帝时期人们就掌握了熬煮海水获得食盐的技术。这种技术与实验室的 (填操作名称)原理相同。
(3)科学家从海水中取样,根据样品中氯化钠和海水的质量比,进而计算出海水中大致的含盐量,理由是溶液具有 性。
(4)配制100g2%的食盐水并模拟熬煮海水实验。
①配制该溶液的正确操作顺序是: (填序号)。
②量取上述实验所需蒸馏水时,选用的仪器是 (填字母)。
a.100mL烧杯 b.100mL量筒 c.50mL烧杯 b.50mL量筒
③为加快氯化钠的溶解速率,可采用的措施有 。
④模拟熬煮海水时,需用玻璃棒搅拌的目的是 。
(5)现有60℃时100g20%的氯化钠溶液,恒温蒸发 g(结果保留整数)水后开始有晶体析出,并在下图中画出析出氯化钠的质量与蒸发水的质量关系 。
已知:60℃时,氯化钠的溶解度约为37g。
18.温州产盐历史悠久,盐产品在日常生活、工业生产中有广泛用途。
(1)用下图方法可进行粗盐提纯,其中操作②的名称为 。
(2)海水晒盐过程中,还能得到氯化镁(MgCl2)。工业上利用氯化镁在通电条件下分解,获得镁和氯气(Cl2)。写出这一反应的化学方程式: 。
(3)腌制咸鸭蛋需要合适溶质质量分数的食盐水。现有10千克溶质质量分数为25%的食盐水,若将其稀释到20%,需加水多少千克?
参考答案:
1.BC
2.AD
3.ABC
4.AB
5.CD
6.C
7.C
8.D
9.C
10.A
11.D
12.D
13.D
14.D
15.D
16.(1) B 方案二中会产生,污染空气(其他合理答案可得分)
(2) 7.84 解:设的质量为x
则溶液的溶质质量分数为:,
答:溶液的溶质质量分数为12.8%。
17.(1)
(2)蒸发
(3)均一
(4) ACDB b 搅拌、加热、或将氯化钠研磨成细小颗粒等(答案合理即可) 使液体受热均匀,防止因局部温度过高造成液滴飞
(5)
18.(1)过滤
(2)
(3)设需要水的质量为,根据稀释前后溶质的质量不变列式,,。
一、多选题
1.现有10gMg(OH)2和MgCO3的固体混合物,在室温条件下,将该混合物与100 g稀硫酸混合,恰好完全反应,得到107.8 g不饱和溶液。下列有关说法中,正确的是
A.生成二氧化碳气体的质量为4.4 g
B.原混合物中镁元素的的质量为3.6 g
C.混合物中碳元素和氢元素的质量比为3:1
D.所用稀硫酸的溶质质量分数为9.8%
2.根据溶解度表中相关数据,下列说法不正确的是
温度/℃ 0 20 40 60 80
溶解度/g 氯化钠 35.7 36.0 36.3 37.3 38.4
硝酸钾 13.3 31.6 63.9 110 169
A.20℃时,氯化钠饱和溶液的质量分数为 36%
B.可以用降温结晶的方法除去硝酸钾中混有的少量氯化钠
C.20℃~40℃,氯化钠和硝酸钾的溶解度可能相等
D.60℃时,硝酸钾的饱和溶液中不能再溶解氯化钠
3.实验室为了测定过氧化氢溶液的质量分数,称取85.00gH2O2溶液和2.0gMnO2混合放入质量为50.00g的烧杯中,用电子天平称得烧杯及内容物的总质量随时间变化如下
时间/S 15 30 45 60 75 90
烧杯及内容物的总质量/g 136.60 136.20 135.80 135.50 135.40 135.40
根据表格中的数据进行计算,结果正确的是
A.90s时,产生O2的质量为1.60g
B.过氧化氢溶液中溶质的质量分数4.0%
C.90s时,MnO2的质量为2.0g
D.30s时,过氧化氢反应掉60%
4.现有9.4 gCaCO3和K2CO3的固体混合物,将该混合物与100g稀盐酸混合,恰好完全反应,所得不饱和溶液的质量为106.1g,则下列判断中,正确的是
A.原固体混合物中含氧元素的质量为3.6g
B.原固体混合物中金属元素的质量为4.9g
C.稀盐酸中氢元素的质量为0.15
D.所用稀盐酸的溶质质量分数为7.3%
5.为探究硝酸钾的溶解性,进行了下图所示实验(实验过程)
结合硝酸钾在不同温度下的溶解度,判断下列说法不正确的是
温度/℃ 10 20 30 40 50 60
KNO3溶解度/g 20.9 31.6 45.8 63.9 85.5 110.0
A.①③中的溶液均为不饱和溶液
B.②③中溶液的质量:③>②
C.②③④中溶液的溶质质量分数:④>③>②
D.④中析出晶体的质量是0.9g
二、选择题
6.如图是NaCl、Na2CO3两种固体物质(均不含结晶水)的溶解度曲线,结合图示判断,下列说法错误的是
A.10℃时,NaCl的溶解度大于Na2CO3的溶解度
B.40℃时,Na2CO3饱和溶液的溶质质量分数小于50%
C.30℃时,将NaCl、Na2CO3两种物质的饱和溶液,分别降温至20℃,析出晶体质量NaCl一定小于Na2CO3
D.Na2CO3中混有少量的NaCl,可以采用冷却热的饱和溶液的方法提纯Na2CO3
7.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图,下列说法中正确的是
A.在,甲乙两种溶液中溶质的质量分数甲乙
B.将甲、乙、丙三种物质的饱和溶液降温至时,所得溶液中溶质的质量分数由大到小为乙甲丙
C.时,甲的饱和溶液中含有甲溶质
D.要除去甲中混有的少量杂质乙,通常可采用蒸发结晶法
8.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是
A.甲的溶解度大于乙的溶解度
B.t2℃时乙的饱和溶液降温析出固体后变为不饱和溶液
C.将t2℃时甲、乙的饱和溶液降温到t1℃,甲析出固体的质量大
D.将t2℃时甲、乙饱和溶液降温到t1℃,所得溶液的溶质质量分数:乙>甲
9.如图是甲、乙两种固体物质(均不含结晶水)的溶解度曲线,结合图示判断,下列说法正确的是
A.20℃时甲、乙溶液中溶质质量相等
B.30℃时甲的饱和溶液中溶质的质量分数为 60%
C.20℃时甲、乙的饱和溶液中溶质的质量分数相等
D.甲中混有少量乙时,可采取蒸发结晶的方法提纯甲
10.甲、乙的溶解度曲线如图所示。下列有关说法不正确的是( )
A.t1℃时,甲、乙两种饱和溶液中溶质的质量相等
B.乙的饱和溶液从t2℃降温到t1℃,溶液仍饱和
C.甲、乙的饱和溶液分别从t2℃降温到t1℃,两溶液中溶质质量分数相等
D.t2℃时,用等质量的甲和乙固体配制饱和溶液,得到乙溶液的质量大于甲
11.甲、乙、丙三种不含结晶水的固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,三种物质的溶解度:乙>甲>丙
B.20 ℃时,将30 g甲放入50 g水中,充分搅拌,所得溶液的质量是80 g
C.分别将t2 ℃时三种物质的饱和溶液降温到t1℃,乙溶液中析出的固体质量最大
D.分别将t1 ℃时三种物质的饱和溶液升温到t2℃,溶液中溶质的质量分数:乙>甲>丙
12.如图为NaCl、KNO3的溶解度曲线,下列说法正确的是
A.KNO3的溶解度一定大于NaCl溶解度
B.20℃时,50g水最多能溶解31.6gKNO3
C.50℃的NaCl饱和溶液降温到20℃时变成不饱和溶液
D.t℃时,NaCl和KNO3的饱和溶液的溶质质量分数相等
13.如图是硫酸钠的溶解度曲线,下列说法合理的是
A.在0℃~70℃时,硫酸钠随着温度的升高,溶解度变大
B.70℃时,硫酸钠的饱和溶液在降温后一定还是饱和状态
C.50℃时,在100g溶质质量分数为20%的硫酸钠溶液中加入25g硫酸钠,溶液质量分数变为36%
D.40℃时,将150g的硫酸钠溶液升温至70时,最多有10g晶体析出
14.右图是甲和乙两种物质的溶解度曲线。下列说法正确的是( )
A.10℃时,甲与乙的饱和溶液中溶质质量相同
B.20℃时,100g甲的饱和溶液中含40g甲
C.30℃时,甲饱和溶液的溶质质量分数为60%
D.30℃时,甲、乙饱和溶液降温都将有晶体析出
15.下列实验方案不正确的是
选项 实验目的 实验方案
A 除去银粉中锌粉 加入过量的稀盐酸,充分反应后过滤、洗涤、干燥
B 验证Mg、Cu、Ag的金属活动性 向硫酸镁溶液和硝酸银溶液中各放入一根铜丝,观察现象
C 除去ZnSO4溶液中的CuSO4 加入过量锌粉充分反应后,过滤
D 配制10%的NaOH溶液 将10 gNaOH放入100g水中完全溶解
A.A B.B C.C D.D
三、综合应用题
16.人类文明进步与金属材料发展关系十分密切,种类繁多的金属材料已成为社会发展的重要物质基础。
(1)众多的金属材料中,铝、铁、铜及其合金一直在人类生产、生活中占据着主导地位。试回答下列问题:
①铝制品具有很好的抗腐蚀性,其原因是铝在空气中易与氧气发生反应,生成一层致密而坚固的 薄膜(填化学式)。
②铁的化学性质比较活泼,在潮湿的空气中容易生锈,工人师傅常用稀盐酸去除铁锈,其反应的化学方程式为 。
③铜质的器皿长期暴露在潮湿空气中会长出一层绿色的铜锈,铜锈的主要成分是碱式碳酸铜。小雪同学认为铜的锈蚀是铜与空气中水蒸气、氧气共同作用的结果,对于这个结论你认为还应补充的一个重要影响因素是 (填化学式)。
④世界年产量前三位的金属分别是铁、铝、铜,为验证这三种金属的活动性顺序,选取了下列四组药品,其中不可行的是 (填选项序号之一)。
A.溶液
B.溶液
C.溶液、溶液
D.溶液、溶液
⑤某化学小组的同学利用废铜制取硫酸铜,设计了如下甲、乙两个方案:
甲:
乙:(已知:)
从环保的角度出发,方案一更合理的理由是 。
(2)化学小组的同学取溶液于烧杯中,然后向烧杯中逐滴加入溶质质量分数为8%的溶液,反应过程中产生沉淀的质量与所滴入溶液的质量关系曲线如图所示,试回答:
①当滴入溶液时(即图中B点),烧杯中溶液里大量存在的酸根阴离子是 (填离子符号)。
②恰好反应时,产生沉淀的质量是 g(计算结果精确至)。
③试通过计算,求所取用的溶液的溶质质量分数(计算结果精确至0.1%) 。
17.食盐是生产生活中常见的物质,自然界中氯化钠储量很大,海水中氯化钠的含量在2%~3%。
(1)构成氯化钠的阳离子是 (填微粒符号)。
(2)据记载,炎帝时期人们就掌握了熬煮海水获得食盐的技术。这种技术与实验室的 (填操作名称)原理相同。
(3)科学家从海水中取样,根据样品中氯化钠和海水的质量比,进而计算出海水中大致的含盐量,理由是溶液具有 性。
(4)配制100g2%的食盐水并模拟熬煮海水实验。
①配制该溶液的正确操作顺序是: (填序号)。
②量取上述实验所需蒸馏水时,选用的仪器是 (填字母)。
a.100mL烧杯 b.100mL量筒 c.50mL烧杯 b.50mL量筒
③为加快氯化钠的溶解速率,可采用的措施有 。
④模拟熬煮海水时,需用玻璃棒搅拌的目的是 。
(5)现有60℃时100g20%的氯化钠溶液,恒温蒸发 g(结果保留整数)水后开始有晶体析出,并在下图中画出析出氯化钠的质量与蒸发水的质量关系 。
已知:60℃时,氯化钠的溶解度约为37g。
18.温州产盐历史悠久,盐产品在日常生活、工业生产中有广泛用途。
(1)用下图方法可进行粗盐提纯,其中操作②的名称为 。
(2)海水晒盐过程中,还能得到氯化镁(MgCl2)。工业上利用氯化镁在通电条件下分解,获得镁和氯气(Cl2)。写出这一反应的化学方程式: 。
(3)腌制咸鸭蛋需要合适溶质质量分数的食盐水。现有10千克溶质质量分数为25%的食盐水,若将其稀释到20%,需加水多少千克?
参考答案:
1.BC
2.AD
3.ABC
4.AB
5.CD
6.C
7.C
8.D
9.C
10.A
11.D
12.D
13.D
14.D
15.D
16.(1) B 方案二中会产生,污染空气(其他合理答案可得分)
(2) 7.84 解:设的质量为x
则溶液的溶质质量分数为:,
答:溶液的溶质质量分数为12.8%。
17.(1)
(2)蒸发
(3)均一
(4) ACDB b 搅拌、加热、或将氯化钠研磨成细小颗粒等(答案合理即可) 使液体受热均匀,防止因局部温度过高造成液滴飞
(5)
18.(1)过滤
(2)
(3)设需要水的质量为,根据稀释前后溶质的质量不变列式,,。
同课章节目录
