10.2酸和碱的中和反应同步练习(含答案)人教版化学九年级下册
文档属性
| 名称 | 10.2酸和碱的中和反应同步练习(含答案)人教版化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 419.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-10 11:52:09 | ||
图片预览



文档简介
10.2酸和碱的中和反应
一、多选题
1.一些国家正在试用碳酸水浇灌某些植物,其作用是
A.调节土壤的pH,改良酸性土壤
B.调节土壤的pH,改良碱性土壤,促进植物的光合作用
C.致使土壤疏松多孔
D.在植物上方形成温室
2.用盐酸和酚酞混合液浸过的滤纸,分别在滤纸上滴入下列溶液,滤纸上不会出现红色的是
A.石灰水 B.稀硫酸 C.氯化钠溶液 D.氢氧化钠
3.下列生活中的做法正确的是
A.修车师傅常用汽油洗去手上的油污
B.春季,在树干上刷石灰水,保护树木
C.冬季雪大路滑,应尽可能多使用融雪剂,减少交通事故的发生
D.被蚊虫叮咬后,可以涂些食醋以减轻疼痛
4.除去下列各组物质中的少量杂质,所用的试剂和方法都正确的是
选项 物质 杂质 所用试剂和方法
A N2 O2 将混合气体通过灼热的铜网
B 铁粉 锌粉 加入过量的稀硫酸,充分反应后过滤
C NaCl溶液 HCl 加入适量NaOH 溶液
D CaO CaCO3 加水,溶解、过滤、蒸发
A.A B.B C.C D.D
5.下列有关盐酸的说法正确的是( )
A.稀盐酸的溶质是一种气体
B.打开浓盐酸瓶塞,可看到大量白烟
C.镁和稀盐酸的反应是一个放热反应
D.向稀盐酸中逐滴加入氢氧化钠溶液,溶液的pH先增大后减小
二、选择题
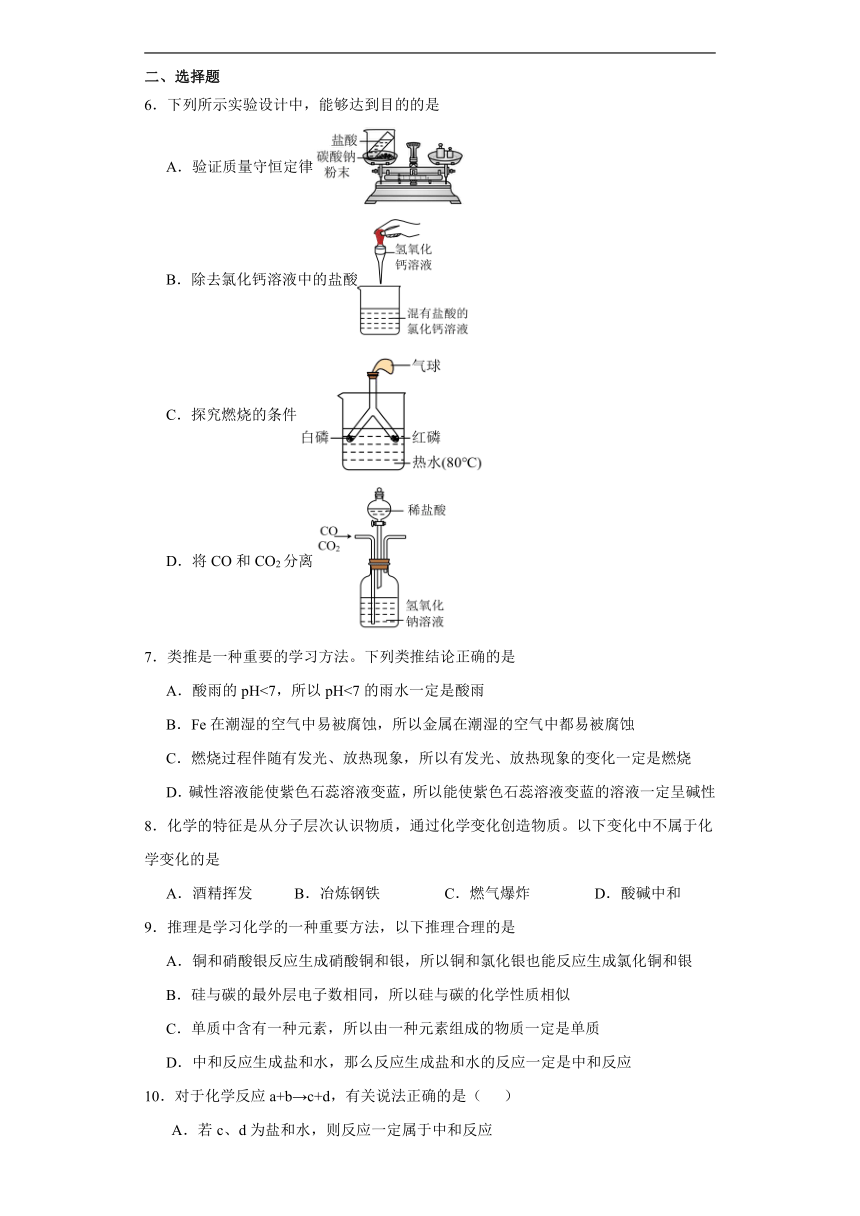
6.下列所示实验设计中,能够达到目的的是
A.验证质量守恒定律
B.除去氯化钙溶液中的盐酸
C.探究燃烧的条件
D.将CO和CO2分离
7.类推是一种重要的学习方法。下列类推结论正确的是
A.酸雨的pH<7,所以pH<7的雨水一定是酸雨
B.Fe在潮湿的空气中易被腐蚀,所以金属在潮湿的空气中都易被腐蚀
C.燃烧过程伴随有发光、放热现象,所以有发光、放热现象的变化一定是燃烧
D.碱性溶液能使紫色石蕊溶液变蓝,所以能使紫色石蕊溶液变蓝的溶液一定呈碱性
8.化学的特征是从分子层次认识物质,通过化学变化创造物质。以下变化中不属于化学变化的是
A.酒精挥发 B.冶炼钢铁 C.燃气爆炸 D.酸碱中和
9.推理是学习化学的一种重要方法,以下推理合理的是
A.铜和硝酸银反应生成硝酸铜和银,所以铜和氯化银也能反应生成氯化铜和银
B.硅与碳的最外层电子数相同,所以硅与碳的化学性质相似
C.单质中含有一种元素,所以由一种元素组成的物质一定是单质
D.中和反应生成盐和水,那么反应生成盐和水的反应一定是中和反应
10.对于化学反应a+b→c+d,有关说法正确的是( )
A.若c、d为盐和水,则反应一定属于中和反应
B.若c、d为单质和化合物,则反应一定为置换反应
C.若a、c均为金属,则b和d可能为可溶性盐溶液
D.若a、b为金属和盐酸,则反应后溶液的质量不一定增加
11.从分子、原子、离子等微观的角度分析,下列解释错误的是
A.好酒不怕巷子深——分子在不断运动
B.热胀冷缩——分子的大小随温度的改变而改变
C.电解水生成氢气和氧气——分子可以分成原子,原子也可重新组合成新的分子
D.中和反应是酸中的氢离子和碱溶液中的氢氧根离子结合生成水的过程
12.下列有关物质用途的说法,正确的是( )
A.生石灰可作为食品干燥剂 B.氢氧化钠可用来治疗胃酸过多
C.聚氯乙烯可用来包装食品 D.铁制容器可用来配制波尔多液
13.类推是化学学习中常见的思维方法,以下类推正确的是( )
A.活泼金属和酸反应有气体生成,所以与酸反应有气体生成的物质一定是活泼金属
B.溶液具有均一性和稳定性,所以具有均一性和稳定性的液体一定是溶液
C.碱的水溶液显碱性,所以NaOH的水溶液一定是碱性溶液
D.酸与碱发生中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
14.推理是化学学习常用的思维方法之一。下列推理正确的是
A.镁条可以在空气中燃烧,故铁丝也可以在空气中燃烧
B.酸能使紫色石蕊溶液变红,通入二氧化碳后的紫色石蕊溶液变红,所以二氧化碳是酸
C.稀有气体的原子(除氦外)最外层电子数都为8,最外层电子数为8的粒子一定是稀有气体原子
D.中和反应生成盐和水,所以氢氧化钠与稀硝酸反应生成硝酸钠和水,一定属于中和反应
15.将稀盐酸分别滴入NaOH溶液和NaCl溶液中 ,充分混合后均无明显现象。混合后相关变化的微观示意图如下,下列说法正确的是
A.物质间均未发生化学反应 B.变化中都有新物质产生
C.混合后溶液酸碱性都不变 D.图甲可表示酸碱反应的实质
三、综合应用题
16.化学实验是进行科学探究的重要方式。
(1)下列有关连接仪器方法的描述中正确的是 。
A.将玻璃导管口小心地旋进单孔胶塞中即可
B.乳胶管与玻璃导管连接前先用水润湿玻璃管口
C.将乳胶管一端塞进玻璃导管内
D.将试管竖直放在桌上并将胶塞用力旋进试管口
(2)做铁丝在氧气中燃烧的实验时,在集气瓶中预先放少量的水可以防止 。
(3)NaOH是化学实验中常用的试剂。
①将某NaOH溶液逐滴滴入一定量的某盐酸中,如图中合理的是 (填“甲”或“乙”)。
②向长期敞口放置的NaOH溶液中滴加盐酸时,意外发现有气泡产生,请解释其原因 。
(4)实验室可利用下图所示实验装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物。已知CO发生装置中的反应为。
①A装置中能观察到什么现象?
②写出B装置中发生反应的化学方程式。
③要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接 、 接 、 接 。
④从环保角度考虑还需对以上装置进行改进请简述改进措施 。
(5)为测定废水中氢氧化钾的含量,向盛有20g废水的锥形瓶中逐滴滴加2%的稀硫酸(废水中的其他物质不与稀硫酸反应),至恰好完全反应,共消耗稀硫酸9.8g。计算废水中氢氧化钾的质量分数 。
17.为了验证氢氧化钠和稀盐酸能发生反应,某化学实验小组进行了下列实验探究:
(1)小丽同学取一定量氢氧化钠溶液于烧杯中,滴入酚酞试液,再逐滴加入稀盐酸。在该实验过程中,能说明氢氧化钠与稀盐酸发生反应的现象为: 。
(2)小亮同学想利用反应前后物质成分的变化来证明氢氧化钠与稀盐酸发生了化学反应,设计了如下实验。
操作 现象 结论
取①中反应后的溶液,滴入少量硝酸银溶液 产生白色沉淀 能证明氢氧化钠与稀盐酸发生了反应
①小君认为上述实验设计无法得出合理结论,他的理由是 。
②中和反应的实质是 。(从微观角度解释)
(3)小明同学要对上述氢氧化钠溶液的溶质质量分数进行测定,其实验方案如下:取氢氧化钠溶液100g,逐滴滴入溶质质量分数为0.73%的稀盐酸,该实验过程中,所加稀盐酸的质量与溶液pH的变化曲线如图所示:
①当滴入稀盐酸60g时(即图中A点),此时所得溶液中的溶质为 (写化学式)。
②试根据化学方程式计算,该氢氧化钠溶液的溶质质量分数是多少?
18.中和反应在日常生活和工农业生产中有着广泛的应用。
(1)请你举出一例有关中和反应的应用 (与下面的例子不同)。
(2)某食品加工厂用质量分数为10%的稀盐酸清洗废液中残余的氢氧化钠,当用去3.65t的稀盐酸时,废液的pH=7。求废液中残余氧氧化钠的质量 ?
参考答案:
1.BD
2.BC
3.AC
4.AC
5.AC
6.D
7.D
8.A
9.B
10.C
11.B
12.A
13.C
14.D
15.D
16. B 高温熔融物溅落炸裂瓶底 乙 NaOH变质生成了Na2CO3,盐酸与Na2CO3反应生成了CO2 Ca(OH)2溶液变浑浊 h
g
e
f
c或d
在A装置后增加一个尾气处理装置。(合理即可) 设参加反应的氢氧化钾的质量为x
112 98
x 9.8g×2%
x=0.224g
废水中氢氧化钾的质量分数为
答:废水中氢氧化钾的质量分数为1.12%。
17.(1)溶液由红色变成无色
(2) 在氢氧化钠和盐酸发生中和反应时,溶液中始终存在Cl-,加入硝酸银产生白色沉淀无法证明氢氧化钠和盐酸能发生反应。(合理即可) H+和OH-结合生成水分子(合理即可)
(3) NaOH、NaC1/NaCl、NaOH
解:HCl的质量=;
设100g该氢氧化钠溶液中溶质质量为x。
x=0.8g
则该氢氧化钠溶液中溶质质量质量分数=
答:该氢氧化钠溶液的溶质质量分数为0.8%。
18. 改良土壤 0.4t
一、多选题
1.一些国家正在试用碳酸水浇灌某些植物,其作用是
A.调节土壤的pH,改良酸性土壤
B.调节土壤的pH,改良碱性土壤,促进植物的光合作用
C.致使土壤疏松多孔
D.在植物上方形成温室
2.用盐酸和酚酞混合液浸过的滤纸,分别在滤纸上滴入下列溶液,滤纸上不会出现红色的是
A.石灰水 B.稀硫酸 C.氯化钠溶液 D.氢氧化钠
3.下列生活中的做法正确的是
A.修车师傅常用汽油洗去手上的油污
B.春季,在树干上刷石灰水,保护树木
C.冬季雪大路滑,应尽可能多使用融雪剂,减少交通事故的发生
D.被蚊虫叮咬后,可以涂些食醋以减轻疼痛
4.除去下列各组物质中的少量杂质,所用的试剂和方法都正确的是
选项 物质 杂质 所用试剂和方法
A N2 O2 将混合气体通过灼热的铜网
B 铁粉 锌粉 加入过量的稀硫酸,充分反应后过滤
C NaCl溶液 HCl 加入适量NaOH 溶液
D CaO CaCO3 加水,溶解、过滤、蒸发
A.A B.B C.C D.D
5.下列有关盐酸的说法正确的是( )
A.稀盐酸的溶质是一种气体
B.打开浓盐酸瓶塞,可看到大量白烟
C.镁和稀盐酸的反应是一个放热反应
D.向稀盐酸中逐滴加入氢氧化钠溶液,溶液的pH先增大后减小
二、选择题
6.下列所示实验设计中,能够达到目的的是
A.验证质量守恒定律
B.除去氯化钙溶液中的盐酸
C.探究燃烧的条件
D.将CO和CO2分离
7.类推是一种重要的学习方法。下列类推结论正确的是
A.酸雨的pH<7,所以pH<7的雨水一定是酸雨
B.Fe在潮湿的空气中易被腐蚀,所以金属在潮湿的空气中都易被腐蚀
C.燃烧过程伴随有发光、放热现象,所以有发光、放热现象的变化一定是燃烧
D.碱性溶液能使紫色石蕊溶液变蓝,所以能使紫色石蕊溶液变蓝的溶液一定呈碱性
8.化学的特征是从分子层次认识物质,通过化学变化创造物质。以下变化中不属于化学变化的是
A.酒精挥发 B.冶炼钢铁 C.燃气爆炸 D.酸碱中和
9.推理是学习化学的一种重要方法,以下推理合理的是
A.铜和硝酸银反应生成硝酸铜和银,所以铜和氯化银也能反应生成氯化铜和银
B.硅与碳的最外层电子数相同,所以硅与碳的化学性质相似
C.单质中含有一种元素,所以由一种元素组成的物质一定是单质
D.中和反应生成盐和水,那么反应生成盐和水的反应一定是中和反应
10.对于化学反应a+b→c+d,有关说法正确的是( )
A.若c、d为盐和水,则反应一定属于中和反应
B.若c、d为单质和化合物,则反应一定为置换反应
C.若a、c均为金属,则b和d可能为可溶性盐溶液
D.若a、b为金属和盐酸,则反应后溶液的质量不一定增加
11.从分子、原子、离子等微观的角度分析,下列解释错误的是
A.好酒不怕巷子深——分子在不断运动
B.热胀冷缩——分子的大小随温度的改变而改变
C.电解水生成氢气和氧气——分子可以分成原子,原子也可重新组合成新的分子
D.中和反应是酸中的氢离子和碱溶液中的氢氧根离子结合生成水的过程
12.下列有关物质用途的说法,正确的是( )
A.生石灰可作为食品干燥剂 B.氢氧化钠可用来治疗胃酸过多
C.聚氯乙烯可用来包装食品 D.铁制容器可用来配制波尔多液
13.类推是化学学习中常见的思维方法,以下类推正确的是( )
A.活泼金属和酸反应有气体生成,所以与酸反应有气体生成的物质一定是活泼金属
B.溶液具有均一性和稳定性,所以具有均一性和稳定性的液体一定是溶液
C.碱的水溶液显碱性,所以NaOH的水溶液一定是碱性溶液
D.酸与碱发生中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
14.推理是化学学习常用的思维方法之一。下列推理正确的是
A.镁条可以在空气中燃烧,故铁丝也可以在空气中燃烧
B.酸能使紫色石蕊溶液变红,通入二氧化碳后的紫色石蕊溶液变红,所以二氧化碳是酸
C.稀有气体的原子(除氦外)最外层电子数都为8,最外层电子数为8的粒子一定是稀有气体原子
D.中和反应生成盐和水,所以氢氧化钠与稀硝酸反应生成硝酸钠和水,一定属于中和反应
15.将稀盐酸分别滴入NaOH溶液和NaCl溶液中 ,充分混合后均无明显现象。混合后相关变化的微观示意图如下,下列说法正确的是
A.物质间均未发生化学反应 B.变化中都有新物质产生
C.混合后溶液酸碱性都不变 D.图甲可表示酸碱反应的实质
三、综合应用题
16.化学实验是进行科学探究的重要方式。
(1)下列有关连接仪器方法的描述中正确的是 。
A.将玻璃导管口小心地旋进单孔胶塞中即可
B.乳胶管与玻璃导管连接前先用水润湿玻璃管口
C.将乳胶管一端塞进玻璃导管内
D.将试管竖直放在桌上并将胶塞用力旋进试管口
(2)做铁丝在氧气中燃烧的实验时,在集气瓶中预先放少量的水可以防止 。
(3)NaOH是化学实验中常用的试剂。
①将某NaOH溶液逐滴滴入一定量的某盐酸中,如图中合理的是 (填“甲”或“乙”)。
②向长期敞口放置的NaOH溶液中滴加盐酸时,意外发现有气泡产生,请解释其原因 。
(4)实验室可利用下图所示实验装置制取纯净、干燥的CO,然后用CO还原Fe2O3并检验气体产物。已知CO发生装置中的反应为。
①A装置中能观察到什么现象?
②写出B装置中发生反应的化学方程式。
③要达到实验目的,装置中导管接口从左到右的连接顺序为:一氧化碳发生装置接 、 接 、 接 。
④从环保角度考虑还需对以上装置进行改进请简述改进措施 。
(5)为测定废水中氢氧化钾的含量,向盛有20g废水的锥形瓶中逐滴滴加2%的稀硫酸(废水中的其他物质不与稀硫酸反应),至恰好完全反应,共消耗稀硫酸9.8g。计算废水中氢氧化钾的质量分数 。
17.为了验证氢氧化钠和稀盐酸能发生反应,某化学实验小组进行了下列实验探究:
(1)小丽同学取一定量氢氧化钠溶液于烧杯中,滴入酚酞试液,再逐滴加入稀盐酸。在该实验过程中,能说明氢氧化钠与稀盐酸发生反应的现象为: 。
(2)小亮同学想利用反应前后物质成分的变化来证明氢氧化钠与稀盐酸发生了化学反应,设计了如下实验。
操作 现象 结论
取①中反应后的溶液,滴入少量硝酸银溶液 产生白色沉淀 能证明氢氧化钠与稀盐酸发生了反应
①小君认为上述实验设计无法得出合理结论,他的理由是 。
②中和反应的实质是 。(从微观角度解释)
(3)小明同学要对上述氢氧化钠溶液的溶质质量分数进行测定,其实验方案如下:取氢氧化钠溶液100g,逐滴滴入溶质质量分数为0.73%的稀盐酸,该实验过程中,所加稀盐酸的质量与溶液pH的变化曲线如图所示:
①当滴入稀盐酸60g时(即图中A点),此时所得溶液中的溶质为 (写化学式)。
②试根据化学方程式计算,该氢氧化钠溶液的溶质质量分数是多少?
18.中和反应在日常生活和工农业生产中有着广泛的应用。
(1)请你举出一例有关中和反应的应用 (与下面的例子不同)。
(2)某食品加工厂用质量分数为10%的稀盐酸清洗废液中残余的氢氧化钠,当用去3.65t的稀盐酸时,废液的pH=7。求废液中残余氧氧化钠的质量 ?
参考答案:
1.BD
2.BC
3.AC
4.AC
5.AC
6.D
7.D
8.A
9.B
10.C
11.B
12.A
13.C
14.D
15.D
16. B 高温熔融物溅落炸裂瓶底 乙 NaOH变质生成了Na2CO3,盐酸与Na2CO3反应生成了CO2 Ca(OH)2溶液变浑浊 h
g
e
f
c或d
在A装置后增加一个尾气处理装置。(合理即可) 设参加反应的氢氧化钾的质量为x
112 98
x 9.8g×2%
x=0.224g
废水中氢氧化钾的质量分数为
答:废水中氢氧化钾的质量分数为1.12%。
17.(1)溶液由红色变成无色
(2) 在氢氧化钠和盐酸发生中和反应时,溶液中始终存在Cl-,加入硝酸银产生白色沉淀无法证明氢氧化钠和盐酸能发生反应。(合理即可) H+和OH-结合生成水分子(合理即可)
(3) NaOH、NaC1/NaCl、NaOH
解:HCl的质量=;
设100g该氢氧化钠溶液中溶质质量为x。
x=0.8g
则该氢氧化钠溶液中溶质质量质量分数=
答:该氢氧化钠溶液的溶质质量分数为0.8%。
18. 改良土壤 0.4t
同课章节目录
