8.2海水“晒盐”同步练习(含答案) 鲁教版化学九年级下册
文档属性
| 名称 | 8.2海水“晒盐”同步练习(含答案) 鲁教版化学九年级下册 |

|
|
| 格式 | docx | ||
| 文件大小 | 541.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-10 00:00:00 | ||
图片预览

文档简介
8.2海水“晒盐”
一、多选题
1.在蒸馏水中加入NaOH固体,不断搅拌,用温度传感器记录溶解过程的温度变化如下图。a、c两点观察到溶液中有固体存在,b点固体完全消失(整个过程不考虑水分蒸发)。下列说法正确的是
A.NaOH固体溶于水是吸热过程
B.a、c两点时,NaOH的溶解度相同
C.不能确定b点溶液是否为饱和溶液
D.c点时的溶剂质量大于d点时的溶剂质量
2.除去下列物质中的少量杂质,所选用试剂及操作方法均正确的是
选项 物质 杂质(少量) 试剂 操作方法
A 铜 氧化铜 足量氢气 将气体通过氧化铜,加热
B 一氧化碳 二氧化碳 氢氧化钠溶液 将气体通入氢氧化钠溶液中
C 氯化亚铁溶液 碳 无 过滤,洗涤,干燥
D 食盐 泥沙 蒸馏水 溶解、过滤、洗涤、烘干
A.A B.B C.C D.D
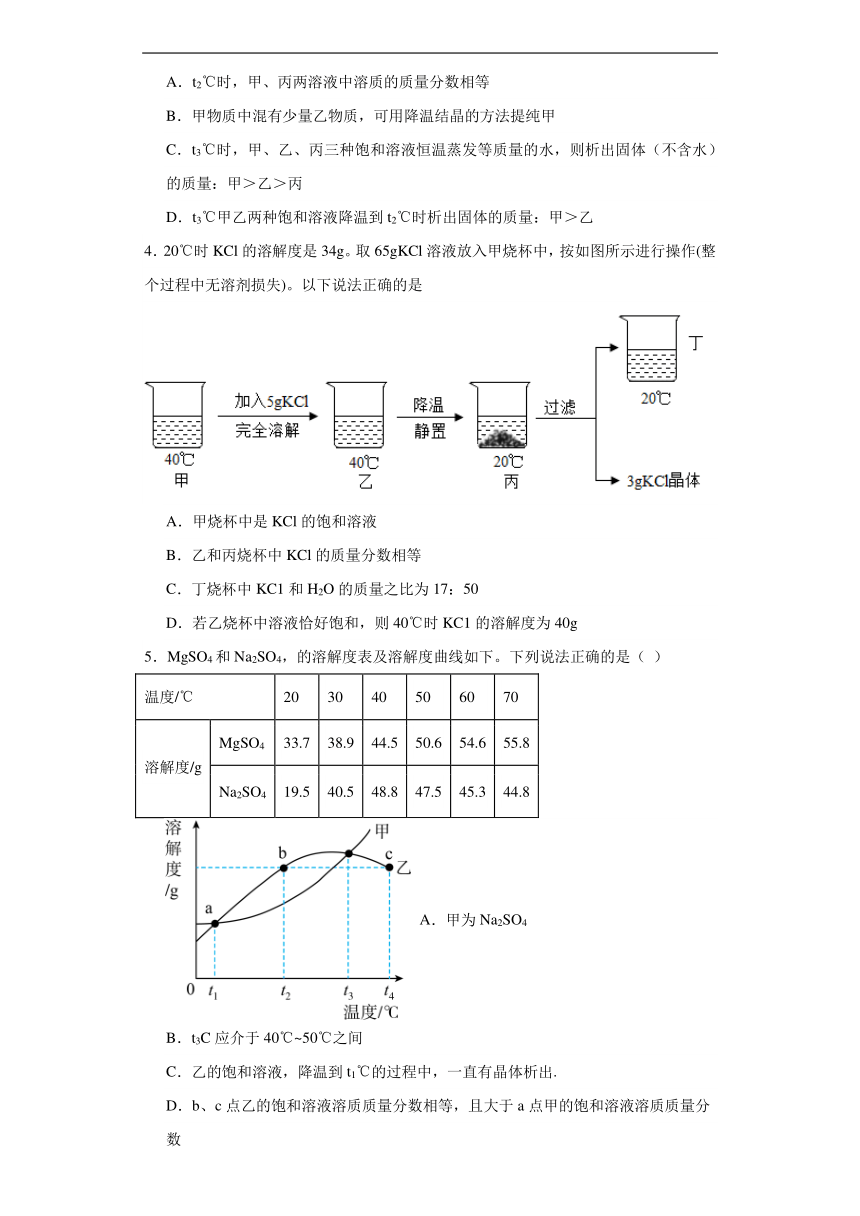
3.如图是甲、乙、丙三种固体物质的溶解度曲线,下列叙述正确的是( )
A.t2℃时,甲、丙两溶液中溶质的质量分数相等
B.甲物质中混有少量乙物质,可用降温结晶的方法提纯甲
C.t3℃时,甲、乙、丙三种饱和溶液恒温蒸发等质量的水,则析出固体(不含水)的质量:甲>乙>丙
D.t3℃甲乙两种饱和溶液降温到t2℃时析出固体的质量:甲>乙
4.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KC1和H2O的质量之比为17:50
D.若乙烧杯中溶液恰好饱和,则40℃时KC1的溶解度为40g
5.MgSO4和Na2SO4,的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ 20 30 40 50 60 70
溶解度/g MgSO4 33.7 38.9 44.5 50.6 54.6 55.8
Na2SO4 19.5 40.5 48.8 47.5 45.3 44.8
A.甲为Na2SO4
B.t3C应介于40℃~50℃之间
C.乙的饱和溶液,降温到t1℃的过程中,一直有晶体析出.
D.b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数
二、选择题
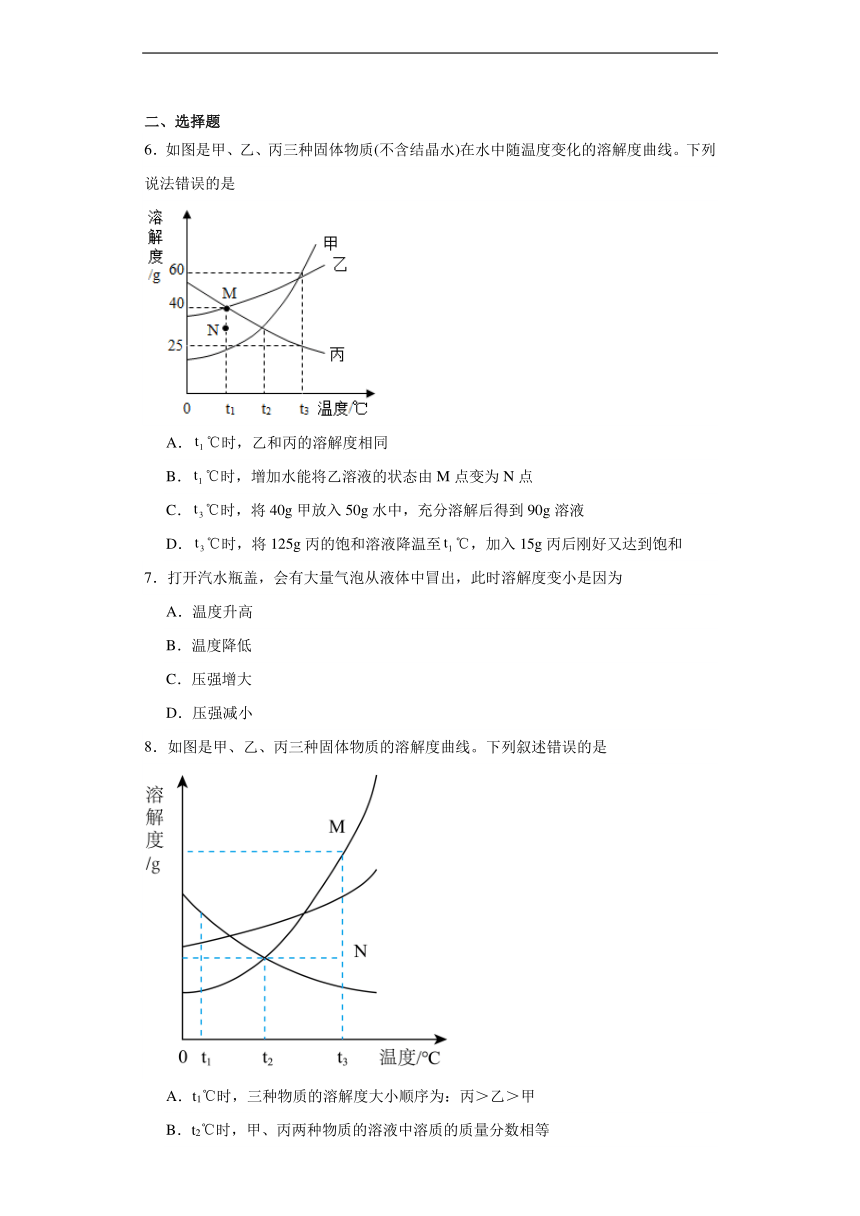
6.如图是甲、乙、丙三种固体物质(不含结晶水)在水中随温度变化的溶解度曲线。下列说法错误的是
A.℃时,乙和丙的溶解度相同
B.℃时,增加水能将乙溶液的状态由M点变为N点
C.℃时,将40g甲放入50g水中,充分溶解后得到90g溶液
D.℃时,将125g丙的饱和溶液降温至℃,加入15g丙后刚好又达到饱和
7.打开汽水瓶盖,会有大量气泡从液体中冒出,此时溶解度变小是因为
A.温度升高
B.温度降低
C.压强增大
D.压强减小
8.如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述错误的是
A.t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲
B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等
C.若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用加入甲物质的方法
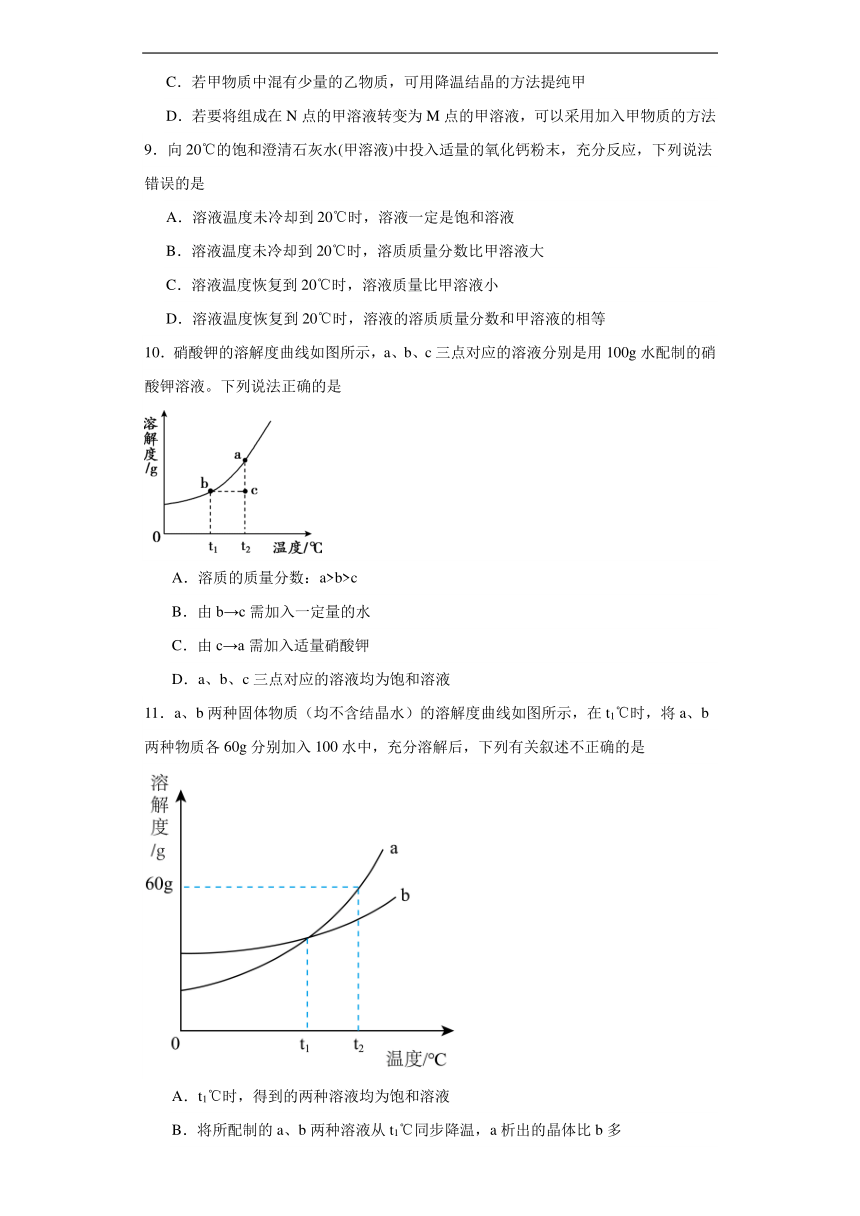
9.向20℃的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是
A.溶液温度未冷却到20℃时,溶液一定是饱和溶液
B.溶液温度未冷却到20℃时,溶质质量分数比甲溶液大
C.溶液温度恢复到20℃时,溶液质量比甲溶液小
D.溶液温度恢复到20℃时,溶液的溶质质量分数和甲溶液的相等
10.硝酸钾的溶解度曲线如图所示,a、b、c三点对应的溶液分别是用100g水配制的硝酸钾溶液。下列说法正确的是
A.溶质的质量分数:a>b>c
B.由b→c需加入一定量的水
C.由c→a需加入适量硝酸钾
D.a、b、c三点对应的溶液均为饱和溶液
11.a、b两种固体物质(均不含结晶水)的溶解度曲线如图所示,在t1℃时,将a、b两种物质各60g分别加入100水中,充分溶解后,下列有关叙述不正确的是
A.t1℃时,得到的两种溶液均为饱和溶液
B.将所配制的a、b两种溶液从t1℃同步降温,a析出的晶体比b多
C.t2℃时a的溶解度比b大
D.将所得的两种溶液温度升高到t2℃时,a溶液的溶质质量分数大于b溶液的溶质质量分数
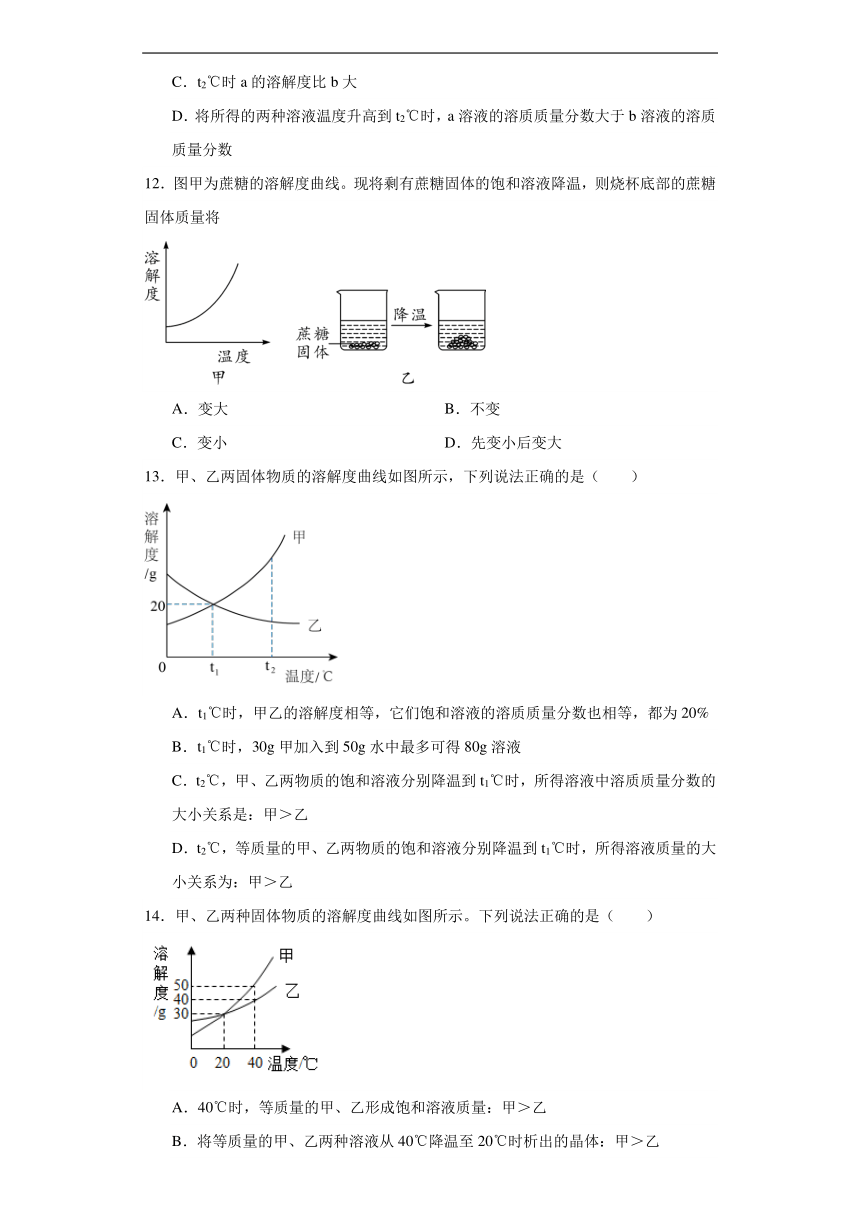
12.图甲为蔗糖的溶解度曲线。现将剩有蔗糖固体的饱和溶液降温,则烧杯底部的蔗糖固体质量将
A.变大 B.不变
C.变小 D.先变小后变大
13.甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,甲乙的溶解度相等,它们饱和溶液的溶质质量分数也相等,都为20%
B.t1℃时,30g甲加入到50g水中最多可得80g溶液
C.t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲>乙
D.t2℃,等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲>乙
14.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.40℃时,等质量的甲、乙形成饱和溶液质量:甲>乙
B.将等质量的甲、乙两种溶液从40℃降温至20℃时析出的晶体:甲>乙
C.20℃时,等质量的甲、乙饱和溶液中溶质的质量分数一定相等
D.40℃时,将30g的乙物质加入到50g水中可形成乙的不饱和溶液
15.如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列叙述正确的是( )
A.t1℃时,a、c两种物质的溶液的溶质质量分数约为16.7%
B.将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法
C.将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c
D.将75g a物质的饱和溶液从t3℃降温至t1℃,可析出15g a物质
三、综合应用题
16.酸、碱、盐是我们身边重要的化合物。
(1)下列不属于氢氧化钠俗称的是______(填字母)。
A.火碱 B.纯碱 C.烧碱 D.苛性钠
(2)生活中可用稀硫酸除铁锈,反应的化学方程式为 。苏打可治疗胃酸过多,反应的化学方程式为 。
(3)固体氢氧化钠可用来干燥某些气体,但不能干燥二氧化碳气体,原因是 (用化学方程式表示)。
(4)侯德榜的“联合制减法”中有一个重要反应:,则X的化学式为 。
(5)现有一定质量含有少量泥沙等不溶性杂质和少量Na2SO4、MgCl2、CaCl2等可溶性杂质的粗盐样品,某实验小组利用化学实验室常用仪器对粗盐样品进行提纯,提纯步骤如下:
图中“滤液”中含有的溶质有 。
图中②③④的顺序能否改变?若不能,请说明理由:若能,写出一种改变的顺序 。
17.溶液在生产生活中有着广泛的应用。
(1)一瓶合格的生理盐水密封放置一段时间后,不会出现浑浊现象,原因是 。
(2)0℃时,101kPa时氮气溶解度为0.024,其意义为 。
(3)甲、乙两种固体物质的溶解度曲线如图1所示,析出的晶体均不含结晶水,回答下列问题:
①乙物质的溶解性属于 (填“易溶”或“可溶”或“微溶”或“无法确定”)。
②A是40℃含有120g水的甲溶液,经过如图2操作。得到50g甲固体。
对以上过程的分析,正确的是 (选填编号)。
A.A到B的过程中,溶质质量没有改变
B.B中溶质与溶剂的质量比为138:100
C.B到C的过程中,溶质甲已全部析出
D.A溶液的质量等于255g
(4)如图3是利用海水提取粗盐的过程。
根据海水晒盐的原理,下列说法正确的是 (选填编号)。
A.海水进入贮水池,其中氯化钠的质量减少
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.在蒸发池中,海水中水的质量逐渐减少
D.析出晶体后的母液是氯化钠的饱和溶液
(5)现有一瓶蒸馏水和一瓶稀氯化钾溶液,请设计实验把它们鉴别开,并填写实验报告。
实验步骤 实验现象 实验结论
18.为测定某氧化镁样品(杂质不溶于水,不与酸反应,且不含镁元素)中氧化镁的含量,向10g样品中加入100g稀硫酸,恰好完全反应,实验过程及测得的数据如下:
(1)上述实验过程中发生反应的化学方程式为______;
(2)根据已知条件列出求解所加的稀硫酸中溶质质量(x)的比例式为_______;
(3)该样品中氧化镁的含量是_________;
(4)若用98%的浓硫酸配制上述实验中所用的稀硫酸,所需浓硫酸的质量为_______g;
(5)若将反应后的滤液蒸发8g水,所得溶液中溶质的质量分数为_________;
(6)若要生产含镁4.5%的铝合金192t,需要上述氧化镁样品的质量为______。
参考答案:
1.BC
2.A
3.BC
4.CD
5.BD
6.C
7.D
8.B
9.B
10.C
11.D
12.A
13.C
14.C
15.D
16.(1)B
(2) Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Na2CO3+2HCl=2NaCl+H2O+CO2↑
(3)2NaOH+CO2=Na2CO3+H2O
(4)NH4Cl
(5) NaCl、NaOH和Na2CO3 能,③②④
17.(1)溶液具有均一、稳定性
(2)0℃,压强为101KPa时,1体积水里最多溶解0.024体积氮气
(3) 易溶 AD/DA
(4)CD
(5) 取两种液体少许进行蒸干 一种有固体出现,另一种没有固体出现 有固体残留的是稀氯化钾溶液,无固体残留的是蒸馏水
18.(1)MgO+H2SO4 =MgSO4+H2O
(2)
(3)解:由图可知,10g样品中氧化镁的质量为10g-2g=8g,设参加反应的H2SO4质量为x,生成硫酸镁的质量为y,则有
样品中氧化镁的含量是×100%=80%;
(4)20
(5)24%
(6)18t
一、多选题
1.在蒸馏水中加入NaOH固体,不断搅拌,用温度传感器记录溶解过程的温度变化如下图。a、c两点观察到溶液中有固体存在,b点固体完全消失(整个过程不考虑水分蒸发)。下列说法正确的是
A.NaOH固体溶于水是吸热过程
B.a、c两点时,NaOH的溶解度相同
C.不能确定b点溶液是否为饱和溶液
D.c点时的溶剂质量大于d点时的溶剂质量
2.除去下列物质中的少量杂质,所选用试剂及操作方法均正确的是
选项 物质 杂质(少量) 试剂 操作方法
A 铜 氧化铜 足量氢气 将气体通过氧化铜,加热
B 一氧化碳 二氧化碳 氢氧化钠溶液 将气体通入氢氧化钠溶液中
C 氯化亚铁溶液 碳 无 过滤,洗涤,干燥
D 食盐 泥沙 蒸馏水 溶解、过滤、洗涤、烘干
A.A B.B C.C D.D
3.如图是甲、乙、丙三种固体物质的溶解度曲线,下列叙述正确的是( )
A.t2℃时,甲、丙两溶液中溶质的质量分数相等
B.甲物质中混有少量乙物质,可用降温结晶的方法提纯甲
C.t3℃时,甲、乙、丙三种饱和溶液恒温蒸发等质量的水,则析出固体(不含水)的质量:甲>乙>丙
D.t3℃甲乙两种饱和溶液降温到t2℃时析出固体的质量:甲>乙
4.20℃时KCl的溶解度是34g。取65gKCl溶液放入甲烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。以下说法正确的是
A.甲烧杯中是KCl的饱和溶液
B.乙和丙烧杯中KCl的质量分数相等
C.丁烧杯中KC1和H2O的质量之比为17:50
D.若乙烧杯中溶液恰好饱和,则40℃时KC1的溶解度为40g
5.MgSO4和Na2SO4,的溶解度表及溶解度曲线如下。下列说法正确的是( )
温度/℃ 20 30 40 50 60 70
溶解度/g MgSO4 33.7 38.9 44.5 50.6 54.6 55.8
Na2SO4 19.5 40.5 48.8 47.5 45.3 44.8
A.甲为Na2SO4
B.t3C应介于40℃~50℃之间
C.乙的饱和溶液,降温到t1℃的过程中,一直有晶体析出.
D.b、c点乙的饱和溶液溶质质量分数相等,且大于a点甲的饱和溶液溶质质量分数
二、选择题
6.如图是甲、乙、丙三种固体物质(不含结晶水)在水中随温度变化的溶解度曲线。下列说法错误的是
A.℃时,乙和丙的溶解度相同
B.℃时,增加水能将乙溶液的状态由M点变为N点
C.℃时,将40g甲放入50g水中,充分溶解后得到90g溶液
D.℃时,将125g丙的饱和溶液降温至℃,加入15g丙后刚好又达到饱和
7.打开汽水瓶盖,会有大量气泡从液体中冒出,此时溶解度变小是因为
A.温度升高
B.温度降低
C.压强增大
D.压强减小
8.如图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述错误的是
A.t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲
B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等
C.若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲
D.若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用加入甲物质的方法
9.向20℃的饱和澄清石灰水(甲溶液)中投入适量的氧化钙粉末,充分反应,下列说法错误的是
A.溶液温度未冷却到20℃时,溶液一定是饱和溶液
B.溶液温度未冷却到20℃时,溶质质量分数比甲溶液大
C.溶液温度恢复到20℃时,溶液质量比甲溶液小
D.溶液温度恢复到20℃时,溶液的溶质质量分数和甲溶液的相等
10.硝酸钾的溶解度曲线如图所示,a、b、c三点对应的溶液分别是用100g水配制的硝酸钾溶液。下列说法正确的是
A.溶质的质量分数:a>b>c
B.由b→c需加入一定量的水
C.由c→a需加入适量硝酸钾
D.a、b、c三点对应的溶液均为饱和溶液
11.a、b两种固体物质(均不含结晶水)的溶解度曲线如图所示,在t1℃时,将a、b两种物质各60g分别加入100水中,充分溶解后,下列有关叙述不正确的是
A.t1℃时,得到的两种溶液均为饱和溶液
B.将所配制的a、b两种溶液从t1℃同步降温,a析出的晶体比b多
C.t2℃时a的溶解度比b大
D.将所得的两种溶液温度升高到t2℃时,a溶液的溶质质量分数大于b溶液的溶质质量分数
12.图甲为蔗糖的溶解度曲线。现将剩有蔗糖固体的饱和溶液降温,则烧杯底部的蔗糖固体质量将
A.变大 B.不变
C.变小 D.先变小后变大
13.甲、乙两固体物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,甲乙的溶解度相等,它们饱和溶液的溶质质量分数也相等,都为20%
B.t1℃时,30g甲加入到50g水中最多可得80g溶液
C.t2℃,甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液中溶质质量分数的大小关系是:甲>乙
D.t2℃,等质量的甲、乙两物质的饱和溶液分别降温到t1℃时,所得溶液质量的大小关系为:甲>乙
14.甲、乙两种固体物质的溶解度曲线如图所示。下列说法正确的是( )
A.40℃时,等质量的甲、乙形成饱和溶液质量:甲>乙
B.将等质量的甲、乙两种溶液从40℃降温至20℃时析出的晶体:甲>乙
C.20℃时,等质量的甲、乙饱和溶液中溶质的质量分数一定相等
D.40℃时,将30g的乙物质加入到50g水中可形成乙的不饱和溶液
15.如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列叙述正确的是( )
A.t1℃时,a、c两种物质的溶液的溶质质量分数约为16.7%
B.将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法
C.将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c
D.将75g a物质的饱和溶液从t3℃降温至t1℃,可析出15g a物质
三、综合应用题
16.酸、碱、盐是我们身边重要的化合物。
(1)下列不属于氢氧化钠俗称的是______(填字母)。
A.火碱 B.纯碱 C.烧碱 D.苛性钠
(2)生活中可用稀硫酸除铁锈,反应的化学方程式为 。苏打可治疗胃酸过多,反应的化学方程式为 。
(3)固体氢氧化钠可用来干燥某些气体,但不能干燥二氧化碳气体,原因是 (用化学方程式表示)。
(4)侯德榜的“联合制减法”中有一个重要反应:,则X的化学式为 。
(5)现有一定质量含有少量泥沙等不溶性杂质和少量Na2SO4、MgCl2、CaCl2等可溶性杂质的粗盐样品,某实验小组利用化学实验室常用仪器对粗盐样品进行提纯,提纯步骤如下:
图中“滤液”中含有的溶质有 。
图中②③④的顺序能否改变?若不能,请说明理由:若能,写出一种改变的顺序 。
17.溶液在生产生活中有着广泛的应用。
(1)一瓶合格的生理盐水密封放置一段时间后,不会出现浑浊现象,原因是 。
(2)0℃时,101kPa时氮气溶解度为0.024,其意义为 。
(3)甲、乙两种固体物质的溶解度曲线如图1所示,析出的晶体均不含结晶水,回答下列问题:
①乙物质的溶解性属于 (填“易溶”或“可溶”或“微溶”或“无法确定”)。
②A是40℃含有120g水的甲溶液,经过如图2操作。得到50g甲固体。
对以上过程的分析,正确的是 (选填编号)。
A.A到B的过程中,溶质质量没有改变
B.B中溶质与溶剂的质量比为138:100
C.B到C的过程中,溶质甲已全部析出
D.A溶液的质量等于255g
(4)如图3是利用海水提取粗盐的过程。
根据海水晒盐的原理,下列说法正确的是 (选填编号)。
A.海水进入贮水池,其中氯化钠的质量减少
B.在蒸发池中,海水中氯化钠的质量逐渐增加
C.在蒸发池中,海水中水的质量逐渐减少
D.析出晶体后的母液是氯化钠的饱和溶液
(5)现有一瓶蒸馏水和一瓶稀氯化钾溶液,请设计实验把它们鉴别开,并填写实验报告。
实验步骤 实验现象 实验结论
18.为测定某氧化镁样品(杂质不溶于水,不与酸反应,且不含镁元素)中氧化镁的含量,向10g样品中加入100g稀硫酸,恰好完全反应,实验过程及测得的数据如下:
(1)上述实验过程中发生反应的化学方程式为______;
(2)根据已知条件列出求解所加的稀硫酸中溶质质量(x)的比例式为_______;
(3)该样品中氧化镁的含量是_________;
(4)若用98%的浓硫酸配制上述实验中所用的稀硫酸,所需浓硫酸的质量为_______g;
(5)若将反应后的滤液蒸发8g水,所得溶液中溶质的质量分数为_________;
(6)若要生产含镁4.5%的铝合金192t,需要上述氧化镁样品的质量为______。
参考答案:
1.BC
2.A
3.BC
4.CD
5.BD
6.C
7.D
8.B
9.B
10.C
11.D
12.A
13.C
14.C
15.D
16.(1)B
(2) Fe2O3+3H2SO4=Fe2(SO4)3+3H2O Na2CO3+2HCl=2NaCl+H2O+CO2↑
(3)2NaOH+CO2=Na2CO3+H2O
(4)NH4Cl
(5) NaCl、NaOH和Na2CO3 能,③②④
17.(1)溶液具有均一、稳定性
(2)0℃,压强为101KPa时,1体积水里最多溶解0.024体积氮气
(3) 易溶 AD/DA
(4)CD
(5) 取两种液体少许进行蒸干 一种有固体出现,另一种没有固体出现 有固体残留的是稀氯化钾溶液,无固体残留的是蒸馏水
18.(1)MgO+H2SO4 =MgSO4+H2O
(2)
(3)解:由图可知,10g样品中氧化镁的质量为10g-2g=8g,设参加反应的H2SO4质量为x,生成硫酸镁的质量为y,则有
样品中氧化镁的含量是×100%=80%;
(4)20
(5)24%
(6)18t
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
