化学人教版(2019)必修第一册1.3.2氧化剂和还原剂(共37张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.2氧化剂和还原剂(共37张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 768.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-10 11:03:01 | ||
图片预览










文档简介
(共37张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第2课时
课前预习·基础回扣
必备知识梳理
第
分
部
一
一、氧化剂和还原剂
1.氧化还原反应中的相关概念
(1)相关概念
①氧化剂与还原剂
氧化剂:在氧化还原反应中,所含元素的化合价______,即得到电子(或电子对偏向)的物质。
还原剂:在氧化还原反应中,所含元素的化合价______,即失去电子(或电子对偏离)的物质。
降低
升高
②氧化产物与还原产物
氧化产物:还原剂失去电子被氧化的产物。
还原产物:氧化剂得到电子被还原的产物。
③氧化性与还原性
氧化性:物质得电子的性质或能力。
还原性:物质失电子的性质或能力。
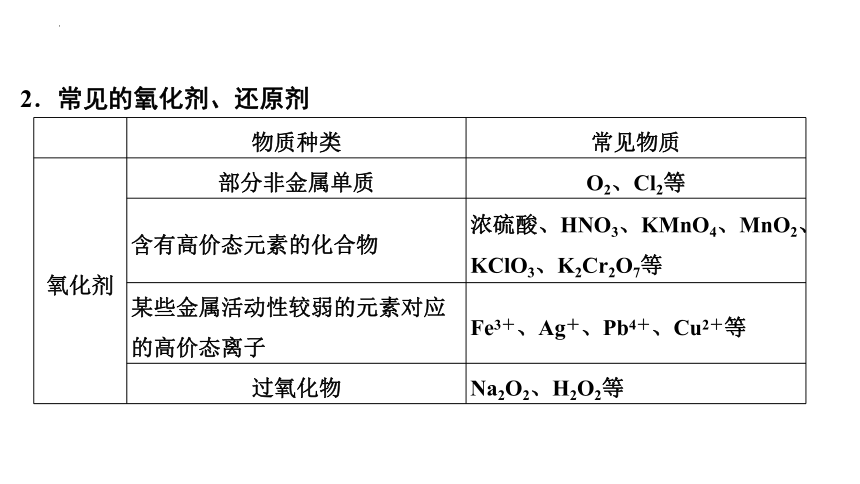
2.常见的氧化剂、还原剂
物质种类 常见物质
氧化剂 部分非金属单质 O2、Cl2等
含有高价态元素的化合物 浓硫酸、HNO3、KMnO4、MnO2、KClO3、K2Cr2O7等
某些金属活动性较弱的元素对应的高价态离子 Fe3+、Ag+、Pb4+、Cu2+等
过氧化物 Na2O2、H2O2等
物质种类 常见物质
还原剂 活泼的金属单质 Al、Zn等
某些非金属单质 C、H2等
非金属阴离子和氢化物 Cl-、Br-、I-、S2-、HI、NH3、H2S等
含有较低价态元素的化合物 CO、SO2、H2SO3、Na2SO3、FeSO4等
1.判断正误(正确的打“√”,错误的打“×”)。
(1)在反应中,氧化剂发生氧化反应,还原剂发生还原反应。( )
(2)氧化剂得电子被氧化为还原产物。( )
(3)在氧化还原反应中,金属单质作反应物时一定是还原剂。( )
(4)在同一反应中,氧化剂和还原剂不可能是同一物质。( )
(5)HCl在反应中既可以作氧化剂又可以作还原剂。( )
(6)元素处于最高化合价时,一定具有强氧化性。( )
自我测评
×
×
√
×
√
×
2.(2022·山西太原高一期末)吸进人体内的氧有2%转化为氧化性极强的活性氧,活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A.作还原剂 B.作氧化剂
C.既作氧化剂又作还原剂 D.以上均不是
解析:活性氧具有较强的氧化性,亚硒酸钠(Na2SeO3)能消除人体内的活性氧,因此亚硒酸钠具有还原性,与活性氧反应时,亚硒酸钠作还原剂。
A
二、氧化性、还原性及其强弱比较
1.氧化性、还原性的强弱与得失电子的关系
(1)氧化性:物质越易得电子,氧化性越强。
(2)还原性:物质越易失电子,还原性越强。
物质氧化性、还原性的强弱与得失电子的难易有关,与得失电子的多少无关。
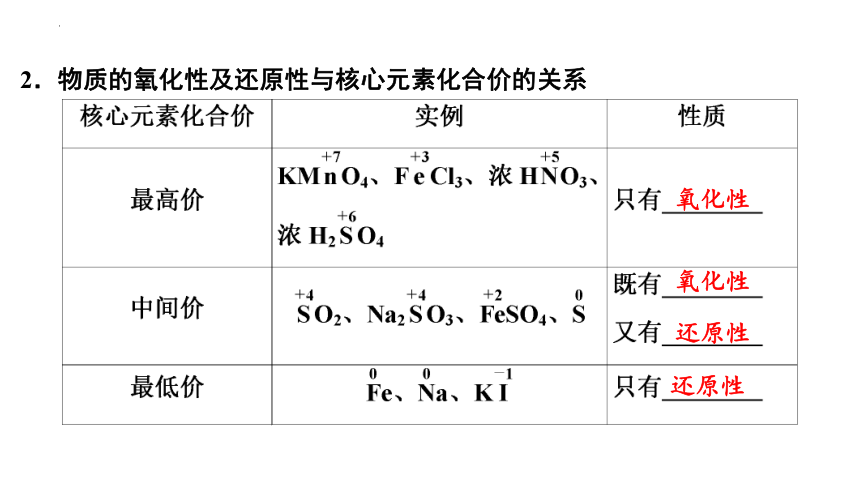
2.物质的氧化性及还原性与核心元素化合价的关系
氧化性
氧化性
还原性
还原性
1.判断正误(正确的打“√”,错误的打“×”)。
(1)还原剂失去电子具有氧化性。( )
(2)碘化氢中碘为最低价,故碘化氢只具有还原性。( )
(3)失电子数越多的物质还原性越强。( )
(4)Cu2+比Fe2+的氧化性强,Cu比Fe的还原性强。( )
自我测评
×
×
×
×
√
2.H2O2有杀菌消毒作用,医疗上常利用它来清洗伤口。
(1)采矿废液中的氰化物(如KCN)一般用H2O2进行无毒化处理,化学方程式为KCN+H2O2+H2O===KHCO3+NH3↑(KCN中N为-3价),该反应中被氧化的元素是____(填元素名称),体现了H2O2的______性。
解析:反应中碳元素化合价从+2升高到+4,碳元素被氧化。
碳
氧化
(2)H2O2被称为“绿色氧化剂”的原因是_____________________________
______________。
解析:H2O2作氧化剂时,其还原产物是H2O,无污染,因此H2O2被称为“绿色氧化剂”。
H2O2作氧化剂,其还原产物是
H2O,无污染
课堂探究·要点精讲
关键能力提升
第
分
部
二
【例1】 宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2===2Ag2S+2H2O,其中H2S是( )
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂
【解析】 反应中Ag元素和O元素化合价发生变化,而S、H元素化合价在反应前后不变,H2S既不是氧化剂也不是还原剂。
探究一 氧化剂和还原剂的判断
D
1.氧化还原反应知识结构模型
巧记:简化为六个字,“升失氧,降得还”。
2.氧化还原反应中的易错点
(1)在氧化还原反应中,若有一种元素被氧化,误认为一定有另一种元素被还原。在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原,因为同种元素之间也能发生氧化还原反应,在反应Cl2+H2O HCl+HClO中,被氧化与被还原的元素均是氯元素。
(2)氧化还原反应中的反应物不一定都是氧化剂和还原剂。在氧化还原反应中一定有氧化剂和还原剂,但氧化剂和还原剂可以是不同种物质,也可以是同一种物质,有的反应物中元素化合价反应前后没有变化,该反应物既不是氧化剂也不是还原剂。
【变式训练1】 (2022·北京顺义区高一检测)单宁是一种天然防腐剂,可有效避免葡萄酒因氧化而变酸,下列判断正确的是( )
A.单宁作还原剂 B.单宁作氧化剂
C.单宁被还原 D.单宁中某元素化合价降低
解析:由题目可知,单宁能有效避免葡萄酒因氧化变酸,因此单宁为还原剂,A正确,B错误;还原剂被氧化,C错误;还原剂具有还原性,化合价升高,D错误。
A
【例2】 (2022·河北唐山遵化期中)根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O===H2SO4+2HI;2FeCl2+Cl2===2FeCl3;2FeCl3+2HI===2FeCl2+2HCl+I2
A.I->Fe2+>Cl->SO2
B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2
D.SO2>I->Fe2+>Cl-
探究二 氧化性、还原性强弱比较
D
【解析】 根据还原剂的还原性强于还原产物的还原性判断:①SO2为还原剂,HI为还原产物,故SO2的还原性强于I-;②FeCl2为还原剂,FeCl3为还原产物,故Fe2+的还原性强于Cl-;③HI为还原剂,FeCl2为还原产物,故I-的还原性强于Fe2+。综上所述,I-、Fe2+、Cl-、SO2四种粒子的还原性强弱顺序为SO2>I->Fe2+>Cl-,故D项正确。
氧化性、还原性强弱比较的常用方法
1.根据氧化还原反应方程式比较
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
即比什么性,找什么剂,产物之性小于剂。
2.根据元素的活动性顺序比较
如:Fe+CuSO4===FeSO4+Cu
还原性:Fe>Cu
在反应中Fe是还原剂,Cu是还原产物。
3.根据氧化产物的价态高低判断
同一物质在相同条件下,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。
Fe被Cl2氧化成+3价,而S只能把其氧化成+2价,故氧化性:Cl2>S。
判断还原剂还原性的原理类似。
4.根据反应条件来判断
当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)反应时,反应越易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。
【变式训练2】 (1)Mg、Cu2+、Cl-、Fe2+四种微粒中,既具有氧化性又具有还原性的是________。
解析:Fe2+既可以失去电子变为Fe3+,表现还原性,也可以得到电子变为Fe单质,表现氧化性,因此Fe2+既具有氧化性又具有还原性。
Fe2+
(2)从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强。
①铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质。则在Cu、Fe、Ag中,_____的还原性最强;在Cu2+、Fe2+、Ag+中,_______的氧化性较强。
②铁在氯气中燃烧生成棕褐色物质(FeCl3),而在盐酸中生成浅绿色溶液(FeCl2)。则在Cl2、Cl-、H+中,____________具有氧化性,______的氧化性较强。
Fe
Ag+
Cl2、H+
Cl2
解析:①铁钉浸入CuSO4溶液中,发生的反应是Fe+Cu2+===Fe2++Cu,则还原性:Fe>Cu,氧化性:Cu2+>Fe2+;铜丝浸入AgNO3溶液中发生的反应是Cu+2Ag+===Cu2++2Ag,则还原性:Cu>Ag,氧化性:Ag+>Cu2+,从而可得还原性:Fe>Cu>Ag,氧化性:Ag+>Cu2+>Fe2+。②铁在氯气中燃烧发生的反应是2Fe+3Cl2 2FeCl3,氧化剂是Cl2,铁和盐酸发生反应:Fe+2H+===Fe2++H2↑,氧化剂是HCl,故Cl2和H+具有氧化性,氧化性较强的是Cl2。
随堂检测·知识巩固
即时演练达标
第
分
部
三
1.(2022·福建福州期末)关于反应Cl2+SO2+2H2O===2HCl+H2SO4,下列说法正确的是( )
A.SO2是氧化剂 B.Cl2发生氧化反应
C.H2SO4是还原产物 D.氧化剂与还原剂的个数之比为1:1
解析:反应过程中SO2转化为H2SO4,S元素化合价升高,SO2是还原剂,H2SO4是氧化产物,A、C错误;Cl2转化为HCl,Cl元素化合价降低,Cl2发生还原反应,B错误;根据方程式可知,氧化剂(Cl2)与还原剂(SO2)的个数之比为1:1,D正确。
D
2.下列说法正确的是( )
A.金属单质在反应中只能作还原剂,非金属单质在反应中只能作氧化剂
B.氧化剂在反应中失去电子,还原剂在反应中得到电子
C.氧化剂具有氧化性,还原剂具有还原性
D.阳离子只有氧化性,阴离子只有还原性
解析:A项,非金属单质在反应中既可以作氧化剂也可以作还原剂,例如氢气和氧气反应时,氢气作还原剂,氧气作氧化剂,错误;B项,氧化剂得到电子,还原剂失去电子,错误;D项,阳离子可能有还原性,例如亚铁离子,阴离子可能有氧化性,例如MnO 、ClO-等,错误。
C
3.含有铜元素的物质在以下反应中表现还原性的是( )
A.图①:铜丝在空气中加热
B.图②:氢气与灼热的氧化铜反应
C.图③:硫酸铜溶液中滴加氢氧化钠溶液
D.图④:铁丝插入CuSO4溶液中
解析:氢气还原氧化铜,铁丝插入硫酸铜溶液中,+2价的铜均被还原,含铜元素物质表现氧化性,B、D错误;C项发生复分解反应,不是氧化还原反应,C错误。
A
4.常温下,在溶液中可发生以下反应:
①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2。由此判断下列说法中错误的是( )
A.铁元素在反应①和③中均被氧化
B.当反应②中有1个Cl2被还原时,有2个Br-被氧化
C.氧化性强弱顺序为Cl2>Br2>Fe3+>I2
D.还原性强弱顺序为I->Fe2+>Br->Cl-
A
解析:反应①中Fe2+作还原剂,在反应中被氧化,反应③中Fe3+作氧化剂,在反应中被还原,A不正确;反应②中Cl2作氧化剂,当1个Cl2被还原时,有2个Br-被氧化,B正确;由反应①可知,氧化性:Br2>Fe3+,还原性:Fe2+>Br-,由反应②可知,氧化性:Cl2>Br2,还原性:Br->Cl-,由反应③可知,氧化性:Fe3+>I2,还原性:I->Fe2+,C、D正确。
(2)用单线桥法表示出电子转移情况。
(3)该反应中氧化剂是________,发生氧化反应的是_______,氧化产物是______。
(4)氧化性:MnO2比Cl2的____。
MnO2
HCl
Cl2
强
第一章 物质及其变化
第三节 氧化还原反应
第2课时
课前预习·基础回扣
必备知识梳理
第
分
部
一
一、氧化剂和还原剂
1.氧化还原反应中的相关概念
(1)相关概念
①氧化剂与还原剂
氧化剂:在氧化还原反应中,所含元素的化合价______,即得到电子(或电子对偏向)的物质。
还原剂:在氧化还原反应中,所含元素的化合价______,即失去电子(或电子对偏离)的物质。
降低
升高
②氧化产物与还原产物
氧化产物:还原剂失去电子被氧化的产物。
还原产物:氧化剂得到电子被还原的产物。
③氧化性与还原性
氧化性:物质得电子的性质或能力。
还原性:物质失电子的性质或能力。
2.常见的氧化剂、还原剂
物质种类 常见物质
氧化剂 部分非金属单质 O2、Cl2等
含有高价态元素的化合物 浓硫酸、HNO3、KMnO4、MnO2、KClO3、K2Cr2O7等
某些金属活动性较弱的元素对应的高价态离子 Fe3+、Ag+、Pb4+、Cu2+等
过氧化物 Na2O2、H2O2等
物质种类 常见物质
还原剂 活泼的金属单质 Al、Zn等
某些非金属单质 C、H2等
非金属阴离子和氢化物 Cl-、Br-、I-、S2-、HI、NH3、H2S等
含有较低价态元素的化合物 CO、SO2、H2SO3、Na2SO3、FeSO4等
1.判断正误(正确的打“√”,错误的打“×”)。
(1)在反应中,氧化剂发生氧化反应,还原剂发生还原反应。( )
(2)氧化剂得电子被氧化为还原产物。( )
(3)在氧化还原反应中,金属单质作反应物时一定是还原剂。( )
(4)在同一反应中,氧化剂和还原剂不可能是同一物质。( )
(5)HCl在反应中既可以作氧化剂又可以作还原剂。( )
(6)元素处于最高化合价时,一定具有强氧化性。( )
自我测评
×
×
√
×
√
×
2.(2022·山西太原高一期末)吸进人体内的氧有2%转化为氧化性极强的活性氧,活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A.作还原剂 B.作氧化剂
C.既作氧化剂又作还原剂 D.以上均不是
解析:活性氧具有较强的氧化性,亚硒酸钠(Na2SeO3)能消除人体内的活性氧,因此亚硒酸钠具有还原性,与活性氧反应时,亚硒酸钠作还原剂。
A
二、氧化性、还原性及其强弱比较
1.氧化性、还原性的强弱与得失电子的关系
(1)氧化性:物质越易得电子,氧化性越强。
(2)还原性:物质越易失电子,还原性越强。
物质氧化性、还原性的强弱与得失电子的难易有关,与得失电子的多少无关。
2.物质的氧化性及还原性与核心元素化合价的关系
氧化性
氧化性
还原性
还原性
1.判断正误(正确的打“√”,错误的打“×”)。
(1)还原剂失去电子具有氧化性。( )
(2)碘化氢中碘为最低价,故碘化氢只具有还原性。( )
(3)失电子数越多的物质还原性越强。( )
(4)Cu2+比Fe2+的氧化性强,Cu比Fe的还原性强。( )
自我测评
×
×
×
×
√
2.H2O2有杀菌消毒作用,医疗上常利用它来清洗伤口。
(1)采矿废液中的氰化物(如KCN)一般用H2O2进行无毒化处理,化学方程式为KCN+H2O2+H2O===KHCO3+NH3↑(KCN中N为-3价),该反应中被氧化的元素是____(填元素名称),体现了H2O2的______性。
解析:反应中碳元素化合价从+2升高到+4,碳元素被氧化。
碳
氧化
(2)H2O2被称为“绿色氧化剂”的原因是_____________________________
______________。
解析:H2O2作氧化剂时,其还原产物是H2O,无污染,因此H2O2被称为“绿色氧化剂”。
H2O2作氧化剂,其还原产物是
H2O,无污染
课堂探究·要点精讲
关键能力提升
第
分
部
二
【例1】 宋代著名法医学家宋慈的《洗冤集录》中有“银针验毒”的记载,“银针验毒”的原理是4Ag+2H2S+O2===2Ag2S+2H2O,其中H2S是( )
A.氧化剂 B.还原剂
C.既是氧化剂又是还原剂 D.既不是氧化剂也不是还原剂
【解析】 反应中Ag元素和O元素化合价发生变化,而S、H元素化合价在反应前后不变,H2S既不是氧化剂也不是还原剂。
探究一 氧化剂和还原剂的判断
D
1.氧化还原反应知识结构模型
巧记:简化为六个字,“升失氧,降得还”。
2.氧化还原反应中的易错点
(1)在氧化还原反应中,若有一种元素被氧化,误认为一定有另一种元素被还原。在氧化还原反应中,一种元素被氧化,不一定有另一种元素被还原,因为同种元素之间也能发生氧化还原反应,在反应Cl2+H2O HCl+HClO中,被氧化与被还原的元素均是氯元素。
(2)氧化还原反应中的反应物不一定都是氧化剂和还原剂。在氧化还原反应中一定有氧化剂和还原剂,但氧化剂和还原剂可以是不同种物质,也可以是同一种物质,有的反应物中元素化合价反应前后没有变化,该反应物既不是氧化剂也不是还原剂。
【变式训练1】 (2022·北京顺义区高一检测)单宁是一种天然防腐剂,可有效避免葡萄酒因氧化而变酸,下列判断正确的是( )
A.单宁作还原剂 B.单宁作氧化剂
C.单宁被还原 D.单宁中某元素化合价降低
解析:由题目可知,单宁能有效避免葡萄酒因氧化变酸,因此单宁为还原剂,A正确,B错误;还原剂被氧化,C错误;还原剂具有还原性,化合价升高,D错误。
A
【例2】 (2022·河北唐山遵化期中)根据下列反应的化学方程式,判断有关物质的还原性强弱顺序是( )
I2+SO2+2H2O===H2SO4+2HI;2FeCl2+Cl2===2FeCl3;2FeCl3+2HI===2FeCl2+2HCl+I2
A.I->Fe2+>Cl->SO2
B.Cl->Fe2+>SO2>I-
C.Fe2+>I->Cl->SO2
D.SO2>I->Fe2+>Cl-
探究二 氧化性、还原性强弱比较
D
【解析】 根据还原剂的还原性强于还原产物的还原性判断:①SO2为还原剂,HI为还原产物,故SO2的还原性强于I-;②FeCl2为还原剂,FeCl3为还原产物,故Fe2+的还原性强于Cl-;③HI为还原剂,FeCl2为还原产物,故I-的还原性强于Fe2+。综上所述,I-、Fe2+、Cl-、SO2四种粒子的还原性强弱顺序为SO2>I->Fe2+>Cl-,故D项正确。
氧化性、还原性强弱比较的常用方法
1.根据氧化还原反应方程式比较
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
即比什么性,找什么剂,产物之性小于剂。
2.根据元素的活动性顺序比较
如:Fe+CuSO4===FeSO4+Cu
还原性:Fe>Cu
在反应中Fe是还原剂,Cu是还原产物。
3.根据氧化产物的价态高低判断
同一物质在相同条件下,被不同氧化剂氧化的程度越大,氧化剂的氧化性越强。
Fe被Cl2氧化成+3价,而S只能把其氧化成+2价,故氧化性:Cl2>S。
判断还原剂还原性的原理类似。
4.根据反应条件来判断
当不同的氧化剂(或还原剂)与同一还原剂(或氧化剂)反应时,反应越易进行,则对应的氧化剂(或还原剂)的氧化性(或还原性)越强,反之越弱。
【变式训练2】 (1)Mg、Cu2+、Cl-、Fe2+四种微粒中,既具有氧化性又具有还原性的是________。
解析:Fe2+既可以失去电子变为Fe3+,表现还原性,也可以得到电子变为Fe单质,表现氧化性,因此Fe2+既具有氧化性又具有还原性。
Fe2+
(2)从下列各组反应对比中,判断哪种粒子的氧化性最强,哪种粒子的还原性最强。
①铁钉浸入CuSO4溶液后,表面会附有红色物质;铜丝浸入AgNO3溶液后,表面会附有银白色物质。则在Cu、Fe、Ag中,_____的还原性最强;在Cu2+、Fe2+、Ag+中,_______的氧化性较强。
②铁在氯气中燃烧生成棕褐色物质(FeCl3),而在盐酸中生成浅绿色溶液(FeCl2)。则在Cl2、Cl-、H+中,____________具有氧化性,______的氧化性较强。
Fe
Ag+
Cl2、H+
Cl2
解析:①铁钉浸入CuSO4溶液中,发生的反应是Fe+Cu2+===Fe2++Cu,则还原性:Fe>Cu,氧化性:Cu2+>Fe2+;铜丝浸入AgNO3溶液中发生的反应是Cu+2Ag+===Cu2++2Ag,则还原性:Cu>Ag,氧化性:Ag+>Cu2+,从而可得还原性:Fe>Cu>Ag,氧化性:Ag+>Cu2+>Fe2+。②铁在氯气中燃烧发生的反应是2Fe+3Cl2 2FeCl3,氧化剂是Cl2,铁和盐酸发生反应:Fe+2H+===Fe2++H2↑,氧化剂是HCl,故Cl2和H+具有氧化性,氧化性较强的是Cl2。
随堂检测·知识巩固
即时演练达标
第
分
部
三
1.(2022·福建福州期末)关于反应Cl2+SO2+2H2O===2HCl+H2SO4,下列说法正确的是( )
A.SO2是氧化剂 B.Cl2发生氧化反应
C.H2SO4是还原产物 D.氧化剂与还原剂的个数之比为1:1
解析:反应过程中SO2转化为H2SO4,S元素化合价升高,SO2是还原剂,H2SO4是氧化产物,A、C错误;Cl2转化为HCl,Cl元素化合价降低,Cl2发生还原反应,B错误;根据方程式可知,氧化剂(Cl2)与还原剂(SO2)的个数之比为1:1,D正确。
D
2.下列说法正确的是( )
A.金属单质在反应中只能作还原剂,非金属单质在反应中只能作氧化剂
B.氧化剂在反应中失去电子,还原剂在反应中得到电子
C.氧化剂具有氧化性,还原剂具有还原性
D.阳离子只有氧化性,阴离子只有还原性
解析:A项,非金属单质在反应中既可以作氧化剂也可以作还原剂,例如氢气和氧气反应时,氢气作还原剂,氧气作氧化剂,错误;B项,氧化剂得到电子,还原剂失去电子,错误;D项,阳离子可能有还原性,例如亚铁离子,阴离子可能有氧化性,例如MnO 、ClO-等,错误。
C
3.含有铜元素的物质在以下反应中表现还原性的是( )
A.图①:铜丝在空气中加热
B.图②:氢气与灼热的氧化铜反应
C.图③:硫酸铜溶液中滴加氢氧化钠溶液
D.图④:铁丝插入CuSO4溶液中
解析:氢气还原氧化铜,铁丝插入硫酸铜溶液中,+2价的铜均被还原,含铜元素物质表现氧化性,B、D错误;C项发生复分解反应,不是氧化还原反应,C错误。
A
4.常温下,在溶液中可发生以下反应:
①2Fe2++Br2===2Fe3++2Br-,②2Br-+Cl2===Br2+2Cl-,③2Fe3++2I-===2Fe2++I2。由此判断下列说法中错误的是( )
A.铁元素在反应①和③中均被氧化
B.当反应②中有1个Cl2被还原时,有2个Br-被氧化
C.氧化性强弱顺序为Cl2>Br2>Fe3+>I2
D.还原性强弱顺序为I->Fe2+>Br->Cl-
A
解析:反应①中Fe2+作还原剂,在反应中被氧化,反应③中Fe3+作氧化剂,在反应中被还原,A不正确;反应②中Cl2作氧化剂,当1个Cl2被还原时,有2个Br-被氧化,B正确;由反应①可知,氧化性:Br2>Fe3+,还原性:Fe2+>Br-,由反应②可知,氧化性:Cl2>Br2,还原性:Br->Cl-,由反应③可知,氧化性:Fe3+>I2,还原性:I->Fe2+,C、D正确。
(2)用单线桥法表示出电子转移情况。
(3)该反应中氧化剂是________,发生氧化反应的是_______,氧化产物是______。
(4)氧化性:MnO2比Cl2的____。
MnO2
HCl
Cl2
强
