化学人教版(2019)必修第一册1.3.1氧化还原反应第1课时(共45张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.1氧化还原反应第1课时(共45张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-03-10 11:04:56 | ||
图片预览










文档简介
(共45张PPT)
第一章 物质及其变化
第三节 氧化还原反应
第1课时
课前预习·基础回扣
必备知识梳理
第
分
部
一
一、认识氧化还原反应
1.从得失氧的角度
从得失氧的角度分析以下反应,完成下表。
物质 反应物 发生的反应(氧化
反应或还原反应)
得到氧的物质 __________ __________
失去氧的物质 ________________ __________
结论:一种物质得到氧发生__________,必然有一种物质失去氧发生__________,氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
C、CO
氧化反应
CuO、Fe2O3
还原反应
氧化反应
还原反应
2.从元素化合价升降的角度
(1)对于有氧元素参加的反应
①铜元素化合价______,发生______反应。
②碳元素化合价______,发生______反应。
降低
还原
升高
氧化
(2)对于无氧元素参加的反应
例:Fe+CuSO4===FeSO4+Cu。
①铜元素化合价______,发生______反应。
②铁元素化合价______,发生______反应。
(3)结论:①反应前后有元素化合价变化(升降)的反应称为氧化还原反应。
②物质所含元素化合价______的反应是氧化反应,物质所含元素化合价______的反应是还原反应。
③氧化还原反应的特征:反应前后有元素________的变化(升降)。
降低
还原
升高
氧化
升高
降低
化合价
3.从电子转移的角度
①钠原子______最外层1个电子,成为具有稳定结构的Na+,其化合价由0价升高为_____价,发生了______反应,被______。
②氯原子最外层______1个电子,成为具有稳定结构的Cl-,其化合价由___价降低为_____价,发生了______反应,被______。
③在这个反应中,氯原子和钠原子之间发生了电子的______,分别形成阴离子和阳离子,使元素的化合价发生了变化。
失去
+1
氧化
氧化
得到
0
-1
还原
还原
得失
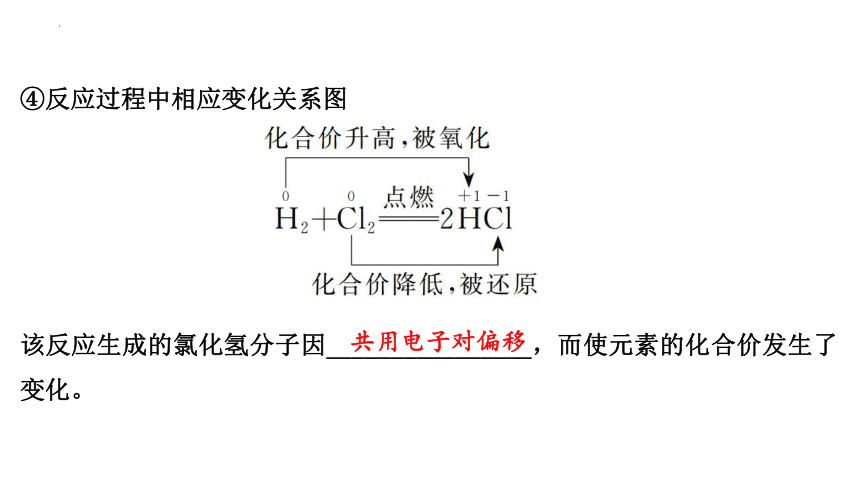
④反应过程中相应变化关系图
(2)在H2+Cl2 2HCl的反应过程中
①氢原子和氯原子都不易失去电子,都可______1个电子形成稳定结构,二者只能形成共用电子对,使双方最外电子层都达到稳定结构。
②共用电子对______于吸引力稍强的氯原子,氯元素的化合价由___价降低为_____价,被______,氯气发生了______反应。
③共用电子对______于吸引力稍弱的氢原子,氢元素的化合价由___价升高到_____价,被______,氢气发生了______反应。
获得
偏向
0
-1
还原
还原
偏离
0
+1
氧化
氧化
④反应过程中相应变化关系图
该反应生成的氯化氢分子因________________,而使元素的化合价发生了变化。
共用电子对偏移
(3)结论:①有电子转移(电子得失或共用电子对偏移)的反应是氧化还原反应。
②元素的原子失去电子(或电子对偏离),则元素的化合价______,物质被______,发生______反应;元素的原子得到电子(或电子对偏向),则元素的化合价______,物质被______,发生______反应。
③氧化还原反应的本质是__________。
升高
氧化
氧化
降低
还原
还原
电子转移
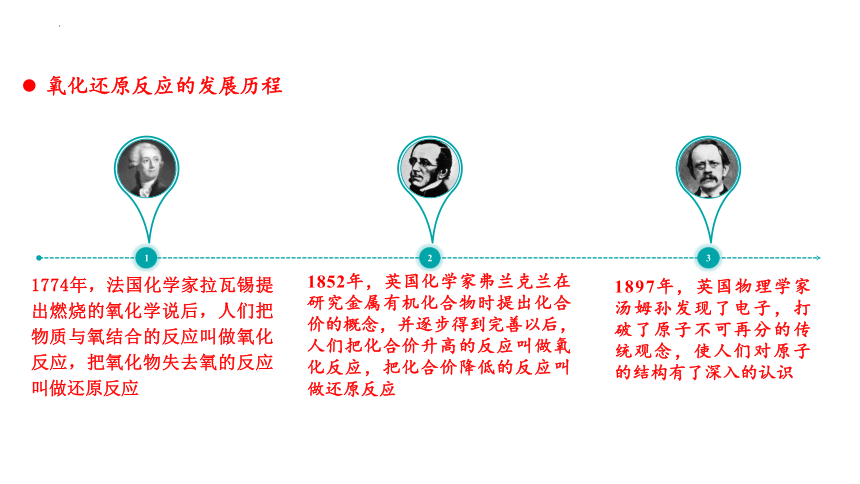
氧化还原反应的发展历程
1774年,法国化学家拉瓦锡提出燃烧的氧化学说后,人们把物质与氧结合的反应叫做氧化反应,把氧化物失去氧的反应叫做还原反应
1
1852年,英国化学家弗兰克兰在研究金属有机化合物时提出化合价的概念,并逐步得到完善以后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应
2
1897年,英国物理学家汤姆孙发现了电子,打破了原子不可再分的传统观念,使人们对原子的结构有了深入的认识
3
1.判断正误(正确的打“√”,错误的打“×”)。
(1)氧化还原反应中一定有氧元素的得失。( )
(2)氧化还原反应中所有元素的化合价都一定发生变化。( )
(3)氧化还原反应中一种元素的化合价升高,必定另一种元素的化合价降低。( )
(4)某元素从游离态变为化合态,该元素一定被氧化。( )
(5)氧化还原反应中得失电子总数一定相等。( )
自我测评
×
×
×
×
√
C
H
O
Cl
SO2
H2S
S
S
HCl
MnO2
Cl
Mn
二、氧化还原反应中电子转移的两种表示方法
1.双线桥法
(1)含义:表示反应前后__________由反应物转化为生成物时电子转移的情况。如
同一元素
得到
失去
(2)注意事项
①箭头、箭尾必须对应化合价变化的同种元素的原子。
②必须注明“得到”或“失去”。
③电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略。
④被还原的物质和被氧化的物质得失电子数守恒。
2.单线桥法
(1)表示反应过程中__________原子间的电子转移情况,用箭头标明__________的方向。如
(2)单线桥表示法的特点
①箭头由反应物中____________原子指向____________原子,箭头的指向即电子转移的方向。
②________标明“得到”或“失去”,只标明电子转移______。
不同元素
电子转移
失电子元素
得电子元素
不需要
数目
1.(2022·浙江衢州高一检测)下列变化没有发生电子转移的是( )
自我测评
D
2.下列氧化还原反应方程式表示的变化过程中,正确的是( )
解析:A、B中得、失电子数目不相等,错误;C中应得失1个电子,且得失电子标反了,错误。
D
课堂探究·要点精讲
关键能力提升
第
分
部
二
【例1】 化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可以分为氧化还原反应和非氧化还原反应。回答下列问题:
探究一 氧化还原反应的判断
(1)既是氧化还原反应又是化合反应的为____(填序号,下同)。
(2)属于非氧化还原反应的为________。
(3)不属于四种基本反应类型的为____。
(4)属于置换反应的为____。
①
②⑤⑥
⑦
③
【解析】 根据氧化还原反应的特征可知,凡是反应前后有元素化合价变化的反应都属于氧化还原反应,对比反应前后元素化合价的变化可知,反应①③④⑦中元素化合价发生了变化,属于氧化还原反应;反应②⑤⑥中元素化合价没发生变化,属于非氧化还原反应;结合四种基本反应类型的概念可知,既是氧化还原反应又是化合反应的为①;不属于四种基本反应类型的为⑦;属于置换反应的为③。
1.判断、分析氧化还原反应的基本思路
(1)标化合价:根据化学反应方程式中各物质的化学式确定相关元素的化合价。
(2)比化合价:对比反应前后同种元素的化合价,根据化合价是否变化及变化趋势判断反应类型。
2.确定元素化合价的方法
(1)在单质中元素的化合价为0。
(2)化合物中正负化合价的代数和为0,先标出熟悉元素的化合价,再求解其他元素的化合价。
(3)有机物中碳元素化合价的确定方法:有机物中氧元素的化合价为-2,氢元素的化合价为+1。利用各元素正、负化合价代数和为0的原则确定碳元素的化合价。例如,设乙酸(C2H4O2)中C的平均化合价为x,满足2x+(+1)×4+(-2)×2=0,则x=0。
(4)“根”(又叫原子团)的化合价的代数和等于“根”所带电荷数目,符号与电荷类型相同。如硫酸根(SO ):(+6)+(-2)×4=-2,铵根离子(NH ):(+1)×4+(-3)=+1。
3.氧化还原反应与四种基本反应类型之间的关系
微点拨:有单质参加或生成的反应不一定是氧化还原反应。如同素异形体之间的相互转化:3O2放电 2O3,不属于氧化还原反应。
【变式训练1】 磷单质在反应4P+3KOH+3H2O===3KH2PO2+PH3↑中的变化是( )
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
解析:标出磷元素的化合价:由反应前的0价,部分升高为KH2PO2中的+1价,被氧化;另一部分降低为PH3中的-3价,被还原。
C
【例2】 下列单、双线桥的表示方法正确的是( )
探究二 电子转移的表示方法
C
【解析】 钠元素的化合价升高,氯元素的化合价降低,Na失电子,Cl得电子,转移的电子数为2e-,A错误;Cl元素的化合价既升高又降低,转移的电子数为e-,B错误;Fe元素的化合价升高,Cl元素的化合价降低,Fe失电子,Cl得电子,转移的电子数为6e-,C正确;Fe元素的化合价升高,H元素的化合价降低,Fe失电子,H得电子,转移的电子数为2e-,D错误。
电子转移标注的分析步骤
1.双线桥法
2.单线桥法
【变式训练2】 已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是_____,被还原的元素是____,发生氧化反应的物质是_____,发生还原反应的物质是_________。
Cu
N
Cu
HNO3
(2)用双线桥法表示反应中电子转移的方向和数目:
__________________________________。
(3)用单线桥法表示反应中电子转移的方向和数目:
___________________________________________________。
解析:由化学方程式可知,铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原。故Cu发生氧化反应,HNO3发生还原反应。
随堂检测·知识巩固
即时演练达标
第
分
部
三
1.(2022·贵州黔东南高一检测)诗词是中华民族的文化瑰宝。下列诗词中不涉及氧化还原反应的是( )
A.爆竹声中一岁除 B.吹尽狂沙始到金
C.野火烧不尽 D.蜡炬成灰泪始干
解析:爆竹声中一岁除,涉及元素化合价变化,属于氧化还原反应,A错误;吹尽狂沙始到金,为物理法淘金,不涉及氧化还原反应,B正确;野火烧不尽,蜡炬成灰泪始干,存在燃烧现象,燃烧属于氧化还原反应,C、D错误。
B
2.从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是( )
C
解析:该反应不是氧化还原反应,A错误;CuO―→Cu,铜元素由+2价降低到0价,发生还原反应,B错误;Fe―→FeCl2,铁元素由0价升高到+2价,发生氧化反应,C正确;HCl―→H2,氢元素由+1价降低到0价,发生还原反应,D错误。
3.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影区域的是( )
D
解析:阴影区域的反应必须属于氧化还原反应,且不属于化合、分解、置换反应。A项,该反应既属于分解反应,又属于氧化还原反应;B项,该反应属于分解反应,不属于氧化还原反应;C项,该反应既属于化合反应,又属于氧化还原反应;D项,该反应属于氧化还原反应,但不属于化合、分解、置换反应中的任意一种,故属于阴影区域。
4.在反应中,元素X的原子将电子转移给元素Y的原子,则下列说法正确的是( )
①元素X被氧化 ②元素Y被氧化 ③元素X发生还原反应 ④元素Y发生还原反应
A.①② B.③④
C.②③ D.①④
解析:反应中,元素X的原子将电子转移给元素Y的原子,则X失去电子,Y得到电子,则X被氧化,发生氧化反应,①正确,③错误;Y被还原,发生还原反应,②错误,④正确。
D
铝
失去
氮
还原
(2)上述反应是否属于四种基本类型?____(填“是”或“否”)。
(3)用双线桥法表示出反应中电子转移的方向和数目:
___________________________。
解析:在题述反应中,Al由0价升高到+3价,失去电子,被氧化;N由+5价降低到0价,得到电子,被还原。
否
第一章 物质及其变化
第三节 氧化还原反应
第1课时
课前预习·基础回扣
必备知识梳理
第
分
部
一
一、认识氧化还原反应
1.从得失氧的角度
从得失氧的角度分析以下反应,完成下表。
物质 反应物 发生的反应(氧化
反应或还原反应)
得到氧的物质 __________ __________
失去氧的物质 ________________ __________
结论:一种物质得到氧发生__________,必然有一种物质失去氧发生__________,氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
C、CO
氧化反应
CuO、Fe2O3
还原反应
氧化反应
还原反应
2.从元素化合价升降的角度
(1)对于有氧元素参加的反应
①铜元素化合价______,发生______反应。
②碳元素化合价______,发生______反应。
降低
还原
升高
氧化
(2)对于无氧元素参加的反应
例:Fe+CuSO4===FeSO4+Cu。
①铜元素化合价______,发生______反应。
②铁元素化合价______,发生______反应。
(3)结论:①反应前后有元素化合价变化(升降)的反应称为氧化还原反应。
②物质所含元素化合价______的反应是氧化反应,物质所含元素化合价______的反应是还原反应。
③氧化还原反应的特征:反应前后有元素________的变化(升降)。
降低
还原
升高
氧化
升高
降低
化合价
3.从电子转移的角度
①钠原子______最外层1个电子,成为具有稳定结构的Na+,其化合价由0价升高为_____价,发生了______反应,被______。
②氯原子最外层______1个电子,成为具有稳定结构的Cl-,其化合价由___价降低为_____价,发生了______反应,被______。
③在这个反应中,氯原子和钠原子之间发生了电子的______,分别形成阴离子和阳离子,使元素的化合价发生了变化。
失去
+1
氧化
氧化
得到
0
-1
还原
还原
得失
④反应过程中相应变化关系图
(2)在H2+Cl2 2HCl的反应过程中
①氢原子和氯原子都不易失去电子,都可______1个电子形成稳定结构,二者只能形成共用电子对,使双方最外电子层都达到稳定结构。
②共用电子对______于吸引力稍强的氯原子,氯元素的化合价由___价降低为_____价,被______,氯气发生了______反应。
③共用电子对______于吸引力稍弱的氢原子,氢元素的化合价由___价升高到_____价,被______,氢气发生了______反应。
获得
偏向
0
-1
还原
还原
偏离
0
+1
氧化
氧化
④反应过程中相应变化关系图
该反应生成的氯化氢分子因________________,而使元素的化合价发生了变化。
共用电子对偏移
(3)结论:①有电子转移(电子得失或共用电子对偏移)的反应是氧化还原反应。
②元素的原子失去电子(或电子对偏离),则元素的化合价______,物质被______,发生______反应;元素的原子得到电子(或电子对偏向),则元素的化合价______,物质被______,发生______反应。
③氧化还原反应的本质是__________。
升高
氧化
氧化
降低
还原
还原
电子转移
氧化还原反应的发展历程
1774年,法国化学家拉瓦锡提出燃烧的氧化学说后,人们把物质与氧结合的反应叫做氧化反应,把氧化物失去氧的反应叫做还原反应
1
1852年,英国化学家弗兰克兰在研究金属有机化合物时提出化合价的概念,并逐步得到完善以后,人们把化合价升高的反应叫做氧化反应,把化合价降低的反应叫做还原反应
2
1897年,英国物理学家汤姆孙发现了电子,打破了原子不可再分的传统观念,使人们对原子的结构有了深入的认识
3
1.判断正误(正确的打“√”,错误的打“×”)。
(1)氧化还原反应中一定有氧元素的得失。( )
(2)氧化还原反应中所有元素的化合价都一定发生变化。( )
(3)氧化还原反应中一种元素的化合价升高,必定另一种元素的化合价降低。( )
(4)某元素从游离态变为化合态,该元素一定被氧化。( )
(5)氧化还原反应中得失电子总数一定相等。( )
自我测评
×
×
×
×
√
C
H
O
Cl
SO2
H2S
S
S
HCl
MnO2
Cl
Mn
二、氧化还原反应中电子转移的两种表示方法
1.双线桥法
(1)含义:表示反应前后__________由反应物转化为生成物时电子转移的情况。如
同一元素
得到
失去
(2)注意事项
①箭头、箭尾必须对应化合价变化的同种元素的原子。
②必须注明“得到”或“失去”。
③电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略。
④被还原的物质和被氧化的物质得失电子数守恒。
2.单线桥法
(1)表示反应过程中__________原子间的电子转移情况,用箭头标明__________的方向。如
(2)单线桥表示法的特点
①箭头由反应物中____________原子指向____________原子,箭头的指向即电子转移的方向。
②________标明“得到”或“失去”,只标明电子转移______。
不同元素
电子转移
失电子元素
得电子元素
不需要
数目
1.(2022·浙江衢州高一检测)下列变化没有发生电子转移的是( )
自我测评
D
2.下列氧化还原反应方程式表示的变化过程中,正确的是( )
解析:A、B中得、失电子数目不相等,错误;C中应得失1个电子,且得失电子标反了,错误。
D
课堂探究·要点精讲
关键能力提升
第
分
部
二
【例1】 化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可以分为氧化还原反应和非氧化还原反应。回答下列问题:
探究一 氧化还原反应的判断
(1)既是氧化还原反应又是化合反应的为____(填序号,下同)。
(2)属于非氧化还原反应的为________。
(3)不属于四种基本反应类型的为____。
(4)属于置换反应的为____。
①
②⑤⑥
⑦
③
【解析】 根据氧化还原反应的特征可知,凡是反应前后有元素化合价变化的反应都属于氧化还原反应,对比反应前后元素化合价的变化可知,反应①③④⑦中元素化合价发生了变化,属于氧化还原反应;反应②⑤⑥中元素化合价没发生变化,属于非氧化还原反应;结合四种基本反应类型的概念可知,既是氧化还原反应又是化合反应的为①;不属于四种基本反应类型的为⑦;属于置换反应的为③。
1.判断、分析氧化还原反应的基本思路
(1)标化合价:根据化学反应方程式中各物质的化学式确定相关元素的化合价。
(2)比化合价:对比反应前后同种元素的化合价,根据化合价是否变化及变化趋势判断反应类型。
2.确定元素化合价的方法
(1)在单质中元素的化合价为0。
(2)化合物中正负化合价的代数和为0,先标出熟悉元素的化合价,再求解其他元素的化合价。
(3)有机物中碳元素化合价的确定方法:有机物中氧元素的化合价为-2,氢元素的化合价为+1。利用各元素正、负化合价代数和为0的原则确定碳元素的化合价。例如,设乙酸(C2H4O2)中C的平均化合价为x,满足2x+(+1)×4+(-2)×2=0,则x=0。
(4)“根”(又叫原子团)的化合价的代数和等于“根”所带电荷数目,符号与电荷类型相同。如硫酸根(SO ):(+6)+(-2)×4=-2,铵根离子(NH ):(+1)×4+(-3)=+1。
3.氧化还原反应与四种基本反应类型之间的关系
微点拨:有单质参加或生成的反应不一定是氧化还原反应。如同素异形体之间的相互转化:3O2放电 2O3,不属于氧化还原反应。
【变式训练1】 磷单质在反应4P+3KOH+3H2O===3KH2PO2+PH3↑中的变化是( )
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
解析:标出磷元素的化合价:由反应前的0价,部分升高为KH2PO2中的+1价,被氧化;另一部分降低为PH3中的-3价,被还原。
C
【例2】 下列单、双线桥的表示方法正确的是( )
探究二 电子转移的表示方法
C
【解析】 钠元素的化合价升高,氯元素的化合价降低,Na失电子,Cl得电子,转移的电子数为2e-,A错误;Cl元素的化合价既升高又降低,转移的电子数为e-,B错误;Fe元素的化合价升高,Cl元素的化合价降低,Fe失电子,Cl得电子,转移的电子数为6e-,C正确;Fe元素的化合价升高,H元素的化合价降低,Fe失电子,H得电子,转移的电子数为2e-,D错误。
电子转移标注的分析步骤
1.双线桥法
2.单线桥法
【变式训练2】 已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下:
3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
(1)被氧化的元素是_____,被还原的元素是____,发生氧化反应的物质是_____,发生还原反应的物质是_________。
Cu
N
Cu
HNO3
(2)用双线桥法表示反应中电子转移的方向和数目:
__________________________________。
(3)用单线桥法表示反应中电子转移的方向和数目:
___________________________________________________。
解析:由化学方程式可知,铜元素化合价升高,从0价变为+2价,被氧化;氮元素化合价降低,从+5价变为+2价,被还原。故Cu发生氧化反应,HNO3发生还原反应。
随堂检测·知识巩固
即时演练达标
第
分
部
三
1.(2022·贵州黔东南高一检测)诗词是中华民族的文化瑰宝。下列诗词中不涉及氧化还原反应的是( )
A.爆竹声中一岁除 B.吹尽狂沙始到金
C.野火烧不尽 D.蜡炬成灰泪始干
解析:爆竹声中一岁除,涉及元素化合价变化,属于氧化还原反应,A错误;吹尽狂沙始到金,为物理法淘金,不涉及氧化还原反应,B正确;野火烧不尽,蜡炬成灰泪始干,存在燃烧现象,燃烧属于氧化还原反应,C、D错误。
B
2.从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是( )
C
解析:该反应不是氧化还原反应,A错误;CuO―→Cu,铜元素由+2价降低到0价,发生还原反应,B错误;Fe―→FeCl2,铁元素由0价升高到+2价,发生氧化反应,C正确;HCl―→H2,氢元素由+1价降低到0价,发生还原反应,D错误。
3.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影区域的是( )
D
解析:阴影区域的反应必须属于氧化还原反应,且不属于化合、分解、置换反应。A项,该反应既属于分解反应,又属于氧化还原反应;B项,该反应属于分解反应,不属于氧化还原反应;C项,该反应既属于化合反应,又属于氧化还原反应;D项,该反应属于氧化还原反应,但不属于化合、分解、置换反应中的任意一种,故属于阴影区域。
4.在反应中,元素X的原子将电子转移给元素Y的原子,则下列说法正确的是( )
①元素X被氧化 ②元素Y被氧化 ③元素X发生还原反应 ④元素Y发生还原反应
A.①② B.③④
C.②③ D.①④
解析:反应中,元素X的原子将电子转移给元素Y的原子,则X失去电子,Y得到电子,则X被氧化,发生氧化反应,①正确,③错误;Y被还原,发生还原反应,②错误,④正确。
D
铝
失去
氮
还原
(2)上述反应是否属于四种基本类型?____(填“是”或“否”)。
(3)用双线桥法表示出反应中电子转移的方向和数目:
___________________________。
解析:在题述反应中,Al由0价升高到+3价,失去电子,被氧化;N由+5价降低到0价,得到电子,被还原。
否
