7.3+探索更小的微粒(课件)(共49张PPT)苏科版八年级物理下册同步教学精美课件
文档属性
| 名称 | 7.3+探索更小的微粒(课件)(共49张PPT)苏科版八年级物理下册同步教学精美课件 |  | |
| 格式 | pptx | ||
| 文件大小 | 15.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏科版 | ||
| 科目 | 物理 | ||
| 更新时间 | 2024-03-10 20:56:04 | ||
图片预览










文档简介
(共49张PPT)
八年级物理下册 苏科版
世界万物是由什么组成的
它们有最小的结构吗 如果有,那是什么呢
眨着眼的小星星是什么精灵
滋润万物生长的太阳会不会熄灭
天上的银河是一条河吗
面对宇宙万物,人们从没停止过探索.
向物质世界的两极进军
第七章 从粒子到宇宙
原子的核式
结构模型
科学家探索微
观粒子的进展
三、探索更小的微粒
1
导入新课
导入新课
前面我们学过,物质是由分子组成的;科学家通过研究又发现分子是由原子构成的(如图);
第3节 探索更小的微粒
石墨烯分子结构
那么原子是否可以再分呢?我们顺着物理学家的足迹一起探索更小的微粒吧!
水分子
2
学习新课
德谟克利特(约公元前460~公元前370),出生在色雷斯海滨的阿布德拉的商业城市,古希腊伟大的唯物主义哲学家,原子唯物论学说的创始人之一(率先提出原子论—“万物由原子构成”)。
①德谟克利特首先提出物质是由原子构成
一、原子的核式结构模型
1. 古代模型
他认为:万物的本原是原子和虚空。原子是不可再分的物质微粒,虚空是原子运动的场所。
②中国古代思想家庄子提出“物质无限可分”的哲理
庄子(约公元前369年—公元前286年),战国时期宋国蒙(主流说法为今河南商丘东北)人。 战国中期思想家、哲学家、文学家,道家学派代表人物,与老子并称“老庄”。
一、原子的核式结构模型
1. 古代模型
一尺长的棍棒,每日截取它的一半,永远截不完。提出“物质无限可分”的哲理.
1803年9月,道尔顿利用当时已掌握的一些分析数据,计算出了第一批原子量。1803年10月21日,在曼彻斯特的“文学和哲学学会”上,道尔顿第一次阐述了他关于原子论以及原子量计算的见解,其要点:
约翰·道尔顿
(John Dalton,1766—1844年),英国化学家、物理学家。原子理论的提出者。
道尔顿的原子论
化学元素由不可分的微粒——原子构成,原子在一切化学变化中是不可再分的最小单位。同种元素的原子性质和质量都相同,不同元素原子的性质和质量各不相同,原子质量是元素基本特征之一。
一、原子的核式结构模型
2. 道尔顿模型
十九世纪末(1897年),英国物理学家汤姆生在对阴极射线的研究中发现了带负电的电子,并得出电子是所有物质中原子的组成部分,揭开了原子具有结构的秘密。
汤姆生
英国物理学家,电子的发现者。
于1906年获得
诺贝尔物理学奖
①汤姆生发现电子
由于电子是带负电的,而原子又是中性的,因此物理学家推断出在原子中还存在带正电荷的其它物质。
一、原子的核式结构模型
3. 汤姆生模型
②汤姆生的“葡萄干蛋糕模型”
1903年物理学家汤姆生提出了一个原子结构模型,人们把它叫做“葡萄干蛋糕”模型。 翻译为“枣糕模型”或“西瓜模型”或“汤姆生模型”。
汤姆生模型认为:正电荷均匀分布在整个原子球体中,带负电的电子散布在原子中,这些电子分布在对称的位置上。
历史上,在一段时间内汤姆生的原子模型曾得到广泛的承认,后来被卢瑟福的有核模型所取代。
一、原子的核式结构模型
3. 汤姆生模型
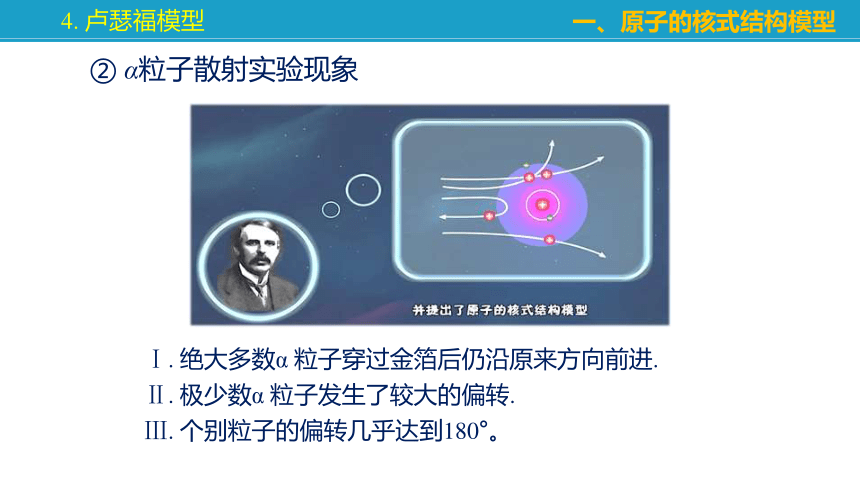
① α粒子散射实验
卢瑟福在1898年发现了α射线。他用准直的α射线轰击厚度为微米的金箔时,发现大多数粒子散射角度很小,但有少数α 粒子偏角很大。
4. 卢瑟福模型
欧内斯特·卢福瑟
(1871-1937),英国籍的新西兰人,著名物理学家,知名为原子核物理学之父。学术界公认他为继法拉第之后最伟大的实验物理学家。
一、原子的核式结构模型
② α粒子散射实验现象
Ⅰ. 绝大多数α 粒子穿过金箔后仍沿原来方向前进.
Ⅱ. 极少数α 粒子发生了较大的偏转.
Ⅲ. 个别粒子的偏转几乎达到180°。
4. 卢瑟福模型
一、原子的核式结构模型
③ α 粒子散射实验结论
实验结论:
原子中绝大部分是空的;α 粒子前进时撞在一个体积很小而质量又比它大很多的微粒上(原子核)。
根据实验进行推导:当α粒子穿过原子时,电子对α粒子运动的影响很小,影响α粒子运动的主要是另一种带正电的“粒子”,即原子核。
因为绝大多数的α粒子穿过原子时离核较远,受到的斥力很小,运动方向几乎没有改变,只有极少数α粒子可能与核十分接近,受到较大的斥力,才会发生大角度的偏转。
4. 卢瑟福模型
一、原子的核式结构模型
原子核
核外电子
原 子
④核式结构模型
通过对电荷,质量和偏转角度等的运算,卢瑟福1911年提出了原子的核式结构模型:
原子是由带正电的质量很集中的很小的原子核和在它周围运动着的带负电的电子组成的;就像行星绕太阳运转一样的一个体系。
一、原子的核式结构模型
4. 卢瑟福模型
电子云
原子的“电子云模型”
1926年奥地利物理学家埃尔温·薛定谔提出“电子云模型”。该模型中, 电子在原子核外很小的空间内做高速运动,其运行没有固定的规律,电子分层排布,接近现代人类对原子结构的认识。
埃尔温·薛定谔
(1887—1961年),奥地利物理学家,量子力学奠基人之一。因发展了原子理论,和狄拉克共获1933年诺贝尔物理学奖。
电子
原子核
一、原子的核式结构模型
5. 电子云模型
①汤姆生的
“葡萄干蛋糕模型”
②卢瑟福的
“核式结构模型”
③电子云模型
一、原子的核式结构模型
5. 总结:原子模型的建立过程
原子模型是人们对物质世界微观结构的认识而建立的模型。人们普遍接受的原子模型为由原子核(质子和中子)和电子构成,电子绕核做不规则运动,形成的电子云模型。原子模型最早由英国科学家道尔顿在1803年提出,经过汤姆逊、卢瑟福、波尔等人的改进与完善,进而形成了近代原子模型.
一、原子的核式结构模型
6. 摩擦起电的原因
由原子的核式结构模型进一步推理可知:
因为原子核很小且质量很大,而电子运动的空间很大且质量很小,所以移动或改变原子核非常困难,移动或改变电子比较容易。人们认为静电现象都是由于电子转移而形成的,这种观点称为电子转移观点。
应用电子转移观点,可以解释原子带电、物体带电和摩擦起电现象。
①电子转移观点
一、原子的核式结构模型
6. 摩擦起电的原因
②原子带电成为离子
一个中性的原子,如果失去一个或几个电子,就会使核内正电荷总数大于核外负电荷总数,则该原子将带正电,例如氢离子、钠离子。如果得到一个或几个电子,就会使核内正电荷总数小于核外负电荷总数,则该原子将带负电,例如氧离子、氯离子。
③物体带电成为带电体
一个中性的物体,如果失去若干电子,则该物体将带正电,如果得到若干电子,则该物体将带负电。
带正电荷
带负电荷
④为什么物体摩擦会起电的呢
束缚能力弱
的失去电子
束缚能力强
的得到电子
不同物质的原
子核束缚电子
的本领不同
摩擦起电的本质:电子的转移。
摩擦起电不是创造了电荷,只是电荷从一个物体转移到另一个物体,使正、负电荷分开。
摩擦时
一、原子的核式结构模型
6. 摩擦起电的原因
原子核还能再分吗?随着历史的发展,人们对原子内部结构的研究逐步深入。
质子所带正电荷的数量=电子所带负电荷的数量
①质子的发现
质子
原子核
1919年,卢瑟福用速度是20000km/s的“子弹”—α 粒子去轰击氮、氟、钾等元素的原子核时,发现在原子核中还存在一种带正电的质量比电子大很多的微粒——质子。
二、科学家探索微观粒子的进展
1. 原子核
中子的概念是由英国物理学家卢瑟福提出,中子的存在是1932年英国物理学家詹姆斯·查德威克用镭的α-射线轰击铍原子时的实验中证实的。
科学家在实验中进一步发现中子的质量与质子相同、但是不带电。
②中子的发现
詹姆斯·查德威克 (1891-1974),英国物理学家,于1935年获得诺贝尔物理学奖。
中子
原子核
二、科学家探索微观粒子的进展
1. 原子核
原子核
中子
质子
不带电
+
+
③原子核的组成
中子
质子
原子核,简称“核”,位于原子的核心部分,由质子和中子两种微粒构成;质子和中子统称为核子。
原子核带正电(即质子所带的正电),中子不带电。
二、科学家探索微观粒子的进展
1. 原子核
原 子
原子核
电 子
中子
质子
不带电
不带电
+
+
-
④原子的组成及带电情况
中子
质子
电子
二、科学家探索微观粒子的进展
1. 原子核
原子核极小,它的直径在10-16m~10-14m之间,体积只占原子体积的几千亿分之一,在这极小的原子核里却集中了99.95%以上原子的质量。
形象来说,就是地球和乒乓球的比例, 大约一比一千亿。
原子的直径:约10-10米
原子核的直径:约10-15米
⑤原子与原子核的大小比较
1. 原子核
二、科学家探索微观粒子的进展
1. 原子核
⑥夸克
默里·盖尔曼
(Murray Gell-Mann,1929—2019),生于美国纽约的一个犹太家庭,物理学家,提出了质子和中子是由三个夸克组成的,并因此获得诺贝尔物理学奖。
二、科学家探索微观粒子的进展
质子和中子是分别由三个夸克组成的.
质子和中子还能再分吗?随着人们对原子内部结构的研究逐步深入,物理学家默里·盖尔曼提出了质子和中子还可以再分。
电子<10-18m
核子由
夸克组成
质子
中子
粒子 分子 原子 原子核 核子
大小
原子核由质子和中子组成
总结:不同微观粒子的层次结构示意图
10-10~10-5m
10-10m
10-15~10-14m
10-15m
1. 原子核
二、科学家探索微观粒子的进展
加速器
生活 物理 社会
1911年,卢瑟福领导的研究组,利用一束高速运动的带正电的α粒子轰击很薄的金箔,获得了极有价值的实验现象和有关数据。由此,卢瑟福提出了著名的原子核式结构模型。该实验也启发了人们用具有更高能量的粒子作为“炮弹”,来探究微观世界的奥秘.
我们把能使带电粒子增加速度(或动能)的装置称为加速器。利用它可以加速电子、质子、 α粒子等带电粒子,使其具有很高的能量.
20世纪30年代,劳伦斯发明了回旋加速器。最早的回旋加速器可将质子的能量提高到 106eV(eV称为电子伏,是高能物理学中常用的能量单位)。1988年,我国建成了北京正负电子对撞机,它可使电子的能量提高到109eV。
加速器
生活 物理 社会
目前,世界上最大的加速器,是欧洲核子研究中心的大型强子对撞机,它可将质子的能量提高到1013eV。
大型强子对撞机
加速器在帮助人们深入探索微观世界的奥秘中发挥了重大作用,已有几十项与粒子物理研究有关的成果获得了诺贝尔物理学奖.
加速器在生产、生活中同样有着非常重要的作用,如用于癌症的治疗、工业探伤、食品的防腐与保鲜、复合材料的生产以及医疗用品消毒等。
【例题1】能保持物质化学性质不变的最小微粒是_____(选填字母:A.原子,B.分子);科学家对原子的结构进行猜想和实验,并提出了多种模型。在如图所示的两种模型中,卢瑟福提出的原子模型是_______(选填“甲”或“乙”)。
B
实验表明,分子是由原子组成的,分子是保持物质化学性质不变的最小微粒。故选B。
卢瑟福认为原子不是均匀分布的,而是中间很小的体积聚集了原子绝大部分的质量,核外质量很小的电子围绕着原子核转动,故原子模型为乙。所以选乙。
乙
本节典型例题
【例题2】如图所示是用来说明原子及原子核结构情况的示意图。原子是由原子核和核外带______电的电子组成的,原子核内的______带正电,原子自身______(带负/不带/带正)电。原子的质量几乎集中于______。由此图提供的信息可知:原子核内的质子和中子______(有/没有)更精细的结构。
负
质子
本节典型例题
不带
原子核
有
原子是由原子核和核外带负电的电子组成的,原子核内的质子带正电,质子带的正电荷数和电子带的负电荷数相抵,整个原子自身不带电,原子的质量几乎都集中在原子核中。
原子核内的质子和中子由夸克组成,可知原子核内的质子和中子有更精细的结构。
【例题3】如图所示,是α粒子散射实验示意图。1909年,著名科学家卢瑟福进行了α粒子散射实验,结果发现,绝大多数α粒子穿过金箔后仍沿原方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数的α粒子偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
①根据实验现象,卢瑟福提出,“原子的大部分质量集中到了一个很小的结构上”,这个“很小的结构”指的是_______;
①若原子的质量、正电荷在原子内均匀分布,则发生散射的α粒子将很多,而不是只有少数发生偏折;因为电子质量很小,若α粒子遇到电子,就像飞行的子弹碰到灰尘一样,运动方向不会发生明显的改变,所以发生偏折的α粒子一定遇到的是质量很大的粒子,这说明在原子中有一个集中了原子大部分质量的微小粒子,即原子核。
本节典型例题
原子核
②1μm金箔包含了3000层金原子,
绝大多数α粒子穿过后方向不变,
下列有关该现象的解释中合理的是_____.
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
③卢瑟福根据实验现象,经过想象、类比建立了类似行星绕日的____
模型。这种方法叫____(选填“控制变量”或“建构模型”)法;
④根据以上的现象分析,以氢原子为例,正确的模型是图中的____。
②原子核外有一个很大的空间,使绝大多数α粒子穿过后方向不变,B正确。
③科学家卢瑟福进行了α粒子散射实验,提出了原子核式结构模型,这种方法在物理学研究中叫建构模型法。
④原子是由原子核和核外电子构成的,原子核体积很小、质量大,原子核外有一个非常大的空间,核外电子围绕原子核作高速运动,故B图正确。
B
B
B
核式结构
本节典型例题
3
课堂总结
原子结构
探索更小的微粒
质子(带正电)—夸克
⑤原子的三种模型
原子
模型
电子(带负电)
课堂总结①
道尔顿模型;汤姆生模型;
卢瑟福的核式结构模型.
原子核
③詹姆斯·查德威克通过实验证实中子的存在.
①汤姆生发现电子,提出原子的葡萄干蛋糕模型.
④默里·盖尔曼发现质子和中子分别由三个夸克组成的.
②卢瑟福通过α粒子实验,发现质子,提出核式结构模型.
中子(不带电)—夸克
1803年
道尔顿
原子
模型
1903年
1898年
1932年
查德威克
证实中子的存在
1964年
汤姆生
“枣糕模型”
并发现电子
默里·盖尔曼
发现质子和中
子由夸克组成
原子模型建立的历史进程
卢瑟福
“核式结构模型”并发现质子
质子
中子
课堂总结②
4
WHAT WHY WOW
课外实践与练习——WWW
1. 查阅有关资料,将你查到的微观粒子的名称列成清单,并与同学交流.
第一类纯单个粒子:中微子、电子、夸克;
第二类由两个粒子合成的粒子:π介子,W、Z玻色子;
第三类由三个基本粒子合成的粒子:中子、质子、强子。
课外实践与练习——WWW
2. 请在电子的发现者汤姆生、原子核式结构模型的提出者卢瑟福、中子的发现者查德威克和夸克的提出者盖耳曼中任选一位,查阅资料进一步了解他们。例如,他们的生平、有关图片、对科学的贡献以及有关的趣闻轶事等。
汤姆生(1856年12月18日-1940年8月30日),著名的英国物理学家,以其对电子和同位素的实验著称。1905年被任命为英国皇家学院的教授,1906年荣获诺贝尔物理学奖,1916年任皇家学会主席,1919年被选为科学院外籍委员会首脑。汤姆生在担任卡文迪许实验物理教授及实验室主任的34年,桃李满天下。1940年8月30日逝世于剑桥,终年84岁。
课外实践与练习——WWW
卢瑟福(1871年8月30日-1937年10月19日),新西兰著名物理学家,著名的原子核物理学之父。学术界公认他为继法拉第之后最伟大的实验物理学家;卢瑟福首先提出放射性半衰期的概念,证实放射性涉及从一个元素到另一个元素的嬗变。他又将放射性物质按照贯穿能力分类为α射线与β射线,并且证实前者就是氦离子。因为“对元素蜕变以及放射化学的研究“,他荣获1908年诺贝尔化学奖。
查德威克,英国实验物理学家,1891年10月20日生于英国柴郡,毕业于曼彻斯特大学物理学院。1919年,入英国剑桥大学从事a粒子人工轰击各种元素的试验。1923年被任命为剑桥大学卡文迪什实验室主任助理。1935~1948任利物浦大学教授。1939~1943年参加“英国及美国曼哈顿工程地原子弹研究”,获得多种荣誉。1935年获诺贝尔物理学奖,1974年7月24日去世。
课外实践与练习——WWW
盖耳曼( Murray Gell-Mann 1929~),美国物理学家,生于纽约。15岁时就读于耶鲁大学,19岁毕业。随后入加利福尼亚大学理工学院,直接攻读博士研究生,1951年获哲学博士学位。后曾在普林斯顿高级研究院工作和芝加哥大学任教。1956年任加州理工学院教授。
汤姆生发现了电子,从而说明原子是可以再分的;在此基础上,卢瑟福建立了原子的核式结构模型;查德威克通过实验发现了中子;盖尔曼提出质子和中子都是由被称为夸克的更小粒子组成的。解答本题时,需要上网查阅资料或查阅相关物理学史即可。
科学家是科学知识和科学精神的重要承载者,每一个实验结论的得出都离不开科学家辛勤的汗水,我们在平时的学习中,要学习科学家坚持不懈、勇于探索的精神,努力提高自己的学。
5
课堂练习
1.当下“新冠病毒”疫情防控仍不能放松警惕。以下关于“新冠病毒”及微粒尺度按从大到小排列正确的是( )
A.新冠病毒、原子、夸克、质子
B.新冠病毒、原子、质子、夸克
C.原子、新冠病毒、质子、夸克
D.原子、质子、夸克、新冠病毒
B
“新冠病毒”的直径约为10-7m,原子的直径约为10-9m,其中原子是由位于中心的原子核和核外电子构成的,而原子核是由质子和中子构成的,质子和中子又是由更小的微粒夸克组成。所以微粒由大到小排列正确的是新冠病毒、原子、质子、夸克,故ACD错误,B正确。
故选B。
课堂练习
2. 自从汤姆孙发现了电子,人们开始研究原子的内部结构,科学家提出了许多原子结构的模型,下图中所示的三种模型中与核式结构模型最为相似的是( )
C
核式结构模型,即原子的中心是带正电的原子核,占很小的体积,但其密度很大,几乎集中了原子的全部质量;带负电的电子在不同的轨道上绕着原子核运动,就像地球绕着太阳运动一样。因此与核式结构模型相似的是“行星”模型。故C符合题意,AB不符合题意。
所以选C。
A.“实心球”模型 B.“枣糕”模型 C.“行星”模型
课堂练习
3. 关于氢原子的模型结构示意图,下列正确的是 ( )
B
原子的中心是原子核,而且只占了很小一部分的体积,在原子核周围,有电子在核外运动,故ACD错误,B 正确。
所以选B。
课堂练习
A. B. C. D.
4. 下列关于原子核式结构的描述:①电子均匀分布在整个原子中;②原子核是由质子和中子构成的;③电子围绕着原子核作高速旋转;④原子核占据了原子内大部分空间;⑤原子的质量几乎都集中在原子核上;⑥原子核带负电。其中正确的是( )
A.②④⑥ B.②③⑤ C.①③⑤ D.①④⑤
B
①③电子带负电,它是在不同的轨道上绕着原子核运动,电子并不是均匀分布在整个原子中,故①错误;③正确;
②⑥原子核位于原子中心,是由质子和中子组成的,其中质子带正电,中子不带电,所以,原子核整体带正电,故②正确;⑥错误;
④⑤原子核几乎集中了原子的全部质量,但只占有原子核内极少空间,故④错误;⑤正确. 综上所述,②③⑤正确,①④⑥错误。
所以选B。
课堂练习
5. 如图所示,已知氢原子只有一个质子,一个电子,虚线表示氢原子核外电子的运动轨道。请在此图上完成氢原子的核式结构模型示意图,要求:用“+”“-”分别表示原子核、电子,并标出原子核、电子的大致位置。
课堂练习
氢原子的中心是一个带正电的原子核,一个带负电的电子在原子核外绕原子核做圆周运动,如图所示:
6. 19世纪以前,人们一直以为原子是不可再分的,直到1897年,汤姆生发现了带负电的电子后,才引起人们对原子结构的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
【进行实验】英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图所示。
课堂练习
①放射源——放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍;
②金箔——作为靶子,
厚度1 m,重叠了3000层左右的原子;
③荧光屏——α粒子打在上面发出闪光;
④显微镜——观察闪光,且通过360 转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样,运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
①若原子的质量、正电荷在原子内均匀分布,就______(会/不会)出现实验中的现象,卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是_________。
②1μm金泊包含了3000层金原子,绝大多数α粒子穿过后方向不变,该现象可以说明( )
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
课堂练习
不会
解析见下页
原子核
B
课堂练习
①若原子的质量、正电荷在原子内均匀分布,则绝大多数α粒子穿过后方向将要发生改变,就不会出现实验中的现象,卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是原子核。
(2)A.若原子的质量是均匀分布的,则绝大多数α粒子穿过后方向将要发生改变,故A不符合题意;
B.若原子内部绝大部分空间是空的,则绝大多数α粒子穿过后方向不变,故B符合题意。 故选B。
八年级物理下册 苏科版
世界万物是由什么组成的
它们有最小的结构吗 如果有,那是什么呢
眨着眼的小星星是什么精灵
滋润万物生长的太阳会不会熄灭
天上的银河是一条河吗
面对宇宙万物,人们从没停止过探索.
向物质世界的两极进军
第七章 从粒子到宇宙
原子的核式
结构模型
科学家探索微
观粒子的进展
三、探索更小的微粒
1
导入新课
导入新课
前面我们学过,物质是由分子组成的;科学家通过研究又发现分子是由原子构成的(如图);
第3节 探索更小的微粒
石墨烯分子结构
那么原子是否可以再分呢?我们顺着物理学家的足迹一起探索更小的微粒吧!
水分子
2
学习新课
德谟克利特(约公元前460~公元前370),出生在色雷斯海滨的阿布德拉的商业城市,古希腊伟大的唯物主义哲学家,原子唯物论学说的创始人之一(率先提出原子论—“万物由原子构成”)。
①德谟克利特首先提出物质是由原子构成
一、原子的核式结构模型
1. 古代模型
他认为:万物的本原是原子和虚空。原子是不可再分的物质微粒,虚空是原子运动的场所。
②中国古代思想家庄子提出“物质无限可分”的哲理
庄子(约公元前369年—公元前286年),战国时期宋国蒙(主流说法为今河南商丘东北)人。 战国中期思想家、哲学家、文学家,道家学派代表人物,与老子并称“老庄”。
一、原子的核式结构模型
1. 古代模型
一尺长的棍棒,每日截取它的一半,永远截不完。提出“物质无限可分”的哲理.
1803年9月,道尔顿利用当时已掌握的一些分析数据,计算出了第一批原子量。1803年10月21日,在曼彻斯特的“文学和哲学学会”上,道尔顿第一次阐述了他关于原子论以及原子量计算的见解,其要点:
约翰·道尔顿
(John Dalton,1766—1844年),英国化学家、物理学家。原子理论的提出者。
道尔顿的原子论
化学元素由不可分的微粒——原子构成,原子在一切化学变化中是不可再分的最小单位。同种元素的原子性质和质量都相同,不同元素原子的性质和质量各不相同,原子质量是元素基本特征之一。
一、原子的核式结构模型
2. 道尔顿模型
十九世纪末(1897年),英国物理学家汤姆生在对阴极射线的研究中发现了带负电的电子,并得出电子是所有物质中原子的组成部分,揭开了原子具有结构的秘密。
汤姆生
英国物理学家,电子的发现者。
于1906年获得
诺贝尔物理学奖
①汤姆生发现电子
由于电子是带负电的,而原子又是中性的,因此物理学家推断出在原子中还存在带正电荷的其它物质。
一、原子的核式结构模型
3. 汤姆生模型
②汤姆生的“葡萄干蛋糕模型”
1903年物理学家汤姆生提出了一个原子结构模型,人们把它叫做“葡萄干蛋糕”模型。 翻译为“枣糕模型”或“西瓜模型”或“汤姆生模型”。
汤姆生模型认为:正电荷均匀分布在整个原子球体中,带负电的电子散布在原子中,这些电子分布在对称的位置上。
历史上,在一段时间内汤姆生的原子模型曾得到广泛的承认,后来被卢瑟福的有核模型所取代。
一、原子的核式结构模型
3. 汤姆生模型
① α粒子散射实验
卢瑟福在1898年发现了α射线。他用准直的α射线轰击厚度为微米的金箔时,发现大多数粒子散射角度很小,但有少数α 粒子偏角很大。
4. 卢瑟福模型
欧内斯特·卢福瑟
(1871-1937),英国籍的新西兰人,著名物理学家,知名为原子核物理学之父。学术界公认他为继法拉第之后最伟大的实验物理学家。
一、原子的核式结构模型
② α粒子散射实验现象
Ⅰ. 绝大多数α 粒子穿过金箔后仍沿原来方向前进.
Ⅱ. 极少数α 粒子发生了较大的偏转.
Ⅲ. 个别粒子的偏转几乎达到180°。
4. 卢瑟福模型
一、原子的核式结构模型
③ α 粒子散射实验结论
实验结论:
原子中绝大部分是空的;α 粒子前进时撞在一个体积很小而质量又比它大很多的微粒上(原子核)。
根据实验进行推导:当α粒子穿过原子时,电子对α粒子运动的影响很小,影响α粒子运动的主要是另一种带正电的“粒子”,即原子核。
因为绝大多数的α粒子穿过原子时离核较远,受到的斥力很小,运动方向几乎没有改变,只有极少数α粒子可能与核十分接近,受到较大的斥力,才会发生大角度的偏转。
4. 卢瑟福模型
一、原子的核式结构模型
原子核
核外电子
原 子
④核式结构模型
通过对电荷,质量和偏转角度等的运算,卢瑟福1911年提出了原子的核式结构模型:
原子是由带正电的质量很集中的很小的原子核和在它周围运动着的带负电的电子组成的;就像行星绕太阳运转一样的一个体系。
一、原子的核式结构模型
4. 卢瑟福模型
电子云
原子的“电子云模型”
1926年奥地利物理学家埃尔温·薛定谔提出“电子云模型”。该模型中, 电子在原子核外很小的空间内做高速运动,其运行没有固定的规律,电子分层排布,接近现代人类对原子结构的认识。
埃尔温·薛定谔
(1887—1961年),奥地利物理学家,量子力学奠基人之一。因发展了原子理论,和狄拉克共获1933年诺贝尔物理学奖。
电子
原子核
一、原子的核式结构模型
5. 电子云模型
①汤姆生的
“葡萄干蛋糕模型”
②卢瑟福的
“核式结构模型”
③电子云模型
一、原子的核式结构模型
5. 总结:原子模型的建立过程
原子模型是人们对物质世界微观结构的认识而建立的模型。人们普遍接受的原子模型为由原子核(质子和中子)和电子构成,电子绕核做不规则运动,形成的电子云模型。原子模型最早由英国科学家道尔顿在1803年提出,经过汤姆逊、卢瑟福、波尔等人的改进与完善,进而形成了近代原子模型.
一、原子的核式结构模型
6. 摩擦起电的原因
由原子的核式结构模型进一步推理可知:
因为原子核很小且质量很大,而电子运动的空间很大且质量很小,所以移动或改变原子核非常困难,移动或改变电子比较容易。人们认为静电现象都是由于电子转移而形成的,这种观点称为电子转移观点。
应用电子转移观点,可以解释原子带电、物体带电和摩擦起电现象。
①电子转移观点
一、原子的核式结构模型
6. 摩擦起电的原因
②原子带电成为离子
一个中性的原子,如果失去一个或几个电子,就会使核内正电荷总数大于核外负电荷总数,则该原子将带正电,例如氢离子、钠离子。如果得到一个或几个电子,就会使核内正电荷总数小于核外负电荷总数,则该原子将带负电,例如氧离子、氯离子。
③物体带电成为带电体
一个中性的物体,如果失去若干电子,则该物体将带正电,如果得到若干电子,则该物体将带负电。
带正电荷
带负电荷
④为什么物体摩擦会起电的呢
束缚能力弱
的失去电子
束缚能力强
的得到电子
不同物质的原
子核束缚电子
的本领不同
摩擦起电的本质:电子的转移。
摩擦起电不是创造了电荷,只是电荷从一个物体转移到另一个物体,使正、负电荷分开。
摩擦时
一、原子的核式结构模型
6. 摩擦起电的原因
原子核还能再分吗?随着历史的发展,人们对原子内部结构的研究逐步深入。
质子所带正电荷的数量=电子所带负电荷的数量
①质子的发现
质子
原子核
1919年,卢瑟福用速度是20000km/s的“子弹”—α 粒子去轰击氮、氟、钾等元素的原子核时,发现在原子核中还存在一种带正电的质量比电子大很多的微粒——质子。
二、科学家探索微观粒子的进展
1. 原子核
中子的概念是由英国物理学家卢瑟福提出,中子的存在是1932年英国物理学家詹姆斯·查德威克用镭的α-射线轰击铍原子时的实验中证实的。
科学家在实验中进一步发现中子的质量与质子相同、但是不带电。
②中子的发现
詹姆斯·查德威克 (1891-1974),英国物理学家,于1935年获得诺贝尔物理学奖。
中子
原子核
二、科学家探索微观粒子的进展
1. 原子核
原子核
中子
质子
不带电
+
+
③原子核的组成
中子
质子
原子核,简称“核”,位于原子的核心部分,由质子和中子两种微粒构成;质子和中子统称为核子。
原子核带正电(即质子所带的正电),中子不带电。
二、科学家探索微观粒子的进展
1. 原子核
原 子
原子核
电 子
中子
质子
不带电
不带电
+
+
-
④原子的组成及带电情况
中子
质子
电子
二、科学家探索微观粒子的进展
1. 原子核
原子核极小,它的直径在10-16m~10-14m之间,体积只占原子体积的几千亿分之一,在这极小的原子核里却集中了99.95%以上原子的质量。
形象来说,就是地球和乒乓球的比例, 大约一比一千亿。
原子的直径:约10-10米
原子核的直径:约10-15米
⑤原子与原子核的大小比较
1. 原子核
二、科学家探索微观粒子的进展
1. 原子核
⑥夸克
默里·盖尔曼
(Murray Gell-Mann,1929—2019),生于美国纽约的一个犹太家庭,物理学家,提出了质子和中子是由三个夸克组成的,并因此获得诺贝尔物理学奖。
二、科学家探索微观粒子的进展
质子和中子是分别由三个夸克组成的.
质子和中子还能再分吗?随着人们对原子内部结构的研究逐步深入,物理学家默里·盖尔曼提出了质子和中子还可以再分。
电子<10-18m
核子由
夸克组成
质子
中子
粒子 分子 原子 原子核 核子
大小
原子核由质子和中子组成
总结:不同微观粒子的层次结构示意图
10-10~10-5m
10-10m
10-15~10-14m
10-15m
1. 原子核
二、科学家探索微观粒子的进展
加速器
生活 物理 社会
1911年,卢瑟福领导的研究组,利用一束高速运动的带正电的α粒子轰击很薄的金箔,获得了极有价值的实验现象和有关数据。由此,卢瑟福提出了著名的原子核式结构模型。该实验也启发了人们用具有更高能量的粒子作为“炮弹”,来探究微观世界的奥秘.
我们把能使带电粒子增加速度(或动能)的装置称为加速器。利用它可以加速电子、质子、 α粒子等带电粒子,使其具有很高的能量.
20世纪30年代,劳伦斯发明了回旋加速器。最早的回旋加速器可将质子的能量提高到 106eV(eV称为电子伏,是高能物理学中常用的能量单位)。1988年,我国建成了北京正负电子对撞机,它可使电子的能量提高到109eV。
加速器
生活 物理 社会
目前,世界上最大的加速器,是欧洲核子研究中心的大型强子对撞机,它可将质子的能量提高到1013eV。
大型强子对撞机
加速器在帮助人们深入探索微观世界的奥秘中发挥了重大作用,已有几十项与粒子物理研究有关的成果获得了诺贝尔物理学奖.
加速器在生产、生活中同样有着非常重要的作用,如用于癌症的治疗、工业探伤、食品的防腐与保鲜、复合材料的生产以及医疗用品消毒等。
【例题1】能保持物质化学性质不变的最小微粒是_____(选填字母:A.原子,B.分子);科学家对原子的结构进行猜想和实验,并提出了多种模型。在如图所示的两种模型中,卢瑟福提出的原子模型是_______(选填“甲”或“乙”)。
B
实验表明,分子是由原子组成的,分子是保持物质化学性质不变的最小微粒。故选B。
卢瑟福认为原子不是均匀分布的,而是中间很小的体积聚集了原子绝大部分的质量,核外质量很小的电子围绕着原子核转动,故原子模型为乙。所以选乙。
乙
本节典型例题
【例题2】如图所示是用来说明原子及原子核结构情况的示意图。原子是由原子核和核外带______电的电子组成的,原子核内的______带正电,原子自身______(带负/不带/带正)电。原子的质量几乎集中于______。由此图提供的信息可知:原子核内的质子和中子______(有/没有)更精细的结构。
负
质子
本节典型例题
不带
原子核
有
原子是由原子核和核外带负电的电子组成的,原子核内的质子带正电,质子带的正电荷数和电子带的负电荷数相抵,整个原子自身不带电,原子的质量几乎都集中在原子核中。
原子核内的质子和中子由夸克组成,可知原子核内的质子和中子有更精细的结构。
【例题3】如图所示,是α粒子散射实验示意图。1909年,著名科学家卢瑟福进行了α粒子散射实验,结果发现,绝大多数α粒子穿过金箔后仍沿原方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数的α粒子偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
①根据实验现象,卢瑟福提出,“原子的大部分质量集中到了一个很小的结构上”,这个“很小的结构”指的是_______;
①若原子的质量、正电荷在原子内均匀分布,则发生散射的α粒子将很多,而不是只有少数发生偏折;因为电子质量很小,若α粒子遇到电子,就像飞行的子弹碰到灰尘一样,运动方向不会发生明显的改变,所以发生偏折的α粒子一定遇到的是质量很大的粒子,这说明在原子中有一个集中了原子大部分质量的微小粒子,即原子核。
本节典型例题
原子核
②1μm金箔包含了3000层金原子,
绝大多数α粒子穿过后方向不变,
下列有关该现象的解释中合理的是_____.
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
③卢瑟福根据实验现象,经过想象、类比建立了类似行星绕日的____
模型。这种方法叫____(选填“控制变量”或“建构模型”)法;
④根据以上的现象分析,以氢原子为例,正确的模型是图中的____。
②原子核外有一个很大的空间,使绝大多数α粒子穿过后方向不变,B正确。
③科学家卢瑟福进行了α粒子散射实验,提出了原子核式结构模型,这种方法在物理学研究中叫建构模型法。
④原子是由原子核和核外电子构成的,原子核体积很小、质量大,原子核外有一个非常大的空间,核外电子围绕原子核作高速运动,故B图正确。
B
B
B
核式结构
本节典型例题
3
课堂总结
原子结构
探索更小的微粒
质子(带正电)—夸克
⑤原子的三种模型
原子
模型
电子(带负电)
课堂总结①
道尔顿模型;汤姆生模型;
卢瑟福的核式结构模型.
原子核
③詹姆斯·查德威克通过实验证实中子的存在.
①汤姆生发现电子,提出原子的葡萄干蛋糕模型.
④默里·盖尔曼发现质子和中子分别由三个夸克组成的.
②卢瑟福通过α粒子实验,发现质子,提出核式结构模型.
中子(不带电)—夸克
1803年
道尔顿
原子
模型
1903年
1898年
1932年
查德威克
证实中子的存在
1964年
汤姆生
“枣糕模型”
并发现电子
默里·盖尔曼
发现质子和中
子由夸克组成
原子模型建立的历史进程
卢瑟福
“核式结构模型”并发现质子
质子
中子
课堂总结②
4
WHAT WHY WOW
课外实践与练习——WWW
1. 查阅有关资料,将你查到的微观粒子的名称列成清单,并与同学交流.
第一类纯单个粒子:中微子、电子、夸克;
第二类由两个粒子合成的粒子:π介子,W、Z玻色子;
第三类由三个基本粒子合成的粒子:中子、质子、强子。
课外实践与练习——WWW
2. 请在电子的发现者汤姆生、原子核式结构模型的提出者卢瑟福、中子的发现者查德威克和夸克的提出者盖耳曼中任选一位,查阅资料进一步了解他们。例如,他们的生平、有关图片、对科学的贡献以及有关的趣闻轶事等。
汤姆生(1856年12月18日-1940年8月30日),著名的英国物理学家,以其对电子和同位素的实验著称。1905年被任命为英国皇家学院的教授,1906年荣获诺贝尔物理学奖,1916年任皇家学会主席,1919年被选为科学院外籍委员会首脑。汤姆生在担任卡文迪许实验物理教授及实验室主任的34年,桃李满天下。1940年8月30日逝世于剑桥,终年84岁。
课外实践与练习——WWW
卢瑟福(1871年8月30日-1937年10月19日),新西兰著名物理学家,著名的原子核物理学之父。学术界公认他为继法拉第之后最伟大的实验物理学家;卢瑟福首先提出放射性半衰期的概念,证实放射性涉及从一个元素到另一个元素的嬗变。他又将放射性物质按照贯穿能力分类为α射线与β射线,并且证实前者就是氦离子。因为“对元素蜕变以及放射化学的研究“,他荣获1908年诺贝尔化学奖。
查德威克,英国实验物理学家,1891年10月20日生于英国柴郡,毕业于曼彻斯特大学物理学院。1919年,入英国剑桥大学从事a粒子人工轰击各种元素的试验。1923年被任命为剑桥大学卡文迪什实验室主任助理。1935~1948任利物浦大学教授。1939~1943年参加“英国及美国曼哈顿工程地原子弹研究”,获得多种荣誉。1935年获诺贝尔物理学奖,1974年7月24日去世。
课外实践与练习——WWW
盖耳曼( Murray Gell-Mann 1929~),美国物理学家,生于纽约。15岁时就读于耶鲁大学,19岁毕业。随后入加利福尼亚大学理工学院,直接攻读博士研究生,1951年获哲学博士学位。后曾在普林斯顿高级研究院工作和芝加哥大学任教。1956年任加州理工学院教授。
汤姆生发现了电子,从而说明原子是可以再分的;在此基础上,卢瑟福建立了原子的核式结构模型;查德威克通过实验发现了中子;盖尔曼提出质子和中子都是由被称为夸克的更小粒子组成的。解答本题时,需要上网查阅资料或查阅相关物理学史即可。
科学家是科学知识和科学精神的重要承载者,每一个实验结论的得出都离不开科学家辛勤的汗水,我们在平时的学习中,要学习科学家坚持不懈、勇于探索的精神,努力提高自己的学。
5
课堂练习
1.当下“新冠病毒”疫情防控仍不能放松警惕。以下关于“新冠病毒”及微粒尺度按从大到小排列正确的是( )
A.新冠病毒、原子、夸克、质子
B.新冠病毒、原子、质子、夸克
C.原子、新冠病毒、质子、夸克
D.原子、质子、夸克、新冠病毒
B
“新冠病毒”的直径约为10-7m,原子的直径约为10-9m,其中原子是由位于中心的原子核和核外电子构成的,而原子核是由质子和中子构成的,质子和中子又是由更小的微粒夸克组成。所以微粒由大到小排列正确的是新冠病毒、原子、质子、夸克,故ACD错误,B正确。
故选B。
课堂练习
2. 自从汤姆孙发现了电子,人们开始研究原子的内部结构,科学家提出了许多原子结构的模型,下图中所示的三种模型中与核式结构模型最为相似的是( )
C
核式结构模型,即原子的中心是带正电的原子核,占很小的体积,但其密度很大,几乎集中了原子的全部质量;带负电的电子在不同的轨道上绕着原子核运动,就像地球绕着太阳运动一样。因此与核式结构模型相似的是“行星”模型。故C符合题意,AB不符合题意。
所以选C。
A.“实心球”模型 B.“枣糕”模型 C.“行星”模型
课堂练习
3. 关于氢原子的模型结构示意图,下列正确的是 ( )
B
原子的中心是原子核,而且只占了很小一部分的体积,在原子核周围,有电子在核外运动,故ACD错误,B 正确。
所以选B。
课堂练习
A. B. C. D.
4. 下列关于原子核式结构的描述:①电子均匀分布在整个原子中;②原子核是由质子和中子构成的;③电子围绕着原子核作高速旋转;④原子核占据了原子内大部分空间;⑤原子的质量几乎都集中在原子核上;⑥原子核带负电。其中正确的是( )
A.②④⑥ B.②③⑤ C.①③⑤ D.①④⑤
B
①③电子带负电,它是在不同的轨道上绕着原子核运动,电子并不是均匀分布在整个原子中,故①错误;③正确;
②⑥原子核位于原子中心,是由质子和中子组成的,其中质子带正电,中子不带电,所以,原子核整体带正电,故②正确;⑥错误;
④⑤原子核几乎集中了原子的全部质量,但只占有原子核内极少空间,故④错误;⑤正确. 综上所述,②③⑤正确,①④⑥错误。
所以选B。
课堂练习
5. 如图所示,已知氢原子只有一个质子,一个电子,虚线表示氢原子核外电子的运动轨道。请在此图上完成氢原子的核式结构模型示意图,要求:用“+”“-”分别表示原子核、电子,并标出原子核、电子的大致位置。
课堂练习
氢原子的中心是一个带正电的原子核,一个带负电的电子在原子核外绕原子核做圆周运动,如图所示:
6. 19世纪以前,人们一直以为原子是不可再分的,直到1897年,汤姆生发现了带负电的电子后,才引起人们对原子结构的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在着带正电荷的部分,它们是均匀分布还是集中分布的呢?
【进行实验】英国科学家卢瑟福进行了著名的α粒子轰击金箔实验。实验做法如图所示。
课堂练习
①放射源——放射性物质放出α粒子(带正电荷),质量是电子质量的7000倍;
②金箔——作为靶子,
厚度1 m,重叠了3000层左右的原子;
③荧光屏——α粒子打在上面发出闪光;
④显微镜——观察闪光,且通过360 转动可观察不同角度α粒子的到达情况。
【收集证据】绝大多数α粒子穿过金箔后仍沿原来的方向前进,但是有少数α粒子却发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
【猜想与假设】α粒子遇到电子后,就像飞行的子弹碰到灰尘一样,运动方向不会发生明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
①若原子的质量、正电荷在原子内均匀分布,就______(会/不会)出现实验中的现象,卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是_________。
②1μm金泊包含了3000层金原子,绝大多数α粒子穿过后方向不变,该现象可以说明( )
A.原子的质量是均匀分布的 B.原子内部绝大部分空间是空的
课堂练习
不会
解析见下页
原子核
B
课堂练习
①若原子的质量、正电荷在原子内均匀分布,则绝大多数α粒子穿过后方向将要发生改变,就不会出现实验中的现象,卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是原子核。
(2)A.若原子的质量是均匀分布的,则绝大多数α粒子穿过后方向将要发生改变,故A不符合题意;
B.若原子内部绝大部分空间是空的,则绝大多数α粒子穿过后方向不变,故B符合题意。 故选B。
